
文章信息
- 蔡丽希. 2018.
- CAI Li-xi. 2018.
- 一株芘降解菌Bacilluscereus Py5的分离鉴定
- Isolation and characterization of a pyrene-degrading bacterial strain Bacilluscereus Py5
- 海洋科学, 42(11): 29-34
- Marine Sciences, 42(11): 29-34.
- http://dx.doi.org/10.11759/hykx20180920003
-
文章历史
- 收稿日期:2018-09-20
- 修回日期:2018-11-04
多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)是一类由两个或多个苯环以线状、簇状或角状排列组成的典型有机污染物, 具有致畸、致癌、致诱变性[1-2]。此类污染物水溶性极低, 且对海洋污泥吸附力较强, 往往在海洋环境中富集, 其生物降解率随着苯环数的增加而降低, 尤其四环及以上的PAHs很难被氧化降解。芘作为环境中存在的典型的高分子质量多环芳烃, 是检测多环芳烃污染的指示物[3-5]。目前微生物修复具备成本低, 环境友好和降解彻底等优点, 被认为是治理PAHs污染的最具前景的修复方法[6], 而从海洋环境中筛选分离出高效土著降解菌是多环芳烃微生物降解技术的关键[7]。
虽然现阶段已发现不少PAHs降解的微生物及其共代谢的研究报道, 但这些研究主要集中于萘、茐、菲等低分子质量PAHs降解菌的分离纯化及其微生物代谢途径的探讨, 而对于高分子质量PAHs降解的研究一直是近来年的一个研究热点, 有待于对其降解途径进一步深入探究[8-9]。本文以高分子质量PAHs的典型代表物——芘作为代谢底物, 从红树林表面污泥中驯化分离出芘降解土著菌株, 对5株降解菌进行了生理生化及分子生物学的鉴定, 同时选择其中一株最高效降解菌株来探究其降解特性, 并分析了共代谢基质对多环芳烃降解的强化作用, 进而为多环芳烃的微生物修复和污染治理提供参考。
1 材料与方法 1.1 材料与试剂环境样品采集于福建惠安近海红树林区, 为滩涂表层沉积物。
多环芳烃标准品芘(Pyene, 质量分数99.1%), Sigma-Aldrich公司;
无机培养基(MSM, mg/L): FeCl3·6H2O, 5 mg/L; CaCl2·2H2O, 100 mg/L; Na2HPO4, 800 mg/L; (NH4)6MOO24·4H2O, 1 mg/L; MgSO4·H2O, 200 mg/L; KH2PO4, 200 mg/L; (NH4)2SO4, 1000 mg/L; pH值为7.2。
5 g/L芘浓缩液:准确称取多环芳烃芘50 mg, 丙酮溶解并定容至10 mL, 经无菌的0.22 μm针管式尼龙膜过滤后避光封口保存。
PYR-MSM培养基:移取不同体积的5 g/L芘浓缩液至无菌的MSM中使芘终浓度在50~500 mg/L之间, 避光过夜待丙酮挥发后使用。
海洋细菌培养基:磷酸高铁0.01 g; 酵母浸膏1 g; 蛋白胨5 g以陈海水溶解, 并定容至1 L, pH 7.6~7.8。
1.2 菌种的筛选、纯化与分子鉴定 1.2.1 芘降解菌群的富集筛选取红树林表层沉积物样品10 g和90 mL无菌dd水至三角瓶中磁力搅拌3 h。恒温静置30 min后, 转移5 mL上清液至45 mL新配置的PYR-MSM培养基中, 其中芘做为唯一碳源与能源, 终浓度为100 mg/L。25℃, 150 r/min避光振荡培养, 每3 d记录三角瓶中培养液的浊度和颜色的变化。30 d后, 转接5 mL的上层培养液到新配制的45 mLPYR-MSM培养基中(200 mg/L), 富集驯化筛选30 d, 等比例增加多环芳烃芘的浓度并重复以上步骤; 富集驯化培养五个循环150 d后, 得到以500 mg/L芘做为唯一碳源与能源的芘降解菌群[10]。
1.2.2 菌株的分离纯化与形态观察在无机固体培养基上涂上一层芘(0.5 g/L)的丙酮溶液, 过夜待丙酮充分挥发后, 接入0.l mL富集培养的混合菌液, 均匀涂布在PAHs表层上, 每个稀释度作一个空白对照, 3个平行样。25℃避光培养21 d左右, 挑取平板上形成噬菌斑晕圈的菌落, 划线于海洋细菌培养基的斜面上。斜面培养2 d后, 再重新划线接种于PAHs-MSM平板, 观察菌落的生长情况[11]。重复划线纯化并保存备用。上述操作均在暗室培养箱中进行以防芘被光解。
1.2.3 芘降解菌的分子鉴定提取单菌的总DNA, 并以16S rDNA通用引物L1: AGAGTTTGATCATGG CTCAG、L2: TACGGT TACC TTGTTACGACTT进行PCR扩增, 得到长度约1500 bp的条带, 将PCR回收产物寄往公司测序。对测序序列与NCBI数据库中细菌的16S rDNA序列进行比对。并用MEGA 7.0软件以Neighbor-Joining法构建系统发育进化树。
1.3 B.cereus PY5对芘的降解将斜面保存的降解菌B.cereus PY5划线接种于海洋细菌固体培养基上, 25℃培养2 d。挑取生长好的单菌落置于200 mL海洋细菌培养基中, 转速100 r/min、温度25℃培养48 h后, 离心收集菌种, 菌体分别用100 mL无机盐培养基洗涤2次, 去上清液, 并初步称量菌种的湿重, 配成10 g/L菌悬液待用。
移取2 mLB.cereus PY5的菌悬液到18 mL以多环芳烃作为单一碳源和能源的无机培养液中, 使菌液和芘的终浓度分别为1 g/L与50 mg/L, 设不加菌的培养基为对照。培养条件为25℃, 150 r/min避光培养。每3 d取1次样, 共取样7次, 置于-20℃冰箱中保存, 到时一起取样进行萃取。以未加菌的MSM-芘(50 mg/L)设为空白对照。每个实验设置3个平行实验, 取平均值进行分析[12]。
1.4 不同降解体系对B.cereus Py5降解芘的影响在B. cereus Py5菌液和芘的终浓度分别为1 g/L与50 mg/L的灭菌无机盐培养基中, 分别加入①Tween-80, ②Fe3+、Mn2+混合液, ③葡萄糖, ④水杨酸, ⑤Fe3+、Mn2+和葡萄糖混合液, ⑥Fe3+、Mn2+和水杨酸混合液, 其中Tween-80浓度为0.6临界浓度(Critical Micelle Concentration, CMC), 葡萄糖和水杨酸的浓度均为50 mg/L, Fe3+和Mn2+浓度分别为0.1 mg/L和1 mg/L, 所有样品于25℃、150 r/min避光培养21 d后, 测定培养液芘的残余量, 对照组为只加菌悬液和芘的样品。
1.5 芘的定量方法收集样品并以盐酸调pH至2。加入等体积的二氯甲烷, 在超声振荡仪中处理30 min, 保持超声振荡仪中水的温度在40℃以下。后用分液漏斗萃取两次并定容。取2 mL样品用0.22 µm尼龙膜过滤后, 于高效液相色谱仪检测。测试条件如下:分析仪器为安杰伦1100型液相色谱仪, 色谱柱为依利特ODSC18柱(250 mm×4.6 mm, 5 µm), 紫外线检测器, 波长为239 nm, 进样过程:流速为1.0 mL/min, 流动相为不同的甲醇与水配比, 进样量20µL, 柱温30℃。
2 结果与分析 2.1 从红树林表层污泥中富集筛选出芘降解菌群Grifoll等[13]发现微生物在多环芳烃降解去除过程中会释放一些中间产物, 培养液的颜色也相应发生改变。例如细菌在多环芳烃降解去除过程中, 培养液的水相由澄清变浑浊, 随即出现一些红色或橙黄色物质, 这表明培养液中存在以PAHs为唯一碳源与能源的降解菌株[14-15]。在本研究中, 红树林表层污泥样品加入唯一碳源和能源-芘进行驯化筛选30 d后, 培养液的颜色由乳白色(无色透明的无机培养基加入高浓度芘后会转变成乳白色)-白色混浊-淡黄色有丝状条带-稳定不变, 在随后120 d的驯化筛选过程中, 均可以观测到上述颜色变化且变化所需时间间隔逐步缩短, 表明随着细菌暴露于芘时间的增加, 培养液中的微生物及其酶体系已适应高浓度芘存在的环境且生长的延滞期逐渐缩短, 其降解能力在增强, 其混合微生物可以利用芘作为生长基质进行繁殖生长。
2.2 芘降解菌的16S rDNA鉴定采用试剂盒提取单菌PY5的PCR模板, 以细菌通用引物L1、L2进行16S rDNA高变区的扩增, 得到产物的长度约1500 bp。BLAST分析结果表明Py5为蜡状芽孢杆菌(Bacillus cereus)。选用MEGA 7.0软件通过Neighbor-Joining法构建Py5的系统发育树(图 1), 如图所示Py5菌株与几株蜡状芽孢杆菌位于同一分支, 结合菌株的形态特征、16S rDNA序列结果以及生理生化特性, 推测Py5属于蜡状芽孢杆菌, 命名为Bacillus cereus Py5。
 |
| 图 1 基于16S rDNA基因序列同源性的PY5系统发育树 Fig. 1 Phylogenetic tree of PY5 based on the 16S rDNA gene homology |
利用高效液相色谱对菌株B. cereus Py5降解芘的效率进行定量分析, 该菌在芘初始浓度为50 mg/L培养基中对芘的降解效果如图 2所示。芘具有难溶性与高生物毒性, 正常情况下难以被微生物完全分解利用[15-16]。B. cereus Py5受芘的协迫和毒害, 在实验的前12 d并不能很快地利用芘作为碳源和能源, 对芘降解的幅度不大(仅仅降解14.8%)。这说明微生物对不易挥发又稳定的芘降解一般都有一段延滞期, 而且B. cereus Py5降解芘时所需要的酶, 特别是芘降解的起始酶, 很难被诱导产生, 但是一旦B. cereus Py5降解芘的基因被诱导后, 其降解芘的能力明显加强, 这个可以从第12 d后芘的降解曲线变化得到证实。从第15 d开始, 芘的降解幅度增大。在培养的第21 d, 测定培养液中芘残余的浓度为0.854 mg, 对应其降解率为65.8%。而不含菌液的对照中芘的回收率达到90%以上, 可视为对照样无变化, 表明在培养条件下, 非生物因子对芘降解的影响可忽略不计。
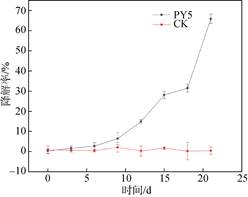 |
| 图 2 B. cereus Py5对芘的降解曲线 Fig. 2 The degradation curve of pyrene by B. cereus Py5 |
多环芳烃在海洋环境中有较高的稳定性, 其生物可降解性与苯环数呈显著的负相关关系[17]。在没有共代谢基质提供碳源和能源的情况下, 海洋环境中很少有能直接降解高分子质量多环芳烃的微生物。共代谢体系可以扩大微生物对碳源和能源的选择范围, 提高微生物降解多环芳烃的效率, 从而达到难降解的多环芳烃最终被微生物利用并降解的目的[18]。因此本研究选择对PAH-芘的共代谢机制开展研究:在培养液中添加了几种不同的共代谢基质与酶活诱导因子, 如生物表面活性剂Tween-80、水杨酸、葡萄糖、Fe3+、Mn2+等。由图 3可以看到, 与对照组相比, 在培养21d后, 添加Tween-80、水杨酸、Fe3+、Mn2+、葡萄糖等基质均对B. cereus Py5降解芘的效率具有不同程度的正面促进作用, 其中酶活诱导因子Fe3+、Mn2+与外加C源葡萄糖的混合体系对芘降解的促进效果最好, 芘降解率由65.8%上升至81.4%, 其次是添加Fe3+、Mn2+和水扬酸的混合液的促进效果, 培养液中芘降解率由65.8%上升至79.6%, 而单独添加Fe3+、Mn2+、葡萄糖或水杨酸的芘降解率维持在67.2%~74.2%之间。
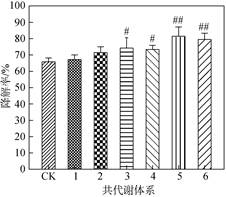 |
| 图 3 B. cereus Py5对芘生物降解的共代谢体系 Fig. 3 The Cometabolism system of pyrenedegradation by B. Cereus Py5 注: CK.对照组; 1. Tween-80; 2. Fe3+、Mn2+混合液; 3.葡萄糖; 4.水杨酸; 5.Fe3+、Mn2+和葡萄糖混合液; 6. Fe3+、Mn2+和水杨酸混合液, #代表显著性(P < 0.05), ##代表极显著性(P < 0.01) |
芘是高分子质量多环芳烃, 水溶性和生物毒性大, 这是低生物降解率的主要原因。表面活性剂可降低芘的界面张力、促进溶解与解吸, 因此在培养体系中添加毒性较小的非离子表面活性剂Tween-80可以增强芘的生物可利用性, 从而提高生物修复效率[19]。葡萄糖是最为常见并易被生物分解消耗的速效碳源, 可以作为碳源促进B. cereus Py5生长, 减短生长延滞期从而促进芘的分解利用[20]。Jerom等[21]发现多环芳烃中间产物具有激活加氧酶系活性的作用, 而多环芳烃降解最重要的一步‒苯环的断开通常需要由加氧酶在环内加入氧原子完成的。这也可以说明中间产物水扬酸对微生物内普遍存在的加氧酶具有诱导作用。同时, 芘降解过程中的关键酶是邻苯二酚1, 2-双加氧酶和锰过氧化物酶, Fe3+和Mn2+作为这两种关键酶的激活剂可以显著提高其生物活性, 从而提高B. cereus Py5对芘的降解率。由此可见, 在多环芳烃芘污染的治理体系中, B. cereus Py5起着主导作用, 但是菌体的代谢活性是主要限制因素。相较于表面活性剂, 酶活诱导因子以及外加碳源对B. cereus Py5降解芘的促进作用更明显。
3 结论(1) 通过富集驯化培养从红树林污泥中分离到一株以芘作为唯一碳源与能源的高效降解菌株PY5, 16S rDNA鉴定为蜡状芽孢杆菌(Bacillus cereus), 21 d内对50 mg/L芘的降解率为65.8%。
(2) 投加Tween-80、葡萄糖、水杨酸、Mn2+、Fe3+等基质可以不同程度强化降解芘的能力, 其中投加葡萄糖+Mn2++Fe3+的混合体系对蜡状芽孢杆菌降解芘的强化效果最好, 培养液中芘的降解率由65.8%提高到81.4%。
| [1] |
Lee D W, Lee H, Lee A H, et al. Microbial community composition and PAHs removal potential of indigenous bacteria in oil contaminated sediment of Taean coast, Korea[J]. Environmental Pollution, 2018, 234: 503-512. DOI:10.1016/j.envpol.2017.11.097 |
| [2] |
曾光明, 刘少恒, 牛秋雅, 等. Cd(Ⅱ)对多环芳烃降解菌Bacills sp. P1产酶及酶促降解过程影响研究[J]. 湖南大学学报, 2017, 41(12): 109-114. Zeng Guangming, Liu Shaoheng, Niu Qiuya, et al. Effects of Cd(Ⅱ)on enzyme productions of PAHs biodegrading Bacills sp. P1 and the characteristics of enzymatic degradation[J]. Journal of Hunan University, 2017, 41(12): 109-114. |
| [3] |
Bourguignon N, Isaac P, Alvarez H, et al. Enhanced polyaromatic hydrocarbon degradation by adapted cultures of actinomycete strains[J]. Journal of Basic Microbiology, 2014, 54(12): 1288-1294. DOI:10.1002/jobm.v54.12 |
| [4] |
刘世亮, 骆永明, 吴龙华, 等. 真菌对污染旱地红壤中苯并[a]芘共代谢降解研究[J]. 环境科学, 2010, 40(4): 1948-1950. Liu Shiliang, Luo Yongming, Wu longhua, et al. Effects of fungi on co-metabolic degradation of benzo[a]pyrene in droughty red soil[J]. Environmental science, 2010, 40(4): 1948-1950. |
| [5] |
Guzik U, Hupert-Kocurek K, Sitnik M, et al. High activity catechol 1, 2-dioxygenase from Stenotrophomonasmaltophilia strain KB2 as a useful tool in cis-muconic acid production[J]. Antonie van Leeuwenhoek, 2013, 103(6): 1297-1307. DOI:10.1007/s10482-013-9910-8 |
| [6] |
Li C H, Ye C, Hou X P, et al. Isolation and characterization of polycyclic aromatic hydrocarbon-degrading bacteria with tolerance to hypoxic environments[J]. Journal of Environmental Science and Health Part A, 2017, 52(7): 581-589. DOI:10.1080/10934529.2017.1293991 |
| [7] |
Yao X, Tao F, Zhang K. Multiple roles of two efflux pumps in a polycyclic aromatic hydrocarbon-degrading Pseudomonas putida strain B6-2(DSM 28064)[J]. Applied and Environmenta Microbiology, 2017, 83(24): 65-70. |
| [8] |
Wang B, Lai Q, Cui Z, et al. A pyrene-degrading consortium from deep-sea sediment of the West Pacific and its key member Cycloclasticus sp. P1[J]. Environmental Microbiology, 2008, 10(8): 1948-1963. |
| [9] |
Wang W, Wang L, Shao Z. Polycyclic Aromatic Hydrocarbon (PAH) Degradation Pathways of the Obligate Marine PAH Degrader Cycloclasticus sp. Strain P1[J]. Applied and Environmental Microbiology, 2018, 84(21): 1261-1276. |
| [10] |
张娜, 尹华, 彭辉, 等. 嗜麦芽窄食单胞菌J12对芘的降解特性[J]. 环境科学与技术, 2010, 33(4): 6-9. Zhang Na, Yin Ha, Peng Hui, et al. Pyrenedegradation by Stenotrophomonasmaltophilia J12 and its degradation characteristics[J]. Environmental Science and Technology, 2010, 33(4): 6-9. DOI:10.3969/j.issn.1003-6504.2010.04.002 |
| [11] |
蔡丽希, 许桂芬. 芘降解质粒提取方法的研究[J]. 生物技术通报, 2009, 202(5): 92-95. Cai Lixi, Xu Guifen. Isolation and research of pyrene degrading plasmids[J]. Biotechnology Bulletin, 2009, 202(5): 92-95. |
| [12] |
张宏波, 林爱军, 刘爽, 等. 芘高效降解菌的分离鉴定及其降解特性研究[J]. 环境科学, 2010, 31(1): 243-248. Zhang Hongbo, Lin Aijun, Liu Shuang, et al. Identification of pyrene degrading strains and the degrading characteristics research[J]. Chinese Jouranl of Environmental Science, 2010, 31(1): 243-248. |
| [13] |
Grifoll M, Selifonov S A, Gatlin C V, et al. Actions of a versatile fluorene-degrading bacterial isolate on polycyclic aromatic compounds[J]. Appl Environ Microbiol, 1995, 61: 3711-3723. |
| [14] |
魏妍, 杨娇艳, 王文玲, 等. 多环芳烃降解菌的筛选及其对天然水的净化效果分析[J]. 化学与生物工程, 2010, 27(12): 56-60. Wei Yan, Yang Jiaoyan, Wang Wenling, et al. Isolation of aPAHs-degrading bacterium and analysis of its PAHs-degrading effect in water[J]. Chemistry & Bioengineering, 2010, 27(12): 56-60. DOI:10.3969/j.issn.1672-5425.2010.12.018 |
| [15] |
Lin Y, Cai L X. PAH-degrading microbial consortium and its pyrene-degrading plasmidsfrom mangrove sediment samples in Huian, China[J]. Marine Pollution Bulletin, 2008, 57: 703-706. DOI:10.1016/j.marpolbul.2008.03.025 |
| [16] |
葛成军, 俞花美. 多环芳烃在土壤中的环境行为研究进展[J]. 中国生态农业学报, 2006, 14(1): 162-164. Ge Chengjun, Yu Huamei. The environmental behaviors of polycyclic aromatic hydrocarbons (PAHs) in the soil[J]. Chinese Journal of Eco-Agriculture, 2006, 14(1): 162-164. |
| [17] |
邱云云, 尹华, 叶锦韶, 等. 嗜麦芽窄食单胞菌去除水中芘-镉复合污染的特性[J]. 农业环境科学学报, 2013, 32(3): 629-634. Qiu Yunyun, Yin Hua, Ye Jinshao, et al. Research on characteristics of removing combined contamination of pyrene and cadmium in water by stenotrophomonasmaltophilia[J]. Journal of Agro-Environment Science, 2013, 32(3): 629-634. |
| [18] |
Chen K, Zhu Q, Qian Y G, et al. Microcalorimetric investigation of the effect of non-ionic surfactant on biodegradation of pyrene by PAH-degrading bacteria Burkholderiacepacia[J]. Ecotoxicologyand Environmental Safety, 2013, 98(12): 361-367. |
| [19] |
王帅, 郑立, 韩笑天, 等. 富油微藻富碳培养下油脂积累及固碳研究[J]. 海洋学报(英文版), 2018(2): 119-126. Wang Shuai, Zheng Li, Han Xiaotian, et al. Lipid accumulation and CO2 utilization of two marine oil-rich microalgal strains in response to CO2 aeration[J]. Journal of ocean, 2018(2): 119-126. |
| [20] |
刘魏魏.多环芳烃污染农田土壤的生物协同修复及有机废物调控强化修复技术[D].南京: 南京农业大学, 2009: 48-57. Liu Weiwei. Remediation of polycyclic aromatic hydrocarbons (PAHS) -contaminated arable soils by bio-synergistic method and organic wastes eco-regulation[D]. Nanjing: Nanjing Agricultural University, 2009: 48-57. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1763008 |
 2018, Vol. 42
2018, Vol. 42

