文章信息
- 韩莎, 胡炜, 李成林, 赵斌, 孙永军, 刘兆存. 2018.
- HAN Sha, HU Wei, LI Cheng-lin, ZHAO Bin, SUN Yong-jun, LIU Zhao-cun. 2018.
- pH胁迫对不同规格刺参生长及免疫酶活性的影响
- Effect of pH stress on growth and activities of immune enzyme of different-sized sea cucumber, Apostichopus japonicus Selenka
- 海洋科学, 42(11): 51-58
- Marine Sciences, 42(11): 51-58.
- http://dx.doi.org/10.11759/hykx20180821001
-
文章历史
- 收稿日期:2018-08-21
- 修回日期:2018-10-12
2. 好当家集团有限公司, 山东 威海 264300;
3. 山东黄河三角洲海洋科技有限公司, 山东 东营 257000
2. Hao Dangjia Group Corporation, Weihai 264300, China;
3. Marine Science and Technology Corporation of Yellow River Delta of Shandong Province, Dongying 257000, China
刺参(Apostichopus japonicus Selenka)是我国名贵海产品, 陆基池塘养殖是刺参养殖的主要模式。近几年, 由于异常气候以及养殖环境的变化, 致使刺参池塘养殖因过度应激而导致的综合并发症逐年上升, 如2013年夏季的持续高温闷热和集中强降雨天气直接导致刺参主产区的山东和辽宁池塘养殖大面积减产, 部分地区池塘养殖刺参损失达90%以上。池塘养殖刺参减产的问题日益凸显, 造成养殖投入增加、效益降低、风险增大, 成为制约刺参养殖产业可持续发展的瓶颈[1-3]。
刺参池塘养殖受天气、海水水质等自然环境因素影响相对较大[4]。在池塘水质理化因子中, pH是水体化学状态和生命活动的综合体现, 也是易于变化的并且成为制约刺参集约化养殖的关键水质因子之一[5]。池塘水体pH常因阴天暴雨、大型藻类和浮游藻类大量繁殖、底质老化等因素的影响, 导致水体pH在4~10范围内波动变化[6]。同时, 池塘还易受近岸海水影响, 尤其是近年来海水酸化、浒苔灾害性频繁爆发等, 也导致了池塘养殖水环境pH的大幅波动变化。
在刺参养殖生态学研究中, pH变化对刺参免疫生理机能的影响正逐渐成为众多学者关注的问题之一[7]。目前, 基于pH胁迫对不同规格刺参生长及免疫水平的影响尚未见报道。因此, 本实验选用不同规格的刺参, 针对不同pH条件下对其生长及免疫酶活性的变化进行了实验观察, 旨在为池塘刺参健康养殖提供理论依据。
1 实验材料和方法 1.1 实验材料实验在青岛国家海洋科学研究中心山东省海洋生物研究院种质资源中心鳌山实验室进行, 时间为2017年4月至5月共30 d。实验刺参为本中心选育的“鲁海1号”刺参, 选用体表正常、活力旺盛、摄食良好的不同规格苗种, 按体质量分为小(S)、中(M)、大(L)3个规格, 分别为(10.78±0.13) g、(24.35±0.29) g、(51.21±0.45) g。实验刺参置于容积为1.0 m3的圆形玻璃钢水槽中暂养, 养殖用水为经沉淀沙滤的自然海水, 实验期间水温15.3~19.8℃, 盐度31.6±0.5, 日全量换水1次, 连续充气, 每天按刺参体质量的3%~ 5%投喂人工配合饲料1次, 暂养适应7 d后进行实验。
1.2 实验方法通过预实验, 实验pH分别设置为7.3(Ⅰ)、7.5(Ⅱ)、8.2(对照CK)、8.7(ⅢII)、8.9(ⅣV), 每组刺参均为10头, 分别放养于80 cm60 cm48 cm的塑料水箱中, 每实验组均设3个平行。各实验组使用1 mol/L的盐酸和1 mol/L的氢氧化钠调节pH, 整个实验期间, 每隔8 h采用多参数水质分析仪测定并校正水中pH一次, 变化幅度±0.05个单位。pH调节采取逐步变化的方式, 日变化幅度为0.2个单位, 各实验组pH达到实验设计pH时, 开始胁迫实验。
实验期间, 观测刺参存活、摄食及活动情况, 每10 d统计1次各组刺参生长情况, 实验周期为30 d。
1.3 样品采集与免疫酶指标测定在胁迫5 d、10 d、15 d、20 d、25 d、30 d时, 随机选取刺参共3~5头, 用5.0 mL一次性注射器抽取刺参体腔液, 并将其置于4℃条件下, 以1 000 r/min离心10 min, 取上清液分装于500 L灭菌离心管中, 放置于–80℃冰箱中待测。超氧化物歧化酶(Superoide dismutase, SOD)、过氧化氢酶(Catalase, CAT)和溶菌酶(Lysozyme, LZM)活性的测定均采用南京生物工程研究所研制的试剂盒测定。
LZM含量测定采用比浊法, 每80 U/mL相当于1 μg/mL含量; SOD活性测定采用黄嘌呤氧化酶法, 以1 mL体腔上清液中SOD抑制率达50%时所对应的SOD量为1个活力单位; CAT活性测定采用钼酸铵法, 以1 mL体腔上清液每秒分解1 μmol的H2O2的量为1个活力单位。
1.4 存活和生长指标计算实验期间刺参存活率采用以下公式计算:
存活率(%)=Nd/N0×100,
式中, N0为实验开始时刺参头数, Nd为实验进行到一定天数时刺参存活头数。
实验期间刺参特定生长率(specific growth rate, SGR)采用以下公式计算:
SGR (%/d)=(lnWt–lnW0)/t×100.
式中, W0为初始体质量(g), Wt为终末体质量(g), t为实验天数(d)。
1.5 数据统计实验数据以平均值±标准差(
实验期间, 所有pH胁迫组和对照组3种不同规格刺参存活率均达100%。但实验发现: pH7.5与pH8.7组中, 3种不同规格刺参均正常活动、摄食与生长, 与对照组(pH 8.2)无差异, 而在pH7.3与pH8.9超出正常pH范围下, 不同规格刺参活动与体态伸展差别较大, 并且随着规格减小, 刺参身体逐渐收缩, 摄食量减少, 粪便呈细短状, 活动能力减弱, 尤其pH为8.9时, M和S组刺参身体逐渐明显收缩、肉刺呈平滑状态。
从表 1可以看出, 不同规格刺参经30d胁迫后生长状况呈显著差异。30 d实验结束时, 各规格刺参终末体质量与初始体质量相比不同程度地均有所增加, 除S组pH7.5外, 但各实验组终末体质量均显著低于对照组(P < 0.05), pH偏离越大, 终末体质量越低。3种规格刺参平均体质量最高均为对照组, 分别为S组13.43g、M组29.86g和L组60.28g。
| 规格 | pH | 初体质量/g | 末体质量/g | 存活率/% | 特定生长率/(%/d) |
| SⅠ | 7.3 | 10.78±0.13a | 11.78±0.15a | 100 | 0.30±0.018a |
| SⅡ | 7.5 | 10.78±0.13a | 12.87±0.19bc | 100 | 0.59±0.015b |
| SⅢ | 8.7 | 10.78±0.13a | 12.32±0.24ab | 100 | 0.53±0.023b |
| SⅣ | 8.9 | 10.78±0.13a | 11.59±0.13a | 100 | 0.24±0.021a |
| SCK | 8.2 | 10.78±0.13a | 13.43±0.26c | 100 | 0.73±0.012c |
| MⅠ | 7.3 | 24.35±0.29b | 26.79±0.21de | 100 | 0.32±0.019a |
| MⅡ | 7.5 | 24.35±0.29b | 27.99±0.21d | 100 | 0.46±0.013b |
| MⅢ | 8.7 | 24.35±0.29b | 27.78±0.20d | 100 | 0.44±0.027b |
| MⅣ | 8.9 | 24.35±0.29b | 26.58±0.20e | 100 | 0.29±0.026a |
| MCK | 8.2 | 24.35±0.29b | 29.86±0.17f | 100 | 0.68±0.021d |
| LⅠ | 7.3 | 51.21±0.45c | 56.57±0.12g | 100 | 0.33±0.014a |
| LⅡ | 7.5 | 51.21±0.45c | 58.69±0.12h | 100 | 0.45±0.019b |
| LⅢ | 8.7 | 51.21±0.45c | 58.17±0.23h | 100 | 0.42±0.025b |
| LⅣ | 8.9 | 51.21±0.45c | 56.86±0.23g | 100 | 0.35±0.026a |
| LCK | 8.2 | 51.21±0.45c | 60.28±0.09i | 100 | 0.54±0.011b |
| 注:同列中字母不同表示差异显著(P < 0.05) | |||||
pH胁迫对不同规格刺参SGR的影响同样显著, pH值偏离越大, 刺参SGR越低, 除L组外, 其余各pH组均显著低于对照组(P < 0.05), S对照组个体SGR最高, 为0.73(%/d), 其次为M和L组, 分别为0.68(%/d)、0.54(%/d)。
上述结果表明, 刺参长时间在偏离正常pH范围的水环境中, 会明显抑制其生长。
2.2 pH胁迫对不同规格刺参LZM活性的影响3种规格刺参在不同pH条件的LZM活性如图 1、图 2和图 3所示。3种规格刺参的LZM活性整体表现出相同的变化趋势, 均是先升高后降低。第10天时, 3种不同规格刺参的LZM活性均达到峰值, 显著高于对照组(P < 0.05), 其后随着时间的延长呈现持续降低的趋势, 第25天时, 小规格刺参LZM活性显著低于对照组(P < 0.05), 至胁迫30 d结束时, 各pH处理组刺参LZM活性均显著低于对照组(P < 0.05)。相同pH条件下, 大规格刺参LZM活性高于中、小规格刺参。可以看出, 不同规格刺参LZM活性变化趋势与胁迫强度和时间密切相关。
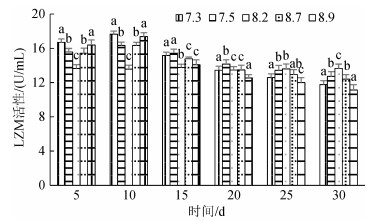 |
| 图 1 不同pH对小规格刺参LZM活性的影响 Fig. 1 Effect of different pH on the activity of LZM of small-sized sea cucumber |
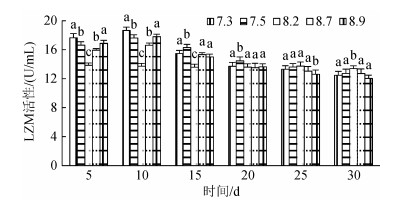 |
| 图 2 不同pH对中规格刺参LZM活性的影响 Fig. 2 Effect of different pH on the activity of LZM of medium-sized sea cucumber |
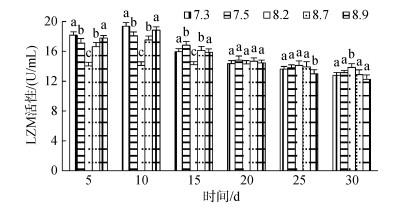 |
| 图 3 不同pH对大规格刺参LZM活性的影响 Fig. 3 Effect of different pH on activity of LZM of large- sized sea cucumber |
3种规格刺参在不同pH条件的SOD活性如图 4~图 6所示。3种规格刺参的SOD活性整体表现出相同的变化趋势, 随着胁迫时间的增加, SOD活性呈现先升高而后降低的变化。在胁迫开始的10d内, 随着胁迫程度加大, 刺参SOD活性呈上升趋势, 到第10天时, 各pH组刺参的SOD活性均达到最高, 显著高于对照组(P < 0.05), 随后刺参SOD活性随胁迫程度加大, 呈下降趋势。当pH 7.5、8.7时, 小中大规格在胁迫20 d后SOD活性低于对照组, 但差异不显著, 而当pH 7.3、8.9时, 小中大规格分别在胁迫20 d、20 d、25 d后免疫酶活性显著低于对照组(P < 0.05)。在相同胁迫条件下, 酶活性依次为大规格> 中规格> 小规格。综上所述, 刺参SOD活性的变化趋势与胁迫强度和时间密切相关。
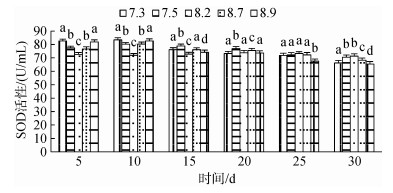 |
| 图 4 不同pH对小规格刺参SOD活性的影响 Fig. 4 Effect of different pH on the activity of SOD of small-sized sea cucumber |
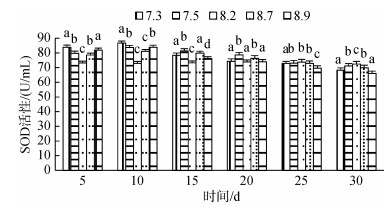 |
| 图 5 不同pH对中规格刺参SOD活性的影响 Fig. 5 Effect of different pH on the activity of SOD of medium-sized sea cucumber |
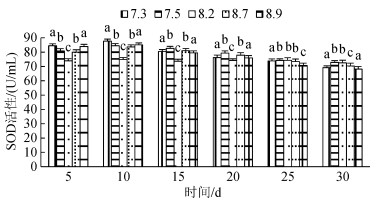 |
| 图 6 不同pH对大规格刺参SOD活性的影响 Fig. 6 Effect of different pH on the activity of SOD of large- sized sea cucumber |
3种规格刺参在不同pH条件的CAT活性如图 7~图 9所示。3种规格刺参的CAT活性整体表现出相同的变化趋势, 随着胁迫时间的增加, CAT活性呈现先升高而后降低的变化。在胁迫开始的10 d内, 刺参CAT活性与胁迫程度呈正相关, 至第10天时, 各pH组刺参的CAT活性均达到最高, 显著高于对照组(P < 0.05), 随后刺参CAT活性与胁迫程度呈反相关。当pH 7.5、8.7时, 小中大规格在胁迫25 d后CAT活性低于对照组, 但差异不显著, 而当pH 7.3、8.9时, 小中大规格分别在胁迫15 d、20 d、20 d后CAT活性显著低于对照组(P < 0.05)。在相同胁迫条件下, 酶活性依次为大规格> 中规格> 小规格。综上所述, 刺参CAT活性的变化趋势与胁迫强度和时间密切相关。
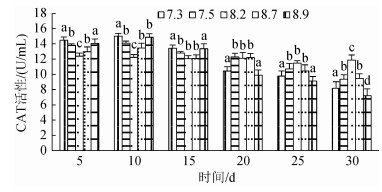 |
| 图 7 不同pH对小规格刺参CAT活性的影响 Fig. 7 Effect of different pH on the activity of CAT of small- sized sea cucumber |
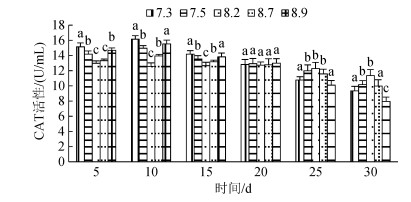 |
| 图 8 不同pH对中规格刺参CAT活性的影响 Fig. 8 Effect of different pH on the activity of CAT of medium- sized sea cucumber |
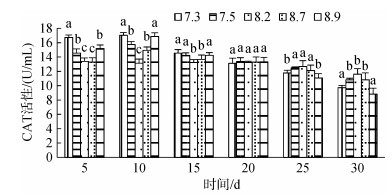 |
| 图 9 不同pH对大规格刺参CAT活性的影响 Fig. 9 Effect of different pH on the activity of CAT of large- sized sea cucumber |
已有研究表明, 环境因子在适宜范围内变动, 对水生生物的生长和存活影响不大, 而如果超过了适宜范围, 就会产生抑制作用[8-9]。在自然环境下, pH变化不仅直接影响水生生物的渗透调节、代谢机能, 而且还可影响氨氮、硫化氢和重金属离子等环境因子, 进而间接影响水生生物的存活、摄食和生长[10]。本实验中, pH对刺参的摄食和生长均有显著的影响, 这与其他学者对大菱鲆(Scophthalmus maximus)[11]、凡纳滨对虾(Litopenaeus nannamei)[12]、毛蚶(Scapharca subcrenata)[13]的研究结果相一致。
刺参作为棘皮动物, 其体腔内环境与水环境密切相关, 水体pH变化直接影响着刺参消化道酶活性, 其活性的高低决定着刺参对营养物质消化吸收的能力, 从而影响刺参生长速率。多数研究表明, 海洋无脊椎动物消化道的pH为5.7~7.9[14]。本研究发现, 当pH为7.5~8.7时, 刺参均能正常活动、摄食与生长, 未表现出异常状况; 而当超出此pH范围时, 出现残饵增多、粪便细短甚至不成形的现象, 这表明不适的pH变化可能不同程度地影响了刺参的消化生理, 导致其饵料利用率下降。
据Wong等[15]研究发现, 为了满足生长和代谢的能量需求, 海洋生物可通过自身调节来补偿因外界条件变化而对其造成的负面影响。刺参长时间处于环境胁迫下, 为减少因外界环境不断变化对机体造成的损伤, 刺参用于代谢的能量消耗增加, 而用于生长的能量消耗减少, 这种现象在刺参处于盐度[16]、温度[17]等胁迫环境下都有相关的研究报道, 本实验研究结果表明pH也同样存在类似变化规律。我们推测, 超过适宜的pH范围, 刺参摄入的能量减少, 而在对pH胁迫的持续抵御中耗费了大量的能量, 显著增加了能量的需求, 因而其能量分配方式发生了变化, 从而导致其生长减缓。
3.2 pH胁迫对刺参非特异性免疫酶活性的影响有研究指出, 环境因子如盐度、温度、溶解氧、氨氮等不仅影响刺参的存活、代谢和生长, 而且显著影响其免疫防御能力[18-21]。刺参属于无脊椎动物, 只具有非特异性免疫, 体液免疫属于非特异性免疫, 有着多种对抗外界病原及异物的各种生物活性分子以及各种免疫活性的酶类[22], 在抵抗外界病原的过程中发挥着巨大作用。LZM是一种专门作用于微生物细胞壁的水解酶, 它广泛存在于水产动物的各种组织、体液和分泌物中, 是生物体内重要的非特异性免疫因子之一, 在抵御外来病原入侵中起重要的作用[23]。因此, LZM作为重要的免疫指标, 其活性可以反映非特异免疫水平[24]。养殖水环境pH的变化往往伴随着其他水质因子的变化, 导致水环境恶化、致病菌滋生, 刺参病原敏感性提高, 因此选择LZM作为首要测定指标。SOD和CAT是生物体内两种相互关联的抗氧化酶, 也是反映生物应对各种胁迫的重要指标[19], 两者能够联合清除活性氧自由基, 在防御机体衰老和生物分子损伤等方面有着极为重要的作用[25]。如果体内SOD和CAT活性下降, 说明刺参在环境胁迫下生命代谢能力减弱或免疫调节功能下降。因此, 研究pH胁迫下SOD和CAT活性的变化具有重要意义。
本实验结果表明, pH胁迫对刺参LZM、SOD和CAT 3种免疫酶活性总体随着胁迫强度和时间呈现先升高后降低的变化趋势, 这说明刺参对pH变化具备一定的渗透调节能力, 刺参为维持体内环境酸碱平衡, 通过调节免疫酶活性来适应pH的变化, 但刺参在维持非特异性免疫酶的高活性存在一个时间极限值, 长期处于应激状态导致刺参机体代谢紊乱, 故又出现酶活性降低的现象, 这与有关学者对脊尾白虾(Palaemon (Exopaemon) carinicauda Holthuis)[26]、拟穴青蟹(Scylla paramamosain)[27]及背角无齿蚌(Anodonta woodiana)[28]的研究结果基本一致。赵先银等[29]曾报道3种虾的LZM、SOD活力随pH(pH7.2和pH9.2)胁迫时间的延长逐渐下降, 由此可见, 适度pH变化刺激可促进生物体的免疫水平, 但若pH应激强度加大时, 生物体免疫活性降低甚至低于正常水平, 这与本实验结果并不矛盾。
3.3 不同规格刺参对pH胁迫的响应养殖环境的剧烈变化, 对刺参生理、免疫等功能产生严重影响, 从而降低了其对环境的适应性。同时, 不同规格刺参对外界的胁迫刺激反应不同[30], 赵斌等[21]研究认为不同规格刺参对氨氮胁迫的敏感性略有差异。本实验中, 不同规格刺参在不同pH条件下对SGR的影响略有差异, 说明刺参的SGR也会受体质量和pH的交互影响。在各pH组中大规格刺参在其表观状态、摄食情况及免疫酶活性均优于中、小规格刺参, 而将同规格的刺参在不同pH组中通过进行生长和免疫酶活性的纵向比较, 发现小规格刺参SGR和免疫酶活性变化幅度最大, 分析原因认为可能是小规格刺参用于维持正常代谢的能量占相对较大的比例, 其免疫调节能力相对较弱, 不能充分调动自身能量保持较高的免疫酶活性, 因此在实验过程中不同pH条件及不同胁迫时间小规格刺参酶活性均最低。另外, 刺参机体免疫活性降低甚至低于正常水平出现的时间节点在不同规格中变化也不尽相同, 研究结果表明, 这种时间临界值小规格刺参出现在15 d, 而大中规格刺参出现在20 d。说明相比较小规格而言, 中、大规格刺参有较强的pH适应性及pH胁迫下非特异性免疫系统的稳定性, 较大规格刺参在面对胁迫环境时更能合理分配并有效利用体内的能量, 通过产生大量免疫酶来提高自身的免疫能力, 以维持自身的生存并抵御环境恶化对机体产生的损伤。
目前, 池塘养殖是刺参养殖的主要模式之一, 随着刺参养殖规模和空间拓展的不断扩大, 刺参池塘存在着在其建设时酸性底质改良不彻底以及养殖池塘老化等问题, 同时在养殖过程中, 池塘养殖密度过大、排泄物及残饵的不断积累, 致使底质恶化, 导致池塘水体呈现周期性或临时性的波动。当pH在7.5~8.7范围时, 刺参通常处于正常的生理状态, 当pH≥8.7或者pH≤7.5时, 短时间内会激活刺参免疫系统, 但长时间胁迫会导致刺参非特异性免疫酶活性持续降低, 病原敏感性增加, 尤其在环境突变的情况下, 极易导致刺参吐脏、化皮, 甚至死亡。因此, 在养殖过程中水环境pH应控制在正常范围内, 以保证刺参正常生存和生长, 若超出正常范围, 长时间胁迫下(小规格≥20 d、大中规格≥25 d)会导致刺参生理代谢紊乱, 生长受到抑制, 增加不良应激反应或患病及死亡的风险。
| [1] |
李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010, 31(4): 126-133. Li Chenglin, Song Aihuan, Hu Wei, et al. Status analysis and sustainable development strategy of sea cucumber Apostichopus japonicas Selenka aquaculture industry in Shandong Province[J]. Progress in Fishery Science, 2010, 31(4): 126-132. DOI:10.3969/j.issn.1000-7075.2010.04.018 |
| [2] |
李成林, 胡炜. 我国刺参产业发展状况、趋势与对策建议[J]. 中国海洋经济, 2017, 1(1): 3-20. Li Chenglin, Hu Wei. The devoplement situation, trend and suggestions on the Apostichopus japonicus Selenka aquaculture industry of China[J]. Marine Economy of China, 2017, 1: 3-20. |
| [3] |
常亚青, 隋锡林, 李俊. 刺参增养殖业现状、存在问题与展望[J]. 水产科学, 2006, 25(4): 198-201. Chang Yaqing, Sui Xilin, Li Jun. The current situation, problem and prospect on the Apostichopus japonicus aquaculture[J]. Fisheries science, 2006, 25(4): 198-201. DOI:10.3969/j.issn.1003-1111.2006.04.010 |
| [4] |
迟爽, 曾勇, 赵振军, 等. 刺参养殖池塘的水质变化[J]. 济南大学学报(自然科学版), 2013, 27(3): 239-244. Chi Shuang, Zeng Yong, Zhao Zhenjun, et al. Variation of water quality in culture ponds for Apostichopus japonicus[J]. Journal of University of Jinan (Science and Technology), 2013, 27(3): 239-244. |
| [5] |
王芸, 李健, 李吉涛, 等. pH胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响[J]. 中国水产科学, 2011, 18(3): 556-564. Wang Yun, Li Jian, Li Jitao, et al. Effects of pH stress on antioxidant system enzyme activities and gene expression of Fenneropenaeus chinensis[J]. Journal of Fishery Science of China, 2011, 18(3): 556-564. |
| [6] |
王双耀, 王鑫, 姜志强, 等. pH值对大菱鲆生长及鱼体生化组成的影响[J]. 广东海洋大学学报, 2013, 33(6): 42-46. Wang Shuangyao, Wang Xin, Jiang Zhiqiang, et al. Effects of pH on growth and biochemical indices of Juvenile Turbot (Scophthalmus maximus)[J]. Journal of Guangdong Ocean University, 2013, 33(6): 42-46. |
| [7] |
Wen Zhao, Miao Liang, Peng Zhang. Effect of yeast polysaccharide on the immune function of juvenile sea cucumber, Apostichopus japonicus Selenka under pH stress[J]. Aquaculture International, 2010, 18(5): 777-786. DOI:10.1007/s10499-009-9300-4 |
| [8] |
许友卿, 张仁珍, 丁兆坤. pH对鱼类繁育及生长发育的影响[J]. 水产科学, 2014, 33(2): 13-136. Xu Youqing, Zhang Renzhen, Ding Zhaokun. Effects of pH on reproduction, growth and development in fish:a review[J]. Fisheries science, 2014, 33(2): 13-136. |
| [9] |
胡思玉, 蔡江燕, 赵海涛, 等. pH对昆明裂腹鱼幼鱼生存的影响[J]. 湖北农业科学, 2014, 53(2): 389-391. Hu Siyu, Cai Jangyan, Zhao Haitao, et al. Effects of pH on growth of juveniles of Schizothorax grahami[J]. Hubei Agricultural Sciences, 2014, 53(2): 389-391. DOI:10.3969/j.issn.0439-8114.2014.02.038 |
| [10] |
张林娟, 潘鲁青, 栾治华. pH变化对日本囊对虾仔虾离子转运酶活力和存活、生长的影响[J]. 水产学报, 2008, 32(5): 758-764. Zhang Linjuan, Pan Luqing, Luan Zhihua. Effects of pH on ion-rransport enzyme activities and survival, growth if Marspenaeus japonicas postlarvae[J]. Journal of Fisheries of China, 2008, 32(5): 758-764. |
| [11] |
王双耀, 毛守康, 苗治欧, 等. pH对大菱鲆幼鱼平均日增重及鳃纤维结构的影响[J]. 天津农学院学报, 2013, 20(4): 10-13. Wang Shuangyao, Mao Shoukang, Miao Zhiou, et al. Effects of pH on average daily growth rate and gill microstructure of juvenile Scophthalmus maximus[J]. Journal of Tianjin Agricultural University, 2013, 20(4): 10-13. DOI:10.3969/j.issn.1008-5394.2013.04.004 |
| [12] |
郑振华, 董双林, 田相利. pH不同处理时间的周期性变动对凡纳滨对虾生长的影响[J]. 中国海洋大学学报, 2008, 38(1): 45-51. Zheng Zhenhua, Dong Shuanglin, Tian Xiangli. Effects of cyclic pH with different durations on the growth of Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2008, 38(1): 45-51. |
| [13] |
方军, 闫茂仓, 张炯明, 等. pH和氨氮对毛蚶稚贝生长与存活影响的初步研究[J]. 浙江海洋学院学报, 2008, 27(3): 281-285. Fang Jun, Yan Maochang, Zhang Jiongming, et al. Preliminary studies on the effects of pH and ammonia on growth and survival to Scapharca subcrenata juveniles[J]. Journal of Zhejiang Ocean University(Natural Science), 2008, 27(3): 281-285. DOI:10.3969/j.issn.1008-830X.2008.03.005 |
| [14] |
王吉桥, 唐黎, 许重, 等. 温度、pH和金属离子对仿刺参蛋白酶活力影响的研究[J]. 海洋科学, 2007, 31(11): 14-18. Wang Jiqiao, Tang Li, Xu Zhong, et al. Effects of temperature, pH value and metal ions on protease activities in the digestive tract from sea cucumber (Apostichopus japonicus)[J]. Marine Sciences, 2007, 31(11): 14-18. DOI:10.3969/j.issn.1000-3096.2007.11.004 |
| [15] |
Wong W H, Cheung S G. Feeding behavior of the green mussel, Perna viridis (L.):Responses to variation in seston quantity and quality[J]. Journal of Experimental Marine Biology and Ecology, 1999, 236(2): 191-207. DOI:10.1016/S0022-0981(98)00207-X |
| [16] |
赵斌, 胡炜, 李成林, 等. 低盐环境对3种规格刺参幼参生长与消化酶活力的影响[J]. 渔业科学进展, 2015, 36(1): 91-96. Zhao Bin, Hu Wei, Li Chenglin, et al. The effects of low salinity on the growth and activities of digestive enzymes in sea cucumber Apostichopus japonicus[J]. Progress in Fishery Science, 2015, 36(1): 91-96. |
| [17] |
赵斌, 李成林, 胡炜, 等. 低温对不同规格刺参幼参生长与耗氧率的影响[J]. 海洋科学, 2011, 35(12): 88-91. Zhao Bin, Li Chenglin, Hu Wei, et al. Effects of low temprature on growth and oxygen consumption rate of different sizes of sea cucumber, Apostichopus japonicus in industrial aquaculture[J]. Marine Sciences, 2011, 35(12): 88-91. |
| [18] |
董晓亮, 李成林, 赵斌, 等. 低盐胁迫对刺参非特异性免疫酶活性及抗菌活力的影响[J]. 渔业科学进展, 2013, 34(3): 82-87. Dong Xiaoliang, Li Chenglin, Zhao Bin, et al. Effects of low salinity stress on the activities of non-specific immune enzymes and antibacterial activity of sea cucumber Apostichopus japonicus[J]. Progress in Fishery Science, 2013, 34(3): 82-87. DOI:10.3969/j.issn.1000-7075.2013.03.011 |
| [19] |
沙飞, 常亚青, 丁君. 两种降温模式的低温胁迫对刺参抗氧化酶活性及丙二醛含量的影响[J]. 大连海洋大学学报, 2015, 30(1): 25-29. Sha Fei, Chang Yaqing, Ding Jun. Effects of two cooling modes of low temperature stress on antioxidant enzyme activities and malondiadehyde level in sea cucumber Apostichopus japonicus[J]. Journal of Dalian Ocean University, 2015, 30(1): 25-29. DOI:10.3969/J.ISSN.2095-1388.2015.01.005 |
| [20] |
李根瑞, 任利华, 孙国华, 等. 低溶氧胁迫对刺参(Apostichopus japonicus)氧化应激指标的影响[J]. 渔业科学进展, 2016, 37(5): 133-139. Li Genrui, Ren Lihua, Sun Guohua, et al. Effects of hypoxic stress on oxidative stress indices in Apostichopus japonicus[J]. Progess in Fishery Sciences, 2016, 37(5): 133-139. |
| [21] |
徐松涛, 赵斌, 李成林, 等. 氨氮胁迫对不同规格刺参(Apostichopus japonicus)存活及非特异性免疫酶活性的影响[J]. 渔业科学进展, 2017, 38(3): 172-179. Xu Songtao, Zhao Bin, Li Chenglin, et al. Effect of ammonia nitrogen stress on the survival and activities of non-specific immune enzymes of different-sized sea cucumber (Apostichopus japonicus)[J]. Progess in Fishery Sciences, 2017, 38(3): 172-179. |
| [22] |
刘洪展, 郑凤荣, 孙修勤, 等. 氨氮胁迫对刺参几种免疫酶活性的影响[J]. 海洋科学, 2012, 36(8): 47-52. Liu Hongzhan, Zheng Fengrong, Sun Xiuqin, et al. Effects of exposure to ammonia nitrogen stress on immune enzyme of holothurians Apostichopus japonicus[J]. Marine Sciences, 2012, 36(8): 47-52. |
| [23] |
常杰, 牛化欣, 张文兵. 刺参免疫系统及其免疫增强剂评价指标的研究进展[J]. 中国饲料, 2011(6): 8-12. Chang Jie, Niu Huaxin, Zhang Wenbing. The research process of immune functions of echinoderms and the evaluation index of immunostimulant[J]. China Feed, 2011(6): 8-12. DOI:10.3969/j.issn.1004-3314.2011.06.004 |
| [24] |
李鑫, 谭志坚, 凌欣华, 等. 溶菌酶在养殖中的应用[J]. 兽医导刊, 2014(4): 51-53. Li Xin, Tan Zhijian, Ling Xinhua, et al. The use of lysozyme in aquaculture[J]. Veterinary Orientation, 2014(4): 51-53. |
| [25] |
王吉桥, 王志香, 张凯, 等. 饲料中添加蛋氨酸硒对仿刺参幼参存活、生长及免疫指标的影响[J]. 大连海洋大学学报, 2012, 27(2): 110-115. Wang Jiqiao, Wang Zhixiang, Zhang Kai, et al. Effects of dietary selenomethionine levels on growth and some immune indices in juvenile sea cucumber Apostichopus japonicus[J]. Journal of Dalian Ocean University, 2012, 27(2): 110-115. DOI:10.3969/j.issn.1000-9957.2012.02.004 |
| [26] |
于天基, 李健, 李吉涛, 等. pH胁迫对脊尾白虾抗氧化酶活力的影响[J]. 海洋科学, 2015, 39(5): 47-53. Yu Tianji, Li Jian, Li Jitao, et al. The effect of changes on antioxidant enzyme activities of ridgetail white prawn (Palaemon carinicauda)[J]. Marine Science, 2015, 39(5): 47-53. |
| [27] |
曾媛媛, 艾春香, 刘建国, 等. pH胁迫对拟穴青蟹体内几种免疫因子的影响[J]. 厦门大学学报(自然科学版), 2008, 47(3): 413-418. Zeng Yuanyuan, Ai Chunxiang, Liu Jianguo, et al. Effects of pH on some immune factors of mud crab, Scylla paramamosain[J]. Journal of Xiamen University (Naturel Science), 2008, 47(3): 413-418. DOI:10.3321/j.issn:0438-0479.2008.03.024 |
| [28] |
文春根, 张丽红, 胡宝庆, 等. pH对背角无齿蚌(Anodonta woodiana)5种免疫因子的影响[J]. 南昌大学学报(理科版), 2009, 33(2): 172-176. Wen Chungen, Zhang Lihong, Hu Baoqing, et al. Effects of pH on the five immune factors of Anodonta woodiana[J]. Journal of Nanchang university (Natural Science), 2009, 33(2): 172-176. DOI:10.3969/j.issn.1006-0464.2009.02.018 |
| [29] |
赵先银, 李健, 陈萍, 等. pH胁迫对3种对虾存活率、离子转运酶和免疫酶活力的影响[J]. 上海海洋大学学报, 2011, 20(5): 720-728. Zhao Xianyin, Li Jian, Chen Ping, et al. Effects of pH stress on survival rate and activities of ion-transport enzyme, immune-related enzymes in three species of shrimps[J]. Journal of shanghai ocean university, 2011, 20(5): 720-728. |
| [30] |
赵斌, 胡炜, 李成林, 等. 低盐环境对3种规格刺参(Apostichopus japonicus)幼参生长与消化酶活力的影响[J]. 渔业科学进展, 2015, 36(1): 91-96. Zhao Bin, Hu Wei, Li Chenglin, et al. The effects of low salinity on the growth and activities of digestive enzymes in sea cucumber Apostichopus japonicus[J]. Progress in Fishery Science, 2015, 36(1): 91-96. |
 2018, Vol. 42
2018, Vol. 42


