文章信息
- 吴志鹏, 王三英, 章跃陵. 2018.
- WU Zhi-peng, WANG San-ying, ZHANG Yue-ling. 2018.
- 大黄鱼肝脏免疫保护蛋白的鉴定
- Identification of immunoprotection proteins in the liver tissue of Larimichthys crocea
- 海洋科学, 42(3): 23-30
- Marine Sciences, 42(3): 23-30.
- http://dx.doi.org/10.11759//hykx20171218003
-
文章历史
- 收稿日期:2017-12-18
- 修回日期:2018-01-15
2. 厦门大学 生命科学学院, 福建 厦门 361005;
3. 汕头大学 理学院生物学系, 广东 汕头 515063
2. School of Life Sciences, Xiamen University, Xiamen 361005, China;
3. Department of Biology, Shantou University, Shantou 515063, China
大黄鱼(Larimichthys crocea)是中国近海主要经济鱼类, 随着人工养殖规模扩大, 其病害问题也频繁爆发[1]。鉴于此, 学者们对大黄鱼的防病抗病机制进行了广泛而深入的研究。然而迄今, 对大黄鱼的研究大多集中在基因结构和功能分析[2-3]、鱼类营养配置[4-6]、优良品种选育[7-9]和相关病原体鉴定[10-11]上, 但对大黄鱼自身免疫抗病机制中的免疫保护蛋白相关研究鲜见报道, 还有待进一步研究。
值得关注的是, 近些年, 人们在水生生物体内发现了一些有意义的免疫保护蛋白。如Myron等[12]在斑点叉尾
因实验周期长达一个多月, 在实验室环境下大黄鱼难以饲养。本研究的大黄鱼是在厦门海面废弃的鱼排进行分组处理, 挑选大小一致(250 g/尾)外表健康无伤的大黄鱼共40条平均分成两组, 即免疫保护组和对照组大黄鱼各20尾分别投放于两个长宽深1 m×1 m×1.5m的小网箱内, 隔日用同种饲料等量喂养。实验期间海水水温为26.1~27.6℃, pH为7.95~8.12。
作者先前利用0.5%福尔马林4℃灭活法制备三联疫苗并通过腹腔注射方式免疫大黄鱼取得初步成效[15]。本研究用同样方法制备三联疫苗后, 对疫苗保护组大黄鱼通过腹腔注射方式进行免疫保护, 实验期间共进行3次免疫, 第一次免疫与第二次免疫相隔14 d, 第二次免疫与第三次免疫相隔10 d, 第三次免疫完后再过7 d用相应的3种混合活菌(副溶血弧菌(Vibrio parahaemolyticus)、嗜水气单胞菌(Aeromonas hydrophila)以及溶藻弧菌(V. alginolyticus))腹腔注射攻击, 3种活菌浓度均为2×109 cfu/mL, 0.2 mL/尾。实验期间对照组同步3次腹腔注射无菌生理盐水后, 用上述3种活菌同剂量腹腔注射攻击。
1.2 样品收集处理免疫保护组中, 收集活菌攻击一周后仍存活的17尾大黄鱼的肝脏样品。对照组中, 收集活菌攻击后一周内濒临死亡(指鱼体倒翻并漂浮水面状态下)共19尾大黄鱼的肝脏样品。所有肝脏样品取自每条鱼的相同位置。用于大黄鱼肝脏样品裂解液配方: 8.0 mol/L尿素, 1% Triton X-100, 2.0 mol/L硫脲, 0.125%SDS, 4%β-巯基乙醇, Tris缓冲液40 mmol/L, 1%两性电解质。肝脏样品处理方法:疫苗保护组每条鱼取100 mg肝脏样品混合后, 按质量比1:4加入上述裂解液, 先用匀浆器匀浆, 再剧烈搅拌裂解, 充分溶解后, 4℃ 10 000 g离心20 min收集上清备用。对照组肝脏样品处理方式与疫苗保护组一样。
1.3 双向电泳两组样品通过常规的双向电泳进行分离, 每管取10 μL上清液直接上样进行双向电泳。第一向等电聚焦电泳, pH范围3.5~10, 预电泳电压200 V, 15 min; 300 V, 30 min; 400 V, 60 min。正式电泳电压400 V, 18 h。样品在等电聚焦电泳分离的基础上, 再通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)进一步分离, 分离胶浓度为13%, 分离胶电压为120 V。疫苗保护组和对照组的肝脏样品在双向电泳时都是在同一套电泳装置上同时进行的。电泳结束后分离胶用浓度为1%的考马斯亮蓝R-250进行染色, 用甲醇-醋酸脱色液脱色后扫描保存, 再用双向凝胶分析软件Melanie进行差异点分析。
1.4 差异点PMF分析和数据库检索对差异点采用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF-MS)进行肽质量指纹图谱(peptide mass fingerprint, PMF)分析。差异点质谱样品使用德国ReFlexTM Ⅲ MALDI-TOF质谱仪进行分析, 质谱仪参数设定与大黄鱼血清蛋白差异点质谱一样[16]。
通过网站(http://www.expasy.org/tools/peptident. Html)对各差异点PMF数据进行匹配查询。查询条件参数设定为: PMF中的肽片段质量控制在800~3 500, 表观PI值为正负2, 表观Mw的误差为正负30%, 肽片段分子量最大容许误差范围为正负100×106, 每个肽链允许有1个不完全裂解位点, 最少匹配肽片段数规定为4, 离子选择[M+H]+和monoisotopic, 物种来源选择other Vertebrata, 数据库选择Swiss-Prot and TrEMBL, 半胱胺酸用碘乙酰胺处理。
1.5 差异点抗体制备和Western-blot分析收集1号、10号、14号、18号蛋白差异点切成碎片, 反复冻融, 与相同体积完全佐剂(0.3 mg/mL卡介苗, 羊毛脂:石蜡油=1:3, v/v)混合, 先用注射器反复挤压, 再超声处理2 min后直接皮下注射免疫小鼠, 剂量为0.2 mL/只。每只小鼠先后进行3次注射免疫, 第三次注射免疫后过5 d收集小鼠血清作为一抗。
Western blot检测肝脏样品中相应蛋白的表达变化情况。对照组和疫苗保护组样品进行SDS-PAGE (其中浓缩胶浓度5%, 分离胶浓度13%;浓缩胶电压80 V, 分离胶电压120 V)后, 电转移至PVDF膜, 先后与鼠源血清一抗(1:200, 室温孵育2 h)、兔抗鼠二抗IgG-HRP(购自SouthernBiotech, 1:500, 室温孵育1 h)孵育, 最后加底物二氨基联苯胺(Diaminobenzidine, DAB)进行显色。
2 结果与分析 2.1 大黄鱼疫苗保护组与对照组肝脏2D-PAGE图谱比较分析在相同的电泳条件和电泳装置下, 获得对照组和疫苗保护组肝脏样品各自2DE图谱, 见图 1。两组图谱模式一致可进行对比分析。在两图谱相同位置共找到20个显著差异点。这些差异点在图 1中分别用箭头和数字标出。图 2是肝脏2DE图谱切割图比较, 旁边图是用2D凝胶分析软件Melanie对这些差异点做相对定量比较。其中, 1是对照组, 2是疫苗保护组, 1、2上方的数值是各差异点的具体数值。这20个差异点中, 疫苗保护组中新增的点编号为: 9, 11, 14, 17, 19;疫苗保护组中消失的点编号为: 1, 4, 6, 7;疫苗保护组中表达上调的点编号为: 5, 10, 12, 13, 16, 18, 20;疫苗保护组中疫苗保护组中表达下调的点编号为: 2, 3, 8, 15。
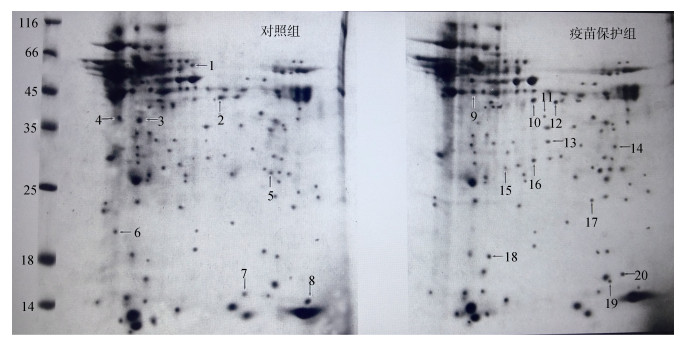 |
| 图 1 大黄鱼免疫保护组和对照组肝脏2-DE图谱比较分析(pH 3.5~10) Fig. 1 Comparative analysis of 2-DE maps between control group (above left) and vaccine protection group (above right) in the liver of L. crocea (pH 3.5~10) |
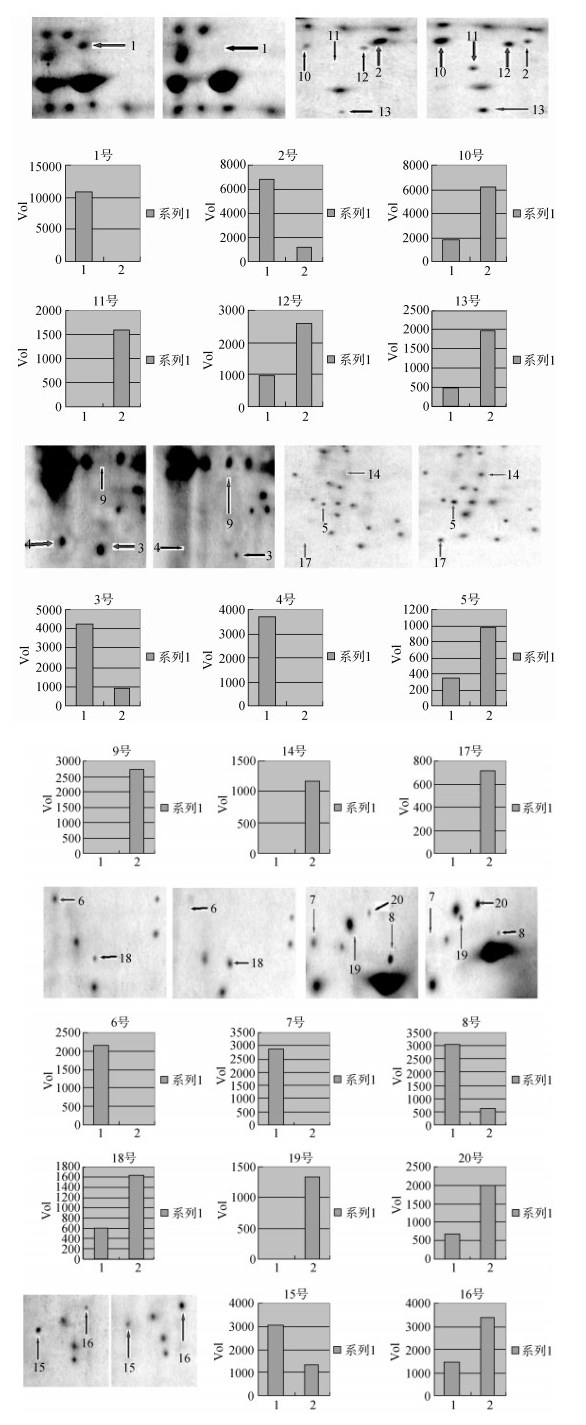 |
| 图 2 大黄鱼肝脏2-DE局部图比较分析(箭头所示为差异点, 左为对照组, 右为疫苗保护组) Fig. 2 Comparative analysis of partial 2-DE maps in the liver of L. crocea (The arrows show the different spots, left as the control group and right as the vaccine protection group) |
如表 1所示, 对20个显著的差异点采用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)进行肽质量指纹图谱(PMF)分析, 共得到18个差异点的肽质量指纹图谱。18个差异点的肽指纹图谱信息用PepIdent软件在Swiss-Prot and TrEMBL数据库进行检索, 发现其与与免疫型受体、新型抗原受体等蛋白具有高度同源性。对这些同源蛋白进行归类, 其中属于调控蛋白类差异点有5个(6号、9号、12号、15号、16号), 代谢酶类5个(1号、5号、8号、19号、20号), 核蛋白3个(2号、3号、10号), 免疫相关类蛋白2个(13号、18号), 细胞外基质糖蛋白1个(11号), 其他功能未知蛋白2个(4号、14号)。
| 差异点编号 | 匹配肽数量/个 | 数据库中编号 | 描述 | 等电点 | 分子量/kDa | 覆盖率/% |
| 1 | 11 | O42138 | 一种金属蛋白酶(EC 3.4.24.1) | 6.14 | 69.5 | 19.0 |
| 2 | 6 | Q9DD48 | 鲱鱼上某种功能未知核蛋白 | 6.50 | 46.4 | 16.5 |
| 3 | 10 | Q7ZU28 | 斑马鱼核仁中富含半胱氨酸蛋白 | 5.01 | 35.9 | 27.2 |
| 4 | 7 | Q802V2 | 斑马鱼上某种蛋白 | 4.40 | 39.1 | 30.4 |
| 5 | 8 | Q90XF8 | 剑鱼上磷酸丙糖异构酶B(EC 5.3.1.1) | 7.61 | 26.5 | 39.3 |
| 6 | 5 | Q9DGF2 | 鲤鱼上抑制素/激活素 | 未知 | 未知 | 39.1 |
| 8 | 4 | Q7LZQ1 | 中华鳖溶菌酶C(EC 3.2.1.17) | 8.77 | 14.7 | 38.2 |
| 9 | 5 | Q6TNV4 | 斑马鱼上分子伴侣TCP1的亚基 | 5.22 | 59.3 | 16.1 |
| 10 | 14 | Q8JFF3 | 黄尾 上含锌指结构的核蛋白 上含锌指结构的核蛋白 |
6.12 | 48.9 | 23.7 |
| 11 | 4 | Q8AYK9 | 青鳉鱼上胞外基质糖蛋白ZPC3 | 6.36 | 40.6 | 20.9 |
| 12 | 12 | Q9PVE4 | 斑马鱼上甲状腺素β受体 | 6.49 | 44.3 | 32.1 |
| 13 | 5 | Q9IAY7 | 桔点圆鲀鱼上免疫型受体 | 6.95 | 36.7 | 25.2 |
| 14 | 6 | Q7ZVX2 | 斑马鱼上某种蛋白 | 7.98 | 35.2 | 23.9 |
| 15 | 8 | Q8JIP6 | 珠星滩头鱼绒毛膜蛋白酶抑制剂 | 5.68 | 32.7 | 31.5 |
| 16 | 5 | Q90ZZ0 | 斑马鱼上含锌指结构调节蛋白 | 6.42 | 30.0 | 25 |
| 18 | 4 | Q8AXI1 | 铰口鲨上新型抗原受体 | 未知 | 未知 | 44.1 |
| 19 | 4 | P60043 | 眼镜蛇磷脂酶A2的一种亚型 | 7.53 | 13.2 | 30.3 |
| 20 | 6 | P81458 | 蝰蛇磷脂酶A2 RVV-VD(EC 3.1.1.4) | 8.19 | 13.6 | 35.5 |
在上述研究基础之上, 为了进一步鉴定差异点变化规律, 选取对照组中1号点, 免疫保护组中新增的14号点以及表达上调的10号和18号点。除18号分子量未知外, 1号、10号、14号分子量分别约是69.5、48.9和35.2 kDa(表 1)。4个差异点的Western blot验证结果见图 3。结果发现, 这4个差异点的分子量和相对蛋白质浓度信息与图 3中抗体显示的条带与对应的蛋白点的分子量位置相符, 4个差异点的条带浓度变化与双向电泳图谱一致。图 3中10号差异点对照组出现2条反应条带, 推测下方的条带可能是该蛋白的降解产物。
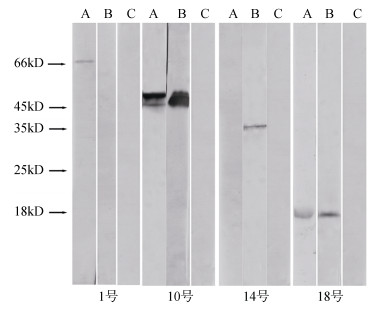 |
| 图 3 部分差异点的Western blot分析 Fig. 3 Western blot analysis of some different spots A.对照组; B.疫苗保护组; C.空白 A. control group; B. vaccine protection group; C. blank |
肝脏是生物体最重要的代谢器官, 不同的生理或病理状态下, 肝脏合成和分泌的蛋白质存在较大差异。近些年, 针对不同模型的老鼠肝脏蛋白质组学研究取得不少进展。Zhang等[17]、Mako等[18]利用比较蛋白质组技术分别在C57BL/6J小鼠和慢性酒精肝小鼠鉴定了748个低丰度蛋白和46个蛋白差异点。这些研究成果表明, 利用比较蛋白质组学技术的高灵敏高通量特性对生物体肝脏蛋白质组进行研究是确实可行的。利用比较蛋白质组学技术对鱼类的肝脏蛋白质组进行研究也取得一些进展。如万翔[19]利用病毒类似物Poly(I:C)诱导大黄鱼, 从大黄鱼的肝脏中初步鉴定出30个蛋白质差异点。
本研究通过比较蛋白质组学技术对比疫苗保护组和对照组的大黄鱼肝脏蛋白质双向电泳图谱, 找到20个明显的差异点, 进一步利用MALDI-TOF-MS对差异点进行肽质量指纹图谱(PMF)分析, 并通过数据库查询初步鉴定出18个差异点的肽段。进一步分析发现, 2个免疫相关蛋白是与免疫保护直接相关的蛋白质, 其中13号为免疫型受体(分子量约为36.7 kDa), 18号为新型抗原受体。近些年, 对鱼类体内的免疫型受体研究逐渐深入。Serena等[20]、Desai等[21]分别对欧洲海鲈鱼(Dicentrarchus labrax)和青鳉鱼(Oryzias Latipes)的免疫型受体相应基因结构进行分析, 发现此类受体基因是免疫球蛋白超级基因家族一员, 且是一种可以迅速进化的基因复合体。Prapruddee等[22]在牙鲆(Paralichthys olivaceus)鳃、肠、肝脏、心脏等器官中发现一种新型免疫型受体, 与之前报道的其他鱼类免疫型受体之间的氨基酸序列存在约30%~40%相似性。Jacqueline等[23]发现斑点叉尾
除了对免疫型受体分子结构和基因研究外, 更多学者对免疫型受体分子功能进行探索。现有文献[24-26, 28]表明, 免疫型受体在鱼类抵抗病原体感染中发挥重要的作用。Benjamin等[24]揭示了在斑点叉尾
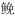


本研究疫苗保护组的大黄鱼攻毒后免疫保护率达85%, 远高于而没有疫苗保护的对照组。同时在疫苗保护组的肝脏检测到13号免疫型受体浓度(相对值1978.02)是对照组(相对值490.13)的4倍, 18号新型抗原受体浓度(相对值1638.71)是对照组(相对值608.19)的2.7倍。经过疫苗保护后的大黄鱼肝脏中免疫型受体和新型抗原受体浓度明显升高。作者认为这两类受体在大黄鱼肝脏保持较高浓度(特别是免疫型受体的浓度)与提高鱼体自身免疫功能密切相关。大黄鱼在疫苗刺激后, 通过某种信号途径增强了肝脏细胞中这两类受体相应基因的表达, 从而使这两类受体在疫苗保护组的大黄鱼肝脏中维持较高浓度, 较高浓度免疫型受体可直接增强免疫细胞的吞噬作用, 在抵抗致病菌感染时发挥作用。至于较高浓度新型抗原受体, 有限的研究文献[27]表明其在淋巴细胞上表达, 作为特定免疫反应的调解者。另外Carla等[28]在感染拟锥虫(Trypanoplasma borreli)的鲤鱼体内发现巨噬细胞表达了大量可溶性的免疫型受体, 通过吗啉反义技术(morpholino antisense technology)进一步发现这类免疫型受体参与在寄生虫诱导下NO的生成, 从而推测这类免疫型受体是在NO介导抵御寄生虫中发挥重要作用。巧合的是, 作者曾在抗病力强的大黄鱼血清蛋白中, 初步鉴定诱导型一氧化氮合成酶(iNOS)与大黄鱼抵抗病原体入侵密切相关, 诱导型一氧化氮合成酶所催化产生的NO可直接结合病原体的靶点, 抑制病原体入侵[17]。结合本研究中发现的免疫型受体和新型抗原受体, 前者直接增强免疫细胞的吞噬作用, 后者作为特定免疫反应的调解者, 两者作为大黄鱼体内重要的免疫保护蛋白, 它们和iNOS催化产生的NO, 一起协助大黄鱼抵御病原体的入侵。
| [1] |
曹飞飞, 朱凝瑜, 郑晓叶. 2014-2016年浙江省大黄鱼养殖病害测报及防治建议[J]. 浙江农业科学, 2017, 58(6): 1043-1047. Cao Feifei, Zhu Ningyu, Zheng Xiaoye. Suggestions on diseases detection and prevention culture large yellow croaker in Zhejiang Province by 2014-2016[J]. Journal of Zhejiang Agricultural Sciences, 2017, 58(6): 1043-1047. |
| [2] |
郑维兵, 慕鹏飞, 丁连帅, 等. 大黄鱼(Larimichthys crocea)IL-10基因的克隆与表达分析[J]. 海洋学报, 2017, 39(4): 50-60. Zheng Weibing, Mu Pengfei, Ding Lianshuai, et al. Cloning and expression analysis of large yellow croaker (Larimichthys rocea) IL-10 gene[J]. Journal of Oceanography, 2017, 39(4): 50-60. |
| [3] |
He J Y, Hui H H, Wu C W. Identification of SCARA3, SCARA5 and MARCO of class A scavenger receptor-like family in Pseudosciaena crocea[J]. Fish and Shellfish Immunology, 2014, 41(2): 238-249. DOI:10.1016/j.fsi.2014.07.037 |
| [4] |
陆游, 周飘萍, 袁野, 等. 不同小麦淀粉和脂肪水平对大黄鱼的生长性能、饲料利用及糖代谢关键酶活力的影响[J]. 水产学报, 2017, 41(2): 297-310. Lu You, Zhou Piaoping, Yuan Ye, et al. Effects of different wheat starch and lipid levels on growth performance, feed utilization and hepatic carbohydrate metabolism key enzymes activities in large yellow croaker (Larimichthys crocea)[J]. Journal of Fisheries of China, 2017, 41(2): 297-310. |
| [5] |
邢淑娟, 孙瑞健, 马俊, 等. 饲料糖水平对大黄鱼生长和糖代谢的影响[J]. 水生生物学报, 2017, 41(2): 265-276. Xing Shujuan, Sun Ruijian, Ma Jun, et al. Effects of dietary carbohydrate on growth performance and glycometabolism of large yellow croaker Larimichthys crocea[J]. Acta Hydrobiologica Sinica, 2017, 41(2): 265-276. DOI:10.7541/2017.33 |
| [6] |
Zheng J L, Zhu Q L, Shen B, et al. Effects of starvation on lipid accumulation and antioxidant response in the right and left lobes of liver in large yellow croaker Pseudosciaena crocea[J]. Ecological Indicators, 2016, 66: 269-274. DOI:10.1016/j.ecolind.2016.01.037 |
| [7] |
黄伟卿, 韩坤煌, 陈仕玺, 等. 海捕野生大黄鱼选育子代生长性能及现实遗传力分析[J]. 水产科学, 2016, 35(3): 204-209. Huang Weiqing, Han Kunhuang, Chen Shixi, et al. Realized heritability and growth of offsprings of wild large yellow croaker Pseudosciaena crocea[J]. Fisheries Science, 2016, 35(3): 204-209. |
| [8] |
杨启莲, 姚翠鸾, 王志勇. 大黄鱼选育群体与普通养殖群体部分免疫指标的比较[J]. 海洋科学, 2012, 36(10): 48-53. Yang Qilian, Yao Cuiluan, Wang Zhiyong. Comparasion of some immune parameters between different strains of large yellow croaker (Larimichthys crocea)[J]. Marine Sciences, 2012, 36(10): 48-53. |
| [9] |
刘招坤. 大黄鱼群体选育世代F1和F2生长比较分析[J]. 水产科学, 2015, 32(1): 38-42. Liu Zhaokun. Comparison of growth in generations F1 and F2 of large yellow croaker Larimichthys crocea bred seletively[J]. Fisheries Science, 2015, 32(1): 38-42. |
| [10] |
李忠琴, 张坤, 林茂, 等. 大黄鱼(Pseudosciaena crocea)致病性维氏气单胞菌的分离鉴定与药敏特性研究[J]. 海洋与湖沼, 2017, 48(1): 139-147. Li Zhongqin, Zhang Kun, Lin Mao, et al. Isolation and identification of pathogenic Aeromonas veronii from Pseudosciaena crocea[J]. Oceanology Et Limnology Sinica, 2017, 48(1): 139-147. |
| [11] |
刘家富, 余祚溅, 林永添, 等. 大黄鱼假单胞菌病的初步研究[J]. 海洋科学, 2004, 28(2): 5-7, 80. Liu Jiafu, Yu Zuojian, Lin Yongtian, et al. Studies on the Pseudomonas disease of large yellow croaker[J]. Maine Sciences, 2004, 28(2): 5-7, 80. |
| [12] |
Myron A Z, Fei C J, Dustin M E, et al. Imaging flow cytometry and GST pulldown assays provide new insights into Channel catfish leukocyte immune-type receptor-mediated phagocytic pathways[J]. Developmental and Comparative Immunology, 2017, 67: 126-138. DOI:10.1016/j.dci.2016.10.011 |
| [13] |
章跃陵, 卓奕明, 朱永飞, 等. 南美白对虾人工感染细菌后肝胰脏中主要变化蛋白的研究[J]. 水产科学, 2005, 24(6): 19-23. Zhang Yueling, Zhuo Yiming, Zhu Yongfei, et al. Identification of two types of main differential proteinsin the hepatopancreas in whiteleg shrimp Litopenaeus vannamei infected by pathogenic bacteria Vibrio alginolyticus[J]. Fisheries Science, 2005, 24(6): 19-23. |
| [14] |
李长平, 黄河, 王帆, 等. 凡纳滨对虾血蓝蛋白酶解多肽的凝集与抑菌活性[J]. 水生生物学报, 2017, 41(5): 1042-1047. Li Changping, Huang He, Wang Fan, et al. Agglutinative and antibacterial activity of the peptides hydrolyzed from Litopenaeus vannamei hemocyanin with trypsin[J]. Acta Hydrobiologica Sinica, 2017, 41(5): 1042-1047. DOI:10.7541/2017.130 |
| [15] |
吴志鹏, 王三英. 三联疫苗对大黄鱼常见细菌性疾病免疫保护的实验研究[J]. 厦门大学学报(自然科学版), 2004, 43(1): 115-118. Wu Zhipeng, Wang Sanying. Experimental study on immune protection of trivalent vaccine to common bacterial diseases of Pseudosciaena crocea[J]. Journal of Xiamen University(Natural Science), 2004, 43(1): 115-118. |
| [16] |
吴志鹏, 王三英. 大黄鱼血清抗病功能蛋白分析[J]. 厦门大学学报(自然科学版), 2012, 51(1): 121-124. Wu Zhipeng, Wang Sanying. Analysis of the antidisease protien in Pseudosciaena crocea serum[J]. Journal of Xiamen University (Natural Science), 2012, 51(1): 121-124. |
| [17] |
Zhang Y, Fang C, Bao H, et al. Nuclear proteome profile of C57BL/6J mouse liver[J]. Sci China Life Sci, 2013, 56: 513-523. DOI:10.1007/s11427-013-4488-y |
| [18] |
Mako Y, Mamoru S, Masanori S, et al. Combined proteomic analysis of liver tissue and serum in chronically alcohol-fed rats[J]. Alcohol Clin Exp Res, 2013, 37(s1): 79-87. |
| [19] |
万翔. Poly(I: C)诱导的大黄鱼肝脏的差异蛋白质组学研究及两种免疫相关基因的克隆和鉴定[D]. 厦门: 国家海洋局第三海洋研究所, 2008: 28-45. Wan Xiang. Proteomics for liver of Pseudosciaena crocea induced by Poly(I: C) and identification of two immune genes[D]. Xiamen: the third Marine institute of the state oceanic administration, 2008: 28-45. http://cdmd.cnki.com.cn/Article/CDMD-85303-2008148746.htm |
| [20] |
Serena F, Heiner K, Massimo M, et al. Identification and characterisation of a novel immune-type receptor (NITR) gene cluster in the European sea bass, Dicentrarchus labrax, reveals recurrent gene expansion and diversification by positive selection[J]. Immunogenetics, 2009, 61(11-12): 773-788. DOI:10.1007/s00251-009-0398-3 |
| [21] |
Desai S, Heffelfinger A K, Orcutt T M, et al. The medaka novel immune-type receptor (NITR) gene clusters reveal an extraordinary degree of divergence in variable domains[J]. BMC Evolutionary Biology, 2008, 8: 177. DOI:10.1186/1471-2148-8-177 |
| [22] |
Prapruddee P, Hidehiro K, Ikuo H, et al. A novel immune-type receptor of Japanese flounder (Paralichthys olivaceus) is expressed in both T and B lymphocytes[J]. Fish and Shellfish Immunology, 2007, 22(5): 467-476. DOI:10.1016/j.fsi.2006.05.007 |
| [23] |
Jacqueline M, Karlijn V, Benjamin C S, et al. Stimulatory catfish leukocyte immune-type receptors (IpLITRs) demonstrate a unique ability to associate with adaptor signaling proteins and participate in the formation of homo-and heterodimers[J]. Molecular Immunology, 2009, 47(2-3): 318-331. DOI:10.1016/j.molimm.2009.09.014 |
| [24] |
Benjamin C M, Herman D C, Deborah N B, et al. Channel catfish leukocyte immune-type receptor mediated inhibition of cellular cytotoxicity is facilitated by SHP-1-dependent and -independent mechanisms[J]. Developmental and Comparative Immunology, 2012, 37(1): 151-163. |
| [25] |
Meng F Q, Wang R X, Xu T J. Identification of 21 novel immune-type receptors in miiuy croaker and expression pattern of three typical inhibitory members[J]. Developmental and Comparative Immunology, 2014, 45(2): 269-277. |
| [26] |
Dustin M E, Joshua G P, James L S. Trypsin differentially modulates the surface expression and function of channel catfish leukocyte immune-type receptors[J]. Developmental and Comparative Immunology, 2016, 65: 231-244. DOI:10.1016/j.dci.2016.07.014 |
| [27] |
Zuniga-Pfluker J C. Introduction:antigen receptors during lymphocyte development[J]. Seminars in Immunology, 2002, 14(5): 295-296. DOI:10.1016/S1044-5323(02)00062-3 |
| [28] |
Carla M S, Bird S, Raes G, et al. A novel soluble immune-type receptor (SITR) in teleost fish:carp SITR is involved in the nitric oxide-mediated response to a protozoan parasite[J]. PLOS One, 2011(1): e15986. |
 2018, Vol. 42
2018, Vol. 42

