文章信息
- 刘慧, 杨振男, 刘岚, 陈碧双. 2018.
- LIU Hui, YANG Zhen-nan, LIU Lan, CHEN Bi-Shuang. 2018.
- 海洋真菌Rhodotorula mucilageinosa GIM 2.157介导邻-、间-、对-溴苯乙酮的不对称还原反应
- Asymmetric bioreduction of o-, m-, and p-bromo acetophenone by whole cells of marine-derived fungi
- 海洋科学, 42(3): 106-112
- Marine Sciences, 42(3): 106-112.
- http://dx.doi.org/10.11759/hykx20170711002
-
文章历史
- 收稿日期:2017-07-11
- 修回日期:2017-12-10
2. 中山大学 南海资源开发与保护协同创新中心, 广东 广州 510275
2. South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center, Sun Yat-Sen University Guangzhou 510275, China
苯环上含卤素的手性芳香醇是合成手性药物、精细化学品、农药及液晶材料等的重要中间体[1]。随着环境污染的日益加剧和石油资源的日益枯竭, 以可再生的物质资源为原料, 以高效专一、绿色节能为特征的生物催化过程越来越受到关注。以海洋来源微生物作为生物催化剂应用于有机合成的研究在世界范围内都属于新兴领域。与常规来源的酶相比, 海洋微生物在极端条件(例如极端温度、压力、pH或有机溶剂)下产生的新型酶具有更高的稳定性和活性, 更值得广泛应用于生物催化生产精细化学品。意大利Romano D.教授课题组从地中海东部的深海超咸水缺氧盆地来源的细菌中, 筛选到一系列具有高效拆分芳基酯生产手性芳基羧酸的催化活性的菌株[2]; 巴西Porto A. L. M.教授课题组从圣保罗州的北部海岸(巴西)来源的真菌中, 筛选到一系列具有高效不对称还原叠氮基酮的催化活性的菌株[3-6]; 韩国Lee E. Y.教授课题组从海洋来源真菌中, 筛选到一系列具有高效水解苯乙烯氧化物生产手性邻二醇的催化性能的菌株[7-9]。而采集自广东省各地的海洋来源微生物作为催化剂的研究则是甚少。不同采集地点的微生物的组成是存在显著差异的, 体内形成的代谢途径和酶系也是极其不同的, 因此, 利用不同来源的海洋真菌催化芳基酮的不对称还原反应具有重要的研究价值。
本文以研究海洋真菌R.mucilageinosa GIM 2.157催化邻-、间-、对-溴苯乙酮的不对称还原反应为模型(图 1), 考察底物取代基位置的差异性对产物产率和立体选择性的影响。同时考察了温度、pH、反应时间和底物浓度等多个因素对还原产物(S)-1-(4-溴苯基)乙醇产率和对映选择性的影响。
 |
| 图 1 芳香酮的不对称还原 Fig. 1 Asymmetric reduction of aromatic ketones |
LC1620高效液相色谱[正相手性柱: Ultimate Cellu-D, 4.6 mm × 250 mm, 5 μm](购买于上海舜宇恒平科技有限公司); MS-100恒温混匀仪(购买于北京奥创兴业科技发展有限公司); Anton Paar型旋光仪MCP200(购买于安东帕中国有限公司); PHS-3C型pH计(购买于上海嘉鹏科技有限公司); Bruker-400核磁共振仪(购买于瑞士Bruker有限公司); 湘仪L530离心机(购买于上海沪粤明科学仪器有限公司); 柱层析硅胶200~300目(购买于青岛鼎康硅胶有限公司); 50 mL离心管(购买于广州豪凯生物科技有限公司)。
邻-, 间-, 对-溴苯乙酮购自上海麦克林科技有限公司, (±) 1-(2-溴苯基)乙醇, (±) 1-(, 3-溴苯基)乙醇, (±) 1-(4-溴苯基)乙醇通过硼氢化钠还原相应的酮制得; 其他试剂均为市售分析纯; R. mucilaginosa GIM 2.157购买于广东省微生物菌种保藏中心。
1.2 菌的活化及培养用无菌吸管吸取0.3~0.5 mL适宜的液体培养基(葡萄糖1%、蛋白胨1%、酵母提取物0.5%、琼脂2%)滴入安瓿瓶内, 轻轻震荡, 使冻干菌体溶解呈悬浮状。吸取全部菌悬液, 移植于培养基平板上, 28℃下培养48 h。然后挑菌落于装有液体培养基的1L的锥形瓶中(培养基配方为:蒸馏水500 mL、葡萄糖7.5 g、蛋白胨2.5 g、酵母膏2.5 g、Na2HPO4 0.25 g、NaH2PO4 0.25 g、MgSO4 0.25 g、NaCl 0.5 g), 在摇床中恒温28℃, 转速180 r/min将该培养物振荡约48 h。然后在4000 r/min和4℃的条件下离心20 min收集细胞。除去上清液, 并用Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH=7.0)冲洗细胞并再次离心, 弃去上清液, 将颗粒物(真菌全细胞)于-20℃条件下保存。
1.3 海洋真菌催化对溴苯乙酮的条件优化 1.3.1 温度的优化反应液含有0.5 g葡萄糖, 10 mmol/L对溴苯乙酮, 10 mL Na2HPO4 -KH2PO4缓冲液(100 mmol/L, pH 7.0)和3 g R. mucilageinosa GIM 2.157静息细胞, 反应在20~50℃条件下分别进行。反应24 h后, 样品经过适当的后处理, 在手性HPLC上进行产物产率和立体选择性的分析。后处理程序如下:离心除去细胞, 添加NaCl以饱和2 mL上清液, 然后用2 × 1 mL的正己烷/异丙醇= 95/5溶剂萃取。将合并的有机层用无水Na2SO4干燥并通过高效液相测定产率和ee值。
1.3.2 pH的优化使用柠檬酸盐/磷酸盐缓冲液(pH 3.0~6.0)和磷酸钾缓冲液(pH 7.0~9.0)来控制反应介质的pH。反应液含有0.5 g葡萄糖, 10 mmol/L对溴苯乙酮, 10 mL Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH 3~9)和3 g R. mucilageinosa GIM 2.157静息细胞。反应在25℃的条件下进行, 反应24 h后, 样品经过适当的后处理(详见1.3.1温度的优化), 在手性HPLC上进行产物产率和立体选择性的分析。
1.3.3 反应时间的优化反应液含有0.5 g葡萄糖, 10 mmol/L对溴苯乙酮, 10 mL Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH=7)和3 g R. mucilageinosa GIM 2.157静息细胞, 反应在25℃的条件下进行。根据反应时间(0.15~48 h)按时取出样品。样品经过适当的后处理后(详见1.3.1温度的优化), 在手性HPLC上进行产物产率和立体选择性的分析。
1.3.4 底物浓度的优化反应液含有0.5 g葡萄糖, 不同浓度(3.33~ 20 mmol/L)的对溴苯乙酮, 10 mL Na2HPO4-KH2PO4Na缓冲液(100 mmol/L, pH=7)和3 g R. mucilageinosa GIM 2.157静息细胞。反应在25℃条件下进行, 反应24 h后, 样品经过适当的后处理(详见1.3.1温度的优化), 在手性HPLC上进行产物产率和立体选择性的分析。
1.3.5 共底物的优化反应液含有10 mmol/L对溴苯乙酮, 10 mL Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH 7)和3 g R. mucilageinosa GIM 2.157静息细胞以及添加不同共底物, 在25℃的条件下进行, 反应24 h后, 样品经过适当的后处理(详见1.3.1温度的优化), 在手性HPLC上进行产物产率和立体选择性的分析。
1.4 海洋真菌催化邻-、间-、对-溴苯乙酮的不对称还原取2~3 g全细胞于50 mL的离心管中, 加入0.5 g葡萄糖, 10 mL Na2HPO4-KH2PO4缓冲溶液(100 mmol/L, pH 7)和10 mmol/L的底物(邻-、间-、对-溴苯乙酮), 在25℃, 220 r/min的条件下反应24 h后取出。离心, 取2 mL上清液用2 mL正己烷︰异丙醇=95︰5的溶剂萃取。有机相合并后用无水Na2SO4干燥。以未添加细胞在相同条件下进行空白实验。反应在给定温度下进行24 h。后处理程序如下:离心除去细胞, 添加NaCl以饱和2 mL上清液, 然后用2 × 1 mL的正己烷/异丙醇=95/5溶剂萃取。将合并的有机层用无水Na2SO4干燥并通过高效液相测定产率和ee值。
1.5 分析与检测通过使用Shimadzu LC-10AT VP系列和Shimadzu SPD-M10Avp光电二极管阵列检测器(190~370 nm)的手性AD-H柱(洗脱液︰正己烷/异丙醇=95︰5, V/V), 流速: 0.5 mL/min, 柱温25℃)。根据以下保留时间数据(如表 1所示), 通过手性HPLC分析测定分析物的(yield)及对映体过量(ee)值。
| 序号 | 化合物 | 底物保留时间/min | 产物保留时间/ min |
| 1 | 邻溴苯乙酮 | 11.85 | tR(R)=12.71; tR(S)=13.23 |
| 2 | 间溴苯乙酮 | 10.66 | tR(R)=16.45; tR(S)=17.39 |
| 3 | 对溴苯乙酮 | 11.21 | tR(R)=16.83; tR(S)=17.99 |
式中, CS表示反应一定时间实际增加的S异构体产物的摩尔浓度; CR表示反应一定时间实际增加的R异构体产物的摩尔浓度; C0表示反应前底物摩尔浓度。
1.6 外消旋醇的化学合成在0℃的冷却条件下, 将2.5 mmol底物(邻-、间-、对-溴苯乙酮)溶于50 mL甲醇, 然后加入10 mmol NaBH4, 搅拌10 min后, 温热至室温, 搅拌3~4 h。再用2 mmol/L的HCl调节pH至7.0猝灭反应。所得的混合物用EtOAc(50 mL×3)进行萃取, 在萃取过程中可以加NaCl以促进有机相和水相分层。合并的有机相用Na2SO4干燥, 过滤并真空浓缩。残余物通过硅胶快速色谱纯化(洗脱液︰EtOAc︰PE=1︰20), 得到外消旋醇。
1.7 手性醇的生物制备为了获得足够量的产物来确定生物还原产物的构型, 反应按制备规模进行。将30 g R. mucilaginosa GIM 2.157的静息细胞重新悬浮于100 mL Na2HPO4- KH2PO4缓冲液(100 mmol/L, pH 7.0)中, 随后加入5 g葡萄糖和100 mmol/L的底物, 将反应混合物在25℃下孵育并在220 r/min下摇动24 h。然后离心除去细胞, 上清液用NaCl饱和, 然后用EtOAc (100 mL×3)萃取上清液。有机相用生理盐水洗涤, 用无水Na2SO4干燥, 过滤并真空浓缩。残余物通过硅胶快速色谱纯化(洗脱液︰EtOAc︰PE=1︰20), 得到对映体醇2a,2b,2c。制备规模的产量和ee与从筛选生物转化获得的产量和ee相当, 对映体醇2a,2b,2c用甲醇稀释, 在Anton Paar型旋光仪测出产物的旋光方向为左旋, 与S型产物的文献值[10]一致, 可知反应主产物为S构型。
2 结果与讨论 2.1 菌株的选择本课题组承担了海洋经济创新发展区域示范专项项目“海洋生物天然产物化合物库”。因为项目需求, 本实验室建有小型海洋微生物菌种保藏库:包括真菌、细菌和放线菌在内的海洋来源微生物7500多种。我们的目标是寻找一株或多株具有高效催化芳香酮不对称还原活性的菌株。利用96微孔板对300株常用菌株进行催化活性筛选, 我们获得了15株具有明显活性的菌株, 并以此15株菌株作为我们进一步研究的目标菌株。在经过更为深入的活性分析后, 我们发现采集自深圳大鹏湾的白百合的真菌R. mucilageinosa GIM 2.157具有最好的催化活性, 包括最优活性和单一立体选择性。因此, 本文将R. mucilageinosa GIM 2.157选为目标菌株, 系统地研究其介导芳香酮的不对称还原的影响因素和反应中底物结构与产物产率及对映选择性之间的构效关系。
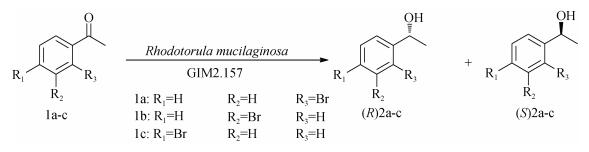
2.2 温度的影响温度是影响细胞生长和发酵产酶的一个重要因素。我们考察了不同温度(20~50℃)下, R. mucilageinosa GIM 2.157催化对溴苯乙酮的活性。反应液包含有0.5 g葡萄糖, 10 mmol/L1c, 10 mL Na2HPO4- KH2PO4缓冲液(100 mmol/L, pH 7.0)和3 g R. mucilageinosa GIM 2.157静息细胞。反应在(20~50℃)条件下分别进行24 h后, 经过适当的处理, 所得样品在手性HPLC上分析观察还原产物(S)-2c的产率及ee值的变化。其产率和ee值如图 2所示。
 |
| 图 2 温度对产率及对映体过量值的影响 Fig. 2 Effects of temperature on the yield and enantioselectivity |
由图 2可以看出, 随着温度的升高, 其反应速率加快, 且伴随着产率的增加。这可能是因为反应温度升高, R. mucilaginosa GIM 2.157细胞内生成产物的速度也得以提高。但随着温度的继续增长(由25℃升至50℃), 产率迅速下降。导致这种趋势的形成原因可能有两种:一是在较高的温度下, 反应过程中其他酶催化的副反应得以加剧, 从而使还原反应速率降低; 二是长时间处于较高的温度下, 催化还原反应的酶渐渐失活, 从而降低了反应速率。Nakamura等[11]对酵母细胞催化β-羰基酯中的不对称还原酶进行研究发现这些酶在40℃以上不稳定, 会部分失活; 即使反应速度会随温度的升高而加快, 但由于还原酶部分失活, 导致反应速度降低。在这两个因素的共同影响下, 产率在25℃左右达到最高99%。而ee值在不同温度下均不变, 据多点依附理论所知[12], 前手性碳周围的3个基团(或原子)必须与酶互相作用, 并在辅酶NAD(P)H的作用下, 使底物被牢牢地控制在一个不对称活性部位上, 只有一个面对着攻击基团, 从而得到某一对映体产物, 即高ee值的产物。R. mucilaginosa GIM 2.157中酶与对溴苯乙酮结合紧密, ee值为99%, 不受温度影响, 因此对ee值而言, 温度不是影响条件。为了得到较高产率, 实验选定在25℃左右进行。
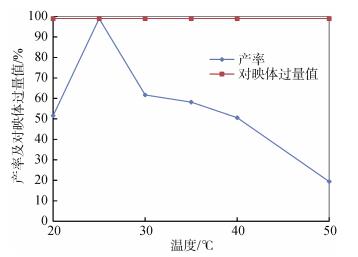
2.3 pH的影响pH是影响细胞生长的一个重要因素而且对菌体各种酶的活性有调节作用。为较好控制反应体系的pH, 我们考察了不同pH(3.0~9.0)对反应产率和立体选择性的影响。本实验使用磷酸钾缓冲液(pH 7.0~9.0)和柠檬酸盐/磷酸盐缓冲液(pH 3.0~6.0)来控制反应介质的pH。反应液含有0.5 g葡萄糖, 10 mmol/L对1c, 10 mL Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH 3.5~9.0)和3 g R. mucilageinosa GIM 2.157静息细胞。反应在25℃的条件下进行24 h后, 经过适当的处理, 所得样品在手性HPLC上分析观察还原产物(S)-2c的产率及ee值的变化。其产率和ee值如图 3所示:
 |
| 图 3 酸碱度对产率及对映体过量值的影响 Fig. 3 Effects of pH on the yield and enantioselectivity |
由图 3可以看出, 还原产物的产率受pH变化的影响。在微生物细胞立体选择性转化的反应过程中, 反应体系的pH不仅影响酶蛋白结构稳定性, 还影响酶活性中心底物的解离状态和必需基团的解离状态, 以及氢的传递及电子的转移情况。R. mucilaginosa GIM 2.157催化还原1c有一个最优的pH范围, 即在中性条件附近。过酸或过碱对还原反应都有抑制作用。与碱性条件相比, 酸性条件下的产率更好, 暗示了R. mucilaginosa GIM 2.157可能是一种好微酸性条件的微生物[13]。但反应体系pH的变化对产物ee值影响不大, ee值基本上都保持在99%左右。所以实验以反应体系的pH=7为最佳条件。
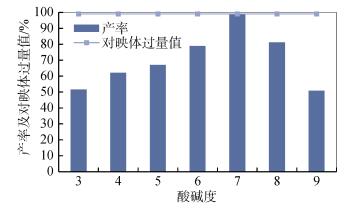
2.4 反应时间的影响反应时间对菌体产量及产酶都有一定的影响, 为较好的控制反应时间, 我们考察了不同反应时间(0.15~48 h)对还原产物产率及立体选择性的影响。反应液含有0.5 g葡萄糖, 10 mmol/L 1c, 10 mL Na2HPO4- KH2PO4缓冲液(100 mmol/L, pH=7)和3 g R. mucilageinosa GIM 2.157静息细胞。反应在25℃条件下进行。根据反应时间(0.15 ~48 h)按时取出样品, 经过适当的处理, 所得样品在手性HPLC上进行分析观察还原产物(S)-2c的产率及ee值的变化。其产率和ee值如图 4所示。
 |
| 图 4 反应时间对产率及对映体过量值的影响 Fig. 4 Effects of reaction time on the yield and enantioselectivity |
由图 4可以看出, 芳香酮1c在氧化还原酶的作用下得到了手性醇, 随着反应时间的增加, 产率逐渐升高:反应0.1 h产率仅为1.53%, 在反应24 h的时候产率达到最大值99%。在反应的前7.45 h, 随反应时间的增加, 产率快速提高; 而在7.45~20.45 h, 随反应时间的增加, 产率增加较平缓; 反应时间在20.45~24 h, 随反应时间的增加, 产率提高; 反应时间超过24 h后, 随反应时间的增加, 产率开始下降, ee值随时间变化没有明显变化。综合考虑反应时间对产率和ee值的影响, 实验选定反应时间为24 h。
2.5 底物浓度的影响酶促反应速度随底物浓度的增加而迅速增加, 若继续增加底物浓度, 酶活性中心分子逐渐被饱和, 反应速度的增加率将减少, 当底物浓度增加到某种程度时, 反应速度会达到一个极限值。因此我们考察了不同底物浓度(3.33~20 mmol/L)对还原产物产率及立体选择性的影响。反应液含有0.5 g葡萄糖, 不同浓度的1c, 10 mL Na2HPO4-KH2PO4Na缓冲液(100 mmol/L, pH=7)和3 g R. mucilageinosa GIM 2.157静息细胞。反应在25℃条件下进行24 h后, 经过适当的处理, 所得样品在手性HPLC上进行分析观察还原产物(S)-2c的产率及ee值的变化。其产率和ee值如图 5所示。
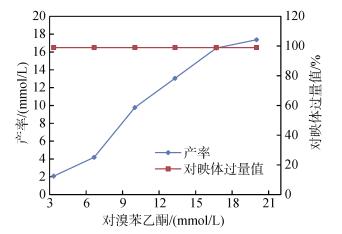 |
| 图 5 底物浓度对产率及对映体过量值的影响 Fig. 5 Effects of substrate concentration on the yield and enantioselectivity |
由图 5可知, 产率随底物浓度的增加而增加。这说明: (1)实验所用的底物的浓度没有达到3 g R. mucilaginosa GIM 2.157所含有酶的饱和值(即红球菌GIM2.157的活性部位相应可接纳一定量的底物), 因而产率随底物浓度的增加而提高; (2)底物浓度在6.67~13.3 mmol/L之间时, 产率随着底物浓度的增加而提高, 并且当底物浓度是10 mmol/L时, 其提高速度最大, 底物利用率最高。产物的ee值随着底物浓度的升高一直为不变趋势。虽然在R. mucilaginosa GIM 2.157中存在有多种类型的还原酶, 但是其中产生S型产物的酶在竞争中占绝对优势。实验所用的底物浓度并没有达到S型酶的结合的极限值, 酶活性部位数目就显得较充足, 对底物的诱导契合好, 即只能得到一种对映体(S构型)的产物。综合产率和ee值情况, 实验选定底物浓度为10 mmol/L。
2.6 共底物的影响还原反应的完成需要辅酶提供电子, 因此海洋真菌催化芳香酮的不对称还原需要辅酶的参与。本实验研究了几种常用的辅助底物(如甘油, 甲醇, 乙醇, 异丙醇, 葡萄糖, 乳酸钠, 果糖)对菌株自身含有的辅酶不断循环的影响。反应液含有10mmol/L1c, 10 mL Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH7)和3 g R. mucilageinosa GIM 2.157静息细胞以及不同的共底物。反应在25℃的条件下进行24 h, 经过适当的处理, 所得样品在手性HPLC上进行分析观察还原产物(S)-2c的产率及ee值的变化。其产率和ee值如表 2所示。
| 共底物 | 时间/h | 产率/% | ee./% | Conf. |
| 无 | 24 | 56.7 | > 99 | S |
| 甘油 | 24 | 32.0 | > 99 | S |
| 甲醇 | 24 | 78.4 | > 99 | S |
| 乙醇 | 24 | 62.8 | > 99 | S |
| 异丙醇 | 24 | 60.6 | > 99 | S |
| 葡萄糖 | 24 | 99 | > 99 | S |
| 乳酸钠 | 24 | 86.6 | > 99 | S |
| D-果糖 | 24 | 64.8 | > 99 | S |
结果表明, R. mucilaginosa GIM 2.157在没有添加辅助底物的条件下也能还原对溴苯乙酮1c, 但产率较低, 仅为56.7%。而加入共底物葡萄糖促进产率的最大增加。在反应过程中细胞需要消耗一定的能源物质; 当这些能源物质被消耗完后, 此时细胞可以利用葡萄糖所产生的辅酶进行能源补充, 从而促进产率增加到99%。而甘油却抑制产率的增加, 这可能是因为甘油的加入使细胞活性得到了抑制; 还可能是因为副反应的加剧引起的。但是共底物的加入对ee值的影响不大。综合考虑产率和ee值的影响, 实验采用葡萄糖作为辅助底物。
2.7 细胞完整性的影响本实验的后处理采用离心去除细胞, 但不代表细胞在整个反应过程中没有破裂, 细胞破裂(或失活)可能是整个实验过程最难以克服的障碍。所以, 反应体系需要温和到不破坏细胞, 使细胞一直处于活的状态(或者, 即使死亡, 蛋白也应该具有活性), 才能证明需要酶催化。因此, 我们考查了细胞完整性对反应的影响。反应液含有0.5 g葡萄糖, 10 mmol/L对溴苯乙酮, 10 mL Na2HPO4-KH2PO4缓冲液(100 mmol/L, pH 7)和3 g高温失活的R. mucilageinosa GIM 2.157静息细胞。反应在25℃条件下进行24 h, 经过适当的处理, 所得的样品在手性HPLC上进行分析观察还原产物(S)-2c的产率及ee值的变化。其产率和ee值如图 3所示。
由表 3可以看出, 当使用高温失活的细胞作为催化剂时, 没有任何底物被还原; 但当我们使用新鲜收集的静息细胞作为催化剂时, 底物可以完全被还原成相应的产物, 产率达到99%, 立体选择性达到99%。这说明本研究所选择的反应体系是比较温和的, 能维持大部分细胞的活性, 使细胞(或酶)在活的状态下对芳香酮进行不对称催化还原。也说明该反应是酶催化反应, 而不是背景的化学反应导致的, 从而证明了细胞完整性对该反应体系的必要性。
| 实验 | 催化剂 | 产率/% | ee/% | Conf. |
| 本实验 | 静息细胞 | 99 | 99 | S |
| 对照实验 | 高温失活细胞 | 0 | n.d. | n.d. |
| n.d. = not determined | ||||
接下来, 我们研究了R. mucilageinosa GIM 2.157催化芳香酮不对称还原的底物特异性。主要选择邻-, 间-, 对-溴苯乙酮这3个化合物为代表性底物, 对应的还原产物的产率及对映体过量值如表 4所示。
| 底物 | 时间/ h | 产率/% | ee/% | Conf. |
| 1a | 24 | 99 | 99 | S |
| 1b | 24 | 99 | 99 | S |
| 1c | 24 | 99 | 99 | S |
由表 4可以看出, R. mucilageinosa GIM 2.157可以催化邻-, 间-, 对-溴苯乙酮, 并且都表现出S-立体选择性, 得到相应的S-构型还原产物, 产率高达99%, ee值也达到99%。这说明官能团位置改变对产物产率和立体选择性的影响不大, 预示着该菌有宽泛的底物谱宽度, 工业应用价值高。
3 结论本文的目标是海洋真菌介导芳香酮的不对称反应, 详细考察了pH、反应温度、底物浓度和反应时间等因素对还原反应的影响。发现当温度为25℃、反应时间24 h、底物浓度10 mmol/L、pH 7时, 还原产物的产率达到99%, ee值也达到99%。关于底物特异性, 我们发现R. mucilageinosa GIM 2.157对邻-、间-、对-溴苯乙酮这三个底物均有催化作用, 且产率和对映选择性均 > 99%;暗示了官能团位置的改变对产物产率和ee值的影响不大。通过对底物结构与产物产率及立体选择性之间的构效关系的研究, 有助于我们扩展对底物谱的研究, 有助于我们挖掘该工艺的工业应用潜力。
| [1] |
Gamenara D, Domínguez D M P. Candida spp. redox machineries:An ample biocatalytic platform for practical applications and academic insights[J]. Biotechnology Advances, 2009, 27: 278-285. DOI:10.1016/j.biotechadv.2009.01.005 |
| [2] |
Vitis D V, Guidi B, Contente M L, et al. Marine microorganisms as source of stereoselective esterases and ketoreductases:kinetic resolution of a prostaglandin intermediate[J]. Marine Biotechnology, 2015, 17: 144-152. DOI:10.1007/s10126-014-9602-z |
| [3] |
Rocha L C, Ferreira H V, Pimenta E F, et al. Biotransformation of α-bromoacetophenones by the marine fungus Aspergillus sydowii[J]. Marine Biotechnology, 2010, 12: 552-557. DOI:10.1007/s10126-009-9241-y |
| [4] |
Rocha L C, Seleghim M H R, Comasseto J V, et al. Stereoselectivebioreduction of α-azido ketones by whole cells of marine-derived fungi[J]. Marine Biotechnology, 2015, 17: 736-742. DOI:10.1007/s10126-015-9644-x |
| [5] |
Oliveira J R D, Seleghim M H R, Porto A L M. Biotransformation of methylphenylacetonitriles by Brazilian marine fungal strain Aspergillus sydowii CBMAI 934:Eco-friendly reactions[J]. Marine Biotechnology, 2014, 16: 156-160. DOI:10.1007/s10126-013-9534-z |
| [6] |
Rocha L C, Ferreira H V, Luiz R F, et al. Stereoselectivebioreduction of 1-(4-methoxyphenyl) ethanone by whole cells of marine-derived fungi[J]. Marine Biotechnology, 2012, 14: 358-362. DOI:10.1007/s10126-011-9419-y |
| [7] |
Kim H S, Lee O K, Hwang S, et al. Biosynthesis of (R)-phenyl-1, 2-ethanediol from racemic styrene oxide by using bacterial and marine fish epoxide hydrolases[J]. Biotechnology Letter, 2008, 30: 127-133. |
| [8] |
Kim H S, Lee S J, Lee E J, et al. Cloning and characterization of a fish microsomal epoxide hydrolase and application to kinetic resolution of racemic styrene oxide[J]. Journal of Molecular Catalysis B:Enzymatic, 2005, 37: 30-35. DOI:10.1016/j.molcatb.2005.09.003 |
| [9] |
Kim H S, Lee O K, Lee S J, et al. Enantioselective epoxide hydrolase activity of a newly isolated microorganism, Sphingomonasechinoides EH-983, from seawater[J]. Journal of Molecular Catalysis B:Enzymatic, 2006, 41: 130-135. DOI:10.1016/j.molcatb.2006.05.009 |
| [10] |
Neeta A. Salvi, Subrata Chattopadhyay. Asymmetric reduction of halo-substituted arylalkanones with Rhizopusarrhizus[J]. Tetrahedron Asymmetry, 2008, 19: 1992-1997. DOI:10.1016/j.tetasy.2008.07.035 |
| [11] |
Nakamura K, Kawai Y, Nakajima N, et al. Stereochemicalcontrol of microbial reduction, a method for controlling the enantioselectivityof reductions with bakers' Yeast[J]. Journal of Organic Chemistry, 1991, 56(15): 4778-4783. DOI:10.1021/jo00015a038 |
| [12] |
弗斯特著. 杜锦珠, 茹炳根. 酶的结构和作用机制[M]. 卫新成, 译. 北京: 北京大学出版社, 1991: 240. Foster (written), Du Jinzhu, Ru Binggen. The structure and mechanism of enzyme[M]. Wei Xincheng (translated). Beijin: Beijin University Press, 1991: 240. |
| [13] |
Griffin D R, Yang F, Gainer J L. Asymmetricreduction ofacetophenonewithcalcium-alginate-entrapped Baker'syeastin organic solvents[J]. , Biotechnology Progress, 1998, 14(4): 588-593. DOI:10.1021/bp9800586 |
 2018, Vol. 42
2018, Vol. 42


