
文章信息
- 胡静, 周胜杰, 杨蕊, 杨其彬, 刘亚娟, 马振华. 2018.
- HU Jing, ZHOU Sheng-jie, YANG Rui, YANG Qi-bin, Liu Ya-juan, MA Zhen-hua. 2018.
- 亚硝酸盐胁迫对尖吻鲈稚鱼抗氧化酶活性及皮质醇的影响
- Effect of acute nitrite on antioxidant enzymes and cortisol in juvenile Lates calcarifer
- 海洋科学, 42(4): 132-140
- Marine Sciences, 42(4): 132-140.
- http://dx.doi.org/10.11759//hykx20180202001
-
文章历史
- 收稿日期:2018-02-02
- 修回日期:2018-03-22
2. 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300
2. Key Laboratory of South China Sea Fishery Resources Exploitation and Utilization, Ministry of Agriculture, Guangzhou 510300, China
尖吻鲈(Lates calcarifer), 俗称盲鰽, 分类学上隶属于鲈形目(Perciforme)、鲈亚目(Percoidei)、尖吻鲈科(Latidae)、尖吻鲈属(Lates), 是东南亚和太平洋及亚热带地区的一种广盐性经济鱼类[1]。尖吻鲈肉质鲜美、营养丰富深受消费者喜爱, 且因其生长迅速、体型较大、经济价值高及抗逆性强等优势已成为中国华南地区海水网箱养殖及池塘养殖的重要对象之一[2]。有关尖吻鲈的研究及育苗工作已日趋完善, 内容涉及苗种繁育[3]、早期发育[4]、营养病害[5-7]、生理生化[8]及分子生物学[9-10]等方面, Woo等[11]对体质量为90~170 g的尖吻鲈幼鱼进行了亚硝酸盐胁迫实验, 分析了血液学和呼吸系统的相关变化规律, 未见对其稚鱼的环境胁迫研究报告。
鱼类早期发育摄食行为是育苗成功的关键所在[12], 而摄食能力受光照、温度及氨氮等环境因子影响[13-14], 作为水产养殖中的典型污染物, 亚硝酸盐由于其抑制高铁血红蛋白氧气运输能力的毒性, 将导致鱼类离子调控、呼吸、心血管及内分泌等多种生理进程紊乱, 甚至引起鱼类缺氧而窒息死亡及鱼类疾病的暴发[11, 15-16]。本研究通过研究不同浓度亚硝酸盐急性胁迫下, 尖吻鲈稚鱼超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)及谷胱甘肽过氧化物酶(GSH-PX)等非特异性抗氧化酶活性及皮质醇(COR)含量变化规律, 揭示亚硝酸盐对其生理生化的影响机制, 为提高尖吻鲈稚鱼养殖存活率和丰富尖吻鲈养殖生态学理论提供依据。
1 材料和方法 1.1 实验材料尖吻鲈受精卵由中国水产科学研究院南海水产研究所海南热带水产研究开发中心陵水基地职工自行催产获得, 实验于该基地原地进行。受精卵置于27.5℃水中平衡20 min, 然后轻缓倒入500 L的玻璃纤维孵化器中孵化、暂养。仔、稚鱼养殖过程中水质参数:温度(29.0±1.0)℃, 盐度33±0.8, 溶氧>6.5 mg/L, pH 8.0~8.2, 亚硝酸盐含量小于0.03 mg/L, 氨氮含量小于0.01 mg/L, 每日换水2次, 每次换水两位10%, 同时提供2 000 lx的光照14 h以及黑暗环境10 h。营养投喂: 3日龄开始投喂轮虫(Brachionus rotundiformis), 水体中轮虫密度保持在(10~20)个/mL直至9日龄(4.50±0.10) mm, 于7日龄混合投喂卤虫无节幼体, 轮虫密度不变, 卤虫无节幼体密度范围保持在20~30个/mL直至15日龄, 生物饵料投喂之前使用强化剂DHA蛋白(Spresso)(INVE Aquaculture, Salt Lake City, UT, USA)进行12 h营养强化。为保证轮虫投喂至育苗桶中有足够饵料及为仔、稚鱼提供绿色水体环境, 轮虫投喂期间加入海水拟微球藻(Nannocholoropsis sp., 青岛宏邦生物技术有限公司)。为防止出水口被排泄物堵塞, 每日定时清理排水口过滤网。每日采取虹吸的方法除去育苗桶中剩余饵料、排泄物以及死去的仔、稚鱼。
1.2 实验设计正式试验开始前先进行预试验, 将分析纯NaNO2配置成不同浓度的溶液, 观察尖吻鲈仔、稚鱼的行为及存活状况, 得到24 h 100%死亡质量浓度和96 h 100%死亡质量浓度, 确定实验液浓度的上下限, 然后按等间距分别设立各实验液的浓度。
本试验通过72 h半静水方式[17]水生生物急性毒性试验法, 试验用水为过滤的海水, 其参数与暂养系统相同。试验鱼来自同一批受精卵, 以消除不同批次的差异性, 同时试验鱼不重复使用, 实验过程停止投喂。试验毒物为分析纯NaNO2, 按比例配置浓度分别为: 100、300和500 mg/L的亚硝酸盐试验用水, 以自然海水为对照组, 共计4个亚硝酸盐浓度梯度组, 各组3个平行, 每个实验容器(50 L)内投放120尾15日龄健康尖吻鲈稚鱼, 分别于0、6、12、24、36、48及72 h 7个时间点从各个养殖容器取样5尾, 取样时用10 mg/L丁香酚进行麻醉。同时, 每隔3 h从每个容器中取水样, 采用重氮-偶氮比色法测定试验用水亚硝酸盐浓度[18], 及时调整至设定的表观浓度。试验开始过程中, 连续观察中毒症状, 并记录各试验组尖吻鲈的存活率及生理活性状况, 死亡的判断标准为试验鱼鳃部停止煽动超过15 s。
1.3 样品处理各试验组所取样品称量体质量后, 与0.2 mol/L生理盐水按试剂盒(南京建成生物工程研究所)说明书指定比例分别进行研磨, 研磨液2℃、15 000 r/min离心10 min, 取上清, 置于–80℃冰箱备测, 蛋白、皮质醇含量及各抗氧化酶活性测定分别采用相关试剂盒进行测定(南京建成生物工程研究所)。
1.4 数据处理本论文中数据采用Mean±SD表达, 实验数据通过SPSS19.0进行统计分析, 先对数据作单因素方差分析(ANOVA), 处理间若有显著差异, 再Duncan法进行多重比较, P<0.05为差异显著。
2 实验结果 2.1 急性亚硝酸盐胁迫对尖吻鲈稚鱼行为及存活率的影响实验过程中各水质指标严格控制在设定范围内, 未发生变化。在各亚硝酸盐处理组中, 随着亚硝酸盐含量的升高, 尖吻鲈稚鱼表现不同程度的应激行为, 个体表现狂躁不安、呼吸急促及痉挛濒死现象, 同时活动缓慢, 失去躲避能力, 鳃盖煽动频率加快、局补充血及体表黏液分泌增多等, 经24 h适应后基本恢复正常。500 mg/L亚硝酸盐处理组的个体有些还出现体色变淡现象, 并于48 h出现少量死亡个体, 死亡鱼体僵硬弯曲、背鳍胸鳍张开, 鳃盖及口裂亦剧烈张开, 存活率为99%, 其余各组存活率为100%。
2.2 急性亚硝酸盐胁迫对尖吻鲈稚鱼抗氧化酶活性影响 2.2.1 SOD活性亚硝酸盐胁迫对尖吻鲈稚鱼SOD活性的影响见图 1。实验结果表明, 亚硝酸盐对尖吻鲈稚鱼SOD活性影响极显著(P<0.01), 不同含量亚硝酸盐胁迫导致各组处理个体SOD活性变化趋势存在明显差异(P<0.05)。100 mg/L处理组: 6 h内个体SOD活性保持平稳水平, 之后呈“M”型变化, 折点分别出现在12、48 h(P<0.05); 300 mg/L处理组:个体SOD活性呈“M”型变化后又于48 h显著回升(P<0.05); 500 mg/L处理组:个体SOD活性6 h内显著下降(P<0.05)后保持稳定水平直至36 h, 于36~72 h显著上升后又回落(P<0.05)。试验终止时, 各胁迫组个体SOD活性均显著高于对照组(P<0.05)。
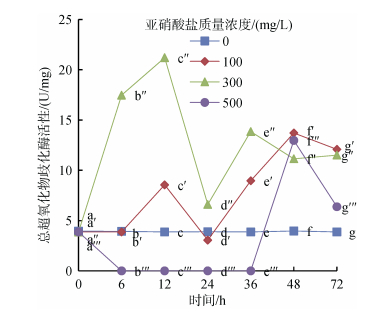 |
| 图 1 亚硝酸盐对尖吻鲈稚鱼超氧化物歧化酶活性的影响 Fig. 1 Effect of nitrite concentration on SOD activities of juvenile L. calcarifer 字母不同表示存在显著性差异(下图同) Different letters denotes significant differences |
亚硝酸盐胁迫对尖吻鲈稚鱼POD活性的影响见图 2。实验结果表明, 亚硝酸盐对尖吻鲈稚鱼POD活性影响极显著(P<0.01), 不同含量亚硝酸盐胁迫导致各组处理个体POD酶活性变化趋势存在明显差异(P<0.05)。100 mg/L处理组:个体POD活性呈“U”型变化趋势, 折点出现在48 h(P<0.05); 300 mg/L处理组:个体POD活性呈多重“V”型分布, 3个谷值分别出现在6、24和48 h(P<0.05); 500 mg/L处理组:个体POD活性呈“N”型变化, 谷值和峰值分别出现在6和48 h(P<0.05)。试验终止时, 各胁迫组个体POD活性均显著低于对照组(P<0.05)。
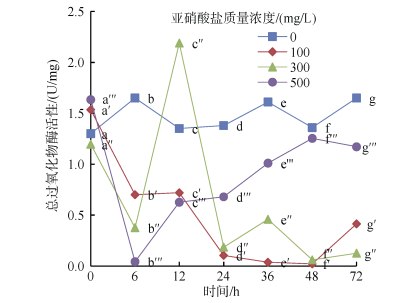 |
| 图 2 亚硝酸盐对尖吻鲈稚鱼过氧化物酶活性的影响 Fig. 2 Effect of nitrite concentration on POD activities of juvenile L. calcarifer |
亚硝酸盐胁迫对尖吻鲈稚鱼CAT活性的影响见图 3。实验结果表明, 亚硝酸盐对尖吻鲈稚鱼CAT活性影响极显著(P<0.01), 不同含量亚硝酸盐胁迫导致各组处理个体CAT活性变化趋势存在明显差异(P<0.05)。100 mg/L处理组:个体CAT活性在48 h内呈“W”型变化后显著回落至显著低于对照组水平(P<0.05); 300 mg/L处理组:个体CAT活性48 h内呈“M”型变化后显著回升至显著高于对照组水平(P<0.05); 500 mg/L处理组:呈“W”型变化至最后显著高于对照组水平, 折点分别出生在6和48 h处。试验终止时, 除100mg/L处理组外, 其他各胁迫组个体CAT活性均显著高于对照组(P<0.05)。
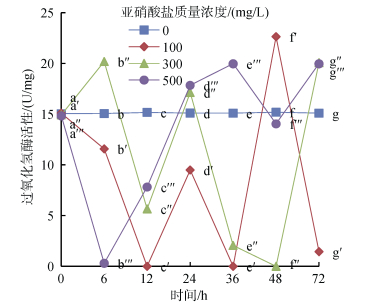 |
| 图 3 亚硝酸盐对尖吻鲈稚鱼过氧化氢酶活性的影响 Fig. 3 Effect of nitrite concentration on CAT activities of juvenile L. calcarifer |
亚硝酸盐胁迫对尖吻鲈稚鱼ACP活性的影响见图 4。实验结果表明, 亚硝酸盐对尖吻鲈稚鱼ACP活性影响极显著(P<0.01), 不同含量亚硝酸盐胁迫导致各组处理个体ACP活性变化趋势存在明显差异(P<0.05)。100 mg/L处理组:个体ACP活性呈“V”型分布, 谷值出现在24 h处(P<0.05); 300 mg/L处理组:个体ACP活性呈“N”型变化, 谷值和峰值分别出现在6和48 h处(P<0.05); 500 mg/L处理组:个体ACP活性48 h内呈“M”型变化后显著回升至对照组水平, 双峰值分别出现在6和24 h处。试验终止时, 除100 mg/L处理组外, 其他各胁迫组个体ACP活性与对照组维持相似水平(P<0.05)。
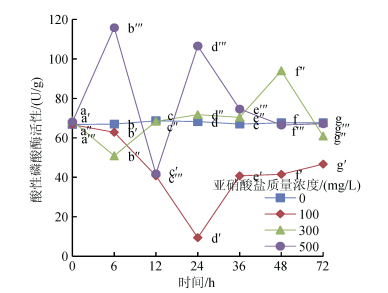 |
| 图 4 亚硝酸盐对尖吻鲈稚鱼酸性磷酸酶活性的影响 Fig. 4 Effect of nitrite concentration on ACP activities of juvenile L. calcarifer |
亚硝酸盐胁迫对尖吻鲈稚鱼GSH-PX活性的影响见图 5。实验结果表明, 亚硝酸盐对尖吻鲈稚鱼GSH-PX活性影响极显著(P<0.01), 不同含量亚硝酸盐胁迫导致各组处理个体GSH-PX活性变化趋势存在明显差异(P<0.05)。100 mg/L处理组:个体GSH-PX活性呈“M”型变化, 双峰值分别出现在12和48 h处(P<0.05); 300 mg/L处理组:个体GSH-PX活性呈“N”型分布, 折点分别为36和48 h(P<0.05); 500 mg/L处理组:个体GSH-PX活性呈倒“N”型变化趋势, 即先显著下降后上升, 最后回落至显著低于对照组水平(P<0.05)。试验终止时, 除300 mg/L处理组外, 其他各胁迫组个体GSH-PX活性与对照组维持相似水平(P<0.05)。
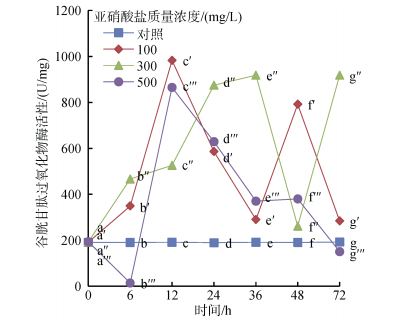 |
| 图 5 亚硝酸盐对尖吻鲈稚鱼谷胱甘肽过氧化物酶活性的影响 Fig. 5 Effect of nitrite concentration on GSH-PX activities of juvenile L. calcarifer |
亚硝酸盐胁迫对尖吻鲈稚鱼COR浓度的影响见图 6。实验结果表明, 亚硝酸盐对尖吻鲈稚鱼COR浓度的影响极显著(P<0.01), 不同含量亚硝酸盐胁迫导致各组处理个体COR浓度变化趋势存在明显差异(P<0.05)。100 mg/L处理组:个体COR浓度持续显著下降至48 h后显著上升(P<0.05); 300 mg/L处理组:个体COR浓度呈“M”变化趋势, 双峰值分别出现在12和48 h处(P<0.05); 500 mg/L处理组:个体COR浓度于6 h内显著下降后, 持续上升至36 h达到最高点(P<0.05), 后显著回落至试验结束(P<0.05)。整个试验过程中, COR最高浓度和次高浓度分别出现在500 mg/L处理组的36 h及300 mg/L处理组的48 h, 试验终止时, 各处理组个体皮质醇浓度均显著低于对照组(P<0.05)。
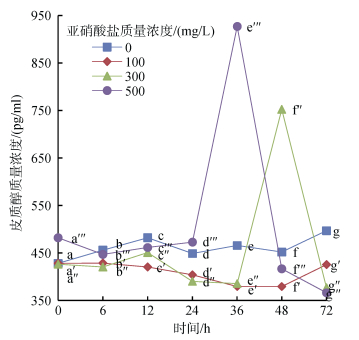 |
| 图 6 亚硝酸盐对尖吻鲈稚鱼皮质醇质量浓度的影响 Fig. 6 Effect of nitrite concentration on COR concentration of juvenile L. calcarifer |
高浓度的亚硝酸盐将导致鱼类产生剧烈游窜挣扎、窒息[19], 在该亚硝酸盐胁迫试验中, 尖吻鲈稚鱼表现出一定的应激行为即中毒现象, 个体表现狂躁不安、呼吸急促及痉挛濒死现象, 同时活动缓慢而鳃盖煽动频率加快及体表黏液分泌增多等, 500 mg/L处理组的个体还出现体色变淡、发白现象, 并于48 h出现少量死亡个体, 死亡鱼体僵硬弯曲、背鳍胸鳍张开, 以上中毒现象与Tomasso[20]所描述的中毒现象一致, 同时与长尾墨金丝(Pterophyllum scalare)[21]、红鳍东方鲀(Takifugu rubripe)[22]和黄颡鱼(Pelteobagrus fulvidraco)[19]等的中毒现象相似, 而与尖吻鲈稚鱼体色发白不同的是, 文昌鱼(Branchiostoma belcheri)[23]及斜带石斑鱼苗(Epinephelus coioides)[24]的体色发黑, 这可能与种间亚硝酸盐耐受性、个体规格或胁迫程度不同有关, 而徐勇等[25]对半滑舌鳎(Cynoglossus semilaevis)的急性毒性效应发现, 个体除了狂躁不安、相互碰撞或侧翻等行为, 还伴随呼吸减慢症状, 推测与其所处生理状态不同有关, 其1 h后发生昏迷沉底现象证明了该推测, 个体亚硝酸盐中毒初期主要表现反应激烈, 包括呼吸、游动各行为, 而随着胁迫时间增长、胁迫浓度增大个体活力降低, 于中毒后期表现出呼吸受阻、缓慢现象[26]。
在正常溶氧((4.5~5.5)mg/L)条件下, 亚硝酸盐对斜带石斑鱼(E.coioides)小规格(全长4.4 cm)鱼苗的24、48、72、96 h LC50值分别为288.4、281.8、270.4和267.3 mg/L, 大规格(全长10.5 cm)个体分别为354.8、346.7、280.5和208.4 mg/L[24]; 溶氧高于5.0 mg/L情况下, 真鲷(Pagrum major)仔鱼的24、48、72及96 h的L50值分别为152.6、115.4、41.25以及23.74 mg/L[27]; 溶氧为7.0 mg/L时, 红鳍东方鲀(T.rubripe)的24、48、72和96h LC50值分别为201.88、190.57、171.09和159.25 mg/L[22]; 溶氧7.6 mg/L下, 长尾墨金丝神仙幼鱼(P.scalare)24、48、72和96 h的LC50值分别为164.25、98.41、76.73和48.90 mg/L[21]。本试验中, 尖吻鲈稚鱼仅在亚硝酸盐浓度为500 mg/L、胁迫时间为48 h时出现了部分个体死亡, 存活率为99%, 其他处理组的存活率为100%。在本实验条件下, 从对亚硝酸盐表观耐受性及存活率两方面来看, 尖吻鲈稚鱼体现出了较强的抗逆性。
3.2 亚硝酸盐对尖吻鲈稚鱼个体抗氧化酶活性的影响大量研究表明, 亚硝酸盐会对鱼类的生长摄食、组织器官、血液指标和免疫机能产生消极影响[28-29]。鱼类非特异性免疫系统在应对逆环境应激时起主导作用, 其中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)以及谷胱甘肽过氧化物酶(GSH-PX)等在免疫调节过程中占重要份额[30-32]。该研究针对亚硝酸盐胁迫下的尖吻鲈稚鱼个体进行了以上抗氧化酶测定分析, 结果表明, 无论是胁迫时间还是胁迫剂量均对各抗氧化酶活存在显著的影响, 而针对其他鱼类的亚硝酸盐应激下抗氧化酶的研究不多见, 该研究丰富了相关资料, 具有一定借鉴意义。
不少研究结果表明, 在一定亚硝酸盐胁迫时间或胁迫剂量内, 抗氧化酶活性呈增强趋势, 而随着胁迫浓度增大、时间的增长, 抗氧化酶活性反而受抑制。强俊等[33]对吉富罗非鱼(GIFT O.niloticus)、韩英等[34]对鲤鱼(Cyprinus carpio)及汪家鑫等[22]对红鳍东方鲀(T.rubripe)的亚硝酸盐毒理实验中, 个体SOD、CAT活性呈先升高后降低趋势。研究表明, 当鱼体受到轻度逆境胁迫时, SOD、CAT活性被诱导, 而受重度逆境胁迫时, 其活性则被抑制[35]; 白秀娟等[23]对茂名海域文昌鱼(B.becheri)的亚硝酸盐毒理试验中同样得出, 低浓度亚硝酸盐中, 其ALP、ACP表现出一定的应激反应, 当水体亚硝酸盐浓度增加时, 其对应的相关ALP、ACP活性降低。以上现象的发生可能是细胞代谢发生一定程度的改变而不是氧化应激的结果[22-23, 36], 鱼体长时间在高浓度的亚硝酸盐氮胁迫下, 抗氧化体系不能及时清除自由基, 机体的氧化与抗氧化平衡被破坏, 致使自由基在鱼体内累积, 从而对细胞产生氧化损伤; 同时, 鱼体抗氧化体系也受到破坏, 表现为酶活性持续降低[22-23, 37]。以上研究表明, 在亚硝酸盐的超时或超量胁迫下鱼体的抗氧化体系受到破坏, 导致鱼体的免疫力下降、抵抗力下降、容易患病[22-23]。所以, 在一定程度上, 抗氧化酶活性恢复正常水平的时间反映了机体对环境的适应能力。在该研究中, 所测定的五种抗氧化酶活性, 在亚硝酸盐剂量和胁迫时间双重因子的影响下, 于各试验组个体均存在显著差异, 不同的是在试验结束时, 与对照组对比关系存在差异。SOD活性于实验结束时高于对照组, 而POD活性在实验结束时均显著低于对照组, CAT活性除最低浓度胁迫处理组显著低于对照组以外, 其他均显著高于对照组, ACP活性低于或略低于对照组水平, 其中最低浓度胁迫处理组ACP活性与对照组差距最大; 实验结束时, GSH-PX活性最低值出现在最高浓度胁迫组且显著低于对照组, 其他显著高于对照组, 这可能与以上有关低浓度胁迫促进抗氧化酶活而高浓度胁迫抑制抗氧化酶活的相关结论有关, 亦与其胁迫后行为与存活情况相应。各抗氧化酶活性随着处理时间的推移, 并不存在明显的线性关系, 变化规律较特异, 这可能与尖吻鲈的广盐性、高抗逆性等生理习性或所处发育阶段不同有关, 也可能是亚硝酸的胁迫对其抗氧化系统造成了一定紊乱效应, 但胁迫处理计量仍在其适应范围内, 同时不少研究亦表明实验对象规格不同、养殖密度不同以及包括溶氧、氯含量等在内的环境因子不同, 亦可造成亚硝酸盐胁迫程度的显著差异, 适度低密度、低温度及高溶氧、高氯含量一定程度上可降低亚硝酸盐应激, 提高机体亚硝酸盐耐受能力[19, 25, 38-39]。
3.3 亚硝酸盐对尖吻鲈稚鱼个体激素(皮质醇)含量的影响研究表明, 鱼类的应激反应首先表现为血液中激素含量的变化, 在环境胁迫过程中, 下丘脑-垂体-肾间组织轴(HPI)占主导地位, 在此过程中皮质醇等激素因应激而合成与释放[40], 进而影响机体的离子渗透及新陈代谢以维持机体的生理平衡[41]。在该胁迫实验中, 实验结束时各胁迫组个体皮质醇含量均显著低于对照组, 而整个实验过程中除了在500 mg/L处理组的36 h及300 mg/L的48 h出现极显著高于对照组水平的最高值和次高值以外, 其他各组、各时变化平稳但与对照组差异显著。推测, 在最高浓度胁迫下, 机体于36 h的毒害累积到耐受极限, 次高浓度胁迫下, 机体于48 h达到耐受极限, 而同其他处理组一样, 于试验结束时均达到对照组以下水平, 推测在高浓度和次高浓度亚硝酸盐胁迫下, 该激素调节体系相关调节功能受到了一定程度的抑制作用。有关亚硝酸盐对鱼类胁迫、毒理实验主要集中在机体的血液学、组织学及存活生长等方面[21-22, 24-29], Woo等[11]研究了不同亚硝酸浓度胁迫下, 尖吻鲈幼鱼血液学和血液呼吸属性做了研究, 并设置了0、15、20、30、50及80 mg/L 6种浓度的养殖试验组, 结果表明尖吻鲈随亚硝酸盐浓度的变化, 其血红蛋白、高铁血红蛋白及血液亚硝酸盐含量呈显著降低或升高变化。鲜见对激素(皮质醇)的测定分析, 该研究充实了亚硝酸盐对鱼类毒理实验的基础数据, 可为其他鱼类亚硝酸盐胁迫实验提供数据基础和科学依据。
作为中国华南地区热门海水网箱养殖及池塘养殖的鱼种之一[2], 尖吻鲈早期发育的水质调控工作尤为重要, 作为重要环境因子之一, 亚硝酸盐对养殖存在巨大危害。在养殖过程中, 亚硝酸盐含量、溶氧、温度、养殖密度及个体规格等对个体养殖效果之间存在联合作用, 尖吻鲈稚鱼对亚硝酸盐的耐受性呈较高水平, 而Ganzon-Naret[42]对尖吻鲈稚鱼的多密度梯度养殖试验得出, 亚硝酸含量随养殖密度的增大的升高, 而增质量率、增长率、存活率等参数均因亚硝酸盐的变化而产生显著地变化, 因此针对不同规格机体, 开展亚硝酸盐浓度、温度、溶氧及养殖密度等的多因素的试验对尖吻鲈的养殖更具有实用价值, 且有研究表明水体中氯离子含量的适当增加可增强机体的亚硝酸盐耐受性, 因此水产养殖中一些常见具有协同或抑制作用的离子亦可考虑到试验、养殖中来, 以提高养殖的有效性。
| [1] |
孟庆闻, 苏锦祥, 缪学祖. 鱼类分类学[M]. 北京: 中国农业出版社, 1995: 505-506. Meng Qingwen, Su Jinxiang, Miao Xuezu. Fish taxonomy[M]. Beijing: China Agricultural Press, 1995: 505-506. |
| [2] |
中国科学院动物研究所. 南海鱼类志[M]. 北京: 科学出版社, 1962: 311-312. Institute of Zoology Chinese Academy of Sciences, et al. Fishes of the South China Sea[M]. Beijing: Science Press, 1962: 311-312. |
| [3] |
陈刚, 叶善明, 黎祖福, 等. 尖吻鲈规模化育苗技术研究[J]. 内陆水产, 2005, 7: 42-44. Chen Gang, Ye Shanming, Li Zufu, et al. Study on scale breeding of barramundi (Lates calcarifer)[J]. Inland Auaculture, 2005, 7: 42-44. |
| [4] |
Shadrin A M, Pavlov D S. Embryonic and larval development of the Asian seabass Lates calcarifer (Pisces: Perciformes: Latidae) under thermostatically controlled conditions[J]. Biology Bulletin, 2015, 42(4): 334-346. DOI:10.1134/S1062359015040123 |
| [5] |
Ganzon-Naret E S. Growth response and feed intake of Latescalcarifer to four different dietary protein levels with green pea (Pisum sativum) under controlled laboratory condition[J]. Animal Biology & Animal Husbandry International Journal of the Bioflux Societry, 2013, 5(2): 137-144. |
| [6] |
Glencross B. A comparison of the digestibility of diets and ingredients fed to rainbow trout (Oncorhynchus mykiss) or barramundi (Lates calcarifer)-the potential for inference of digestibility values among species[J]. Aquaculture Nutrition, 2011, 17: 207-215. DOI:10.1111/anu.2011.17.issue-2 |
| [7] |
John K R, George M R, Jeyatha B, et al. Isolation and characterization of Indian betanodavirusstrain from infected farm-reared Asian seabass Lates calcarifer (Bloch, 1790) juveniles[J]. Aquaculture Research, 2014, 45(9): 1481-1488. DOI:10.1111/are.12095 |
| [8] |
Trujillo-González A, Johnson L K, Constantinoiu C C, et al. Histopathology associated with haptor attachment of the ectoparasitic monogenean Neobenedenia sp. (Capsalidae) to barramundi, Lates calcarifer (Bloch)[J]. Journal of Fish Diseases, 2015, 38(12): 1063-1067. DOI:10.1111/jfd.12320 |
| [9] |
Domingos J A, Zenger K R, Jerry D R. Whole-genome shotgun sequence assembly enables rapid gene characterization in the tropical fish barramundi, Lates calcarifer[J]. Animal Genetics, 2015, 46(4): 468-469. DOI:10.1111/age.2015.46.issue-4 |
| [10] |
Rahman Z A, Choay-Hoong L, Khairuddin R M, et al. Isolation and characterization of novel microsatellite loci for Asian seabass, Lates calcarifer from genome sequence survey database[J]. Journal of Genetics, 2014, 93(S1): 82-85. DOI:10.1007/s12041-012-0171-5 |
| [11] |
Woo N Y S, Chiu S F. Effect of nitrite exposure on hematological parameters and blood respiratory properties in the sea bass Lates calcarifer[J]. Environmental Toxicology and Water Quality: An International Journal, 1995, 10: 259-266. DOI:10.1002/(ISSN)1098-2256 |
| [12] |
Yufera M, Darias M J. The onset of exogenous feeding in marine fish larvae[J]. Aquaculture, 2007, 268: 53-63. DOI:10.1016/j.aquaculture.2007.04.050 |
| [13] |
Ma Z H. Food ingestion, prey selectivity, feeding incidence, and performance of yellowtail kingfish Seriola lalandi larvae under constant and varying temperatures[J]. Aquaculture International, 2014, 22: 1317-1330. DOI:10.1007/s10499-013-9749-z |
| [14] |
Ma Z H, Qin J G, Nie Z. Morphological Changes of Marine Fish Larvae and Their Nutrition Need. In: Pourali K, Raad V N Larvae morphology, biology and life cycle[M]. New York, USA: Nova Science Publishers Inc, 2012: 1-20.
|
| [15] |
Jensen F B. Nitrite disrupts multiple physiological functions in aquatic animals[J]. Comparative Biochemistry and Physiology Part A Molecular & Integrative Physiology, 2003, 135(1): 9-24. |
| [16] |
Kroupova H, Machova J, Svobodova Z. Nitrite influence on fish: a review[J]. Veterinární Medicína- Czech, 2005, 50(11): 461-471. |
| [17] |
Deutsches Institutfür Normung. Water quality-determination of the acute lethal toxicity of substances to a freshwater fish[Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)]-Part2: Semi-static method[S]. Geneva, Switzerland: The International Organization for Standardization, 1996: 7346-2.
|
| [18] |
陈佳荣. 水化学实验指导书[M]. 北京: 中国农业出版社, 1996: 126-132. Chen J R. Water chemistry experiment guide[M]. Beijing: China Agricultural Press, 1996: 126-132. |
| [19] |
李波.氨氮和亚硝酸盐对黄颡鱼的毒性研究[D].武汉: 华中农业大学, 2010. Li Bo. Effect of ammonia and nitrite toxicity on yellow catfish Pelteobagrus fulvidraco[D]. Wuhan : Huazhong Agricultural University, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1799459 |
| [20] |
Tomasso Jiarong. Comparative toxicity of nitrite to fresh water fishes[J]. Aquatic Toxicology, 1986, 8(2): 129-137. DOI:10.1016/0166-445X(86)90059-7 |
| [21] |
魏东, 白东清, 乔秀亭, 等. 亚硝酸盐对长尾墨金丝神仙幼鱼的急性毒性试验[J]. 水利渔业, 2007, 27(6): 98, 116. Wei Dong, Bai Dongqing, Qiao Xiuting, et al. Acute toxicity of nitrite to juvenile Pterophyllum scalare[J]. Reservoir Fisheries, 2007, 27(6): 98, 116. |
| [22] |
汪家鑫, 张钊, 胡盼, 等. 亚硝酸氮对红鳍东方鲀的毒性效应[J]. 广东海洋大学学报, 2013, 33(6): 52-56. Wang Jiaxin, Zhang Zhao, Hu Pan, et al. Effect of nitrite on hepatic antioxidant enzymes and acute toxicity in juvenile Takifugu rubripe[J]. Journal of Guangdong Ocean University, 2013, 33(6): 52-56. |
| [23] |
白秀娟, 卢伙胜, 张冰. 亚硝酸盐对茂名海域文昌鱼生长及磷酸酶、酚氧化酶的影响[J]. 齐鲁药业, 2009, 26(8): 7-10. Bai Xiujuan, Lu Huosheng, Zhang Bing. Influence of Nitrite to the growth, phosphatase and phenoloxidase of Branchiostoma becheri Gray[J]. Shandong Fisheries, 2009, 26(8): 7-10. |
| [24] |
郑乐云. 氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J]. 海洋科学, 2012, 36(50): 81-86. Zheng Leyun. Acute toxic effects of ammonia and nitrite on Epinephelus coioides fry[J]. Marine Sciences, 2012, 36(50): 81-86. |
| [25] |
徐勇, 张修峰, 曲克明, 等. 不同溶氧条件下亚硝酸盐和氨氮对半滑舌鳎的急性毒性效应[J]. 海洋水产研究, 2006, 27(5): 28-33. Xu Yong, Zhang Xiufeng, Qu Keming, et al. Acute toxic effects of nitrite and ammonia on Cynoglossus semilaevis at different dissolve oxygen levels[J]. Marine Fisheries Research, 2006, 27(5): 28-33. |
| [26] |
赵元凤, 祝国芹, 吕景才. 亚硝酸盐对尼罗罗非鱼的毒性及其机理的研究[J]. 大连水产学院学报, 1991, 1(6): 62-65. Zhao Yuanfeng, Zhu Guoqin, Lü Jingcai. A study on toxieity and meehanism of nitrite to Tilapia nilotica[J]. Journal of Dalian Fisheries University, 1991, 1(6): 62-65. |
| [27] |
蓝伟光, 陈霓. 氨及亚硝酸盐对真鲷仔鱼的急性毒性研究[J]. 海洋科学, 1992, 16(3): 68-69. Lan Weiguang, Chen Ni. Acute toxicity of ammonia and nitrite to larvae of red sea bream, Pagrus major[J]. Marine Science, 1992, 16(3): 68-69. |
| [28] |
余瑞兰, 聂湘平, 魏泰莉, 等. 分子氨和亚硝酸盐对鱼类的危害及其对策[J]. 中国水产科学, 1999, 6(3): 73-77. Yu Ruilan, Nie Xiangping, Wei Taili, et al. Toxicity of molecular ammonia & nitrite to fishes and the control measures[J]. Journal of Fishery Sciences of China, 1999, 6(3): 73-77. DOI:10.3321/j.issn:1005-8737.1999.03.017 |
| [29] |
王琨.氨氮对鲤(Cyprinus carpio, Linnaeus)幼鱼部分组织及血液指标的影响[D].哈尔滨: 东北农业大学, 2007. Wang Kun. Effect of ammonia on some tissue and haematological parameters of juvenile carp(Cyprinus carpiolinnaeus)[D]. Harbin: Northeast Agriculture University, 2007. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1165296 |
| [30] |
Martine Z, Alvarezr M, Moralesa E, et al. Antioxidant defenses in fish: biotic and abiotic factors[J]. Reviews in Fish Biology Fisheries, 2005, 15(1/2): 75-88. |
| [31] |
张克烽, 张子平, 陈芸, 等. 动物的抗氧化系统[J]. 动物学杂志, 2007, 42(2): 153-160. Zhang Kefeng, Zhang Ziping, Chen Yun, et al. Animal anti-oxidant system[J]. Zoological Journal, 2007, 42(2): 153-160. DOI:10.3969/j.issn.0250-3263.2007.02.031 |
| [32] |
Polstra K, Bakker W W, Klok P A, et al. Dephosphorylation of endotoxin by alkaline phosphatase in vivo[J]. American Journal of Pathology, 1997, 151(4): 1163-1169. |
| [33] |
强俊, 杨弘, 马昕羽, 等. 基于响应曲面法研究亚硝酸盐与养殖密度对吉富罗非鱼幼鱼生长与肝脏抗氧化力的影响[J]. 海洋与湖沼, 2015, 46(5): 1166-1174. Qiang Jun, Yang Hong, Ma Xinyu, et al. Using Response surface methodology to determine effects of chronic nitrite exposure and stocking density on growth of gift tilapia Oreochromis niloticus juveniles[J]. Oceanologia et Limnologia Sinica, 2015, 46(5): 1166-1174. |
| [34] |
韩英, 张辉, 王琨. 亚硝态氮对鲤鱼种血液SOD及GSH-Px的影响[J]. 淡水渔业, 2007, 37(1): 66-68. Han Ying, Zhang Hui, Wang Kun. Activity of SOD and GSH-Px in the blood of fingerling Cyprinus carpio under different nitrite concentration[J]. Freshwater Fisheries, 2007, 37(1): 66-68. DOI:10.3969/j.issn.1000-6907.2007.01.014 |
| [35] |
徐立红, 张甬元, 陈宜瑜. 分子生态毒理学研究进展及其在水环境保护中的意义[J]. 水生生物学报, 1995, 19(2): 171-185. Xu Lihong, Zhang Yongyuan, Chen Yiyu. The advances of molecular ecotoxicology and its significance in water environment protection[J]. Acta Hydrobiloiogca Sinica, 1995, 19(2): 171-185. DOI:10.3321/j.issn:1000-3207.1995.02.011 |
| [36] |
Martínez- lvarez R M, Hidalgo M C, Domezain A, et al. Physiological changes of sturgeon Acipenser naccarii caused by increasing environmental salinity[J]. The Journal of Experimental Biology, 2002, 205(23): 3699-3706. |
| [37] |
吕晓燕, 李嘉尧, 方燕, 等. 亚硝酸盐对红螯光壳螯虾不同组织免疫相关酶活性及超微结构的影响[J]. 水产学报, 2010, 34(12): 1812-1817. Lü Xiaoyan, Li Jiayao, Fang Yan, et al. Nitrite stress on immune-related enzymes and the ultrastructure in different tissue of redclaw crayfish (Cherax quadricarinatus)[J]. Journal of Fisheries of China, 2010, 34(12): 1812-1817. |
| [38] |
Kroupová H, Máchová J, Piacková V, et al. Nitrite intoxication of common carp (Cyprinus carpio L.) at different water temperatures[J]. Acta Veterinaria Brno, 2006, 75(4): 561-569. DOI:10.2754/avb200675040561 |
| [39] |
Wang Y B, Zhang W J, Li W F, et al. Acute toxicity of nitrite on tilapia (Oreochromis niloticus) at different external chloride concentrations[J]. Fish Physiology and Biochemistry, 2006, 32(1): 49-54. DOI:10.1007/s10695-005-5744-2 |
| [40] |
Bernier N J, Peter R E. The hypothalamic-pituitary- interrenal axis and the control of food intake in teleost fish[J]. Comp Biochem PhysioL, 2001, 129B: 639-644. |
| [41] |
BernierN J, Flik G, KlarenP H M. Fish physiology[M]. Salt Lake City: Academic Press, 2009: 235-311.
|
| [42] |
Ganzon-Naret E S. The influence of different stocking densities on the performance and behavior among the hatchery reared sea bass (Lates calcarifer) juveniles in recirculating system[J]. Animal Biology & Animal Husbandry International Journal of the Bioflux Societry, 2014, 6(2): 125-133. |
 2018, Vol. 42
2018, Vol. 42


