文章信息
- 崔晓山, 陈娟娟, 杨锐, 骆其君, 陈海敏. 2018.
- CUI Xiao-shan, CHEN Juan-juan, YANG Rui, LUO Qi-jun, CHEN Hai-min. 2018.
- 红藻中红藻糖苷的研究进展
- Progress in the study of red algal floridosides
- 海洋科学, 42(4): 162-169
- Marine Sciences, 42(4): 162-169.
- http://dx.doi.org/10.11759/hykx20180118002
-
文章历史
- 收稿日期:2018-01-18
- 修回日期:2018-04-16
红藻在进行光合作用时, 会通过核酮糖-二磷酸-羧化酶/加氧酶(RubisCO)将无机碳固定到小分子碳水化合物(LMWCs)中。红藻中的LMWCs比其他藻类更多样化, 包括红藻糖苷、海藻糖、海人草素和甘露醇等, 它们在各类红藻中扮演的角色也不尽相同。其中红藻糖苷是大部分红藻中的主要光合可溶性物质, 是一种典型的低分子质量碳水化合物, 在红藻中的含量占藻体干质量的1.5%~8%, 其在细胞液里合成并在细胞内短期存在, 最终在新陈代谢过程中分解为其他碳水化合物[1]。这里我们对红藻糖苷的结构、生物合成、生理功能和影响因素进行了综述。
1 红藻中的红藻糖苷红藻中的红藻糖苷共有3种结构类型:红藻糖苷(α-D-galactopyransyl-(1-2)-glycerol, floridoside)、D-和L-异红藻糖苷(α-D/L-galactopyranosyl-(1-1)-glycerol, D-isofloridoside和L-isofloridosid)(图 1)[2]。
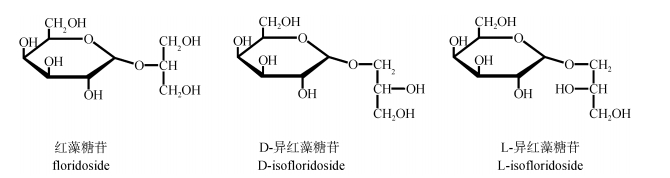 |
| 图 1 红藻糖苷的三种结构(红藻糖苷; D-异红藻糖苷; L-异红藻糖苷) Fig. 1 Three structures of floridoside(floridoside; D-isofloridoside; L-isofloridoside) |
红藻糖苷的三种不同构型在红藻中存在的种类以及含量受多种因素的影响。来自于不同地理地带的同一种红藻含有的红藻糖苷的结构是不一样的, 如紫菜属(Porphyra)就是一个鲜明的例子, 其在欧洲、非洲、北美洲、亚洲和澳大利亚等环境中所含红藻糖苷的结构存在差异。而不同种间所含有的红藻糖苷结构也存在差异, 如在澳大利亚的Porphyracolumbina中, L-异红藻糖苷是占绝对优势; 北海的Porphyradioica中, 红藻糖苷的含量较高, D-异红藻糖苷的量通常都很少; 但在美国北太平洋海岸的Porphyraperforata中, 红藻糖苷、D-异红藻糖苷和L-异红藻糖苷具有相同的含量。造成这种现象的原因可能与种属间同化途径中不同的专一性酶的活性有关[3]。
2 红藻中红藻糖苷的生物合成与代谢红藻糖苷的合成前体是甘油-3-磷酸(G3P)和UDP-半乳糖(UDP-Gal), 甘油-3-磷酸是糖代谢和卡尔文循环代谢的重要中间物。红藻糖苷在红藻中的作用是作为光合作用暂时的碳库, 因此除了合成, 还涉及它的分解和再利用。
2.1 红藻中红藻糖苷的生物合成甘油-3-磷酸在植物或藻类中有两条合成途径:一是光合途径, 通过植物共同的核酮糖-二磷酸-羧化酶/加氧酶(Rubisco)固定无机碳, 通过磷酸戊糖途径, 形成3-磷酸-甘油醛, 异构化后形成磷酸二羟丙酮(DHAP), 再利用3-磷酸-甘油脱氢酶(GPDH)形成L-甘油-3-磷酸; 另一条途径是内源性转变, 即甘油转变为甘油-3-磷酸, 它可以通过甘油激酶(GK)介导的甘油磷酸化。以上两步反应, 在胞浆或质体里进行, 产生的甘油-3-磷酸可以在胞浆和质体基质中进行转运[4]。有研究指出红藻糖苷合成的两种代谢途径(内源性和光合作用)可能不是共用一套前体物质, 这两条途径可能完全分开[5]。
甘油-3-磷酸有两种构型(图 2), 这同时也决定了产物红藻糖苷的构型。利用经典的放射性同位素对链藻属(Catenella repens), 珊瑚藻(Corallina officinalis)和Lomentaria umbellata等体系中红藻糖苷的生物合成研究发现, 外源的无机14C被迅速的摄取并同化到红藻糖苷中, 这证实了红藻糖苷是光合作用同化的直接产物[6]。但目前对红毛菜目(Bangiales)中D-和L-异红藻糖苷同化途径的研究几乎没有[6]。有研究者认为异红藻糖苷是利用不同的底物和不同的酶合成的, 因为在P. columbina中D-异红藻糖苷的浓度是不随L-异红藻糖苷浓度的改变而改变的, 因此认为它存在独立的代谢途径[7]。而红藻门(Rhodophyta)中的红藻糖苷和Poterioochromonas malhamensis中的L-异红藻糖苷是由甘油-3-磷酸和UDP-Gal的缩合反应形成红藻糖苷磷酸(floridoside-P)和L-异红藻糖苷磷酸启动的。它们分别由相应的葡萄糖苷磷酸合成酶催化, 然后由专一性的磷脂酶脱磷酸化[6, 8]。在这两个同化途径中, 甘油-3-磷酸都作为前体。最近从条斑紫菜(Porphyra yezoensis)中筛选到海藻糖-6-磷酸合成酶, 说明在红毛菜纲中, 存在着海藻糖或LMWC生物合成关键酶[3]。
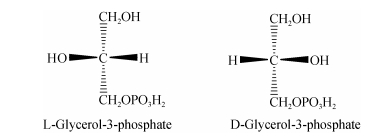 |
| 图 2 G3P的两种构型 Fig. 2 Two configurations of L-glycerol-3-P |
催化L-甘油-3-磷酸的3-磷酸-甘油脱氢酶(GPDH)有两种, 一种定位在线粒体的内膜间隙或细胞质中, 催化磷酸二羟丙酮形成甘油-3-磷酸(GPDH-C或GPD1);另一种定位在线粒体内膜的外表面, 催化甘油-3-磷酸到磷酸二羟丙酮(GPDH-M或GPD2)(图 3)。其次, 在红藻中将磷酸三糖转变为甘油-3-磷酸的是GPDH, 其基本功能是提供足够量的磷酸甘油用于后期六碳糖的形成。在GPDH途径中, GPDH以磷酸二羟丙酮为底物合成甘油-3-磷酸, 甘油-3-磷酸与UDP-半乳糖通过红藻糖苷磷酸合成酶(floridoside phosphate synthetase, FPS)合成P-红藻糖苷。通过同位素标记法显示, 合成红藻糖苷的两个前体甘油和半乳糖, 在光合作用过程中都有14C标记, 说明它们来自于磷酸戊糖途径的中间体。而甘油下降的速度非常快(2 min), 这也说明甘油不是一个光合作用的储备物质[9]。
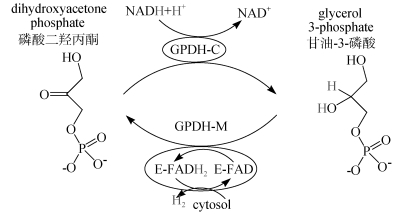 |
| 图 3 GPDH的作用机制 Fig. 3 GPDH reaction mechanism |
合成红藻糖苷的碳来自于光合作用, 或在黑暗中来自于内源性储备多糖(如红藻淀粉[10])。如果红藻糖苷的合成前体是光合作用的产物, 那么它将能够从叶绿体中转出并在光周期时用于红藻糖苷的合成。但目前认为合成红藻糖苷的光合途径和内源途径在时间和空间上也可能完全分开, 而且它们可能不是共用一套前体分子[5]。Pade等[11]以红藻Galdieria sulphuraria为研究对象, 报道了一个类似于海藻糖-6-磷酸合成酶的2个红藻糖苷磷酸合成酶基因及其功能。发现这两个基因正是执行红藻糖苷磷酸合成酶的功能, 催化甘油-3-磷酸和UDP-半乳糖形成P-(异)红藻糖苷, 这个中间体再经过P-红藻糖苷磷脂酶脱磷酸产生(异)红藻糖苷[12]。
2.2 红藻中红藻糖苷的代谢红藻中红藻糖苷的代谢涉及到几个关键酶。合成:红藻糖苷磷酸合成酶; 分解: α-半乳糖苷酶; 异构化: UDP-葡萄糖-4-差向异构酶。目前研究认为红藻糖苷的合成和分解可能在两个不同的细胞区域完成[1, 5]。
红藻糖苷为细胞壁多糖的合成提供碳源。通过14C同位素标记紫球藻属(Porphyridium sp.)(该藻细胞外是硫酸化的细胞壁多糖)的实验发现, 在没有其他的LMWCs的参与下, 14C-红藻糖苷能同化进入细胞壁的硫酸多糖中, 说明在某些生理条件下, 比如N饥饿时, 低分子量的光合同化产物红藻糖苷流到硫酸化的细胞壁多糖。当外源添加14C-红藻糖苷时, 红藻糖苷能够穿入藻细胞, 其中红藻糖苷中甘油的部分有利于它穿透细胞壁和细胞膜, 半乳糖部分则与穿透无关[13]。红藻糖苷的半乳糖被UDP激活形成UDP-D-半乳糖, 用于多糖的合成[14]。UDP-D-半乳糖也可以被异构酶转化为UDP-D-葡萄糖, 用于合成细胞壁多糖或转换成其他单糖。因此, 红藻糖苷的功能是作为细胞动态的碳库提供淀粉和细胞壁多糖合成的碳前体。碳流从红藻糖苷到细胞壁多糖受到黑暗和N的影响。在黑暗时, 溶液中标记的可溶性多糖增多, 但并没有出现标记的淀粉的同步增加, 说明细胞壁的硫酸多糖的净合成并不直接依赖于光合反应, 而是来源于储备的红藻糖苷的碳前体[15-17]。G. sulphuraria和Cyanidioschyz onmerolae的主要区别在于后者缺乏细胞壁。研究发现G. sulphuraria比C. merolae基因组编码了更多的盐藻糖基转移酶、半乳糖基转移酶、木聚糖酶和二磷酸核糖差向异构酶, 这些酶中可能很多都涉及了细胞壁的代谢[13]。
UDP-D-半乳糖是红藻糖苷和琼胶的生物合成途径共用中间体。脉冲追踪实验结果显示在未标记的培养基中, 光周期时, 标记的碳在1~2d内持续的累积到琼胶中, 标记的红藻糖苷出现下降。所以红藻糖苷可能先断裂形成游离的糖, 然后重新循环到琼胶中[18]。
2.3 红藻细胞内碳流转换在红藻Solieria chordalis中既存在海人草酸, 也有红藻糖苷。光合作用的碳流直接流向含D-半乳糖和D-甘露糖(红藻糖苷, 海人草酸)的LMWCs, 或者根据外部条件不同而流向红藻淀粉或细胞壁多糖。在S. chordalis经历追踪期时有68%的红藻淀粉升高, 说明碳流从红藻糖苷到淀粉。在低渗条件下, 只有少量的红藻糖苷和海人草酸合成, 但是这少量的合成却有强的同位素标记特征(67%和59%), 这说明它们是通过光合作用的碳同化过来的[5]。
另外, 碳流在某些情况下, 也会从多糖流回到红藻糖苷中。在红藻淀粉降解的过程中产生UDP-葡萄糖, UDP-葡萄糖再通过异构酶转变为UDP-半乳糖, 有报道指出, 当盐分引起渗透压变化时, 红藻淀粉和(异)红藻糖苷有相互作用, 低盐条件有利于不溶性储备红藻淀粉的积累, 而当盐浓度升高时, 则有利于高可溶性(异)红藻糖苷作为主要光合产物的积累[11, 19-20]。
红藻糖苷的合成和分解是受到渗透压调节的[18], 比如Gracilaria sordida在渗透压变化时, 琼胶的组成和淀粉的含量也会发生变化。当从光周期转入暗周期3 d时, 特别是转到高渗溶液中后再转到低渗条件时, 藻中的淀粉含量会下降。因此认为G. sordida的营养状态在调节淀粉降解方面起重要作用, 但总碳含量在渗透压改变后与对照仍是相同的, 说明淀粉降解产生的碳可以在藻体内循环使用[21]。Chlamydomonas pulsatilla在盐浓度增高时, 甘油库迅速增加, 这种增加是基于淀粉的降解[22], 淀粉降解所产生一定量的碳可能在高渗条件下转向了红藻糖苷的生物合成。但是这个增加量是非常高的, 这不仅仅是红藻糖苷生物合成的增加造成的, 红藻糖苷降解量减少也有贡献。淀粉降解是盐压所引起的碳重新分布, 并合成低分子量物质的主要碳源。当从高渗转低渗时, α-半乳糖苷酶活性增加, 这解释了在低渗时红藻糖苷库的快速转换。在营养丰富时, 暗处培养G. sordida, 当进入高渗环境时, 出现红藻糖苷的累积, 随后转到低渗环境时, α-半乳糖苷酶活性增加, 而淀粉降解提高。说明淀粉降解驱动的碳流可能从红藻糖苷转变, 并重新在藻体内重新回收用于生物合成[23](图 4)。
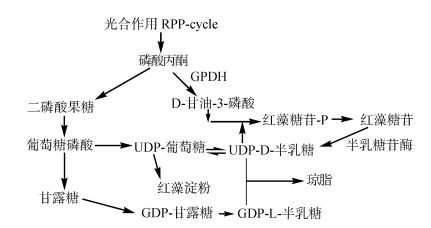 |
| 图 4 红藻细胞内的碳流转换 Fig. 4 Carbon flow conversion process in red algae cells |
在红藻Gelidiumcoulteri中, 氮含量会影响碳固定的速度以及光合作用下转化为终端产物的类型。碳固定速度在富氮比贫氮情况下高7倍。添加NO3-或NH4+到贫氮的藻体环境时, 前7h时会抑制固定作用, 但同时也发现红藻糖苷中存在大量的14C, 说明该红藻在富氮条件下比贫氮条件下有更高水平的红藻糖苷。添加NO3-到培养基中, 在1h内出现红藻糖苷的增加, 并抑制碳转化为琼胶和淀粉。另外, 氮含量显著影响琼胶的产率。当藻体经历几天氮饥饿时, 琼胶量增加达100%, 这被称为neish效应, 这种效应在很多种藻中都观察到[24]。这个效应涉及光合物的分配以及总生长速率的改变。氮匮乏条件诱导可以通过增加碳骨架的可利用性, 以及细胞需要合成细胞壁和保持生长, 从而促进琼胶的合成[18]。
3.2 渗透压因素不同植物和藻类采用不同结构的LMWCs作为渗透压调节物, 尽管他们的化学结构不同, 但是都有某些共性:具有高度溶解性, 在生理pH下不带电荷及在高浓度下具有非抑制性[20, 25]。
红藻糖苷在红藻中是重要的渗透压调节物质, 它的合成受胞外盐浓度(渗透压)的影响。在蓝藻和微藻的某些种中, 当培养基从低盐到高盐转变时, 会出现高浓度有机溶质的富集, 当培养基从高渗回到低渗时, 这些化合物会释放到培养基中。这种规律在红藻中也普遍存在, 在高渗(即高盐浓度)时, 红藻糖苷的合成大量增加, 转向低渗时, 红藻糖苷的含量又会下降, 所以细胞在应对高低渗变化时, 存在红藻糖苷的合成、分解等反应。在高渗透压时, 胞内红藻糖苷增加, 可能是由于生物合成速度增加或降解速度减慢。而红藻糖苷和异红藻糖苷在代谢和功能上可能存在差异性。大多数红藻是以红藻糖苷作为渗透压调节物。例如对Bangia atropurpurea的研究发现, 红藻糖苷的含量随盐的处理直线上升, 然而异红藻糖苷(没分D, L)几乎保持不变。B. purpurea处于淡水和海水环境时, 红藻糖苷的累积量相差7.5倍。说明在红毛菜目中, 红藻糖苷在代谢方面比异红藻糖苷活跃[1, 3]。Reed等[26]指出在Porphyra purpurea中, 尽管异红藻糖苷的相对浓度高, 但只有红藻糖苷响应外部盐浓度的变化。在Gracilariatenuistipitata中, α-半乳糖苷酶是红藻糖苷的降解酶。当细胞所处的外部渗透压降低时, Gracilaria中的α-半乳糖苷酶的活性增高。对Grateloupia doryphore的研究显示, 红藻糖苷的含量在低盐时快速下降, 在高盐时显著上升, 但培养3d后, 会缓慢回到原来的水平。说明G.doryphore适应环境变化的高能力[27]。在高渗条件下, 红藻糖苷不仅来自光合同化, 也有内源碳的参与, 比如红藻淀粉或卡拉胶。在S. chordalis中, 卡拉胶可能是唯一的内源碳的来源。
有研究者认为异红藻糖苷有可能不参与渗透压的调解[6]。例如发现当红藻中红毛菜(P.purpurea)处于不同盐浓度压力时, 异红藻糖苷的水平保持恒定不变[26]。但是也有一些藻是以异红藻糖苷作为渗透压调节物, 如对一种淡水单细胞无细胞壁藻Poterioochromonas malhamensis的研究, 它是以异红藻糖苷来调节的。因为其无细胞壁, 缺乏合成红藻糖苷的能力, 所以有可能只采用异红藻糖苷。当藻体进入高渗透压时, 细胞在1~3min内收缩, 在随后的1~2 h内, 细胞体积恢复, 这种恢复伴随着细胞内异红藻糖苷的升高, 相反降低渗透压引起异红藻糖苷的快速下降[28]。另外Karsten等[29]对P. columbina的研究发现, 随着培养条件中盐含量的变化, L-异红藻糖苷的浓度和比例显著变化, 所以L-异红藻糖苷可能是主要的渗透压调节物, 而红藻糖苷可能主要作为碳储存物质。在P. perforata中, 盐浓度不影响红藻糖苷的水平。因此, Kauss[8], Reed等[26]以及Karsten等[29]研究结果的差异性可能与研究的紫菜属的种不一样有关, 也可能与研究中使用的分析技术的差异有关[30]。
另外, 研究发现红藻糖苷的合成也不都是来源于光合作用的碳同化, 比如在高渗条件下, 红藻Grateloupia doryphora通过内源性储备产物合成红藻糖苷。随后Bondu[5]对另一种藻S. chordalis的研究也证实了这个观察。
3.3 红藻中红藻糖苷随季节和每日时间的变化研究发现红藻糖苷合成酶(FPS)受氮和光的影响。例如在野外养殖的紫菜属中, 从早上到中午红藻糖苷的含量增加4倍, 下午和傍晚时其含量下降。在4、5月采集时, 可能是由于日长增加的原因, 午后的下降不是很明显。2月到5月的每个时间点, 红藻糖苷也增加。这说明红藻糖苷的含量变化与光合作用所需的日长有关。虽然异红藻糖苷的含量也有类似的变化, 但是没有明显的趋势[7]。
FPS活性与温度和季节的变化也相关[29]。2月到4月的变化类似于黄豆中蔗糖的变化, 随着日长和水温的升高, FPS酶的活性也逐渐上升。这时FPS酶活性在一天中都保持在一个较高的水平。5月, FPS活性在一天里逐渐降低, 在傍晚达到最低值, 这个水平在整个晚上保持恒定。另外研究发现, FPS的活性变化与高等植物的蔗糖磷酸合成酶类似[31], 其酶活性受到酶量以及产物转变速度的影响[32]。所以外界环境会影响红藻糖苷含量和FPS活性的变化, 特别是光周期和温度。同时在标准实验室和野外条件FPS的催化研究发现, 其催化速度在早晨时更快, 可能是由于早晨FPS的合成速度增加或调控活性增加, 而与底物浓度似乎无关[7]。
红藻中红藻糖苷的类型也与季节有关。在澳大利亚的7月, P. columbina的幼苗产生几乎质量浓度相等的低浓度的红藻糖苷、L-异红藻糖苷和痕量的D-异红藻糖苷。7月到11月初, 红藻糖苷的量保持不变, L-异红藻糖苷则在这段时期持续增高; 但到11月底, 红藻糖苷含量升高2.3倍, L-异红藻糖苷则保持不变; 12月初时, 红藻糖苷含量降低25%, L-异红藻糖苷出现显著升高, 达到900 mmol/kg干质量的顶峰。在12月的中旬到下旬, L-异红藻糖苷的值降低35%[25]。在悉尼地区的B. atropurpurea也发现了同样有趣的现象, 7月收集的幼苗有490 mmol/kg干质量的红藻糖苷和320 mmol/kg干质量的D-异红藻糖苷, 但没有检测到L-异红藻糖苷。但在11月末, 却检测到了高含量的L-异红藻糖苷(320 mmol/kg)。而且红藻糖苷的含量在这段时期升高了50%以上, D-异红藻糖苷升高的更多, 达到160%。所以P. columbina和B. atropurpurea都显示出红藻糖苷的含量和类型都与季节的变化有关[7]。而北半球的P. perforata中的红藻糖苷也有类似的季节变化趋势。这种季节响应与环境的光照和温度动态有关。在温暖的区域, 如悉尼, 它主要与季节性浮动的日长有关, 与一年中的光强度和温度变化关系较小。因此可以认为在P. columbina和Bangia atropurpurea中, 这种季节性升高的糖苷浓度是光依赖性的, 并响应日长增加的[33-34]。
3.4 干出因素干出胁迫是紫菜养殖中不可避免的逆境。在Goulard等[35]和Karsten等[3]干出胁迫研究中发现, 红藻糖苷的含量随着干出时间的增加而增加。随着干出程度的加深, 失水加重, 渗透压升高。红藻糖苷的升高, 有助于保护细胞器, 尤其是叶绿体和线粒体结构。
4 红藻中红藻糖苷的生理功能红藻糖苷的作用与高等植物中蔗糖的作用类似, 是一种稳定的低分子质量中间物, 作为短期的储备碳库用于有机碳的转运, 将从CO2固定的碳转化为多糖和其他物质, 提供细胞所需的有机碳。同时, 它又类似于海藻糖, 可作为渗透压调节剂, 并在生物或非生物胁迫条件下累积到高含量。红藻糖苷为细胞提供碳源, 作为碳源也会与多糖竞争[19]。
另外, 糖醇在代谢中还有其他功能, 它们除了作为有机渗透和相容性溶质, 还能作为抗氧化剂。因此, 某些来自特殊环境, 如红树林的红藻具有合成并积累这些物质的能力[36]。
5 展望红藻糖苷在红藻的生长与发育, 特别是在胁迫中的渗透具有重要的调节作用。另外红藻糖苷结构简单, 分布广泛, 在红藻中作为碳库参与细胞壁的合成、脂类代谢, 并承担调节渗透压的重要生理作用, 可作为理想的化学指标来进行胁迫条件下红藻进行差异性防御规律的研究。红藻糖苷的三种异构体在藻类中的作用与含量也有一些差异, 且其含量在一定程度上受到外界环境, 比如光照, 温度与季节的影响。另外红藻中含有的红藻糖苷类型在不同物种, 以及相同物种的不同地理环境也存在着差异, 这为以后藻种间关系更深入地研究提供理论基础。
除此之外, 红藻糖苷还具有很多生物活性, 如具有调节免疫系统、保水、保湿抗氧化等多种功效[37-38]。研究发现红藻糖苷能够通过抑制酪氨酸酶的活性, 从而抑制细胞内黑色素的合成, 因此可以应用于多种护肤品的添加物[39]。随着研究的深入, 也发现红藻糖苷不仅可以作为护肤品的添加剂, 在超低温冻存微藻细胞时还可以充当保护剂作用[40], 另也可作为鱼类蛋白的抗冷冻保护剂, 有效抑制鱼糜在冷冻过程中的蛋白质变性, 提高冷冻鱼类的品质[41]。在对黄颡鱼幼鱼的研究中发现红藻糖苷可以促进其生长, 并对其血清生化指标有一定的调节作用[42]。在对人胎肝L-02细胞的研究时发现红藻糖苷不仅对肝细胞无毒, 还可以促进其生长[43]。
综上所述, 红藻糖苷作为一种海藻糖, 不仅在藻类生长发育中起着重要的作用, 还在医药、化妆品、食品和饲料领域有很大的开发价值。因此, 研究藻类中红藻糖苷的作用尤为重要。
| [1] |
Yoon H S, Zuccarello G C, Bhattacharya D. Evolutionary History and Taxonomy of Red Algae[M]//Red Algae in the Genomic Age. Springer Netherlands, 2010: 25-42.
|
| [2] |
Eggert A, Karsten U. Low Molecular Weight Carbohydrates in Red Algae - an Ecophysiological and Biochemical Perspective[M]//Red Algae in the Genomic Age. 2010: 443-456.
|
| [3] |
Karsten U, West J A, Zuccarello G C, et al. Low molecular weight carbohydrate patterns in the bangophyceae (Rhodophyta)[J]. Journal of Phycology, 2010, 35(5): 967-976. |
| [4] |
Chanda B, Venugopal S C, Kulshrestha S, et al. Glycerol-3-phosphate levels are associated with basal resistance to the hemibiotrophic fungus Colletotrichumhigginsianum in Arabidopsis[J]. Plant Physiology, 2008, 147(4): 2017-2029. DOI:10.1104/pp.108.121335 |
| [5] |
Bondu S, Cerantola S, Kervarec N, et al. Impact of the salt stress on the photosynthetic carbon flux and 13C-label distribution within floridoside and digeneaside in Solieriachordalis[J]. Phytochemistry, 2009, 70(2): 173-184. DOI:10.1016/j.phytochem.2008.12.021 |
| [6] |
Lobban C S, Wynne M J. The Biology of seaweeds[M]. University of California Press, 1981: 493-533.
|
| [7] |
Meng J, Srivastava L M. Variations in floridoside content and floridoside phosphate synthase activity in porphyraperforate (Rhodophyta)[J]. Journal of Phycology, 1993, 29(1): 82-84. DOI:10.1111/jpy.1993.29.issue-1 |
| [8] |
Northcote D H. International Review of Biochemistry[M]. University Park Press, 1977: 119-140.
|
| [9] |
Kremer B P, Kirst G O. Biosynthesis of 2-O-D-glycerol- α-D-galactopyranoside (Floridoside) in marine Rhodophyceae[J]. Plant Science Letters, 1981, 23(3): 349-357. DOI:10.1016/0304-4211(81)90047-X |
| [10] |
Arad S, Levy-Ontman O. Red microalgal cell-wall polysaccharides: biotechnological aspects[J]. Current Opinion in Biotechnology, 2010, 21(3): 358-364. DOI:10.1016/j.copbio.2010.02.008 |
| [11] |
Pade N, Linka N, Ruth W, et al. Floridoside and isofloridoside are synthesized by trehalose 6-phosphate synthase-like enzymes in the red alga Galdieria sulphuraria[J]. New Phytologist, 2015, 205(3): 1227-1238. DOI:10.1111/nph.13108 |
| [12] |
Bean R C, Hassid Z. Assimilation of CO2 by a photosynthesising red alga, Iridophycus flaccidum[J]. Journal of Biological Chemistry, 1955, 212: 411-426. |
| [13] |
Li S Y, Shabtai Y, Shoshana Arad. Floridoside as a carbon precursor for the synthesis of cell-wall polysaccharide in the red microalga porphyridium, sp. (Rhodophyta)[J]. Journal of Phycology, 2002, 38(5): 931-938. DOI:10.1046/j.1529-8817.2002.01143.x |
| [14] | |
| [15] |
Prosselkov P V, Gross W, Igamberdiev A U, et al. Purification and characterization of UDP-D-galactose 4-epimerase from the red alga Galdieria sulphuraria[J]. Physiologia Plantarum, 2010, 98(4): 753-758. |
| [16] |
Dorfman, Ralph I, Shipley, et al. Algal physiology and biochemistry[M]. Blackwell Scientific, 1974.
|
| [17] |
Arad S M, Lerental Y B, Dubinsky O. Effect of nitrate and sulfate starvation on polysaccharide formation in Rhodella reticulata[J]. Bioresource technology, 1992, 42(2): 141-148. DOI:10.1016/0960-8524(92)90073-7 |
| [18] |
Macler B A. Regulation of Carbon Flow by Nitrogen and Light in the Red Alga, Gelidiumcoulteri[J]. Plant Physiology, 1986, 82(1): 136-141. DOI:10.1104/pp.82.1.136 |
| [19] |
Barbier G, Oesterhelt C, Larson M D, et al. Comparative genomics of two closely related unicellular thermo- acidophilic red algae, Galdieria sulphuraria and Cyanidioschyzon merolae, reveals the molecular basis of the metabolic flexibility of Galdieria sulphuraria and significant differences in carbohydrate metabolism of both algae[J]. Plant physiology, 2005, 137(2): 460-474. DOI:10.1104/pp.104.051169 |
| [20] |
Kirst G O. Salinity Tolerance of Eukaryotic Marine Algae[J]. Annual Review of Plant Physiology & Plant Molecular Biology, 1990, 40(41): 21-53. |
| [21] |
Ekman P, Pedersén M. The Influence of Photon Irradiance, Day Length, Dark Treatment, Temperature, and Growth Rate on the Composition of Gracilaria sordida W. Nelson and Gracilaria verrucosa (Hudson) Papenfuss (Gigartinales, Rhodophyta)[J]. Botanica Marina, 1990, 33(6): 483-496. |
| [22] |
Hellebust J A, Lin Y H. Regulation of glycerol and starch metabolism in Chlamydomonas pulsatilla in response to changes in salinity[J]. Plant Cell & Environment, 1989, 12(6): 621-627. |
| [23] |
Peter Ekman, ShukunYu, Marianne Pedersen. Effects of altered salinity, darkness and algal nutrient status on floridoside and starch content, Ȋ±-galactosidase activity and yield of cultivated Gracilaria sordida[J]. British Phycological Bulletin, 2007, 26(2): 123-131. |
| [24] |
Bird K T, Hanisak M D, Ryther J. Chemical quality and production of agar extracted from gracilaria tikvahiae grown in different nitrogen enrichment conditions[J]. Botanica Marina, 1981, 24(8): 441-444. |
| [25] |
Karsten U, Barrow K D, Nixdorf O, et al. The Compability with Enzyme Activity of Unusual Organic Osmolytes from Mangrove Red Algae[J]. Functional Plant Biology, 1996, 23(5): 577-582. |
| [26] |
Reed R H, Collins J C, Russell G. The Effects of Salinity upon Galactosyl-Glycerol Content and Concentration of the Marine Red Alga Porphyrapurpurea (Roth) C. Ag.[J]. Journal of Experimental Botany, 1980, 31(125): 1539-1554. |
| [27] |
Simon-Colin C, Bessières M A, Deslandes E. An alternative HPLC method for the quantification of floridoside in salt-stressed cultures of the red alga Grateloupiadoryphora[J]. Journal of Applied Phycology, 2002, 14(2): 123-127. DOI:10.1023/A:1019539225950 |
| [28] |
Schobert B, Untner E, Kauss H. Isofloridosid und die osmoregulation beiOchromonasmalhamensis[J]. ZeitschriftFürPflanzenphysiologie, 1972, 67(5): 385-398. |
| [29] |
Karsten U, Barrow K D, King R J. Floridoside, L-lsofloridoside, and D-lsofloridoside in the Red Alga Porphyracolumbina[J]. Plant Physiol, 1993, 103: 485-491. DOI:10.1104/pp.103.2.485 |
| [30] |
Yu S, Pedersén M. The Effect of salinity changes on the activity of α-Galactosidase of the Red Algae Gracilariasordida and G. tenuistipitata[J]. Botanica Marina, 1990, 33(5): 385-392. |
| [31] |
Sicher R C, Kremer D F. Changes of sucrose-phosphate synthase activity in barley primary leaves during light/ dark transitions[J]. Plant Physiology, 1984, 76(4): 910-912. DOI:10.1104/pp.76.4.910 |
| [32] |
Huber S C, Rufty T W, Kerr P S. Effect of photoperiod on photosynthate partitioning and diurnal rhythms in sucrose phosphate synthase activity in leaves of soybean (Glycine max L.[Merr.]) and tobacco (Nicotiana tabacum L.)[J]. Plant physiology, 1984, 75(4): 1080-1084. DOI:10.1104/pp.75.4.1080 |
| [33] |
King R J, Schramm W. Photosynthetic rates of benthic marine algae in relation to light intensity and seasonal variations[J]. Marine Biology, 1976, 37(3): 215-222. DOI:10.1007/BF00387606 |
| [34] |
Gutkowski R, Maleszewski S. Seasonal changes of the photosynthetic capacity of the Antarctic macroalgaAdenocystisutricularis (Bory) Skottsberg[J]. Polar Biology, 1989, 10(2): 145-148. |
| [35] |
Goulard F, Diouris M, Quere G, et al. Salinity effects on NDP-sugars, floridoside, starch, and carrageenan yield, and UDP-glucose-pyrophosphorylase and -epimerase activities of cultivated Solieriachordalis[J]. Journal of Plant Physiology, 2001, 158(11): 1387-1394. DOI:10.1078/0176-1617-00569 |
| [36] |
Seckbach J, Chapman D J. Red Algae in the Genomic Age[M]. Springer Netherlands, 2010.
|
| [37] |
Li Y X, Li Y, Lee S H, et al. Inhibitors of oxidation and matrix metalloproteinases, Floridoside, and D-isofloridoside from marine red alga Laurencia undulata[J]. Journal of Agricultural & Food Chemistry, 2010, 58(1): 578. |
| [38] |
Courtois A, Simon-Colin C, Boisset C, et al. Floridoside extracted from the red alga Mastocarpus stellatus is a potent activator of the classical complement pathway[J]. Marine Drugs, 2008, 6(3): 407-417. DOI:10.3390/md6030407 |
| [39] |
翦秋丽, 蒋丽刚, 严江燕, 等. 红藻糖苷抑制黑色素形成的作用研究[J]. 生物学杂志, 2017, 34(5): 39-42. Jian Qiuli, Jiang Ligang, Yan Jiangyan, et al. Suppression of melanin formation by floridoside[J]. Journal of Biology, 2017, 34(5): 39-42. DOI:10.3969/j.issn.2095-1736.2017.05.039 |
| [40] |
李九零, 周成旭, 蒋莹, 等. 红藻糖苷对超低温冻存微藻的保护作用[J]. 水生生物学报, 2016, 40(5): 1020-1024. Li Jiuling, Zhou Chengxu, Jiang Ying, et al. The Cryoprotective effect of floridoside on microalgae[J]. Acta Hydrobiologica Sinica, 2016, 40(5): 1020-1024. |
| [41] |
高玉丽, 李九零, 严小军, 等. 红藻糖苷的提取及其对草鱼鱼糜抗冻性能的影响[J]. 水产学报, 2017, 41(2): 311-318. Gao Yuli, Li Jiuling, Yan Xiaojun, et al. Extraction of floridoside and the effect of floridoside on Ctenopharyngodon idellasurimi during frozen storage[J]. Journal of Fisheries of China, 2017, 41(2): 311-318. |
| [42] |
张杰, 陈海敏, 周歧存. 红藻糖苷对黄颡鱼幼鱼生长性能及血液学指标的影响[J]. 动物营养学报, 2015, 27(8): 2443-2449. Zhang Jie, Chen Haimin, Zhou Qicun. Effects of Floridoside on growth performance and haematological indexes of juvenile yellow catfish (Pelteoobagrus fulvidraco)[J]. Chinese Journal of Animal Nutrition, 2015, 27(8): 2443-2449. DOI:10.3969/j.issn.1006-267x.2015.08.016 |
| [43] |
陈余, 蒋丽刚, 李九零, 等. 红藻糖苷对人胎肝L-02细胞抗氧化作用的研究[J]. 营养学报, 2016, 38(6): 607-609. Chen Yu, Jiang Ligang, Li Jiuling, et al. Floridoside protects hepatocyte L-02 cells against oxidative stress[J]. Journal of Nutrition, 2016, 38(6): 607-609. |
 2018, Vol. 42
2018, Vol. 42


