文章信息
- 刘乾, 米铁柱, 甄毓, 王华龙, 于志刚. 2018.
- LIU Qian, MI Tie-zhu, ZHEN Yu, WANG Hua-long, YU Zhi-gang. 2018.
- 硅藻C4固碳途径的研究进展
- Research progress on C4 carbon fixation pathway of diatoms
- 海洋科学, 42(7): 131-140
- Marine Sciences, 42(7): 131-140.
- http://dx.doi.org/10.11759/hykx20180314001
-
文章历史
- 收稿日期:2018-03-14
- 修回日期:2018-07-31
2. 青岛海洋科学技术国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266071;
3. 海洋环境与生态教育部重点实验室, 山东 青岛 266100;
4. 中国海洋大学 环境科学与工程学院, 山东 青岛 266100;
5. 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;
4. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;
5. Key Laboratory of Marine Chemical Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China
每年由太阳到达地球的能量十分巨大, 但大约只有1%可以被植物光合作用所吸收, 而所固定的生物质高达2200亿t, 这是维持地球上生命活动最重要的有机合成反应[1-3]。光合作用的本质是绿色植物将光能转化为分子形式的化学能并储存在体内, 这些能量除了满足植物自身生长发育的需要以外, 还是食物链、食物网向生态系统正常运转所需初级生产力的主要来源, 这在维持生态系统的稳定方面起到了至关重要的作用。
1.1 光合固碳的分类及其划分依据光合作用的类型分为C3(Calvin cycle, 卡尔文循环代谢)、C4(Hatch-Slack cycle, 哈奇-斯莱克循环代谢)和CAM(crassulacean acid metabolism, 景天酸代谢)途径[4-6], 因此植物也相应的被划分为C3、C4和CAM植物, 其依据是C3植物固定CO2后最初产物为3-磷酸甘油酸, 而C4和CAM植物为草酰乙酸[6-8]。最初产物的不同是植物体内不同的生理结构和代谢过程所决定的。C3途径是最早被发现、最原始的光合作用过程[4], 并且所有光合植物体内最终均通过这一代谢过程完成对CO2的同化, 而C4和CAM光合作用的出现只是进一步提高了CO2固定和C3光合作用的效率, 同时也是对生活环境的适应性表现。
具有C4途径的陆地植物相对于C3植物更为复杂, 其叶片在进行光合作用时, 维管束细胞和叶肉细胞构成的Kranz结构[9]会在一系列酶[10]的共同作用下完成对CO2的浓缩后再进行同化。然而也有研究表明在两栖植物黑藻(Hydrillaverticullata)[11]体内还存在一种十分特殊的光合作用过程, 当外界CO2的浓度或者生活环境发生变化时, 其体内的C4途径会适应性地增强或减弱, 从而有效地提高了植物体对CO2的同化效率并且节省了体内积累的能量。这是植物体为了适应外界环境而不断进化的结果, 同时也表明C3和C4过程并非一成不变, 可以根据环境的变化做出相应调控, 并在一定程度上具有很高的关联性[12, 13]。
具有CAM途径的植物大多生活在半干旱的热带沙漠环境中, 为了防止体内水分的丢失, 其气孔只在夜间开放, 所以植物体只在这一时间段吸收CO2并以中间代谢物的形式储存在液泡中, 直到白天光照强烈气孔关闭时再释放CO2并完成固定[14]。因此CAM和C4植物最主要的区别在于CAM植物的CO2浓缩和同化发生在同一细胞内, 但进行的时间不同, 而C4植物的这两个过程是在同一时间内进行, 但涉及不同类型的细胞。因此, C4和CAM植物对于C3植物而言更为高等[15, 16], 虽然其光合作用的运行需要消耗更多的能量, 但对于主要分布在低温、湿润以及高CO2浓度生活环境的C3植物来说, 前两者凭借较高的水分利用效率和光合作用效率得以更好地适应了高温、干燥和低CO2浓度的生活环境, 因此在地球上的分布更为广泛[17-19]。
1.2 硅藻中光合固碳的演化过程关于植物光合作用类型的划分, 最先是在陆地植物中开展的。随着全球CO2浓度的不断增加以及全球变化的日益显著, 承担了全球约50%CO2固定量的海洋生态系统[20]对全球CO2的同化、调节作用及响应机制也受到广泛关注[21-23]。海洋生态系统的面积广大, 存在时间久远, 同时海气界面在气体交换方面还具有一定的特殊性[24], 这主要表现在现代海洋环境中的无机碳浓度约为2 mmol/L, 大部分还是以HCO3–离子的形式存在[25], CO2形式的无机碳只有5~25 μmol/L[26], 但在陆地环境中则大部分是以的CO2形式存在。而植物体的核酮糖-1, 5-二磷酸羧化酶/加氧酶(ribulose-1, 5-bisphosphate carboxylase/oxygenase, Rubisco)作为固碳过程中的关键酶及限速酶[27], 对CO2的平衡浓度(KmCO2)仅为40~60 μmol/L[28], 且只能利用CO2形式的无机碳[29], 同1, 5-二磷酸核酮糖(ribulose-1, 5-disphosphate, RuBP)反应生成3-磷酸甘油酸(3-phosphoglycerate, 3-PGA)。同时植物体内光合作用产生的O2也会与CO2共同竞争Rubisco上有限的反应位点, 进行加氧反应(光呼吸作用)。光呼吸作用虽然可以起到维持细胞内环境稳态的作用, 但其运行过程中不仅没有碳原子的积累而且还消耗了储存在体内的能量[30, 31]。因此, 海洋中的无机碳源是海洋植物进行碳固定的限制性因子[32], 这在一定程度上也成为了植物体为适应海洋环境而不断进化的动力。此外也有研究表明硅藻光合作用对CO2的亲和性远高于其体内Rubisco对CO2的亲和性[28], 并在营养盐含量较高、叶绿素含量较低的海域, 硅藻会在铁离子充足的情况下大量繁殖[33, 34], 这表明硅藻体内对无机碳的利用具有较高效率, 并据此可推测其体内可能还有一套较为完整的针对无机碳源转运、储存和同化的系统, 因此硅藻中这一特殊的机制也成为了新的研究切入点[35]。
作为在海洋生态系统固碳过程中起重要作用的微藻, 在不断进化过程中常依赖特有的CO2浓缩机制(CO2 concentrating mechanisms, CCM)对CO2进行浓缩, 这一机制有效提高了Rubisco周围的CO2浓度, 进而使其固定CO2的能力显著提高, 以此保证固碳代谢途径的顺利进行和正常生长需要[36, 37]。Tortell等[38]的研究表明, 单细胞藻类中的CCM主要分为生物化学和生物物理两种类型(图 1A、B, 分别以绿藻和硅藻的碳固定过程为例)。绿藻中起作用的CCM主要是生物物理机制, 其原理是通过碳酸酐酶(carbonic anhydrase, CA)的作用, 在Rubisco周围催化HCO3–脱水放出CO2, 从而完成相应浓缩反应[38]。而在已经明确证明存在C4过程的硅藻威氏海链藻(Thalassiosira weissflogii)中[39, 40], 其体内的固碳过程则进化出了生物化学和生物物理两种机制同时起作用, 并且当加入CA抑制剂[32](对其体内CCM的生物物理机制进行减弱)或限制CO2浓度时[41], 参与生物化学浓缩机制的编码基因及其对应酶的表达量会有所提高, 以此来保证固碳途径的正常进行。这也是该途径对于外界环境变化进行的适应性表现。
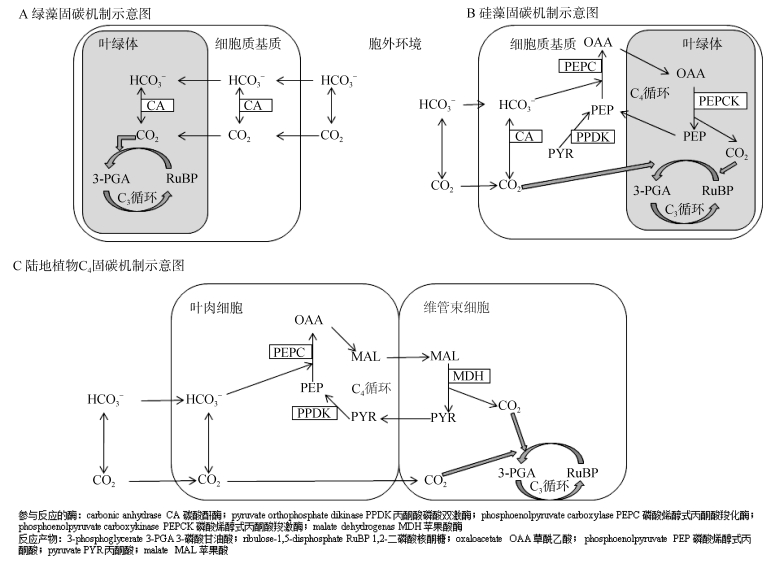 |
| 图 1 单细胞藻类和陆地高等植物体内的CO2浓缩机制 Fig. 1 Different CO2 concentrating mechanisms involving in algae and terrestrial higher plants |
单细胞硅藻体内生物化学机制的运行同陆地高等植物的C4途径十分相似[42](图 1B、C, 分别以单细胞硅藻和陆地高等植物的碳固定过程为例), 其中最基本的代谢过程是在一系列酶的作用下, 通过磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)、草酰乙酸(oxaloacetate, OAA)和丙酮酸(pyruvate, PYR)的相互转化, 在单细胞内对CO2完成了收集、浓缩和转运等一系列过程, 在叶绿体Rubisco周围释放的CO2同RuBP发生反应生成3-PGA, 可以有效降低光呼吸作用的反应强度, 增加Rubisco的固碳效率。有些硅藻种类[43]及陆地高等植物还涉及到了苹果酸、丙氨酸和天冬氨酸等中间代谢物的相互转化, 而对应起作用的酶为磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)、磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)、丙酮酸磷酸双激酶(pyruvate orthophosphate dikinase, PPDK)和苹果酸酶(malate dehydrogenase, MDH)等。硅藻中的C4途径与陆地高等植物的C4途径的本质区别则是, 硅藻作为单细胞, 凭借较为完善的细胞核-叶绿体调控系统、酶类在细胞内作用位点区域的划分、不同细胞器及其膜结构的共同作用来对CO2完成高效率的固定[40], 而不是通过维管束细胞和叶肉细胞共同实现CO2浓缩。
海洋的初级生产力大约同陆地相当, 而硅藻每年大约可以固定1016 gCO2, 相当于全球总固定量的20%[44], 研究硅藻的碳固定意义重大。近年来, 对其固碳途径的深入研究, 也为硅藻为何能对初级生产力有很大的贡献给出了较为合理的解释。一方面, 同多细胞高等植物相比, 硅藻作为单细胞植物拥有更大的表面积/体积比, 这使其同外界环境的接触面积更大, 所以具有更高的反应效率; 另一方面则是由于其体内存在特殊的CO2浓缩机制, 极大地提高了无机碳源的同化效率, 这也是硅藻不断适应海洋环境所进化出的特殊机制[37, 38]。
研究发现, 海洋中大多数可以进行光合作用的微藻大约是在寒武纪(约5.4亿—2.5亿年前)之前出现的[45], 而在随后的演变过程中, 硅藻类群则大规模出现在中生代时期[46](约为2.5亿—6600万年前), 之后由于陆地和海洋植物光合作用的不断加强, 导致大气CO2浓度的不断降低以及O2浓度的升高, 并在4000万年前时出现大气CO2浓度的急剧降低[47], 而硅藻类群也在不断适应外界环境的过程中不断繁盛。事实上, 通过对海洋沉积物碳同位素的研究, 也表明在3500万年前至今的时间段内, 来自硅藻类群中的13C相对较于其他浮游植物类群而言有了显著增加[48], 这也在一定程度是说明硅藻凭借包括CCM机制在内的对海洋环境的高效适应性, 其光合作用积累的有机物不断增加, 因此在初级生产力的贡献中相对于其他类群有了明显的优势。而我们在研究生物进化过程时, 结合对应时代的地质、气候等非生物背景环境的探究, 会对研究结果提供更加有力的证据。
2 硅藻C4途径研究的技术手段 2.1 高通量测序技术对硅藻C4途径的研究基于硅藻体内存在的特殊机制以及在CO2同化过程中的巨大贡献, 新兴的研究方法也在这一类群的研究中迅速开展。首先, Reinfelder等[40]通过荧光定量聚合酶链式反应(real-timequantitativepolymerasechain reaction, qPCR)技术和14C标记C4代谢物的方法, 第一次证明了海链藻属T. weissflogii可以凭借类似于陆地高等植物体内C4途径的单细胞C4浓缩机制进行碳固定。此外, 近些年来基于PCR技术而延伸出的测序技术成为了分子生物学研究中的常用技术手段, 尤其是高通量测序技术(high-throughput sequencing/next-generation sequencing technology, NGS)的发展, 更使人们对硅藻C4途径有了深入了解。一般而言, 硅藻作为拥有复杂结构和代谢过程的单细胞藻类主要起源于第二次内共生事件, 属于不等鞭毛类, 同动物和绿色植物距离较远[49-51]。通过对第一个完成基因组测序的硅藻假微型海链藻(T.pseudonana)的分析[52], 研究者发现在其细胞内存在十分特殊的代谢途径类型。一方面, 其具有完整的尿素循环, 这是动物体内代谢过程的典型特征; 另一方面, 还具有C4途径中代谢物质生成和转化所必需的全部酶类的编码基因。因此, 这一技术不仅提供了对硅藻在进化过程中为了适应海洋环境所出现的特殊性状进行研究的支持, 也为今后在测序技术的基础上对硅藻碳固定途径的研究提供了新的方向。随后, 研究者在对三角褐指藻(Phaeodactylum tricornutum)进行的基因组测序中发现[53], 其细胞内至少5%的基因来源于细菌, 是通过第二次内共生事件中的横向转移所获得; 并且其中也含有C4途径所必需的PEPC、PEPCK、PPDK和MDH酶的编码基因, 这为T. pseudonana和P. tricornutum可以进行C4过程提供了证据。
近几年来, 针对生物体转录组的高通量测序技术也不断发展和完善[54, 55]。转录组主要是指生物体的细胞或组织, 在特定生活环境或生长周期下转录出来的全部RNA的总和[56]。转录组测序可以应用于基因组图谱尚未完成的物种[57], 其基本流程是提取特定样本中的RNA后, 再对反转录成的cDNA进行测序, 这对于短期内无法构建全基因组图谱的物种来说无疑是最好的选择。然而转录又是一个非常复杂的动态过程, 生物体内不同的细胞、组织在某个特定的条件下会呈现不同的表达情况, 因此转录组测序具有很强的目的性、针对性和时效性[58]。结合前人的研究来看, 硅藻的转录组测序结果也只能表明硅藻在转录水平上C4途径的存在, 而在转录后的表达中还需要进一步的验证。因此, 这也为深入研究硅藻的C4过程提供了新的方向。
2.2 代谢物标记和RNA干扰技术对硅藻C4途径的研究随着研究的深入进行, 对于硅藻体内的C4碳固定过程也有人提出不同看法[59]。尽管在海链藻属T. weissflogii和T. pseudonana两个物种中存在有C4过程全部酶所必需的编码基因[60], 但14C的标记试验[61]却呈现出不同的结果。使用14CO2标记5s后, 在T. weissflogii中发现30%的14C标记存在于苹果酸中, 40%存在于丙糖磷酸, 而在T. pseudonana中则没有出现含有14C标记的C4产物, 因此研究人员认为虽然在一些硅藻种类的基因组中存在相关酶的编码基因, 但在T. pseudonana中进行的仍然是典型的C3固碳途径, T. weissflogii则是进行C3-C4中间型代谢途径。所以这些编码基因虽然可以通过基因组测序的技术在硅藻中得到注释, 但其在什么条件下可以完全转录成RNA、翻译成为蛋白质并加工成为可以起作用的酶类也是后续研究需要继续关注的重点。此外, 也有研究人员采用RNA干扰(RNA interference, RNAi)技术对P. tricornutum进行研究[27], 使其C4途径中关键酶PPDK的编码基因沉默, 并通过qPCR和酶活测定的方法验证了突变体植株中ppdk转录本的表达丰度仅为正常植株的20%, PPDK酶活性为正常植株的25%;随后, 通过CO2同化和O2释放量、叶绿素荧光和含量变化以及脂质积累量等参数比对了突变体和野生型的区别, 结果表明两者之间并没有表现出巨大的差异, 均能维持正常的生理功能, 因此C4途径并未在P. tricornutum固碳过程中起到至关重要的作用, 可能只作用于维持细胞内环境稳定。
3 C4途径的生态学意义诸多技术的应用已经证明一些硅藻中的C4浓缩机制, 在固碳途径中起到重要作用, 但由于这一机制的运行涉及硅藻体内能量的积累、对外界环境因子变化的响应、体内各代谢途径的能量分配以及通过食物链和食物网向生态系统能量输送的各个反应, 所以研究也更多倾向于结合不同的生态学尺度, 在个体、种群、群落和生态系统的不同层次不断展开。
3.1 个体层次在个体层次而言, 硅藻体内的C4途径直接作用于固碳途径, 是涉及多种代谢物、多种酶以及多个代谢途径的复杂过程, 具有浓缩CO2、降低光呼吸强度、提高光合效率的积极作用。此外, 这一途径涉及的细胞器内环境还是硅藻体内的CO2临时储存系统[43]。在海洋环境中, 硅藻会随着水体的作用而发生垂直方向的移动, 再加上昼夜交替的原因, 自身所受到的光照是不稳定的, 所以临时储存的CO2及代谢物(磷酸烯醇式丙酮酸、草酰乙酸和苹果酸等)会随着光照强度的变化而相应地消耗或积累, 从而最大限度地减少了这一外界因子对碳固定的影响, 这是硅藻与陆地高等C4植物通过调节气孔的开闭以及液泡储存CO2的功能用以应对强光、适应干旱环境非常相似的地方, 也是硅藻在进化中对多变海洋环境的适应性表现。而涉及到的PPDK酶及其相关的叶黄素循环代谢途径[62]还可以驱散机体内的多余光能[63], 这对于生活环境中光强度随时剧烈变化、运动能力较差的硅藻来说, 可以起到了很好的保护作用[64]。此外, PECP和PEPCK参与的羧化、脱羧反应同CO2和HCO3–的转化相关, 其具体表现为在高CO2浓度的培养环境下, 对应编码基因的转录本丰度及酶活的显著提高[65], 相应的双羧酸生成与转化是内环境中pH值调节的重要方式。Dan等[66, 67]也证明了, 这一调节体系是在细胞质基质和外部环境之间的无机碳源同化过程中的必要环节, 调节的强度与外界无机碳源的浓度密切相关。
另一方面, 这一途径在机体能量分配中也有着重要作用。其过程所涉及到的果糖二磷酸醛缩酶(fructose- bisphosphate aldolase, ALDO)和果糖-1, 6-二磷酸酶(fructose-1, 6-bisphosphatase, FBP)也是糖酵解代谢途径中的关键酶。而卡尔文循环、糖酵解过程、磷酸戊糖途径以及三羧酸循环共同构成了中心碳循环[68]。这些代谢途径, 控制了碳骨架从形成到流动、消耗和积累的一系列生理生化过程, 其合成积累的脂质可以达到细胞干重的20%~30%[69], 同时可以合成大量的ω脂肪酸[70, 71]。2001年, Miyagawa等[72]将存在于藻类体内的FBP基因转入烟草叶绿体中并得以正常表达, 在大气正常CO2(360×10–6)浓度下, 突变体植株的光合作用效率和糖类的积累量相对于野生型有了显著提高, 首次证明了通过改变一种酶的作用就可以提高光合作用效率。一般情况下, 一个代谢过程的研究中涉及能量的流入和输出, 而改变一个酶的活性就可以提高整个代谢途径的效率, 这在植物体内是非常少见的。结合硅藻广泛的分布范围和对初级生产力的显著贡献, 这一代谢途径也成了为提高生物能源生产效率而进行基因工程改造的优良对象, 这也为新能源的开发明确了方向。
3.2 种群和群落层次在种群和群落尺度, 硅藻依靠多种代谢途径的共同作用完成对无机碳的固定, 而积累的能量除了用于自身正常生理活动之外, 还通过食物网的作用得以将能量传递到下一级消费者。硅藻作为对初级生产有巨大贡献的生产者, 在维持整个海洋生态系统的正常运转中起着到重要作用。一方面它可以作为很多经济动物幼体的优质饵料生物, 与海域内渔业产量有密切联系[73]; 另一方面, 一些种类的硅藻如骨条藻、海链藻和角毛藻等还可以直接引发赤潮, 例如长江口、珠江口等海域中的中肋骨条藻、角毛藻属种类等微型硅藻种类就是这些海域的主要赤潮原因种[74]。对于硅藻而言, 在产生巨大初级生产力的同时, 其种群的暴发往往也会造成海域内低氧区的形成[75]。因此硅藻同其他赤潮生物之间的竞争以及自身群落演替也与有害藻华等自然灾害的发生存在密切关系。
固碳途径恰好位于能量流动输入生态系统的起始部分, 因此对硅藻在不同环境中的分子响应机制的深入研究对于监测、预警和防治硅藻大规模暴发以及近海水产养殖具有重要意义。高亚辉等[76]对我国近海长江口海域春季期间的硅藻种类组成和生态分布进行了调查, 并分析了该海域内硅藻的水平和垂直分布特征以及各站位的优势种情况。此外, 美国伍兹霍尔海洋研究所[48]早在1991年就通过碳同位素方法对美国东海岸Georges Bank海域生态系统食物网中硅藻来源的13C比例进行了计算, 表明该生态系统中浮游动物类群中的碳源最少有40%来源于硅藻类群; 同时在北大西洋、西北太平洋和墨西哥湾海域初级生产者中均含有丰富的硅藻来源的13C组分, 表明了硅藻在很多海洋食物网中都是主要的生产者。而有研究表明, 近年来日益频繁的水母暴发也同海域内硅藻的群落演替有关[77]。硅藻凭借体内特有的C4、尿素循环等代谢途径[52], 在自身能量流动分配、抵御不利环境和种间竞争中起到重要作用, 因此对硅藻碳固定以及能量分配的C4过程的解析, 可为研究其在种群竞争、群落交替以及生物对环境因子耐受机制中的作用提供帮助, 进一步还可能为提高水产养殖产量和解决自然灾害问题提供科学基础。
3.3 生态系统层次在生态系统以及更大尺度的生物圈中, 单细胞藻类的光合作用也发挥着重要作用, 其中的硅藻承担了高达20%的CO2同化量, 超过了热带雨林的固碳量[78], 其固碳过程还具有生物碳泵的作用, 可通过细胞沉降作用将生物碳由大洋表面带入深海[79]。全球气候变化下, 环境改变会对生态系统中的生物产生不同程度的扰动[80, 81]。结合植物的光合作用尤其是硅藻的固碳作用的运行机制, 会给我们带来新的研究视角和应对策略。C4途径的进化动力源于海气界面CO2交换的特殊性以及海洋环境中CO2的限制作用。虽然气候变化对生物的影响仍存在争议, 但不可否认的是, 大气CO2浓度在不断升高, 因此这对于承担了巨大固碳作用的硅藻来说, 需要进一步探究气候变化对其碳固定过程的扰动以及C3-C4途径产生的相应响应机制, 代谢过程之间的相互转化和能量分配中的协调变化, 以及最终的CO2同化量、有机物固定和能量的累积情况。然而, C4途径作为一种CO2浓缩机制, 其随着大气CO2浓度的不断升高是否会受到影响而减弱, 这一变化是否会进一步加速CO2浓度的升高, 都需要继续进行探索。
4 展望虽然前期我们对S. marinoi的转录组进行了基础性的研究[82], 并且在RNA层面探究了其C4途径和固碳途径相关酶编码基因的差异表达情况。但是通过中心法则也不难发现, 生命功能的主要体现者是基因转录翻译后的表达产物—蛋白质, 蛋白质有其自身特有的活动规律, 蛋白质的修饰加工形成的各级结构、转运定位、蛋白质与蛋白质的相互作用、蛋白质与核酸的相互作用、尤其是蛋白质的生物学功能以及酶活性的体现, 均无法从基因组和转录水平的研究获知。因此, 如果仅仅从基因组和转录组的角度展开研究, 则对于转录后的过程, 以及细胞特定时期和条件下的动态变化并不能全面认识。如果说对于物种基因组的测序相当于对生命密码的获得, 那么多种组学的结合才是对密码真正的“破译”, 因此还需要以蛋白质组、代谢组等多组学结合的方式解析硅藻体内C4和相关的固碳途径。
十分有趣的是, 关于S. marinoi转录组方面最新的文献证明其体内存在极为特殊的前列腺素代谢途径[83], 这与T. pseudonana中发现的尿素循环代谢途径[52]相类似的是, 两类代谢途径都属于类动物性的代谢途径。一般而言, 前列腺素在高等动物体内免疫系统中起到重要作用, 而在无脊椎动物体内则是作为一种细胞间相互交流的信号传递分子的形式存在, 但其在单细胞微藻中还是首次发现。因次, 这也体现了硅藻在发生次级内共生作用后[52], 兼具动植物和细菌的部分特征, 这极大丰富了我们对硅藻代谢途径的认知, 也为我们的研究提供了新思路:在已有的转录组数据基础上, 也可以尝试对其序列进行动物或细菌的数据库比对和注释, 从而有可能发现更多新的特性, 更好的揭示硅藻在种群进化和生态学上的成功。
| [1] |
Martin W F, Bryant D A, Beatty J T. A physiological perspective on the origin and evolution of photosynthesis.[J]. FEMS Microbiology Reviews, 2018, 42(2): 205-231. |
| [2] |
Nzihou A, Flamant G, Stanmore B. Synthetic fuels from biomass using concentrated solar energy - A review[J]. Energy, 2012, 42(1): 121-131. |
| [3] |
Barber J. Photosynthetic energy conversion: natural and artificial.[J]. Chemical Society Reviews, 2009, 38(1): 185-196. |
| [4] |
Benson A, Calvin M. The dark reductions of photosynthesis[J]. Atomic Energy in Biophysics Biology & Medicine, 1948, 105: 648-648. |
| [5] |
Hatch M D. C4 Photosynthesis: a unique elend of modified biochemistry, anatomy and ultrastructure[J]. Biochimica et Biophysica Acta (BBA) - Reviews on Bioenergetics, 1987, 895: 81-106. |
| [6] |
Bräutigam A, Schlüter U, Eisenhut M, et al. On the evolutionary origin of CAM photosynthesis[J]. Plant Physiology, 2017, 174(2): 473-477. |
| [7] |
Schlüter U, Weber A P M. The road TO C4 photosynthesis: evolution of a complex trait via intermediary states[J]. Plant & Cell Physiology, 2016, 57(5): 881-889. |
| [8] |
Goolsby E W, Moore A J, Hancock L P, et al. Molecular evolution of key metabolic genes during transitions to C4 and CAM photosynthesis[J]. American Journal of Botany, 2018, 105(3): 602-613. |
| [9] |
Rosnow J J, Edwards G E, Roalson E H. Positive selection of Kranz and non-Kranz C4 phosphoenolpyruvate carboxylase amino acids in Suaedoideae (Chenopodiaceae)[J]. Journal of Experimental Botany, 2014, 65: 1-13. DOI:10.1093/jxb/ert385 |
| [10] |
Raven J A, Beardall J, Sãn P. The possible evolution, and future, of CO2-concentrating mechanisms[J]. Journal of Experimental Botany, 2017, 68(14): 3701-3716. DOI:10.1093/jxb/erx110 |
| [11] |
Bowes G, Salvucci M E. Plasticity in the photosynthetic carbon metabolism of submersed aquatic macrophytes[J]. Aquatic Botany, 1989, 34: 233-266. DOI:10.1016/0304-3770(89)90058-2 |
| [12] |
Gao Z, Shen W, Chen G. C4-like photosynthesis has important functions in C3 plant vasculature[J]. Journal of Experimental Botany, 2018, 69(15): 3531-3540. DOI:10.1093/jxb/ery155 |
| [13] |
Christin P, Osborne C P. The evolutionary ecology of C4 plants[J]. New Phytologist, 2015, 204(4): 765-781. |
| [14] |
Barrios B L, Yancas L F, Búrquez A. Plant functional trait structure in two fog deserts of America[J]. Flora, 2018, 243: 1-10. |
| [15] |
Ashraf M, Harris P J C. Photosynthesis under stressful environments: An overview[J]. Photosynthetica, 2013, 51(2): 163-190. DOI:10.1007/s11099-013-0021-6 |
| [16] |
Borland A M, Hartwell J, Weston D J, et al. Engineering crassulacean acid metabolism to improve water-use efficiency.[J]. Trends in Plant Science, 2014, 19(5): 327-338. DOI:10.1016/j.tplants.2014.01.006 |
| [17] |
Sage R F. The evolution of C4 photosynthesis[J]. New Phytologist, 2004, 161: 341-370. DOI:10.1111/nph.2004.161.issue-2 |
| [18] |
Sage R F. Photorespiratory compensation: a driver for biological diversity[J]. Plant Biology, 2013, 15(4): 624-638. |
| [19] |
Yamori W, Hikosaka K, Way D A. Temperature response of photosynthesis in C3, C4, and CAM plants: temperature acclimation and temperature adaptation[J]. Photosynthesis Research, 2014, 119(1-2): 101-117. DOI:10.1007/s11120-013-9874-6 |
| [20] |
Häder D P, Kumar H D, Smith R C, et al. Effects on aquatic ecosystems[J]. Journal of Photochemistry & Photobiology B Biology, 1998, 46(1-3): 53-68. |
| [21] |
Huang Y, Liu X, Laws E A, et al. Effects of increasing atmospheric CO2 on the marine phytoplankton and bacterial metabolism during a bloom: A coastal mesocosm study[J]. Science of the Total Environment, 2018, 633: 618-629. DOI:10.1016/j.scitotenv.2018.03.222 |
| [22] |
Kerr R A. Global warming is changing the world[J]. Science, 2007, 316: 188-190. DOI:10.1126/science.316.5822.188 |
| [23] |
Hein A M, Sand J K. CO2 increases oceanic primary production[J]. Nature, 1997, 388: 526-527. |
| [24] |
Zehr J P, Kudela R M. Photosynthesis in the open ocean[J]. Science, 2009, 326: 945-946. DOI:10.1126/science.1181277 |
| [25] |
Takahashi T, Sutherland S C, Wanninkhof R, et al. Climatological mean and decadal change in surface ocean pCO(2), and net sea-air CO2 flux over the global oceans[J]. Deep Sea Research Part Ⅱ Topical Studies in Oceanography, 2009, 56(s8-10): 554-577. |
| [26] |
Rivas R, Frosi G, Ramos D G, et al. Photosynthetic limitation and mechanisms of photoprotection under drought and recovery of Calotropis procera, an evergreen C3, from arid regions[J]. Plant Physiology & Biochemistry Ppb, 2017, 118: 589. |
| [27] |
Maya H, Nitsan G, Daniela E, et al. The role of C4 metabolism in the marine diatom Phaeodactylum tricornutum[J]. New Phytologist, 2013, 197: 177-185. DOI:10.1111/j.1469-8137.2012.04375.x |
| [28] |
Erb T J, Zarzycki J. A short history of RubisCO: the rise and fall of Nature's predominant CO2 fixing enzyme[J]. Current Opinion in Biotechnology, 2017, 49: 100. |
| [29] |
Tomar V, Sidhu G K, Nogia P, et al. Regulatory components of carbon concentrating mechanisms in aquatic unicellular photosynthetic organisms[J]. Plant Cell Reports, 2017, 36(11): 1671-1688. DOI:10.1007/s00299-017-2191-3 |
| [30] |
Rivas R, Frosi G, Ramos D G, et al. Photosynthetic limitation and mechanisms of photoprotection under drought and recovery of Calotropis procera, an evergreen C-3, from arid regions[J]. Plant Physiology & Biochemistry Ppb, 2017, 118: 589-599. |
| [31] |
Wingler A, Lea P J, Quick W P, et al. Photorespiration: metabolic pathways and their role in stress protection[J]. Philos Trans R Soc Lond B Biol Sci, 2000, 355(1402): 1517-1529. DOI:10.1098/rstb.2000.0712 |
| [32] |
Mcginn P J, Morel F M M. Expression and inhibition of the carboxylating and decarboxylating enzymes in the photosynthetic C4 pathway of marine diatoms[J]. Plant Physiology, 2008, 146: 300-309. |
| [33] |
Behrenfeld M J, Bale A J, Kolber Z S, et al. Confirmation of iron limitation of phytoplankton photosynthesis in the equatorial Pacific Ocean[J]. Brain Behavior and Immunity, 2004, 18: 24-34. DOI:10.1016/S0889-1591(03)00088-6 |
| [34] |
Frank G, Ulf R, Gorbunov M Y. Changes in primary productivity and chlorophyll a in response to iron fertilization in the Southern Polar Frontal Zone[J]. Limnology and Oceanography, 2002, 47: 1324-1335. DOI:10.4319/lo.2002.47.5.1324 |
| [35] |
Clement R, Jensen E, Prioretti L, et al. Diversity of CO2 concentrating mechanisms and responses to CO2 concentration in marine and freshwater diatoms.[J]. Journal of Experimental Botany, 2017, 68(14): 3925-3935. DOI:10.1093/jxb/erx035 |
| [36] |
Hockin N L, Mock T, Mulholland F, et al. The response of diatom central carbon and nitrogen starvation is different from that of green algae and higher plants[J]. Plant Physiology, 2011, 158: 299-312. |
| [37] |
Matsuda Y, Hopkinson B M, Nakajima K, et al. Mechanisms of carbon dioxide acquisition and CO2 sensing in marine diatoms: a gateway to carbon metabolism.[J]. Philosophical Transactions of the Royal Society of London, 2017, 372(1728): 20160403. DOI:10.1098/rstb.2016.0403 |
| [38] |
Tortell P D, Reinfelder J R, Morel F M. Active uptake of bicarbonate by diatoms[J]. Nature, 1997, 390: 243-244. DOI:10.1038/36765 |
| [39] |
Morel F M, Cox E H, Kraepiel A M, et al. Acquisition of inorganic carbon by the marine diatom Thalassiosira weissflogii[J]. Functional Plant Biology, 2002, 29: 301-308. DOI:10.1071/PP01199 |
| [40] |
Reinfelder J R, Kraepiel A M, Morel F M. Unicellular C4 photosynthesis in a marine diatom[J]. Nature, 2000, 407: 996-999. DOI:10.1038/35039612 |
| [41] |
Granum E, Raven J A, Leegood R C. How do marine diatoms fix 10 billion tonnes of inorganic carbon per year[J]. Canadian Journal of Botany, 2005, 83: 898-908. DOI:10.1139/b05-077 |
| [42] |
Edwards G E, Franceschi V R, Voznesenskaya E V. Single-cell C(4) photosynthesis versus the dual-cell (Kranz) paradigm[J]. Annual Review of Plant Biology, 2004, 55: 173-196. DOI:10.1146/annurev.arplant.55.031903.141725 |
| [43] |
Young J N, Hopkinson B M. The potential for co-evolution of CO2-concentrating mechanisms and Rubisco in diatoms[J]. Journal of Experimental Botany, 2017, 68(14): 3751-3762. DOI:10.1093/jxb/erx130 |
| [44] |
Riebesell U. Carbon fix for a diatom[J]. Nature, 2000, 407: 959-960. |
| [45] |
Berner R A. Atmospheric carbon dioxide levels over phanerozoic time[J]. Science, 1990, 249: 1382-1386. DOI:10.1126/science.249.4975.1382 |
| [46] |
Medlin L R, Kooistra W H C F, Gersonde R, et al. Is the origin of the diatoms related to the end Permian mass extinction[J]. Nova Hedwigia, 1997, 65: 1-11. |
| [47] |
Beerling D J, Osborne C P, Chaloner W G. Evolution of leaf-form in land plants linked to atmospheric CO2 decline in the Late Palaeozoic era[J]. Nature, 2001, 410: 352-354. DOI:10.1038/35066546 |
| [48] |
Fry B, Wainright S C. Diatom sources of 13C-rich carbon in marine food webs[J]. Marine Ecology Progress, 1991, 76: 149-157. DOI:10.3354/meps076149 |
| [49] |
Medlin L K. A review of the evolution of the diatoms from the origin of the lineage to their populations[J]. The Diatom World, 2011, 19: 93-118. DOI:10.1007/978-94-007-1327-7 |
| [50] |
Gruber A, Kroth P G. Intracellular metabolic pathway distribution in diatoms and tools for genome-enabled experimental diatom research[J]. Philosophical Transactions of the Royal Society of London, 2017, 372(1728): 20160402. DOI:10.1098/rstb.2016.0402 |
| [51] |
Niklas K J, Cobb E D, Dunker A K. The number of cell types, information content, and the evolution of multicellularity[J]. Acta Societatis Botanicorum Poloniae, 2014, 83(4): 337-347. DOI:10.5586/asbp.2014.034 |
| [52] |
Bowler C, Jenkins B D, Obornik M, et al. The genome of the diatom Thalassiosira pseudonana: ecology, evolution, and metabolism[J]. Science, 2004, 306: 79-86. DOI:10.1126/science.1101156 |
| [53] |
Bowler C, Allen A E, Badger J H, et al. The Phaeodactylum genome reveals the evolutionary history of diatom genomes[J]. Nature, 2008, 456: 239-244. DOI:10.1038/nature07410 |
| [54] |
Mortazavi A, Williams B A, Mccue K, et al. Mapping and quantifying mammalian transcriptomes by RNA- Seq[J]. Nature Methods, 2008, 5: 621-628. DOI:10.1038/nmeth.1226 |
| [55] |
Rastogi A, Maheswari U, Dorrell R G, et al. Integrative analysis of large scale transcriptome data draws a comprehensive landscape of Phaeodactylum tricornutum genome and evolutionary origin of diatoms[J]. Scientific Reports, 2018, 8(4): 909-919. |
| [56] |
Costa V, Angelini C, De F I, et al. Uncovering the Complexity of transcriptomes with RNA-Seq[J]. Biomed Research International, 2010, 1: 853-916. |
| [57] |
Birzele F, Schaub J, Rust W, et al. Into the unknown: expression profiling without genome sequence information in CHO by next generation sequencing[J]. Nucleic Acids Research, 2010, 38: 3999-4010. DOI:10.1093/nar/gkq116 |
| [58] |
Nagalakshmi U, Wang Z, Waern K, et al. The Transcriptional landscape of the yeast genome defined by RNA sequencing[J]. Science, 2008, 320: 1344-1349. DOI:10.1126/science.1158441 |
| [59] |
Ewe D, Tachibana M, Kikutani S, et al. The intracellular distribution of inorganic carbon fixing enzymes does not support the presence of a C4 pathway in the diatom Phaeodactylum tricornutum[J]. Photosynthesis Research, 2018, 3: 1-18. |
| [60] |
Kroth P G, Chiovitti A, Gruber A, et al. A model for carbohydrate metabolism in the diatom Phaeodactylum tricornutum deduced from comparative whole genome analysis[J]. Plos One, 2008, 3: e1426. DOI:10.1371/journal.pone.0001426 |
| [61] |
Roberts k. C3 and C4 pathways of photosynthetic carbon assimilation in marine diatoms are under genetic, not environmental, control[J]. Plant Physiology, 2007, 145: 230-235. DOI:10.1104/pp.107.102616 |
| [62] |
Ambati R R, Gogisetty D, Aswathanarayana R G, et al. Industrial potential of carotenoid pigments from microalgae: Current trends and future prospects.[J]. Gene, 2018, 646: 12-19. DOI:10.1016/j.gene.2017.12.052 |
| [63] |
Eisenstadt D, Ohad I, Keren N, et al. Changes in the photosynthetic reaction centre Ⅱ in the diatom Phaeodactylum tricornutum result in non-photochemical fluorescence quenching[J]. Environmental Microbiology, 2008, 10: 1997-2007. DOI:10.1111/emi.2008.10.issue-8 |
| [64] |
Lavaud J, Strzepek R F, Kroth P G. Photoprotection capacity differs among diatoms: Possible consequences on the spatial distribution of diatoms related to fluctuations in the underwater light climate[J]. Limnology and Oceanography, 2007, 52: 1188-1194. DOI:10.4319/lo.2007.52.3.1188 |
| [65] |
Reinfelder J R. Carbon concentrating mechanisms in eukaryotic marine phytoplankton[J]. Annual Review of Marine Science, 2011, 3: 291-315. DOI:10.1146/annurev-marine-120709-142720 |
| [66] |
Dan T, Silverman J, Luz B, et al. Massive light-dependent cycling of inorganic carbon between oxygenic photosynthetic microorganisms and their surroundings[J]. Seibutsu-kogaku Kaishi, 1993, 71: 437-440. |
| [67] |
Dan T, Hassidim M, Luz B, et al. Sustained net CO2 evolution during photosynthesis by marine microorganisms[J]. Current Biology, 1997, 68: 723-728. |
| [68] |
Hockin N L, Mock T, Mulholland F, et al. The response of diatom central carbon metabolism to nitrogen starvation is different to that of green algae and higher plants[J]. Plant Physiology, 2011, 158: 299-312. |
| [69] |
Hildebrand M, Davis A K, Smith S R, et al. The place of diatoms in the biofuels industry[J]. Biofuels, 2012, 3: 221-240. DOI:10.4155/bfs.11.157 |
| [70] |
Hamilton M L, Haslam R P, Napier J A, et al. Metabolic engineering of Phaeodactylum tricornutum for the enhanced accumulation of omega-3 long chain polyunsaturated fatty acids[J]. Metabolic Engineering, 2014, 22: 3-9. DOI:10.1016/j.ymben.2013.12.003 |
| [71] |
Valenzuela J, Mazurie A, Carlson R P, et al. Potential role of multiple carbon fixation pathways during lipid accumulation in Phaeodactylum tricornutum[J]. Biotechnology for biofuels, 2012, 5: 151-153. |
| [72] |
Miyagawa Y, Tamoi M, Shigeoka S. Overexpression of a cyanobacterial fructose-1, 6-/sedoheptulose- 1, 7-bisphosphatase in tobacco enhances photosynthesis and growth[J]. Nature Biotechnology, 2001, 19: 965-969. DOI:10.1038/nbt1001-965 |
| [73] |
Tan K S, Ransangan J. Effects of nutrients and zooplankton on the phytoplankton community structure in Marudu Bay[J]. Estuarine Coastal & Shelf Science, 2017, 194: 16-29. |
| [74] |
Zhou M J, Zhu M Y, Zhang J. Status of harmful algal blooms and related research activities in China[J]. Chinese Bulletin of Life Sciences, 2001, 13: 54-59. |
| [75] |
Wang B, Chen J, Jin H, et al. Diatom bloom-derived bottom water hypoxia off the Changjiang estuary, with and without typhoon influence[J]. Limnology & Oceanography, 2017, 62: 1-18. |
| [76] |
高亚辉, 虞秋波, 齐雨藻, 等. 长江口附近海域春季浮游硅藻的种类组成和生态分布[J]. 应用生态学报, 2003, 14: 1044-1048. Gao Yahui, Yu Qiubo, Qi Yuzao, et al. Species composition and ecological distribution of planktonic diatoms in the Changjiang River estuary during Spring[J]. Chinese Journal of Applied Ecology, 2003, 14: 1044-1048. DOI:10.3321/j.issn:1001-9332.2003.07.003 |
| [77] |
Purcell J E, Breitburg D L, Beth D M, et al. Pelagic cnidarians and ctenophores in low dissolved oxygen environments: A review[J]. Coastal and Estuaries Studies, 2001, 77-100. |
| [78] |
Field C B, Behrenfeld M J, Randerson J T, et al. Primary production of the biosphere: integrating terrestrial and oceanic components[J]. Science, 1998, 281: 237. DOI:10.1126/science.281.5374.237 |
| [79] |
Keeling P J, Archibald J M, Fast N M, et al. The evolution of modern eukaryotic phytoplankton[J]. Science, 2004, 306: 354-360. |
| [80] |
Walther G R, Post E, Convey P, et al. Ecological responses to recent climate change.[J]. Nature, 2002, 416(6879): 389-395. DOI:10.1038/416389a |
| [81] |
Gopalakrishnan S, Landry C E, Smith M.D.. Climate change adaptation in coastal environments: modeling challenges for resource and environmental economists[J]. Review of Environmental Economics & Policy, 2018, 12(1): 48-68. |
| [82] |
刘乾, 米铁柱, 甄毓, 等. 基于玛氏骨条藻(Skeletonema marinoi)转录组的碳固定代谢途径分析[J]. 科学通报, 2016, 61: 2483-2493. Liu Qian, Mi Tiezhu, Zhen Yu, et al. Description of carbon fixation pathway based on Skeletonema marinoi transcriptome[J]. Chinese Science Bulletin, 2016, 61: 2483-2493. |
| [83] |
Valeria D D, Ida O, Alberto A, et al. Animal-like prostaglandins in marine microalgae[J]. The ISME Journal, 2017, 11: 1722-1726. DOI:10.1038/ismej.2017.27 |
 2018, Vol. 42
2018, Vol. 42


