文章信息
- 姜明, 赵国强, 李兆冉, 盛彦清. 2018.
- JIANG Ming, ZHAO Guo-qiang, LI Zhao-ran, SHENG Yan-qing. 2018.
- 烟台夹河口外柱状沉积物还原性无机硫、活性铁的变化特征及其相互关系
- Distribution characteristics and relationship between reduced inorganic sulfur and reactive iron in core sediments outside the mouth of the Jiahe River in Yantai
- 海洋科学, 42(8): 90-97
- Marine Sciences, 42(8): 90-97.
- http://dx.doi.org/10.11759/hykx20180313001
-
文章历史
- 收稿日期:2018-03-13
- 修回日期:2018-07-12
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
无机硫和活性铁是海洋生态系统中重要的生源要素, 直接影响着生物的新陈代谢[1]。近海海洋沉积物不仅是各种污染物的汇, 同时也是陆源和海洋自生还原性无机硫(RIS)和活性铁埋藏的重要场所, 在复杂的海洋环境条件下, 硫与铁的地球化学过程会直接或间接影响环境质量[2]。沉积物中的RIS通常包括酸性可挥发硫(AVS)、黄铁矿硫(CRS)和元素硫(ES), 活性铁是指能被1 mol/L HCl提取的铁, 主要包括无定形或弱晶型Fe(Ⅲ)氧化物和Fe (Ⅱ)(黄铁矿除外), 以及Fe3S4(含量很少, 可忽略不计)[3]。
烟台夹河口外海域是当地重要的海水养殖区, 同时也承受着一定的陆源污染物输入[4], 研究该区域沉积物中RIS和活性铁的分布特征及其耦合机制, 对揭示近海沉积物在污染胁迫条件下环境质量演变过程具有重要意义。目前国内学者对于沉积物中RIS和活性铁的地球化学过程的研究多集中在表层沉积物(0~15 cm)中[5-6], 对于深度加大的沉积物柱(> 2 m), 沉积环境的历史演变对Fe、S的沉积和成岩作用影响认识尚不清楚。因此, 开展近海深层沉积物中硫与铁环境地球化学过程研究, 对于认识沉积物中生源要素循环过程与机制至关重要。
由Heieh等[7]提出的冷扩散法是沉积物中RIS提取最为广泛的方法之一, 其后Newton等[8]和Sheng等[9]对其进行了改进和优化, 可在短时间内实现AVS、CRS以及ES的连续提取。活性铁的提取相对简单, 即采用盐酸萃取法提取[10]。在还原环境下, 硫酸盐还原产生的H2S一部分在厌氧环境中能够与沉积物中的活性铁形成亚稳态铁硫化物, 并进一步转化为更为稳定的黄铁矿, 从而限制了沉积物中铁的活性[2, 11]。本研究的主要目的为(1)通过调查烟台北部海域柱状沉积物的硫和铁赋存形态识别其地球化学特征; (2)探讨RIS和活性铁的纵向分布规律和环境行为, 揭示近海深层柱状沉积物中RIS和活性铁在污染胁迫下的耦合机制。
1 材料与方法 1.1 样品采集采样点(37°46.93′N, 121°19.39′E)位于黄海北部(NYS)区域, 渤海和黄海分界线约以东53 km, 距离夹河河口约21 km。采样区(图 1)位于与渤海相连的半封闭海域, 是典型的陆架边缘海, 平均水深约38 m[11, 12]。2017年2月23日, 在采样点用聚碳酸酯管采集柱状沉积物(直径10 cm, 长度370 cm), 并对柱状沉积物在0~20 cm、20~150 cm、150~250 cm、250~370 cm区间, 在氮气的保护条件下分别以2、5、10和20 cm间隔进行分层。将分层的沉积物储存在充满N2的密封塑料袋, 于-20℃的条件下冷冻保存, 并尽快进行分析。在分析之前, 所有沉积物在N2密封室中用玻璃棒搅拌均匀。
 |
| 图 1 夹河口外柱状沉积物采样位置 Fig. 1 Sampling location of core sediment in the outside region of the mouth of the Jiahe River |
将经冷冻干燥研磨过100目筛的沉积物用10 mL 1 mol/L盐酸处理, 在室温下振荡16 h, 然后离心(4 000 r/min, 15 min)。弃去上清液, 残留沉淀物用去离子水洗涤两次以除去碳酸盐, 经冷冻干燥后测定沉积物中的TOC, TOC测定采用TOC-VCPH (Shimadzu, 日本)分析仪测定[12], 重复3次测量, 相对标准偏差小于1.5%。
取未经过研磨的沉积物样品, 用次氯酸钠去除每个样品中的中的有机质, 采用Marlvern Mastersizer 2000F(Marlvern, 英国)粒度分析仪, 测定沉积物粒径, 其中粒径小于4 μm为黏土, 4~63 μm为粉砂, 大于63 μm为砂[12]。
1.2.2 沉积物Fe(Ⅱ)和Fe(Ⅲ)的提取在氮气的保护下称取约1 g的湿沉积物, 加入50 mL 1 mol/L HCl, 在室温下振荡24 h, 然后离心(3 000 r/min, 15 min)。吸取上清液, 用邻菲啰啉分光光度法[13]分别测定Fe(Ⅱ)和总活性铁Fe(T)。简言之, Fe(Ⅱ)的测定直接加入缓冲溶液与邻菲啰啉溶液; 对于Fe (T), 在50 mL含铁溶液置于150 mL锥形瓶中, 加入1 mL盐酸(1︰3)和1 mL质量分数为10%盐酸羟胺, 煮沸至15 mL, 以保证全部铁的溶解和还原, 测定提取液中总活性铁Fe(T)的含量。Fe(Ⅲ)的含量为总铁和Fe(Ⅱ)含量差值[10]。实验室内样品重复测定误差小于5%。
1.2.3 沉积物无机硫化物的提取沉积物中AVS、CRS、ES的提取采用改进的RIS分级提取方法[9], 在氮气的保护条件下取10 g湿积物于反应瓶中, 吸收装置中分批加入5 mL 0.05 mol/L的CuCl2溶液, 加入适量无氧去离子水稀释, 接通氮气, 使液面没过出气口, 以400 mL/min流速连续充N2 5~10 min。同时, 通过加热板设定为60℃反应进行(防止ES被还原)。1)调节气流速度(1~2 s, 1个气泡), 反应装置注入15 mL 9 mol/L HCl溶液反应1 h后, 调大流速, 驱除装置内空气, 提取吸收液中的AVS; 2)反应装置再注入15 mL 2 mol/L Cr (Ⅱ)反应2 h后, 调大流速, 驱除装置内空气, 提取吸收液中的CRS; 3)反应装置再注入20 mL DMF(N, N-二甲基甲酰胺), 5 mL Cr (Ⅱ), 5 mL 9 mol/L HCl溶液反应1 h后, 调大流速, 赶尽装置残留的H2S, 提取吸收液中的ES。吸收装置中的CuCl2溶液与反应装置产生H2S充分反应后, 吸收液用0.45 µm滤膜过滤(过滤泵), 通过碘量法进行滴定吸收液测定残留的Cu, 依次提取AVS, CRS, ES。实验重复测定误差小于5%。
2 结果与讨论 2.1 沉积物中粒度、TOC和C/S的垂向分布沉积物TOC的纵向分布如图 2所示。TOC含量在0.3%~0.9%, 平均值为0.52%±0.12%, 与东海沉积物中TOC的含量(0.32%~1.05%)相接近[6], 低于世界陆架区的平均值(0.75 %)[14]。NYS表层沉积物中TOC的含量较高, 随着深度的增加TOC含量先下降后增加, 最后趋于稳定。在-20~ -60 cm, TOC含量显著下降(从0.84%下降到0.35%), 在-60~ -140 cm, TOC含量呈增加趋势(从0.35%增加到0.62%), TOC的含量在-140 cm以下趋于稳定(~0.55%)。TOC在沉积物中的积累和消耗受沉积物来源、沉积速率、有机质活性和微生物代谢活性等多种因素的影响[15]。TOC和RIS的比率可确定古沉积岩中古沉积环境, 在这项研究中, 柱状沉积物C/S平均质量比为19.84, 高于正常海洋沉积物(2.8±1.5)[16], 由于来自渤海及山东半岛和辽东半岛入海河流所携的陆源物质对黄海北部输入的影响[17], 表层沉积物中高C/S比与高TOC有关[18]。在-20~ -60 cm和-60 cm以下, TOC和RIS降低和增加的趋势大致相似。此外, TOC与RIS呈正相关(r=0.42, P < 0.05), 进一步表明沉积物中的硫酸盐还原受TOC控制。随深度增加, 沉积物早期成岩作用的主驱动力以有机质的降解为主, 以硫酸盐还原为有机质矿化的主要路径[19], 可能造成TOC含量降解; 在较深的范围内, 沉积物基于厌氧环境中, TOC消耗速率较慢以及活性铁含量较高的特点, Fe(Ⅲ)的异化还原作用可能对硫酸盐还原有竞争性抑制作用[15]。
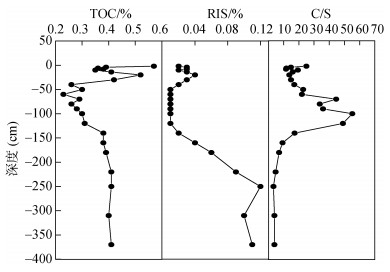 |
| 图 2 沉积物TOC(%), RIS(%)和C/S随深度的垂直分布 Fig. 2 Vertical distribution of TOC (%), RIS (%), and C/S with depth |
采样点沉积物中粉砂(4~63 μm)所占比重最大(平均约占73.6%, 图 3), 其次是砂(> 63 μm, 15.6%)和黏土(< 4 μm, 10.9%), 表明该区域不是细颗粒的主要沉积区。在-55~ -130 cm深度范围内, 黏土平均含量增加超过45 %以上。此外, 在0~130 cm深度范围内, 砂含量由21.8%下降到8.8%。在-130cm以下它们分布是相对均匀的。从表层至底层, 各沉积物的粒径随深度的分布与平均粒径分布大致相似, 主要集中在粉砂和砂粒度区间, 由于该区域的细颗粒级泥质沉积物来源主要由黄河物质和鸭绿江物质形成的[20], 沉积过程往往受到很多人为因素(如养殖、航运、海洋工程活动等)的影响, 在山东沿岸流与黄海暖流和潮流的作用下[21], 减少了该区域悬浮颗粒物等细颗粒的沉降。
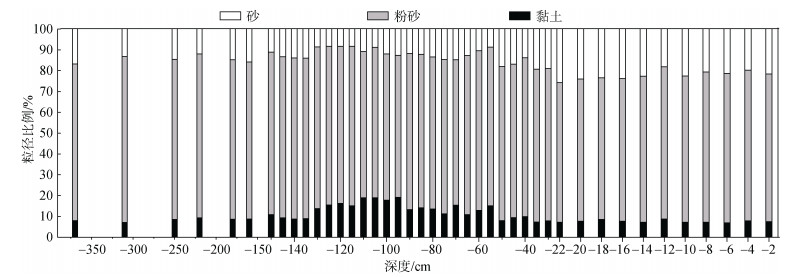 |
| 图 3 沉积物的粒径分布 Fig. 3 Grain size distributions of each depth sediment |
图 4显示了在柱状沉积物中Fe(Ⅱ), Fe(Ⅲ)和总活性铁(Fe(T))的垂直分布。总体而言, Fe(Ⅱ)含量介于9.14~ 59.95 μmol/g之间(均值为41.91μmol/g±15.82 μmol/g), Fe(Ⅲ)含量相对较低, 介于0.43~23.41 μmol/g, 均值仅为10.61 μmol/g ± 7.33 μmol/g, Fe(T)为22.75- 69.91μmol/g(均值52.52 μmol/g±12.58 μmol/g)。其中, Fe(Ⅱ)和Fe(T)的纵向分布呈现相似的变化趋势, 二者含量均在深度为0~90 cm的区间呈下降趋势, 但在-90~ -160 cm却迅速上升, 并最终稳定在56~ 58 μmol/g之间。Fe(Ⅲ)的含量在0.44~14.90 μmol/g, 其随深度的变化趋势正好与Fe(Ⅱ)相反, 这也充分表明, Fe(Ⅱ)来源于铁氧化物的还原。
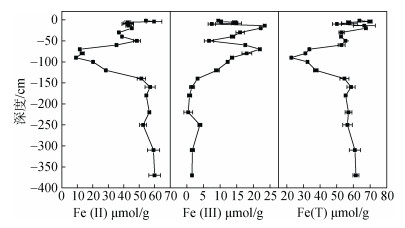 |
| 图 4 沉积物中Fe (Ⅱ), Fe (Ⅲ)和Fe(T)的分布 Fig. 4 Distributions of reactive Fe (Ⅱ), Fe (Ⅲ), and Fe (T) in the sediment profile |
通常, 沉积物中Fe(Ⅲ)的减少主要通过两个途径:一种是被沉积物中的微生物还原(公式1), 另一种是被沉积物中的硫化物等化学还原[2](公式2)。不论是在海洋沉积体系还是淡水沉积体系, Fe(Ⅲ)的微生物还原和化学还原往往同时存在, 其主导地位取决于所处的环境条件, 如有机质的供应等[22]。在本研究中, 相关分析结果表明(表 1), 沉积物中TOC与Fe(T) (r = 0.675, P < 0.01)和Fe(Ⅱ)(r = 0.620, P < 0.01)均呈显著正相关, 表明在沉积物中有机质含量越丰富的地方, 较高的活性铁(Fe(Ⅲ)氧化物)含量会抑制硫酸盐的还原, 导致H2S生成的减少[19]。生成H2S一部分可以生成不稳定的AVS, 另一部分转化为中间态硫化物, 并参与AVS转化为CRS。Fe(Ⅲ)的化学还原减弱, 降低了中间态硫化物的生成量, 阻碍了AVS转化为CRS[23], 有利于研究区域的表层及浅层沉积物Fe(Ⅱ)的累积。此外, Fe(Ⅱ)和Fe(Ⅲ)呈显著负相关(r = -0.629, P < 0.01, 表 1), 这是两种形态的铁所处的氧化还原环境不同所致, 表层为氧化环境, 沉积物深层为还原环境。Fe(Ⅱ)占沉积物总活性铁的主导地位(~80%), 表明该区域沉积物中Fe(Ⅲ)被还原为Fe(Ⅱ)的过程随深度呈增加而加剧。这可能是因为, 随着深度增加, 沉积物的中有机质逐渐被消耗殆尽, 同时矿化程度逐渐加深, 微生物还原过程被逐步抑制, Fe(Ⅲ)的还原主要表现为化学还原。
| Fe2+ | Fe3+ | AVS | CRS | ES | TOC | RIS | |
| Fe2+ | 1 | ||||||
| Fe3+ | -0.629** | 1 | |||||
| AVS | 0.282** | -0.011 | 1 | ||||
| CRS | 0.626** | -0.595** | 0.112 | 1 | |||
| ES | 0.655** | -0.580** | 0.076 | 0.916** | 1 | ||
| TOC | 0.620** | -0.181 | 0.390 | 0.421* | 0.464* | 1 | |
| RIS | 0.618** | -0.584** | 0.120 | 0.928** | 0.996** | 0.420* | 1 |
| 注: *显著性水平为0.05, **显著性水平为0.01 | |||||||
| $ \mathrm{CH}_{2} \mathrm{O}+4 \mathrm{FeOOH}+8 \mathrm{H}^{+}=\mathrm{CO}_{2}+4 \mathrm{Fe}^{2+}+7 \mathrm{H}_{2} \mathrm{O} $ | (1) |
| $ 2 \mathrm{FeOOH}+3 \mathrm{H}_{2} \mathrm{S}+4 \mathrm{H}^{+}=2 \mathrm{FeS}+\mathrm{S}^{0}+4 \mathrm{H}_{2} \mathrm{O} $ | (2) |
沉积物中的AVS是表征沉积物中重金属及硫化物等典型污染物环境毒性的重要指标, AVS的累积会直接影响底栖生物的生存环境[2]。在本研究区域, AVS的纵向分布处于12.14~40.26 μg/g (图 5a), 平均值为26.49 μg/g±7.75 μg/g, AVS含量占RIS总量的平均值为24%±16%, 其在沉积物浅表层(-2~ -20 cm)和底部(-310~ -370 cm)的含量相对较高。AVS的形成和积累受有机质含量、活性铁含量以及氧化还原环境的共同影响[15]。由于上覆水中富含有机质颗粒物的沉积, 使得浅表层沉积物的有机质含量较高, 为微生物硫酸盐还原作用提供了充足的碳源, 从而形成AVS的累积(公式3, 4)。随着沉积物深度增加, 孔隙水的离子扩散及运移能力也大大地减弱, 有限有机质被逐步消耗, 硫酸盐还原菌活性被逐步抑制, AVS逐步减少。随着深度的继续增加, 在较深区域(-250 cm以下), 沉积物基本处于稳定的厌氧环境, 此时铁氧化物等Fe(Ⅲ)被还原为Fe(Ⅱ), 新生成的Fe(Ⅱ)会迅速与部分AVS结合(公式4), 导致“公式2”的平衡向右移动, 从而出现了AVS的轻微增加。尽管累积的AVS存在潜在的矿化过程(即硫酸盐还原和AVS作用), 但AVS向CRS的转化是一个较为缓慢的过程, 使AVS的生成速率大于转化速率[23]。因此, 底部AVS的浓度得以积累。
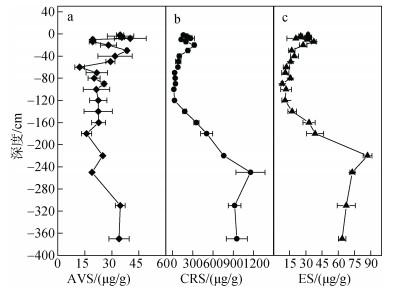 |
| 图 5 RIS的垂直分布 Fig. 5 Vertical distribution of RIS with depth |
| $ \mathrm{SO}_{4}^{2-}+2 \mathrm{CH}_{2} \mathrm{O}+2 \mathrm{H}^{+} \rightarrow \mathrm{H}_{2} \mathrm{S}+2 \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O} $ | (3) |
| $ \mathrm{Fe}^{2+}+\mathrm{H}_{2} \mathrm{S} \rightarrow \mathrm{FeS}+2 \mathrm{H}^{+} $ | (4) |
沉积物中CRS的主要组成为黄铁矿, 因此其在一定程度上代表活性铁氧化物的硫化程度[24-25]。在本研究中, 沉积物中RIS的组成以CRS为主(平均占RIS总量的65%±19%), CRS的含量范围介于21.27~ 1155.6 μg/g之间(图 5b), 平均值为305.07 μg/g± 328.74 μg/g。随着深度的增加CRS的含量先减少再增加最后趋于稳定, 在深度为-2~ -30 cm及-160~ -360 cm区间含量较高, 在-100 cm处出现最小值(21.27 μg/g), 在-250 cm出现最大值(1155.6 μg/g)。CRS/AVS比值在-2~ -60 cm的范围为2.95~11.4, 在-70~ -120 cm处的范围为0.99~2.03, 在-140~ -360 cm范围为8.05~60.78(图 5)。通常, CRS的形成同时受到受沉积物中有机质的含量、硫酸盐还原菌丰度、可溶性硫酸盐的浓度以及活性铁的含量等多种因素的影响[25], 当CRS/AVS > 3时[26], AVS能够有效地转化为黄铁矿, 该指标可进一步判断沉积物中硫化物的活性和生物有效性, 比值越低表明硫化物的活性和对生物有效性越高。在本研究中, 柱状沉积物中上层的(-2~ -60 cm)AVS的含量相对较高, 由于表层有机质促进硫酸盐还原形成大量的H2S, 与沉积物中活性Fe(Ⅱ)结合形成CRS(公式5), 但AVS转化为CRS过程缓慢, 故表层CRS的含量相对较低; 随着深度增加至中间层(-70~ -120 cm), CRS/AVS比值降低(图 6), 这可能主要是由于有机质含量降低, 硫酸盐还原产生的H2S的生成率低于消耗率, 降低了AVS的转化率, CRS的含量相对较低, 同时也表明该区段的沉积物硫化物活性和生物可利用性较高; 在该柱状沉积物底部(-140~360 cm), CRS/AVS的比值逐渐升高, 同时TOC的含量在该区段内也逐渐增加(图 2), 这表明在微生物作用下, 硫酸盐还原菌的活动性可能增强, 其分解产生溶解性H2S与FeS结合, 有利于CRS的生成[27](公式3, 5);此外, CRS还可以通过多硫化物形式[25]与AVS反应造成CRS在柱状沉积物底部的积累(公式6), 但是该区段内的硫化物活性和生物可利用性较低。
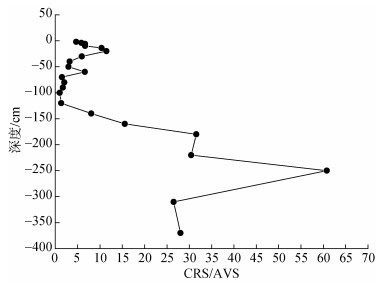 |
| 图 6 CRS和AVS的比值 Fig. 6 CRS to AVS ratio with depth |
| $ \mathrm{FeS}+\mathrm{H}_{2} \mathrm{S} \rightarrow \mathrm{FeS}_{2}+\mathrm{H}_{2} $ | (5) |
| $ {\rm{FeS}} + {{\rm{S}}^{2 - n}} \to {\rm{Fe}}{{\rm{S}}_2} + {{\rm{S}}^{2 - }}_{n - 1} $ | (6) |
沉积物中的ES在部分盐沼湿地广泛存在, 在海洋沉积物中也有着广泛分布[24, 28]。在本研究中, ES含量介于8.17~87.06 μg/g之间(图 5c), 平均值为30.84 μg/g±21.93 μg/g, ES占RIS总量的平均值为11%±4%。NYS沉积物中ES的含量呈现浅表层(-2 ~ -30 cm)和深层(-160~ -360 cm)浓度高(深层含量大于表层), 中间层(-40~ -140 cm)浓度低的趋势。这是由于沉积物表层还原性溶解性无机硫离子和部分氧化性物质的含量较为接近, 有利于H2S不完全氧化产生ES[29](公式6, 7)。随着深度的增加, ES的生成率降低, 在亚氧和缺氧的环境中, 硫酸盐还原相对活跃, 有机质分解产生大量的溶解性的H2S(公式3), 不断消耗活性Fe(Ⅲ)氧化物产生ES(公式2)。此外, ES与HS-等硫化物相互转化(公式9)导致ES和AVS形成产消动态平衡(10), AVS的含量与ES的含量保持一致[28], 导致了深层的ES趋于稳定。
| $ \mathrm{H}_{2} \mathrm{S}+\mathrm{O}_{2} \rightarrow \mathrm{S}^{0}、\mathrm{SO}_{4}^{2-}、\mathrm{S}_{2} \mathrm{O}_{3}^{2-}、\mathrm{SO}_{3}^{2-}+\mathrm{H}_{2} \mathrm{O} $ | (7) |
| $ \mathrm{H}_{2} \mathrm{S}+\mathrm{MnO}_{2} \rightarrow \mathrm{S}^{0}+\mathrm{Mn}^{2+} $ | (8) |
| $ \mathrm{HS}^{-}+\mathrm{S}^{0} \rightarrow \mathrm{S}^{2-}+\mathrm{H}^{+} $ | (9) |
| $ \mathrm{FeS}+\mathrm{S}^{0} \rightarrow \mathrm{FeS}_{2} $ | (10) |
综上诉述, NYS沉积物中RIS的组成以CRS为主(平均为RIS总量的65%±19 %), 其次是AVS和ES(平均分别为RIS总量的24%±16%和11%±4%)。表明RIS主要以稳定的CRS形态(该赋存形态较为稳定)。浅表层AVS和ES含量相对较高, CRS含量相对较低, 较高活性的有机质促进硫酸盐还原产生H2S结合活性Fe(Ⅱ)生成AVS, 造成表层的AVS略微积累, 存在一定的毒性风险。但AVS向CRS转化是一个缓慢过程, 故表层CRS含量没有明显升高, H2S与O2或MnO2不完全氧化生成ES; 随深度增加至底层, AVS变化基本均匀, CRS和ES不断增加至趋于稳定, 在微生物作用下, 硫酸盐还原菌产生溶解性H2S与Fe(Ⅲ)氧化物反应生成不稳定的AVS和ES, AVS和H2S进一步反应生成CRS, 从而造成沉积物底部AVS略微积累, CRS和ES大量积累; 同时ES又可以结合HS-在Fe(Ⅱ)作用下转化为AVS, 形成产消动态平衡, 最后转化为稳定的CRS。
2.4 RIS与活性铁的耦合关系黄铁矿化度(DOP)和硫化度(DOS)是评估沉积物中硫化物和铁耦合关系的重要依据[30]。DOP表征沉积物氧化还原环境(公式11), 分析黄铁矿形成的限制因素。DOS是活性铁转化为硫化物结合态铁的程度(公式12), 可以更好的表征铁的硫化程度[31]。
| $ \mathrm{DOP}=\frac{\mathrm{CRS}(\mathrm{Fe})}{\mathrm{CRS}(\mathrm{Fe})+\mathrm{Fe}(\mathrm{HCl})} $ | (11) |
| $ \mathrm{DOS}=\frac{\mathrm{AVS}(\mathrm{Fe})+\mathrm{CRS}(\mathrm{Fe})}{\mathrm{CRS}(\mathrm{Fe})+\mathrm{Fe}(\mathrm{HCl})} $ | (12) |
式中, CRS(Fe)为黄铁矿铁, Fe(HCl)为总活性铁的含量, AVS(Fe)是以FeS形式存在的硫化物结合态Fe(Ⅱ)的含量。如图 7所示, DOP和DOS呈现相似的变化趋势, 随着深度增加先减小后增加, 并在-300 cm以下趋于稳定。DOP范围为0.01~0.24(平均值0.07± 0.07), DOS范围为0.03~0.25(平均0.09±0.06)。DOP和DOS在-2~ -100 cm区间都处于相对较低的水平, 而在深度-100 cm以下时, 它们显著增加, 说明AVS向CRS转化的程度增加。表层的硫酸盐的还原使AVS累积, 同时该区段内活性铁含量较高, 从而使得DOP和DOS的值较低。较低DOP表明RIS化物的黄铁矿化程度较低, 较低的DOS表明沉积物中铁转化为硫化物的程度较低。总体而言, NYS沉积物中的DOP和DOS值远低于墨西哥湾沉积物(DOP 0.56~ 0.95和DOS 0.63~2.66)[32], 但与黄海胶州湾沉积物(DOP 0.1~0.36和DOS 0.2~1.0) [5]相接近, 本研究较低的DOP和DOS, 或许表明NYS中活性铁的含量不是CRS形成的限制因素。
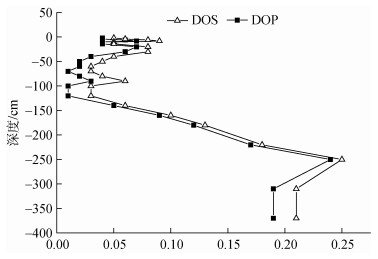 |
| 图 7 沉积物中DOS和DOP Fig. 7 Distribution of DOS and DOP in sediments |
研究区域沉积物粒径分布以粉砂为主(约占73.6%), 该区域沉积物中的RIS由CRS主导, AVS含量随深度变化波动较小, CRS和ES呈表层和底层相对较高, 中间层相对较低的特点。活性Fe(Ⅲ)呈表层相对较高, 底层相对较低, 随深度降低的特点, Fe(Ⅱ)反之。表层区, 以有机质作用于硫酸盐还原产生H2S分别与Fe(Ⅱ)和上覆水中的O2\MnO2等氧化性物质反应生成AVS和ES, AVS向CRS的转化过程较为缓慢, 使表层AVS和ES含量相对较高, CRS含量相对较低; 深层区, 以硫酸盐还原菌产生的H2S将Fe(Ⅲ)还原为Fe(Ⅱ)并产生ES, 生成的Fe(Ⅱ)和H2S反应生成AVS, AVS进一步与H2S反应转化为CRS, 导致了底部AVS略有积累、CRS和ES大量积累; 同时研究表明, 该区域活性铁不是CRS形成的限制因素。
| [1] |
Canfield D E, Raiswell R, Bottrell S H. The reactivity of sedimentary iron minerals toward sulfide[J]. American Journal of Science, 1992, 292(9): 659-683. DOI:10.2475/ajs.292.9.659 |
| [2] |
孙启耀.河口沉积物硫的地球化学特征及其与铁和磷的耦合机制初步研究[D].北京: 中国科学院大学, 2016. Sun Qiyao. Geochemical characteristics of sulfur and its coupling mechanism with iron and phosphorus in estuary sediments[D]. Beijing: University of Chinese Academy of Sciences, 2016. http://www.irgrid.ac.cn/handle/1471x/1066707 |
| [3] |
Mortimer R J G, Davey J T, Krom M D, et al. The effect of macrofauna on porewater profiles and nutrient fluxes in the intertidal zone of the Humber Estuary[J]. Estuarine, Coastal and Shelf Science, 1999, 48(6): 683-699. DOI:10.1006/ecss.1999.0479 |
| [4] |
于靖, 张华. 渤海及北黄海河流悬浮颗粒碳氮同位素时空分布及源解析[J]. 海洋科学, 2017, 41(5): 93-102. Yu Jing, Zhang Hua. Seasonal variations and sources of carbon and nitrogen isotopes in suspended particulate matter in inflow rivers of the Bohai Sea and the North Yellow Sea[J]. Marine Sciences, 2017, 41(5): 93-102. |
| [5] |
Zhu M X, Liu J, Yang G P, et al. Reactive iron and its buffering capacity towards dissolved sulfide in sediments of Jiaozhou Bay, China[J]. Marine environmental research, 2012, 80: 46-55. DOI:10.1016/j.marenvres.2012.06.010 |
| [6] |
Kang X, Liu S, Zhang G. Reduced inorganic sulfur in the sediments of the Yellow Sea and East China Sea[J]. Acta Oceanologica Sinica, 2014, 33(9): 100-108. DOI:10.1007/s13131-014-0499-1 |
| [7] |
Hsieh Y P, Shieh Y N. Analysis of reduced inorganic sulfur by diffusion methods: improved apparatus and evaluation for sulfur isotopic studies[J]. Chemical Geology, 1997, 137(3-4): 255-261. DOI:10.1016/S0009-2541(96)00159-3 |
| [8] |
Newton R J, Bottrell S H, Dean S P, et al. An evaluation of the use of the chromous chloride reduction method for isotopic analyses of pyrite in rocks and sediment[J]. Chemical Geology, 1995, 125(3-4): 317-320. DOI:10.1016/0009-2541(95)00098-7 |
| [9] |
Sheng Y, Sun Q, Shi W, et al. Geochemistry of reduced inorganic sulfur, reactive iron, and organic carbon in fluvial and marine surface sediment in the Laizhou Bay region, China[J]. Environmental Earth Sciences, 2015, 74(2): 1151-1160. DOI:10.1007/s12665-015-4101-8 |
| [10] |
Wallmann K, Hennies K, König I, et al. New procedure for determining reactive Fe(Ⅲ) and Fe(Ⅱ) minerals in sediments[J]. Limnology & Oceanography, 1993, 38(8): 1803-1812. |
| [11] |
Wijsman J W M, Middelburg J J, Herman P M J, et al. Sulfur and iron speciation in surface sediments along the northwestern margin of the Black Sea[J]. Marine Chemistry, 2001, 74(4): 261-278. |
| [12] |
Zhao G, Sheng Y, Wang J, et al. Optimized digestion methods: organic phosphorus sequential extraction, total phosphorus, and nitrogen simultaneous determination in sediments[J]. Journal of Soils and Sediments, 2018, 18(5): 2072-2080. DOI:10.1007/s11368-018-1959-6 |
| [13] |
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 368-370. The State Environmental Protection Administration. Water and wastewater monitoring and analysis method[M]. Fourth Edition. Beijing: China Environmental Science Press, 2002: 368-370. |
| [14] |
Berner R A. Burial of organic carbon and pyrite sulfur in the modern ocean: its geochemical and environmental significance[J]. Am. J. Sci.; (United States), 1982, 282. |
| [15] |
史晓宁.东海陆架沉积物中硫, 铁形态分析及其早期成岩作用[D].青岛: 中国海洋大学, 2012. Shi Xiaoning. Speciation and early diagenesis study of sulfur and iron in sediments of the East China Sea continental shelf[D]. Qingdao: Ocean University of China, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012504092.htm |
| [16] |
Berner R A, Raiswell R. C/S method for distinguishing freshwater from marine sedimentary rocks[J]. Geology, 1984, 12(6): 365. DOI:10.1130/0091-7613(1984)12<365:CMFDFF>2.0.CO;2 |
| [17] |
孙有斌, 高抒, 鹿化煜. 前处理方法对北黄海沉积物粒度的影响[J]. 海洋与湖沼, 2001, 32(6): 665-671. Sun Youbin, Gao Shu, Lu Huayu. Influence of different pretreatment procedures on the particle-size distribution of surficial sediments in the Northern Yellow Sea[J]. Oceanologia Et Limnologia Sinica, 2001, 32(6): 665-671. DOI:10.3321/j.issn:0029-814X.2001.06.013 |
| [18] |
Morse J W, Emeis K C. Controls on C/S ratios in hemipelagic upwelling sediments[J]. American Journal of Science, 1990, 290(10): 1117-1135. DOI:10.2475/ajs.290.10.1117 |
| [19] |
张璐.胶州湾沉积物中硫酸盐还原和铁异化还原的影响因素研究[D].青岛: 中国海洋大学, 2014. Zhang Lu. Study on factors influencing sulfate reduction and microbial iron reduction in Jiaozhou Bay sediments.[D]. qingdao: Ocean University of China, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014368346.htm |
| [20] |
齐君, 李凤业, 宋金明, 等. 北黄海沉积速率及其沉积通量[J]. 海洋地质与第四纪地质, 2004, 24(2): 9-14. Qi Jun, Li Fengye, Song jinming, et al. Sedimentation rate and flux of the Northern Sea[J]. Marine Geology & Quaternary Geology, 2004, 24(2): 9-14. |
| [21] |
王伟, 李安春, 徐方建, 等.北黄海表层沉积物粒度分布特征及其沉积环境分析[J].海洋与湖沼, 2009, 40(5): 525-531. Wang wei, Li Anchun, Xu Fangjian, et al. Distibution of surface sediments and sedimentary envrionment in the north Yellow Sea[J]. 2009, 40(5): 525-531. |
| [22] |
Lovley D R, Phillips E J P. Organic matter mineralization with reduction of ferric iron in anaerobic sediments[J]. Applied and environmental microbiology, 1986, 51(4): 683-689. |
| [23] |
Rickard D, Morse J W. Acid volatile sulfide (AVS)[J]. Marine Chemistry, 2005, 97(3): 141-197. |
| [24] |
古丽.渤, 黄, 东海沉积物中硫化物的研究[D].青岛: 中国海洋大学, 2011. Gu Li. The study of sulfide in the sediment of the Bohai, Yellow and East China Seas[D]. Qingdao: Ocean University of China, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011230515.htm |
| [25] |
曹爱丽.长江口滨海沉积物中无机硫的形态特征及其环境意义[D].上海: 复旦大学, 2010. Cao Aili. The character of reduced inorganic sulfur species in the Yangtze River Eetuary and its environmental significance[D].Shanghai: Fudan University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10246-2010195253.htm |
| [26] |
Gagnon C, Mucci A, Pelletier É. Anomalous accumulation of acid-volatile sulphides (AVS) in a coastal marine sediment, Saguenay Fjord, Canada[J]. Geochimica et Cosmochimica Acta, 1995, 59(13): 2663-2675. DOI:10.1016/0016-7037(95)00163-T |
| [27] |
Berner R A. Sedimentary pyrite formation: an update[J]. Geochimica et cosmochimica Acta, 1984, 48(4): 605-615. DOI:10.1016/0016-7037(84)90089-9 |
| [28] |
周桂平.崇明东滩沉积物中还原无机硫(RIS)的形态特征及其转化机制研究[D].上海: 复旦大学, 2011. Zhou GuiPing. Forms of reduced inorganic sulfur (RIS) and transformation meehanism in sediments of the Dongtan, Chongmin[D]. Shanghai: Fudan University, 2011. http://cdmd.cnki.com.cn/article/cdmd-10246-1011198037.htm |
| [29] |
Cornwell J C, Morse J W. The characterization of iron sulfide minerals in anoxic marine sediments[J]. Marine Chemistry, 1987, 22(2-4): 193-206. DOI:10.1016/0304-4203(87)90008-9 |
| [30] |
Berner R A. Sedimentary pyrite formation[J]. American journal of science, 1970, 268(1): 1-23. |
| [31] |
Boesen C, Postma D. Pyrite formation in anoxic environments of the Baltic[J]. American Journal of Science, 1988, 288(6): 575-603. DOI:10.2475/ajs.288.6.575 |
| [32] |
Morse J W, Thomson H, Finneran D W. Factors controlling sulfide geochemistry in sub-tropical estuarine and bay sediments[J]. Aquatic Geochemistry, 2007, 13(2): 143-156. DOI:10.1007/s10498-007-9012-1 |
 2018, Vol. 42
2018, Vol. 42


