
文章信息
- 艾加林, 栗志民, 刘建勇, 申玉春. 2018.
- AI Jia-lin, LI Zhi-min, LIU Jian-yong, SHEN Yu-chun. 2018.
- 九孔鲍BMP-2基因cDNA克隆及表达分析
- Molecular cloning and expression analysis of BMP-2 cDNA in Haliotis diversicolor supertexta
- 海洋科学, 42(8): 107-115
- Marine Sciences, 42(8): 107-115.
- http://dx.doi.org/10.11759/hykx20180310001
-
文章历史
- 收稿日期:2018-01-21
- 修回日期:2018-03-06
2. 湛江市海洋生态与养殖环境重点实验室, 广东 湛江 524088
2. Marine Ecology and Aquaculture Environment of Zhanjiang, Zhanjiang 524088, China
转化生长因子超家族(transforming growth factor type beta, TGF-β)是一组具有结构相关性的多功能分泌型细胞因子, 参与细胞增殖、分化和生长等多种生物学过程[1]。骨形态发生蛋白(Bone morphogenetic proteins, BMP)是转化生长因子超家族(TGF-β)中最大的分泌型信号传导分子家族, 最早在啮齿类动物中因诱导异位骨形成被发现[2]。该家族成员具有C末端7个保守的半胱氨酸残基等TGF-β超家族典型结构, 又具有自身的特点: N端含有较多的碱性氨基酸, 产生较多正电荷, 易在基质上吸附, 可能与其具有诱骨活性有关[3]。研究表明BMP是一个多功能细胞因子, 参与TGF-β/BMP信号通路的信号传递[4]、骨骼修复[5]、骨骼发育、器官形成和生殖等许多生物学过程[6, 7]。BMP-2基因是BMP家族的重要成员, 通过与细胞膜表面丝氨酸/苏氨酸Ⅱ型和Ⅰ型激酶受体特异性结合形成复合体, 进而将信号传到细胞核内调控一系列基因转录[8], 参与骨骼发育等生理调控过程[9, 10], 是唯一能单独诱导成骨的因子[11]。此外, 在胚胎发育过程中, BMP-2基因可通过诱导生肌基因表达来促进胚胎肌肉的生长, 也可通过诱导细胞凋亡抑制肌肉生长[12]。
贝壳是外套膜分泌物生物矿化的产物, 是软体动物的外骨骼, 为大多数软体动物的内部器官提供保护和支撑。因此, 贝壳发生、钙化机制等成为人们研究的热点之一[13]。贝壳形成的分子机制在合浦珠母贝(Pinctada fucata)中研究的较为深入, 已发现BMP-2基因[14]、酪氨酸酶基因[15]、间液蛋白SPARC (Secreted Protein Acidic and Rich in Cyteine)[16]、贝壳蛋白家族RLCD(related low complexity domain)[17]和BMP-3、BMP-10[18]等参与贝壳形成、修复过程。此外, BMP2/4的源基因engrailed、dpp也参与贝壳的形成调控过程, 欧洲帽贝(Patella vulgata) [19]和静水椎实螺(Lymnaea stagnalis) [20]engrailed、dpp-BMP2/4基因在胚胎的壳腺周围表达, 可能参与了贝壳区域边界的确定; 棘牡蛎(Saccostrea kegaki) [21]dpp基因参与了贝壳发生的调控。
九孔鲍(Haliotisdiversicolorsupertexta)属于软体动物门(Mollusca), 腹足纲(Gastropoda), 前鳃亚纲(Prosobranchia), 原始腹足目(Archaeogastropoda), 鲍科(Haliotidae), 主要分布于日本、韩国及中国台湾等南方各省[22], 有较高的营养和经济价值, 是中国南方重要的养殖贝类。此外, 九孔鲍的贝壳有一定的药用价值, 是中药石决明的来源之一[23], 具有较高的药用价值。鉴于BMP-2基因在贝壳形成过程中的重要作用。本文运用RACE技术克隆出了九孔鲍BMP-2基因cDNA全长, 并通过qRT-PCR技术检测了该基因在不同组织和不同发育时期的表达, 初步探究了BMP-2基因在九孔鲍中的功能, 以期为BMP家族基因功能研究及贝壳形成机理提供参考。
1 材料与方法 1.1 实验材料九孔鲍采自广东省湛江市磠洲岛养殖群体, 体质量(11.42±1.24)g, 壳长(50.7±2.52)mm, 壳宽(31.46± 1.6)mm。选取活力强、健康的5个成鲍分别解剖右侧壳肌、鳃、外套膜、肝胰脏、足、性腺; 亲鲍催产受精后分别收集卵、受精卵、4细胞、8细胞、原肠胚(n > 500)、稚鲍(n > 5)、幼鲍(n > 5);分别保存于RNAhold (全式金, 北京)中, 4℃保存过夜后转移到-20℃短期保存。
1.2 RNA提取和cDNA合成按照TransZol Up Plus RNA Kit(全式金, 北京)试剂盒说明书提取外套膜总RNA, 1%琼脂糖凝胶电泳检测RNA完整性, 并用核酸微量定量仪(Nanodrop 2000 Thermo Scientific, 美国)检测RNA浓度, 保证A260/280为1.8~2.0, RNA具有完整的28S、18S和5S r RNA条带[24]。根据TransScript one-step gDNA Removal and cDNA Synthesis supermix (全式金, 北京)反转录试剂盒说明书, 利用检测合格的总RNA (1μg)和Oligo (dT)引物合成cDNA 20μL, 同时按SMARTerTM RACE 5′、3′Kit user manual(TaKaRa, 大连)合成5′、3′RACE cDNA模板, -20℃短期保存。
1.3 BMP-2基因cDNA全长克隆根据GeneBank中耳鲍(Haliotis asininaDQ298396.1)等贝类的BMP-2基因保守序列设计引物BMP-F, BMP-R(10uM)(表 1), PCR反应程序: 94℃预变性4 min; 94℃ 30 s, 50℃ 30 s, 72℃ 1 min, 40个循环, 72℃ 10 min, PCR产物经1%琼脂糖凝胶电泳、切胶回收, 与pEASY-T1载体连接、转化培养后, 挑选阳性克隆送上海生工生物工程股份有限公司测序, 获得1157 bp BMP-2基因序列。
根据已获得片段设计巢式PCR引物BMP-3F1, BMP-5F1, 与SMARTerTM RACE提供引物UPM Mix、UPM (表 1)分别扩增3′、5′端; 第一轮利用SMARTerTM RACE 5′3′Kit user manual(TaKaRa, 大连)中SeqAmp DNA Polymerase分别进行扩增, PCR反应程序: 94 ℃ 30 s, 72℃ 3 min, 5个循环; 94℃ 30 s, 70℃ 30 s, 72℃ 3 min, 5个循环; 94℃ 30 s, 68℃ 30 s, 72℃ 3 min, 25个循环; 将第一轮PCR产物稀释50倍作为第二轮反应模板, 然后第二轮PCR产物稀释3′端稀释100倍, 5′端稀释50倍分别作为第三轮PCR反应模板, 利用巢式引物(表 1)、TaKaRa LA Taq酶(TaKaRa, 大连)分别进行扩增, 反应程序: 94℃ 30 s, 72℃ 3 min, 5个循环; 94℃ 30 s, 70℃ 30s, 72℃ 3 min, 5个循环; 94℃ 30 s, 68℃ 30 s, 72℃ 3 min, 30个循环; PCR产物经1%琼脂糖凝胶电泳、切胶回收后, 与pEASY-T1(全式金, 北京)载体连接、转化培养后, 挑选阳性克隆送上海生工生物工程股份有限公司测序。
1.4 生物信息学分析测序所得序列通过DNAMAN6.0软件和NCBI blast进行比对、去除接头以及重复序列, 然后拼接获得全长, 利用NCBI ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找基因开放阅读框(ORF), SignalP预测信号肽(http://www.cbs.dtu.dk/services/SignalP/), ExPASy计算相对分子量和等电点pI (http://www.expasy.org/), ProtParam分析蛋白的理化性质(http://web.expasy.org/protparam/), NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)和NetNGlyc1. 0Server (http://www.cbs.dtu.dk/services/NetNGlyc/)预测功能位点, CBSPredictionServers ProP分析蛋白酶水解位点(http://www.cbs.dtu.dk/services/ProP/), 蛋白质结构域用SMART (http://smart.embl-heidelberg.de/), 二级结构预测SOPMA: (http://pbil.ibcp.fr/), 三级结构预测Phyre2 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。氨基酸多序列比对采用DNAMAN6.0软件。
从GenBank中下载虾夷扇贝(Mizuhopecten yessoensis OWF43831.1)、栉孔扇贝(Chlamys farreri AGF68558.1)、耳鲍(Haliotis asinina ABC00191.1)、九孔鲍(Haliotisdiversicolor supertexta)、斑马鱼(Danio rerio BMP4 AAC60285.1)、斑马鱼(Danio rerio BMP2a AAC60287.1)、斑马鱼(Danio rerio BMP2b AAAC60286.1)、人(Homo sapiens NP001191.1)小鼠(Mus musculus NP031579.2)的氨基酸序列来构建系统进化树。利用MEGA6.0软件先进行clustaw序列比对, 用邻位法(Neighbor-Joining)自展(bootstraps) 1000次构建系统进化树。
| 引物 | 引物序列(5′-3′) | 退火温度/℃ | 用途 |
| BMPF | TTAGCCTCACGTTGATTG | 50 | 同源克隆(1157bp) |
| BMPR | CCATTCGTCCAGATACA | ||
| BMP-3F1 | GGTTAAATCATGGGCTTGAGGTTAG | ||
| UPMMix | Long-CTAATACGACTCACTATAGGGCA | 70 | 3′RACE |
| AGCAGTGGTATCAACGCAGAGTGAGGAG | |||
| GCGGAGGAAGCACAAGAATGAGGAGGCGG | |||
| BMP-3F2 | AGGAAGCACAAGAAT | 63 | 3′RACE |
| UPM | short-CTAATACGACTCACTATAGGGC | ||
| BMP-3F3 | AATGATGTTGGCTGGAATGACTGGA | 58.2 | 3′RACE |
| BMP-5F1 | CCCGGTGCCTCTGGGATGTCTTTGC | 70 | 5′RACE |
| BMP-5F2 | CTAAGCTCGGACCAATCAACGTGAGG | 61.7 | 5′RACE |
| BMP-5F3 | CCTCACGTTGATTGGTCCGAGCTTAG | 62 | |
| β-actin-F | TGCCCATCTACGAAGGTTACGCC | 60 | 荧光定量内参(200bp) |
| β-actin-R | GCTGCTGTGGACATCTCCTGCTC | ||
| BMP-RF | GGGTTTAAAGAGTCGCCCCA | 60 | 荧光定量(151bp) |
| BMP-RR | TCCGCACAGTGTTAGCAGAG |
采用ABI7500荧光定量PCR, 以β-actin为内参基因, 利用BMP-2基因cDNA序列设计荧光定量引物BMP-RF、BMP-RR(表 1), 分析成鲍的足、右侧壳肌、外套膜、性腺、鳃、肝脏等6个组织, 以及鲍卵、受精卵、4细胞、8细胞、原肠胚、稚鲍、幼鲍等7个不同发育期的BMP-2基因的表达水平, 每份组织样品5个重复, 反应体系为: PowerUp SYBR Green Master Mix(2x) (TaKaRa, 大连)5.0μL, 引物各1.5μL (1μmol/L), cDNA模板2.0 μL (1ng/μL), 反应程序: 50℃ 2 min; 95 ℃ 2 min, 95 ℃ 15 s, 60℃ 1 min, 40个循环; 95 ℃ 15 s, 60℃ 15 s。
分别以各组织和不同发育时期中基因表达量最低的为基准, 采用2-ΔΔCт法计算基因相对表达量, 数据采用平均值±标准差(means±SD), 通过SPSS19.0单因素方差分析(one way ANOVA), 进行统计学检验, 差异显著性为P < 0.05。
2 结果 2.1 BMP-2基因克隆及序列分析九孔鲍BMP-2基因(HS-BMP-2) cDNA全长2572bp, 其中开放阅读框(ORF)为1299 bp, 编码432个氨基酸, 预测其分子质量为48.59ku, 理论等电点(pI)为9.84。5′非编码区(5′UTR)123bp, 3′非编码区(3′UTR)1150bp, 含有3个加尾信号序列AATAAA(第1442、2526 bp)和ATTAAA(2241 bp)及PolyA(28 bp)尾(图 1)。
 |
| 图 1 九孔鲍BMP-2基因cDNA全长及氨基酸序列 Fig. 1 The nucleotide and deduced amino acid sequences of BMP-2 cDNA from H. diversicolor supertexta. 灰色标注起始密码子和终止密码子, 方框标注信号肽, 单下划线标注TGF-β前肽区, 双下划线标注TGF-β成熟区域, 深灰色标注蛋白酶水解位点(RXXR), 灰色方框标注9个保守的半胱氨酸残基, 波浪线标注加尾信号 Start codon and stop codon are shown in gray; the predicted signal peptide and the TGF-β propeptide domain are shown in boxes and single underline, respectively, TGF-β superfamily domain and proteolytic processing site (RXXR) are show in double underline and dark gray, respectively, seven conserved cysteine residues and putative eukaryotic polyadenylation signal are show in the boxed with gray and wavy line, respectively |
NetPhos3.1和NetNGlyc 1.0功能位点预测结果显示: HS-BMP-2氨基酸序列中有27个丝氨酸磷酸化位点、12个苏氨酸磷酸化位点、3个酪氨酸磷酸化位点和6个N-糖基化位点。SOPMA分析表明:九孔鲍BMP-2蛋白二级结构中α-螺旋占32.18%、β转角占6.48%、无规则卷曲42.36%、延伸链占18.98%。
ProP蛋白酶水解位点分析显示: HS-BMP-2氨基酸序列中具有2个蛋白酶水解位点(RXXR), 为RLRR (272-275 aa)和RTRR (304-307 aa)(图 1), 位点之后有7个保守的半胱氨酸残基, 进一步分析发现RLRR(272-275 aa)为TGF-β超家族物种间保守的蛋白酶水解位点(图 2)。
 |
| 图 2 BMP-2氨基酸序列比对 Fig. 2 Multiple sequence alignment of BMP-2 amino acid sequences from different species 方框标注标注蛋白酶水解位点(RXXR), 单下划线标注TGF-β前肽区域, 双下划线标注成熟区域 Proteolytic processing sites (RXXR) are shown in boxes; the predicted TGF-β propeptide domain and the TGF-β superfamily domain are shown in single underline and double underline, respectively |
Phyre2分析显示:九孔鲍BMP-2基因三级蛋白结构与耳鲍的三级蛋白结构相似(图 3A)。
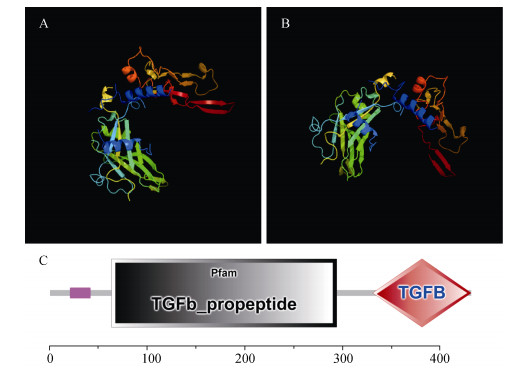 |
| 图 3 九孔鲍BMP-2基因三级结构(A)和结构域(C) Fig. 3 The prediction of BMP-2 tertiary structural (A) and structural dimain (C) H. diversicolor |
SignalP和SMART分析结果显示: HS-BMP-2氨基酸序列中N端信号肽序列为1-39 aa, TGF-β前肽区域为63-294 aa、TGF-β成熟肽区域为331-432 aa (图 1、图 3C)。
2.2 BMP-2基因氨基酸序列及系统进化分析运用NCBI在线Blastx比对, 结果表明:九孔鲍BMP-2氨基酸序列与耳鲍的氨基酸相似性最高, 为98%, 与虾夷扇贝(Mizuhopecten yessoensis)、小鼠(Mus musculus)和人类(Homo sapiens)等的相似性为47%~60%。
基于NJ法构建BMP-2氨基酸序列系统进化树结果显示:哺乳动物单独聚类为一簇, 鱼类和无脊椎动物先聚类随后聚在一起形成一簇。在无脊椎动物中, 九孔鲍、耳鲍; 栉孔扇贝、虾夷扇贝各聚为一支(图 4)。
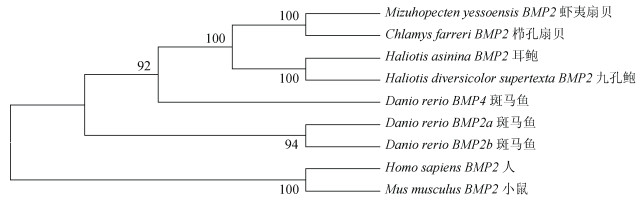 |
| 图 4 基于NJ法构建BMP-2氨基酸序列系统进化树 Fig. 4 Phylogenetic tree of BMP-2 was constructed using the neighbor-joining method |
通过荧光定量PCR分析HS-BMP-2基因在各组织和发育时期的表达水平, 结果显示: BMP-2基因在九孔鲍成鲍的6个组织中均有表达, 其中, 足、右侧壳肌、外套膜及肝脏中高表达, 性腺、鳃中低表达(P < 0.05, 图 5); 在检测的7个发育时期均有表达, BMP-2基因在九孔鲍受精卵时期表达量最高, 其次是4细胞、8细胞、原肠胚、稚鲍时期, 在卵、幼鲍时期表达量最低(P < 0.05, 图 6)。
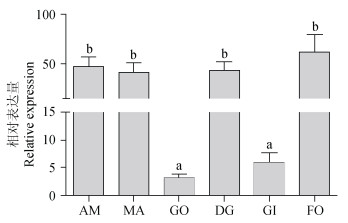 |
| 图 5 九孔鲍BMP-2基因组织表达情况 Fig. 5 The relative expression of BMP-2 in different tissues AM:右侧壳肌MA:外套膜GO:性腺DG:肝脏GI:鳃FO:足。不同字母表示差异显著(P < 0.05) AM: addutor musle MA: mantle GO: gonad DG: diestive gland GI: gill FO: foot. Different letters indicate significant differences (P < 0.05) |
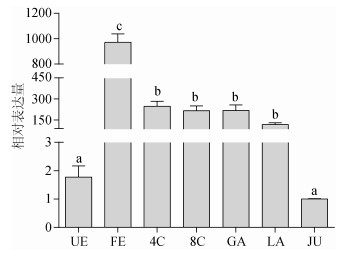 |
|
图 6 九孔鲍BMP-2不同发育时期表达情况 Fig. 6 The relative expression of BMP-2 in different developmental stages UE:卵FE:受精卵4C: 4细胞8C: 8细胞GA:原肠胚LA:稚鲍JU:幼鲍.不同字母表示差异显著(P < 0.05)
Different letters indicate significant differences (P < 0.05). UE: unfertilized egg FE: fertilized egg4C: 4-cell embryos8C: 8-cell embryosGA: gastrulaeLA: larvaeJU: juvenile |
本文利用同源克隆的方法从九孔鲍外套膜中成功获得了BMP-2基因cDNA的全长, 其中开放阅读框(ORF)为1299 bp, 编码432个氨基酸。序列分析结果显示HS-BMP-2氨基酸序列中具有N端信号肽、蛋白酶水解位点RLRR(272~275aa)和C末端7个保守的半胱氨酸残基, 具有TGF-β前肽区域和成熟肽区域两个典型的TGF-β结构域, 符合TGF-β超家族蛋白典型结构特征, 这与在栉孔扇贝[25]、长牡蛎(Crassostrea gigas)[26]等物种中的研究结果一致。多序列比对结果显示物种间BMP-2氨基酸序列具有较高的保守性, 九孔鲍与耳鲍的相似性最高, 为98%, 且物种间C末端的蛋白酶水解位点和7个半胱氨酸残基高度保守, 这暗示着HS-BMP-2基因功能的保守。此外, 除保守的蛋白酶水解位点RLRR(272~275aa)外, HS-BMP-2氨基酸序列中还有一个蛋白酶水解位点RTRR (304~307 aa), 为九孔鲍和耳鲍共有的位点, 该位点可能在九孔鲍中具有某种功能, 具体功能尚需进一步验证。系统进化树结果显示九孔鲍、耳鲍聚为一支, 表明HS-BMP-2基因与耳鲍亲缘关系较近。
本文qRT-PCR结果显示BMP-2基因在九孔鲍6个组织中均表达, 在足、右侧壳肌、外套膜及肝脏中表达量显著高于性腺和鳃(P < 0.05)。研究表明, BMP-2基因在贝类不同组织中的表达模式存在一定差异。譬如: BMP-2/4基因在泥蚶(Tegillarca Granosa)的斧足、闭壳肌、外套膜中高表达, 在内脏团中低表达[27]; BMP-2的同源基因mGDF在长牡蛎的鳃、外套膜、肝脏中高表达, 在性腺、闭壳肌中低表达[26]。HS-BMP-2基因的表达模式与泥蚶、长牡蛎等贝类相似, 即在外套膜中高表达。通过原位杂交发现BMP-2基因在合浦珠母贝外套膜的外侧上皮和外褶内侧上皮高表达[14], 这些部位是合成珍珠层的主要部位。外套膜是参与贝壳形成最重要的器官, 外套膜分泌物通过生物矿化形成贝壳。本文的上述研究结果表明: BMP-2基因可能在九孔鲍贝壳形成中具有重要作用。在不同发育时期, HS-BMP-2基因在检测的7个时期均有表达, 在受精卵、4细胞、8细胞、原肠胚、稚鲍期的表达量显著高于卵、幼鲍期(P < 0.05)。在栉孔扇贝中, BMP-2基因在原肠胚高表达, 受精卵、4细胞时期低表达[25]; 在泥蚶中, BMP-2/4基因在成熟卵、原肠胚、稚贝期均有较高表达[27]; 在长牡蛎中, 从卵到原肠胚没有检测到mGDF基因的表达[26], 贝类中这种复杂的表达模式暗示了BMP-2基因在胚胎发育过程中参与多种生理过程。面盘幼虫、稚贝时期等发育早期是贝壳形成的主要时期, 通过原位杂交发现在静水椎实螺和欧洲帽贝中DPP-BMP2/4在胚胎壳腺周围表达, 可能参与了贝壳区域边界的确定及贝壳形成过程[19, 20]。HS-BMP-2基因在原肠胚、稚鲍等发育早期高表达, 暗示该基因可能在九孔鲍早期贝壳形成发育中具有重要作用。
| [1] |
Kingsley D M. The TGF-B Superfamily: New members, new receptors, and new genetic tests of function in differentorganisms[J]. Genes & Development, 1994(8): 133-146. |
| [2] |
Urist M R. Bone: Formation by Autoinduction[J]. Science, 1965, 150(3698): 893-899. DOI:10.1126/science.150.3698.893 |
| [3] |
郭慧慧.栉孔扇贝TGF-β/Smad信号通路基因的克隆、表达分析及生长性状相关SNP位点筛查[D].青岛: 中国海洋大学, 2012. Guo Hui Hui. TGF-β/Smad signaling pathway genes: molecular clong, expression analysis and SNPs assocated with growth traits in Zhikong scallop (Chlamys Farreri)[D]. Qindao: Ocean University of China, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505824.htm |
| [4] |
Rahman M S, Akhtar N, Jamil H M, et al. TGF-β/BMP signaling and other molecular events: regulation of osteoblastogenesis and bone formation[J]. Bone Research, 2015, 1(3): 11-30. |
| [5] |
Bragdon B, Moseychuk O, Saldanha S, et al. Bone morphogenetic proteins: A critical review[J]. Cellular Signalling, 2011, 23(4): 609-620. DOI:10.1016/j.cellsig.2010.10.003 |
| [6] |
Patricia D, Gerard K. The family of bone morphogenetic proteins[J]. Kidney International, 2000, 57(6): 2207-2214. DOI:10.1046/j.1523-1755.2000.00081.x |
| [7] |
Carragee E J, Hurwitz E L, Weiner B K. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery: Emerging safety concerns and lessons learned[J]. Spine Journal, 2011, 11(6): 471-491. DOI:10.1016/j.spinee.2011.04.023 |
| [8] |
Kawabata M, Imamura T, Miyazono K. Signal transduction by bone morphogenetic proteins[J]. Cytokine & Growth Factor Reviews, 1998, 9(1): 49-61. |
| [9] |
Gill J, Connolly P, Roth M, et al. The effect of bone morphogenetic protein-2 on osteosarcoma metastasis[J]. PLoS One, 2017, 12: e01733223. |
| [10] |
James A W, Lachaud G, Shen J, et al. A Review of the clinical side effects of bone morphogenetic protein-2[J]. Tissue Engineering Part B-rviews, 2016, 22(4): 284-297. DOI:10.1089/ten.teb.2015.0357 |
| [11] |
Musgrave D S, Pruchnic R, Wright V, et al. The effect of bone morphogenetic protein-2 expression on the early fate of skeletal muscle-derived cells[J]. Bone, 2001, 28(5): 499-506. DOI:10.1016/S8756-3282(01)00413-6 |
| [12] |
Amthor H, Christ B, Weil M, et al. The importance of timing differentiation during limb muscle development[J]. Current Biology, 1998, 8(11): 642-652. DOI:10.1016/S0960-9822(98)70251-9 |
| [13] |
刘刚, 郇聘, 刘保忠. 长牡蛎Dpp同源基因的克隆及其在贝壳发生中的功能研究[J]. 海洋科学, 2014, 38(9): 7-12. Liu Gang, Xun Pin, Liu Baozhong. Clone of Dpp gene and its functions in larval shell formation of the Pacific Oyster Crassostrea Gigas[J]. Marine Sciences, 2014, 38(9): 7-12. |
| [14] |
Miyashita T, Hanashita T, Toriyama M, et al. Gene cloning and biochemical characterizationof the BMP-2 of Pinctada fucata[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(1): 37-47. DOI:10.1271/bbb.70302 |
| [15] |
张岑.合浦珠母贝贝壳形成相关蛋白及基因的研究[D].北京: 清华大学, 2006. Zhang Cen. Studies on proteins and genes involved in the shell formation of Pinctada fucata[D]. Beijing: Tsinghua University, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10003-2007070663.htm |
| [16] |
谢军.间液蛋白在合浦珠母贝贝壳形成中的作用机制研究[D].北京: 清华大学, 2016. Xie Jun. The mechanism study of extrapallial fluid protein in the shell formation of Pinctada fucata[D]. Beijing: Tsinghua Univerty, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10003-1017817644.htm |
| [17] |
郑哲.基于多组学分析的马氏珠母贝矿化相关基因研究[D].湛江: 广东海洋大学, 2017. Zheng Zhe. The studies of biomineralization related genes basedon multi-omic analysis in Pinctada fucata martensii[D]. Zhanjiang: Guangdong Ocean University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10566-1017865788.htm |
| [18] |
周代志.合浦珠母贝Bmp3和Bmp10基因的克隆与功能初步研究[D].上海: 上海海洋大学, 2016. Zhou Daizhi. Moleculer Cloning and Preliminary Functional Studies of BMP3 and BMP10 Gene From Pearl Oyster, Pinctada fucata[D]. Shanghai: Shanghai Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912465.htm |
| [19] |
Nederbragt A J, van Loon A E, Dictus W. Expression of patella vulgata orthologs of engrailed and dpp- BMP2/4 in adjacent domains during molluscan shell development suggests a conserved compartment boundary mechanism[J]. Developmental Biology, 2002, 246(2): 341-355. DOI:10.1006/dbio.2002.0653 |
| [20] |
Iijima M, Takeuchi T, Sarashina I, et al. Expression patterns of engrailed and Dpp in the gastropod lymnaea stagnalis[J]. Development Genes and Evolution, 2008, 218(5): 237-251. DOI:10.1007/s00427-008-0217-0 |
| [21] |
Kin K, Kakoi S, Wada H. A novel role for Dpp in the shaping of bivalve shells revealed in a conserved molluscan developmental program[J]. Developmental Biology, 2009, 329(1): 152-166. DOI:10.1016/j.ydbio.2009.01.021 |
| [22] |
高绪生, 王琦, 王仁波, 等. 鲍鱼[M]. 沈阳: 辽宁科学出版社, 2000: 11-29. Gao Xusheng, Wang Qi, Wang Renbo, et al. Abalone[M]. Shenyang: Liaoning Science Press, 2000: 11-29. |
| [23] |
徐卫民, 吴德康. 杂色鲍的贝壳成分分析研究[J]. 时珍国药研究, 1997, 8(5): 28-29. Xu Weimin, Wu Dekang. Ingredient analysis on the shell of Haliotis diversicolour Reeve[J]. Shi Zhen Journal of Traditinal Chinese Medicine Reseach, 1997, 8(5): 28-29. |
| [24] |
冯政夫, 王琳, 李文侠, 等. 海洋无脊椎动物组织总Rna提取方法的探讨[J]. 海洋科学, 2014(11): 24-28. Feng Zhengfu, Wang Lin, Li Wenxia, et al. Extraction of total RNA from marine invertebrate tissue[J]. Marine Sciences, 2014(11): 24-28. |
| [25] |
封利颖, 郭慧慧, 李雪, 等. 栉孔扇贝骨形态发生蛋白2基因的克隆及表达分析[J]. 中国海洋大学学报(自然科学版), 2013, 43(12): 48-55. Feng Liying, Guo Huihui, Li Xue, et al. Cloning and expression analysis of bone morphogenetic protein 2 gene of Chlamys farreri[J]. Periodical of Ocean University of China, 2013, 43(12): 48-55. |
| [26] |
Lelong C, Mathieu M, Favrel P. Structure and expression of mGDF, a new member of the transforming growth factor-beta superfamily in the bivalve mollusc Crassostrea gigas[J]. European Journal of Biochemistry, 2000, 267(13): 3986-3993. DOI:10.1046/j.1432-1327.2000.01432.x |
| [27] |
钱雪骏.泥蚶Smad1/5、BMP2/4基因的克隆、表达分析及生长性状相关SNP位点筛选[D].上海: 上海海洋大学, 2015. Qian Xuejun. Cloning and spatiotemporal expression analysis of Smad1/BMP2/4 gene and growth traits related SNP screening in the Tegillarca Granosa[D]. Shanghai: Shanghai Ocean University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10264-1015974990.htm |
 2018, Vol. 42
2018, Vol. 42


