文章信息
- 吴素煌, 岳洋, 王晶, 张全斌. 2019.
- WU Su-huang, YUE Yang, WANG Jing, ZHANG Quan-bin. 2019.
- 海带中岩藻黄素异构体的分离纯化及其体外抗肿瘤活性研究
- Isolation, identification and the in vitro anti-breast cancer effects of fucoxanthin stereoisomers from Laminaria japonica
- 海洋科学, 43(1): 67-74
- Marine Sciences, 43(1): 67-74.
- http://dx.doi.org/10.11759/hykx20190308001
-
文章历史
- 收稿日期:2018-10-17
- 修回日期:2018-11-29
2. 中国科学院大学, 北京 100049;
3. 中国科学院 海洋大科学研究中心, 山东 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
癌症目前仍是人类健康的最大威胁, 尽管现代医学通过化疗、放疗等方式能够有效治疗癌症, 但往往伴随着巨大的副作用且引起病人较大的痛苦。此外, 长期使用化疗药物易产生耐药性, 导致晚期癌症治疗更加困难。故开发活性强、选择性高、毒副作用低的新型抗肿瘤药显然是目前的重要方向之一。乳腺癌是女性发病率和死亡率最高的癌症, 2018年全世界乳腺癌新增2 088 848例, 占女性肿瘤发生率的24.2%, 626 679名女性死于乳腺癌, 占女性因癌症死亡人数的15.0%[1]。目前来看, 人类发展指数较高的国家, 乳腺癌发病率要高于人类发展指数较低的国家。造成这种现象的原因可能是平均寿命、生殖和激素水平的改变[2]。故随着经济发展和生活方式的改变, 提高乳腺癌的防治水平是非常必要的。
岩藻黄素(Fucoxanthin, Fx)是存在于褐藻中的一种天然色素, 它也是褐藻中类胡萝卜素的主要成分[3]。研究表明, 岩藻黄素在不同种属的褐藻中含量变化较大, 其中马尾藻科褐藻中岩藻黄素含量较丰富, 约为干重的1.1‰~3.7‰, 海带中岩藻黄素含量较低, 约占海带干重的0.7‰[4]。褐藻中岩藻黄素含量受季节影响, 1~3月岩藻黄素含量较高, 这是因为这段时期光照强度和海水温度较低, 而岩藻黄素是褐藻中光合作用重要的捕光色素, 冬季光照不足导致褐藻中岩藻黄素富集以更好的进行光合作用[4]。岩藻黄素分子结构独特, 含有丙二烯键、5, 6-环氧基、共轭羰基以及乙酰基, 化学性质不稳定[5]。岩藻黄素的稳定性易受pH、光照以及温度等因素的影响。研究表明, 岩藻黄素在pH为5~7的条件下较稳定, 在pH < 3的条件下稳定性较差。光照和温度均影响岩藻黄素稳定性, 岩藻黄素在光照下保存4周降解速率要显著高于黑暗中保存的岩藻黄素的降解速率。在50℃下避光保存4周, 岩藻黄素降解速率显著高于4℃和25℃下避光保存的岩藻黄素[6]。岩藻黄素在裙带菜干粉中的稳定性要高于纯化后岩藻黄素本身的稳定性。裙带菜干粉中的岩藻黄素, 在50℃避光保存50 d的条件下, 其岩藻黄素含量未发生显著变化[7]。故在海带贮藏时若想保留其中的岩藻黄素成分要注意避光保存。同时, 岩藻黄素独特的化学结构也决定了其具有很好的生物活性, 如抗氧化活性、抗肿瘤活性、抗炎活性等[8, 9]。自岩藻黄素发现以来, 其抗癌活性一直是研究人员关注的热点。研究表明, 岩藻黄素对骨肉瘤、白血病、淋巴癌、肺癌、前列腺癌、肝癌以及乳腺癌都表现出良好的抑制活性[10-14]。由于岩藻黄素对正常细胞的毒性较低, 故有望开发成为新的癌症治疗药物[15]。岩藻黄素分子中含有不饱和双键, 目前主要发现四种顺反异构体:全反式岩藻黄素(all-trans Fx)、9′-顺岩藻黄素(9′-cis Fx)、13-顺岩藻黄素(13-cis Fx)和13′-顺岩藻黄素(13′-cis Fx), 其主要异构体结构见图 1。由于岩藻黄素异构体分离困难, 目前对于岩藻黄素顺反异构体的生物活性研究仍处于探索阶段。
 |
| 图 1 岩藻黄素异构体结构式 Fig. 1 Structure of fucoxanthin stereoisomers |
研究表明, 不同岩藻黄素异构体生物活性不同[16]。目前, 尚无关于岩藻黄素异构体对乳腺癌细胞的抑制作用及其作用机制报道。本研究通过柱层析以及高效液相色谱法制备了岩藻黄素异构体, 并以乳腺癌细胞MDA-MB-231为模型, 研究了不同岩藻黄素异构体的体外抗肿瘤活性, 为岩藻黄素及其异构体的深入开发利用提供了理论依据。
1 仪器与材料 1.1 仪器Agilent 1260高效液相色谱仪, DAD检测器(美国安捷伦); 旋转蒸发仪(R2003型, 巩义市予华仪器有限责任公司); Agilent Prepstar制备型高效液相色谱, DAD检测器(美国安捷伦); NanoDrop 2000(美国赛默飞世尔科技公司); Eppendorf AG 22331 Hamburg PCR扩增仪(德国艾本德)。
1.2 材料与试剂海带采自山东荣成, 洗净晾干后避光保存备用。
硅胶(200~300目, 青岛海洋化工有限公司); 石油醚(分析纯, 天津市广成化学试剂有限公司); 乙酸乙酯(分析纯, 天津市广成化学试剂有限公司); 甲醇(色谱纯, 德国Merck公司); 乙腈(色谱纯, 德国Merck公司); 全反式岩藻黄素标准品(纯度 > 98%, 北京索莱宝科技有限公司); 针头滤器(尼龙0.22 μm, 天津市津腾实验设备有限公司)。
L-15培养基(HyClone, 美国Gibco公司); 丙酮酸钠(BBI, 生工工程股份有限公司); 胎牛血清(四季青, 浙江天杭生物科技股份有限公司); Plasmocin prophylactic(美国Nvivogen公司); 胰酶(BBI, 生工工程股份有限公司); Cell Counting Kit-8(Solarbio, 北京索莱宝科技有限公司); 总RNA提取试剂盒(Solarbio, 北京索莱宝科技有限公司); 反转录试剂盒(TransScript, 北京全式金生物有限公司); qPCR SuperMix(TransStart, 北京全式金生物有限公司)。
2 实验方法 2.1 岩藻黄素及其异构体分离纯化 2.1.1 岩藻黄素提取与分离将洁净干海带粉碎后按照料液比1︰10加入95%乙醇浸泡提取海带色素。定期搅拌, 提取3 h后过滤, 滤渣再加入10倍体积乙醇提取3 h, 滤液合并后旋转蒸发除去乙醇, 余下的油水混合物加入乙酸乙酯萃取, 将乙酸乙酯相旋转蒸发除去溶剂后称重。加入等质量硅胶拌样, 通过减压柱层析进行岩藻黄素的富集, 洗脱条件为石油醚︰乙酸乙酯(V︰V)=10︰1梯度变化到石油醚︰乙酸乙酯(V︰V)=1︰5。减压柱层析结果通过薄层层析法与标准品进行比较确定富集岩藻黄素组分。将富集岩藻黄素的组分旋转蒸发除去溶剂后加入硅胶拌样, 通过硅胶柱层析对岩藻黄素进行进一步分离。硅胶柱层析采用梯度洗脱的方式, 流动相为石油醚︰乙酸乙酯(V︰V)=10︰1梯度变化到石油醚︰乙酸乙酯(V︰V)=1︰2。硅胶柱层析分离得到的样品通过高效液相色谱检测含岩藻黄素组分。色谱条件为:水︰甲醇︰乙腈=10︰5︰75;色谱柱Agilent Eclipse XDB-C18(5 μm, 4.6 mm×250 mm), 流速1.0 mL/min, 温度30℃, 时间30 min, 检测波长450 nm, 上样量为20 μL。
2.1.2 岩藻黄素异构体分离纯化将硅胶柱层析所得的岩藻黄素组分旋转蒸发除去溶剂后加入少量甲醇溶解, 经针头滤器压滤后通过制备液相进行岩藻黄素异构体制备。色谱条件为:水︰甲醇︰乙腈=10︰15︰75;色谱柱: Agilent Eclipse XDB- C18(5 μm, 9.4 mm×250 mm), 流速2.5 mL/min, 温度30℃, 时间35 min, 检测波长450 nm, 上样量500 μL。得到的样品通过HPLC检测其纯度, 并通过紫外、质谱和核磁共振氢谱验证其化学结构。
2.2 细胞培养人乳腺癌细胞MDA-MB-231细胞来自上海细胞库, 细胞在L-15培养基中培养, 添加10%的胎牛血清和1%的丙酮酸钠, 培养基中加入0.1%的抗支原体药物Plasmocin prophylactic。细胞培养在5%CO2中, 培养温度为37℃。
2.3 细胞活力实验通过CCK-8试剂盒对细胞活力进行检测, 将MDA- MB-231细胞接种在96孔板上, 每孔加入100 μL的细胞悬液。细胞在培养箱中预养24 h, 然后加入不同浓度的岩藻黄素各异构体样品, 分别在细胞培养6、12、24及48 h后加入CCK-8溶液(10 μL)测量其细胞活力。加入CCK-8后孵育时间为1 h, 于450 nm波长下检测其吸光度A。其癌细胞生长的抑制率计算公式为:抑制率(%)=100%–[A(加药)–A(空白)]/[A(0加药)–A(空白)]×100%。
2.4 qPCR测定相关基因表达水平MDA-MB-231细胞加入80 μg/mL岩藻黄素异构体后孵育48 h。使用总RNA提取试剂盒进行细胞总RNA提取, 提取的RNA浓度和纯度通过NanoDrop进行检测, 其260/280值均在2︰1左右。取100 ng左右RNA反转录成cDNA, 反转录体系为:总RNA5 μL, Oligo(dT) 1 μL, Reaction Mix 10 μL, Enzyme Mix 1 μL, gDNA Remover 1 μL, Rnase-free Water 2 μL。PCR程序为: 42℃孵育15 min, 85℃孵育5 s。通过qPCR检测相关基因表达水平。qPCR反应体系为:模板6.8 μL, 引物各0.4 μL, qPCR SuperMix 10 μL, 校正液0.4 μL, Nuclease-free Water 2 μL。qPCR程序为: 94℃孵育30 s, 94℃孵育5 s和60℃孵育30 s循环, 循环次数为45次。各基因表达量以GAPDH基因的表达量作参照, 每组3个复孔。其引物设计见表 1。
| 基因 | 上游引物 | 下游引物 |
| p65 | 5′-CTCCGCGGGCAGCATCC-3′ | 5′-AGCCGCACAGCATTCAGGTCGTAG-3′ |
| p50 | 5′-CACCTAGCTGCCAAAGAAGG-3′ | 5′-AGGCTCAAAGTTCTCCACCA-3′ |
| p52 | 5′-GCAAATCTCCGGGGGCATCAAACC-3′ | 5′-CTCCGCTTCCGCTGCACCTCTTCC-3′ |
| SOX9 | 5′-GGAGATGAAATCTGTTCTGGGAATG-3′ | 5′-TGAAGGTTAACTGCTGGTGTTCTGA-3′ |
| GAPDH | 5′-TGACCACAGTCCATGCCATC-3′ | 5′-ATGAGGTCCACCACCCTGTT-3′ |
每次实验设置至少3组重复, 实验数据使用平均值±标准偏差表示。实验数据使用SPSS进行方差分析。不同处理组间的显著性差异采用邓肯多重检验。P < 0.05视为有显著性差异。
3 结果与分析 3.1 岩藻黄素及其异构体分离纯化海带经由乙醇浸提后得到海带色素粗提物, 其得率约为海带干重的4.8%。岩藻黄素及其异构体分离纯化过程示意图见图 2。减压柱层析能够根据不同色素组分对硅胶的吸附能力不同而达到快速分离的目的。由于岩藻黄素在海带中含量较低, 减压柱层析能很好地富集岩藻黄素, 利于进一步精细分离。经过减压柱层析发现岩藻黄素主要集中在Ⅰ馏分, 得率约为海带干重0.5‰。利用硅胶柱层析进一步纯化获得Ⅳ组分, Ⅰ和Ⅳ组分高效液相色谱图见图 3a。然后通过制备型高效液相色谱进一步制备获得岩藻黄素及其异构体。结果表明, 反向高效液相色谱柱能够有效分离全反式岩藻黄素及其顺式异构体, 分离结果如图 3b, 分别在10、17和19 min采集到3个组分Fx-1、Fx-2和Fx-3(图 3a)。HPLC分析结表明, 通过制备液相制备的3个组分対映3种岩藻黄素异构体, 即Fx-1为全反式岩藻黄素(65.8 mg, 得率0.013‰), Fx-2为9′-顺岩藻黄素(6.7 mg, 得率0.00134‰), Fx-3为13-顺和13′-顺岩藻黄素(6.5 mg, 得率0.0013‰)。通过HPLC分析发现3个岩藻黄素异构体纯度分别达到: 95.59%、98%和93.8%。
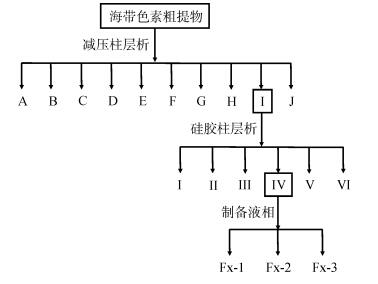 |
| 图 2 岩藻黄素分离纯化过程示意图 Fig. 2 Flow chart of separation and purification of fucoxanthin |
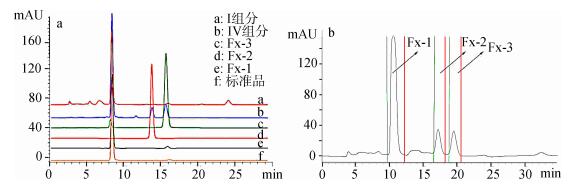 |
| 图 3 岩藻黄素的HPLC分析 Fig. 3 HPLC analysis of fucoxanthin a: 450 nm下不同馏分中岩藻黄素的HPLC图谱; b:岩藻黄素异构体的制备高效液相图谱; Fx-1:全反式岩藻黄素; Fx-2: 9′-顺岩藻黄素; Fx-3: 13-顺和13′-顺岩藻黄素混合物 |
分离所得的三个组分通过紫外可见光谱、ESI质谱和核磁共振氢谱对其结构进行表征及鉴定。三种岩藻黄素异构体的紫外可见光谱扫描结果见图 4a。结果表明, 三种异构体都与全反式岩藻黄素标准品有相似的紫外吸收, 其最大吸收峰都产生在450 nm处, 与岩藻黄素最大吸收峰相符。其320 nm波长下吸收峰强度不同, 表示有顺反异构现象(图 4a)。质谱数据表明, 三种岩藻黄素异构体虽然在制备高效液相色谱中的保留时间(tR)不同, 但是三者有相同的相对分子质量, 在质荷比m/z=659.5处检测到分子离子峰([M+H]+)(图 4b)。由于紫外光谱特征与相对分子质量均与文献报道相符, 因此表明分离得到的是岩藻黄素异构体。
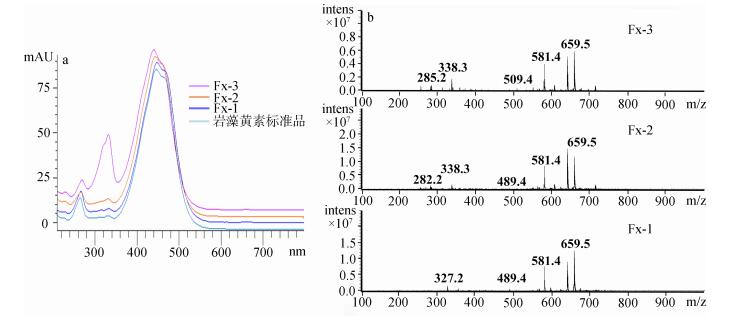 |
| 图 4 岩藻黄素异构体紫外光谱(a)和ESI质谱(b) Fig. 4 UV–VIS spectra (a) and ESIMS (b) of fucoxanthin stereoisomers |
岩藻黄素及其异构体的核磁共振氢谱如图 5a所示。其特征区位于化学位移值6.0到7.2之间, 6.0到7.2氢谱放大数据见图 5b。根据其化学位移值对比可知, H-12在Fx-1和Fx-2中化学位移值分别为6.67和6.66, 而在Fx-3中化学位移值为7.21。H-14在Fx-1和Fx-2中化学位移值均为6.41, 而在Fx-3中化学位移值为6.30, H-15在Fx-1、Fx-2和Fx-3中化学位移值分别为6.63、6.66和6.81。H-15′在Fx-1和Fx-2中化学位移值均为6.75而在Fx-3中化学位移值为6.65。H-10′在Fx-1、Fx-2和Fx-3中化学位移值分别为6.13、6.05、6.17。H-8′在Fx-1、Fx-2和Fx-3中化学位移值分别为6.05、6.68和6.13。其化学位移值均与文献中描述相符[17], 说明分离得到的是岩藻黄素异构体。
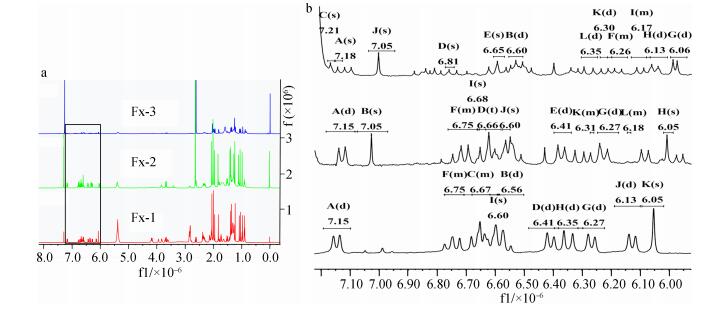 |
| 图 5 岩藻黄素异构体的核磁共振氢谱(a)及特征区域局部放大图(b) Fig. 5 Complete 1H-NMR spectra of fucoxanthin stereoisomers (a) and Enlarged view of featured area (b) |
细胞毒活性结果显示, 减压柱层析后的富集岩藻黄素的Ⅰ组分在浓度为80 μg/mL, 孵育48 h时显示出一定的抗肿瘤活性, 其抑制率约为22.6%(图 6a)。再经过硅胶柱进一步分离后得到Ⅳ组分, 主要包含岩藻黄素及其异构体。Ⅳ组分表现出较强的抗肿瘤作用, 80 μg/mL孵育48 h后对癌细胞抑制率达到56.6%(图 6b)。岩藻黄素及其异构体的体外抗乳腺癌活性见图 7。结果表明, 三种岩藻黄素异构体均对乳腺癌细胞MDA-MB-231细胞生长显示出较强的抑制作用。其抑制作用由强到弱依次为Fx-3 > Fx-2 > Fx-1, Fx-1的IC50值为45.30 μg/mL(67.95 μmol/L), Fx-2的IC50值为27.09 μg/mL(40.63 μmol/L), Fx-3的IC50值为23.71 μg/mL。本实验选取传统抗癌药物顺铂作为阳性对照, 其IC50值为8.54 μg/mL(28.47 μmol/L)。
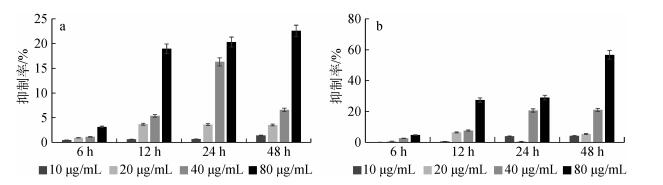 |
| 图 6 色素粗提物对乳腺癌细胞生长的抑制率(Ⅰ组分(a), Ⅳ组分(b)) Fig. 6 Inhibition rate of growth of breast cancer cells by crude pigment extract (constituent Ⅰ (a), constituent Ⅳ (b)). |
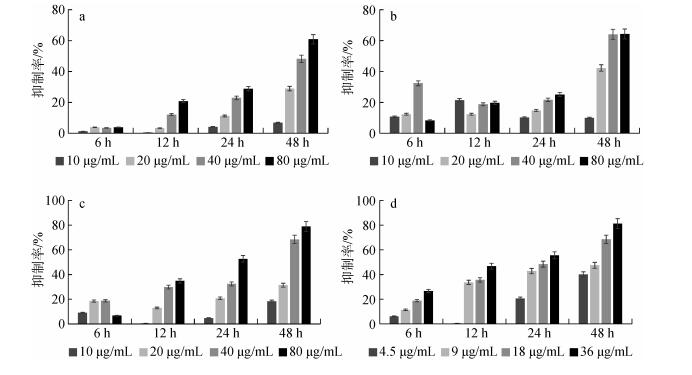 |
| 图 7 岩藻黄素异构体对乳腺癌细胞生长的抑制率 Fig. 7 Inhibition rate of growth of breast cancer cells by fucoxanthin stereoisomers |
通过对乳腺癌细胞NF-κB途径有关基因表达量的研究发现, 三种岩藻黄素异构体在浓度为80 μg/mL, 孵育48 h时, 均显著下调了癌细胞中p65、p50、p52基因的表达量(图 8)。在NF-κB途径中p65、p50、p52蛋白均可进入细胞核刺激相关基因表达, 下调p65、p50、p52基因的表达量说明岩藻黄素显著抑制了NF-κB途径的激活。乳腺癌细胞的SOX9基因是NF-κB途径重要的下游元件, 在肿瘤的发生、发展及转移中均起重要作用[18]。qPCR结果表明, 岩藻黄素显著抑制了SOX9基因的表达量。
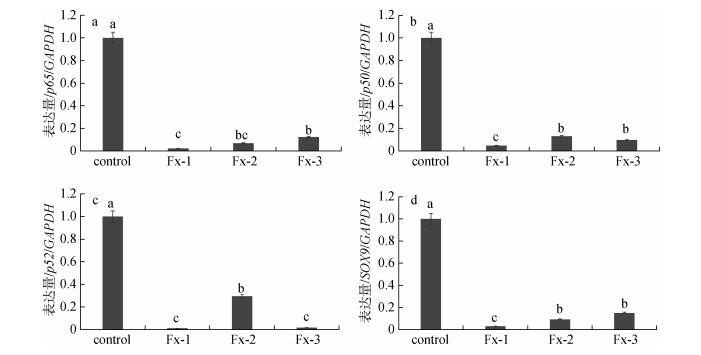 |
| 图 8 岩藻黄素异构体对NF-κB途径有关基因p65(a), p50(b), p52(c)及下游元件SOX9(d)表达量的影响 Fig. 8 Effects of fucoxanthin stereoisomers on transcriptional regulation of members of the NF-κB pathway, p65 (a), p50 (b) and p52 (c), as well as their target gene SOX9 (d) 各组数据间差异性分析采用邓肯多重检验, P < 0.05视为有显著性差异 |
近年来, 我国越来越重视海洋资源的开发利用, 提高现有加工处理海洋资源的能力迫在眉睫。传统的海带产业中, 多以提取褐藻胶为主, 海带色素等脂溶性物质多作为废液遗弃。岩藻黄素作为海带中类胡萝卜素的主要成分, 具有良好的抗氧化、抗炎、抗肥胖及抗肿瘤活性。目前已被食品、化妆品、药品等行业广泛关注, 具有良好的商业前景与商业价值。本实验论证了减压柱层析应用于岩藻黄素富集的可能性, 为海带资源综合利用提供了参考。
通过硅胶柱层析以及制备高效液相色谱制备了三种岩藻黄素异构体, 并对其结构做出了表征。实验结果表明通过硅胶的吸附作用能有效分离海带色素, C-18柱能有效分离岩藻黄素异构体。
岩藻黄素对乳腺癌细胞MDA-MB-231细胞生长具有良好的抑制作用, 且其顺式异构体活性均强于全反式岩藻黄素, 说明在抗癌活性方面, 岩藻黄素顺式异构体可能有更高的开发价值。NF-κB信号通路分为经典通路和非经典通路两种[19]。p65、p50和p52分别是经典通路和非经典通路的重要受体, 均可进入细胞核激活目的基因的表达。癌细胞通过NF-κB途径激活抗凋亡基因的表达, 导致肿瘤发生并生长。有研究表明, p65和p50在乳腺癌细胞中是过表达的[20]。三种岩藻黄素异构体均对乳腺癌细胞p65、p50和p52基因均产生了显著性抑制作用, 表明岩藻黄素可能通过抑制NF-κB经典通路和非经典通路激活途径起到抗癌作用。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.v68.6 |
| [2] |
Fidler M M, Bray F, Soerjomataram I. The global cancer burden and human development:A review[J]. Scand Journal of Public Health, 2018, 46(1): 27-36. |
| [3] |
Satomi Y. Antitumor and cancer-preventative function of fucoxanthin:a marine carotenoid[J]. Anticancer Research, 2017, 37(4): 1557-1562. DOI:10.21873/anticanres |
| [4] |
Masaru Terasaki, Atsushi Hirose, Bhaskar Narayan. Evaluation of recoverable functional lipid components of several brown seaweeds (Phaeophyta) from Japan with special reference to fucoxanthin and fucosterol contents[J]. Journal of Phycology, 2009, 45(4): 974-980. DOI:10.1111/j.1529-8817.2009.00706.x |
| [5] |
Gerhard Englert, Terje Bjørnland, Synnøve Liaaen-Jensen. 1D and 2D NMR-study of some allenic carotenoids of the fucoxanthin series[J]. Magnetic Resonance in Chemistry, 1990, 28(6): 519-528. DOI:10.1002/(ISSN)1097-458X |
| [6] |
Wu Hon Yip, Lim Seng Joe, Wan Aida Wan Mustapha, et al. Characterisation and stability of pigments extracted from Sargassum binderi obtained from Semporna, Sabah[J]. Sains Malaysiana, 2014, 43(9): 1345-1354. |
| [7] |
Sugimura Rumiko, Suad Masatake, Sho Ayumi, et al. Stability of fucoxanthin in dried Undaria pinnatifida (wakame) and baked products (scones) containing wakame powder[J]. Food Science and Technology Research, 2012, 18(5): 687-693. DOI:10.3136/fstr.18.687 |
| [8] |
Rwigemera A, Mamelona J, Martin L J. Martin. Comparative effects between fucoxanthinol and its precursor fucoxanthin on viability and apoptosis of breast cancer cell lines MCF-7 and MDA-MB-231[J]. Anticancer Research, 2015, 35(1): 207-219. |
| [9] |
Nakazawa Y, Sashima T, Hosokawa M, et al. Comparative evaluation of growth inhibitory effect of stereoisomers of fucoxanthin in human cancer cell lines[J]. Journal of Functional Foods, 2009, 1(1): 88-97. DOI:10.1016/j.jff.2008.09.015 |
| [10] |
Chung T W, Choi H J, Lee J Y, et al. Marine algal fucoxanthin inhibits the metastatic potential of cancer cells[J]. Biochemical and Biophysical Research Communications, 2013, 439(4): 580-585. DOI:10.1016/j.bbrc.2013.09.019 |
| [11] |
Wang Jun, Chen Shihui, Xu Shiqiang, et al. In vivo induction of apoptosis by fucoxanthin, a marine carotenoid, associated with down-regulating STAT3/EGFR signaling in sarcoma 180(S180) xenografts-bearing mice[J]. Marine Drugs, 2012, 10(9): 2055-2068. |
| [12] |
Satomi Y, Nishino H. Implication of mitogen-activated protein kinase in the induction of G1 cell cycle arrest and gadd45 expression by the carotenoid fucoxanthin in human cancer cells[J]. BBA-General Subjects, 2009, 1790(4): 260-266. DOI:10.1016/j.bbagen.2009.01.003 |
| [13] |
Swadesh K Das, Takashi Hashimoto, Kazuki Kanazawa. Growth inhibition of human hepatic carcinoma HepG2 cells by fucoxanthin is associated with down-regulation of cyclin D[J]. BBA-General Subjects, 2008, 1780(4): 743-749. DOI:10.1016/j.bbagen.2008.01.003 |
| [14] |
Kotake-Nara E, Terasaki M, Nagao A. Characterization of apoptosis induced by fucoxanthin in human promyelocytic leukemia cells[J]. Bioscience Biotechnology and Biochemistry, 2005, 69(1): 224-227. DOI:10.1271/bbb.69.224 |
| [15] |
Martin L. Fucoxanthin and its metabolite fucoxanthinol in cancer prevention and treatment[J]. Marine Drugs, 2015, 13(8): 4784-4798. DOI:10.3390/md13084784 |
| [16] |
Zhang Yiping, Fang Hua, Xie Quanling, et al. Comparative evaluation of the radical-scavenging activities of fucoxanthin and its stereoisomers[J]. Molecules, 2014, 19(2): 2100-2113. DOI:10.3390/molecules19022100 |
| [17] |
Haugan J A, Liaaen-Jensen S. Isolation and characterisation of four allenic (6'S)-isomers of fucoxanthin[J]. Tetrahedron Letters, 1994, 35(14): 2245-2248. DOI:10.1016/S0040-4039(00)76810-9 |
| [18] |
陈海燕, 王志莲, 郝敏. SOX9与肿瘤的研究进展[J]. 中华临床医师杂志(电子版), 2016, 10(3): 424-428. Chen Haiyan, Wang Zhilian, Hao Min. Research advances in SOX9 and its involvement in human malignancies[J]. Chinese Journal of Clinicians(Electronic Edition), 2016, 10(3): 424-428. DOI:10.3877/cma.j.issn.1674-0785.2016.03.025 |
| [19] |
Hayden M S, Ghosh S. Signaling to NF-kappaB[J]. Genes, 2004, 18(18): 2195-2224. DOI:10.1101/gad.1228704 |
| [20] |
Nakshatri H, Bhat-Nakshatri P, Martin D A, et al. Constitutive activation of NF-kappa B during progression of breast cancer to hormone-independent growth[J]. Molecular and Cellular Biology, 1997, 17(7): 3629-3639. DOI:10.1128/MCB.17.7.3629 |
 2019, Vol. 43
2019, Vol. 43


