
文章信息
- 王可可, 田野, 姜源庆, 李培峰, 刘春颖, 杨桂朋. 2019.
- WANG Ke-ke, TIAN Ye, JIANG Yuan-qing, LI Pei-feng, LIU Chun-ying, YANG Gui-peng. 2019.
- 温度对海洋硅藻吸收或释放一氧化氮的影响
- Effect of temperature on the uptake and release of nitric oxide by marine diatoms
- 海洋科学, 43(11): 35-41
- Marine Sciences, 43(11): 35-41.
- http://dx.doi.org/10.11759/hykx20190506001
-
文章历史
- 收稿日期:2019-05-06
- 修回日期:2019-06-06
2. 国家海洋局 烟台海洋环境监测中心站, 山东 烟台 264006
2. Yantai Marine Environmental Monitoring Center Station, State Oceanic Administration, Yantai, Shandong 264006, China
浮游植物是海洋生态系统中最重要的初级生产者[1], 是水中溶解氧的主要提供者, 也是地球上固碳固氮的重要生物[2-4]。一氧化氮(NO)是浮游植物体内重要的生长调节因子和信号因子[5-6]。Gross研究发现硅藻在产生醛类化合物来控制藻细胞密度的同时也会产生NO, 表明NO可以作为硅藻的信号分子进而参与硅藻生物量的调控[7]。NO阈值概念的提出也是基于外源NO对海洋微藻的生长有显著的影响[8]。另外, NO能参与浮游植物细胞的程序性死亡过程[9-10]以及其它生理活动[11-12], 并能在藻细胞受到非金属、金属、杀虫剂和紫外线等非生物的生长胁迫时起到保护作用[13]。因此, NO与微藻的关系引起了研究者们的关注。
Kim等在三种海洋赤潮藻Chattonella marina、Cryptomonas ovata和Heterosigma akashiwo中观测到NO的释放[14-15]。Zhang等[6]在亚心形扁藻(Platymonas subcordiformis)、中肋骨条藻(Skeletonema costatum)和裸甲藻(Gymnodinium sp.)三种微藻藻液中检测到浓度大约为10–9~10–8 mol/L的NO。如果微藻大规模生长引起藻华现象, 则会导致海水中NO浓度的增高, 而高浓度的NO会通过海气交换进入到大气中, 进而影响气候和环境[16]。另一方面, Yoshihara等[17]和Nagase[18]等研究发现绿藻在吸收利用炉气时, 也能吸收炉气中10–6 mol/L数量级的NO。赤潮藻比如中肋骨条藻、裸甲藻和旋链角毛藻(Chaetoceros curvisetus)也能吸收利用外源的NO[19-20]。因此, 研究微藻释放或吸收NO对进一步认识NO与微藻的关系具有重要的意义。
微藻产生NO的可能途径[21-23]和环境因子对微藻释放NO浓度的影响[20]已有一些报道, 但是关于微藻释放或吸收NO速率的研究基本空白。此外, 温度对海洋微藻生长的影响及机制引起广泛的关注。温度不仅会影响藻类生长和光合作用, 还会影响藻类的细胞组成[24]、短期的营养盐吸收[25]和氮代谢[26]。硅藻因其种类多, 数量大, 增值速率较快, 成为我国近海的优势类群[27]。温度会限制硅藻的生长及对硝酸盐的吸收, 进而对物种演替和氮的海洋生物化学过程产生影响[28-29]。因此本文选用了具有代表性的三种硅藻小新月菱形藻(Nitzschia closterium f. minutissima)、三角褐指藻(Phaeodactylum tricornutum)和中肋骨条藻, 进行实验室模拟培养, 探讨温度升高对NO净释放或净吸收速率的影响, 为进一步了解NO在海洋生态系统中的地位和作用提供一定的科学依据。
1 材料与方法 1.1 仪器与材料小新月菱形藻、三角褐指藻和中肋骨条藻, 同属于硅藻门, 分属于羽纹硅藻纲、羽纹纲和中心纲, 均来自中国海洋大学海洋污染生态化学实验室。选取黄海(121°04.228'E, 35°56.248'N)海水作为培养基底, 先用0.45 µm醋酸纤维滤膜过滤, 再用LDZX-50KBS高压灭菌锅(上海申安医疗器械厂, 中国)灭菌20 min (0.15 MPa), 冷却后充分摇动来恢复溶解气体含量。
用分析天平(Mettller Toledo, 瑞士)准确称取4, 5-二氨基荧光素(DAF-2) (Sigma公司, 美国), 溶于少量Milli-Q水(Millipore公司, 美国)中, 配制成浓度为276 μmol/L的储备液贮于10 mL棕色血清瓶中避光冷冻保存。然后用移液枪(Eppendorf公司, 德国)移取200 µL上述配制好的DAF-2储备液到5 mL Milli-Q水中混匀, 得到NO捕集液, 贮于10 mL棕色血清瓶, 现配现用。
用NaOH和NaH2PO4 (国药集团化学试剂有限公司, 中国)配制成pH在7.3~7.4范围内的10 mmol/L磷酸盐缓冲液, 再用0.22 µm醋酸纤维滤膜过滤, 冷藏备用。
1.2 实验步骤根据f/2配方在上述灭菌海水中加入营养物质, 调节溶液pH值为8.10±0.02, 按培养液和藻液3︰1的比例加入藻液, 置于GXZ-380B型智能光照培养箱(宁波江南仪器厂, 中国)中静置培养, 培养到指数生长期进行接种, 三角褐指藻、小新月菱形藻和中肋骨条藻的初始藻密度分别为1.50×107个/L、2.75×107个/L和1.00×108个/L。每种海洋硅藻设立三个平行样和空白对照, 培养体积均为200 mL。培养温度分别为20℃和25℃。其他培养条件为:明暗周期(L/D)为12 h︰12 h, 光照强度为8 000 Lux。每8 h摇瓶一次, 以保持藻液中的溶解气体含量和防止藻细胞沉降。根据藻密度变化确定其生长周期, 并分别用处于指数生长期、生长平台期和衰亡期的某一天代表这三个生长阶段, 进行密闭实验。具体方法:从200 mL锥形瓶中移取30 mL藻液于40 mL透明玻璃瓶中, 立即压盖密封, 光照培养6 h, 在密封培养前后取样。取样方法:首先将200 µL内插管(CNW公司, 德国)置于2 mL 9 mm棕色螺纹口自动进样瓶中(CNW公司, 德国), 再用微量进样器(上海安亭微量进样器厂, 中国)移取150 µL NO捕集液于200 µL内插管中, 然后用新的微量进样器从透明玻璃瓶中移取50 µL藻液于内插管底部, 混匀待测。
1.3 测定方法 1.3.1 藻密度的测定取4 mL藻液倒入5 mL离心管中, 滴入一滴鲁格试剂, 摇匀, 取洁净的血球计数板(上海市求精生化试剂仪器有限公司, 中国)一块, 用光学显微镜(Nikon ALPHAPHOT-2YS2, 日本)计数, 每个样品重复测量3次。硅藻生长速率根据下列公式计算:
(µ为比生长速率, Nt为从任何时间处开始培养t时间后的藻密度, N为任何时间处的藻密度, t为培养时间)。
1.3.2 NO标准曲线的制定将Milli-Q水加热煮沸并保持沸腾状态1~2 min, 趁热取10 mL到棕色血清瓶中, 立即压盖封口, 然后用高纯氮气(99.999%)(青岛豪森新能源有限公司, 中国)吹扫30 min, 待其氧气除净后通入高纯NO (99.9%) (大连大特气体有限公司, 中国)气体30 min, 得到NO饱和溶液[5]。准确移取100 μL NO饱和溶液到8 mL无氧水中, 得到二级NO母液。再移取100 μL二级NO母液到8 mL无氧水中, 得到三级NO母液。分别移取10、20、40、60、80和100 μL三级母液于8 mL NO捕集液中, 反应完全后用高效液相色谱仪(Agilent 1260 Infinity LC, 美国)测定, 在10–10~ 10–9 mol/L范围内的NO标准系列, 然后以NO浓度为横坐标, 峰面积为纵坐标绘制工作曲线, 得到线性方程y = 0.0094x + 0.1741, R2=0.96。
1.3.3 NO浓度的测定样品采集后, 用高效液相色谱法[30]进行测定, 其中流动相比例为乙腈︰磷酸盐溶液=8︰92, 柱温25℃, 流速1 mL/min, 进样量为10 μL, 荧光检测器的激发波长和发射波长分别为495 nm和515 nm。检测限为0.025×10–9 mol/L, 精密度为3%~5%。
1.3.4 NO净吸收或净释放速率的计算对比空白样, 在藻生长的指数生长期、平台期和衰亡期计算NO表观净吸收或净释放速率, 具体计算方法为:
NO净吸收或净释放速率增加或降低率:
ν为单位藻细胞对NO的净吸收或净释放速率[mol/(个·h)], t为6 h, C1为密闭前藻液中NO浓度, C2为密闭后藻液中NO浓度, 单位为mol/L (假设密闭6 h之内, 硅藻对NO的吸收或释放状态一直不变, 即根据NO速率的正负定义硅藻在这个生长阶段对NO是释放或吸收), A为三个生长阶段取样当天的藻密度, 单位为个/L。
1.3.5 实验数据处理数据采用SPSS 17.0进行相关性分析和显著性差异, 使用OriginPro 8.5绘图。
2 结果 2.1 三角褐指藻的生长与NO净吸收速率三角褐指藻的生长曲线如图 1所示, 两种温度条件下三角褐指藻均在第4天达到生长平台期, 持续3天后进入衰亡期。指数生长期的比生长速率均明显高于衰亡期, 主要是因为生长初期营养盐比较丰富, 随着硅藻高速生长到平台期, 营养盐被大量消耗, 导致衰亡期营养盐不足[20]。在指数生长期, 三角褐指藻对NO的净吸收速率也明显高于平台期和衰亡期(P < 0.05)。温度升高对三角褐指藻的生长并没有明显影响, 但促进了三角褐指藻吸收NO。与20℃相比, 25℃条件下NO净吸收速率在指数生长期、生长平台期和衰亡期分别升高了40.2%、98.2%和16.0%。温度升高对处于生长平台期的三角褐指藻吸收NO的影响程度最大。
 |
| 图 1 不同温度下三角褐指藻的生长曲线、NO净吸收速率(a)和比生长速率(b) Fig. 1 Growth curves, nitric oxide uptake rates (a), and specific growth rates (b) of Phaeodactylum tricornerum at various temperatures |
培养周期内小新月菱形藻的藻密度变化和NO净吸收或净释放速率如图 2所示, 20℃和25℃条件下小新月菱形藻均在第5天进入生长平台期, 持续3天进入衰亡期。两个温度条件下小新月菱形藻的比生长速率差异不显著, 即温度升高对小新月菱形藻的生长没有明显影响, 但促进了小新月菱形藻吸收NO。在指数生长期, 25℃培养条件下的小新月菱形藻对NO的净吸收速率比其在20℃高50.3%。在平台期, NO净吸收速率升高幅度最大, 20℃和25℃条件下NO净吸收速率分别为2.3×10–19 mol/(个·L)和1.54×10–18 mol/(个·L), 升高了5.7倍。同一温度下, 小新月菱形藻对NO的吸收或释放在不同生长阶段呈现出不同的规律。20℃和25℃条件下, 处于指数生长期的小新月菱形藻对NO的净吸收速率均高于平台期。
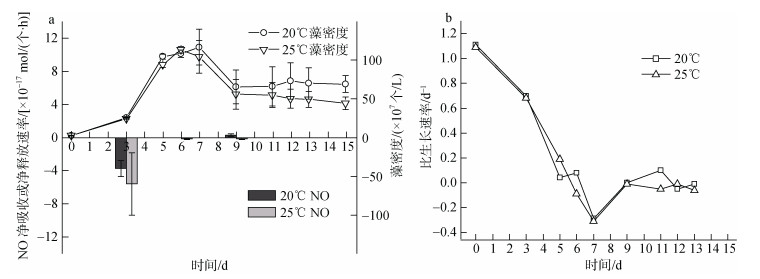 |
| 图 2 不同温度下小新月菱形藻的生长曲线、NO净吸收或净释放速率(a)和比生长速率(b) Fig. 2 Growth curves, nitric oxide uptake or release rates (a), and specific growth rates (b) of Nitzschia closterium at various temperatures |
中肋骨条藻的藻密度变化与NO净吸收或净释放速率如图 3a所示, 两个温度条件下藻密度均在第11天进入平台期, 持续3天。20℃培养条件下的藻密度远高于25℃(P < 0.01), 说明温度升高抑制了中肋骨条藻的生长。在指数生长期和平台期, 25℃条件下NO净释放速率比20℃分别高了4倍和11.5倍, 表明在20~25℃内, 温度升高在一定程度上促进了中肋骨条藻释放NO。而同一温度下, 中肋骨条藻对NO的吸收或释放在不同生长阶段呈现出不同的规律。在指数生长期, 20℃和25℃条件下NO净释放速率均高于平台期。
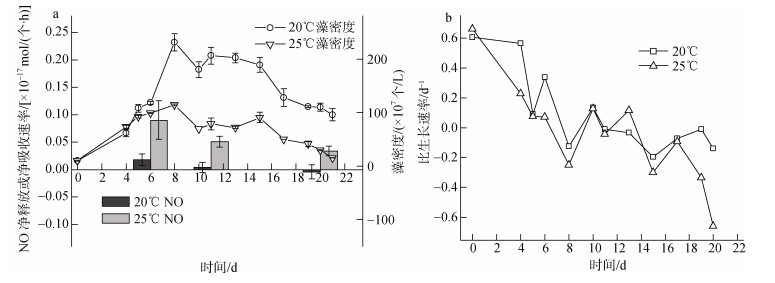 |
| 图 3 不同温度下中肋骨条藻的生长曲线、NO净吸收或净释放速率(a)和比生长速率(b) Fig. 3 Growth curves, nitric oxide uptake or release rates (a), and specific growth rates (b) of Skeletonema costatum at various temperatures |
温度通过影响微藻的光合作用和呼吸作用强度来影响藻的新陈代谢, 对微藻的生长速率产生显著影响[31]。Epple[32]发现大部分硅藻的最适生长温度为20~24℃。但不同种类的硅藻在适应温度方面却具有不同的能力。Bonggil Hyun等[33]研究全球变暖对四种海洋硅藻的生长影响时发现, 当温度从20℃升高到25℃时, 中肋骨条藻的生长受到抑制、而柔弱角毛藻(Chaetoceros debilis)表现出快速生长, 对诺氏海链藻(Thalassiosira nordenskioeldii)和双突角毛藻(Chaetoceros didymus)的生长没有明显影响。在本研究中, 如图 1b~图 3b所示, 与20℃相比, 25℃对三角褐指藻和小新月菱形藻的生长无明显影响, 而显著抑制了中肋骨条藻的生长。
3.2 海洋微藻生长与NO的关系NO是微藻体内重要的生长调节因子, 且NO在藻液中的变化是一个复杂的过程[5-6]。如图 1a~图 3a所示, 三角褐指藻和小新月菱形藻表现为吸收NO, 而中肋骨条藻则表现为释放NO。如引言中提到大量的研究证明微藻在生长过程中可释放一定浓度的NO到细胞外。而NO是一种非极性小分子, 暗示着NO可以通过扩散穿透细胞膜[34], Nagase等[18]研究证明液相中的NO可以通过扩散直接被绿藻吸收, 且藻液中的NO会先降低然后达到一个平衡值。所以在短暂的密闭培养体系中, 三种实验硅藻对NO表现出的表观吸收或释放可能主要是由NO分子扩散速率和藻细胞产生NO速率共同决定的。假设其他环境因素一致, NO分子扩散速率不变, 则三种硅藻对NO的表现不同则是由藻细胞产生NO速率的不同导致的, 而藻细胞产生NO速率的不同可能是存在种间差异的缘故。
在藻的不同生长阶段, 藻液中NO浓度不同, 在藻密度达到最高值之前NO浓度达到峰值[20]。海洋微藻藻液中NO浓度与微藻各生长阶段有着密切的联系。如图 1~3所示, 在20℃和25℃条件下, 三种硅藻对NO的净吸收或净释放速率的大小顺序均为:指数生长期 > 平台期 > 衰亡期, 细胞生长速率变慢, 用于细胞生长的营养物质消耗速率也会变慢, 而同时NO净吸收或净释放速率也降低。这种硅藻的比生长速率与NO净吸收或净释放速率的同时期变化说明NO可能参与了三种硅藻的生长代谢。
3.3 温度对NO净吸收或净释放速率的影响作为影响微藻生长的重要环境因素之一, 温度对NO净吸收或净释放速率也会产生影响。25℃下三角褐指藻和小新月菱形藻对NO的净吸收速率均比20℃条件下高。高温会导致NO在液相中以及细胞膜上的扩散系数增大[35], 进而导致NO扩散速率升高即NO净吸收速率升高。微藻产生NO的具体途径尚不清楚, 但实验培养设定的pH值不支持非酶途径产生NO。Sakihama等[36]研究发现一些海洋微藻可以通过一氧化氮合成酶(NOS)途径或者硝酸还原酶(NR)途径产生NO。温度控制着植物细胞内各种化学反应速率, 影响着参与反应的酶的活性[37], 戴爱泉等[38]研究显示旋链角毛藻的NR最适温度为20℃, 而Venturini等[39]研究发现当温度升高时, 表征NOS-І和NOS-П活性的最大催化速度Vmax增加, 本研究显示中肋骨条藻对NO的净释放速率的温度效应顺序为25℃ > 20℃。由于控制中肋骨条藻产生NO的酶种类的不确定性, 所以温度对NO净释放速率的影响机制也不能确定。
温度升高, 中肋骨条藻的生长受到抑制, 而NO净释放速率增加, 则说明在硅藻生长的适合温度下, 硅藻并不一定具有最大NO净释放或净吸收速率。有研究发现NO在藻细胞受到非生物胁迫时会对其进行保护[13], 且林彩等[40]研究发现当温度在25~30℃时, NO对中肋骨条藻的生长促进作用最明显, 所以高温下中肋骨条藻对NO的净释放速率的增加可能是因为在高温胁迫下, 中肋骨条藻会作出释放NO的响应来保护藻细胞。另外, 由图 3(a)可以看出, 高温对处于平台期的中肋骨条藻释放NO的影响程度最高, NO净释放速率在25℃下比其在20℃下高了11.5倍, 而此生长阶段的藻密度最大, 暗示着当发生中肋骨条藻藻华时, 高温会引起NO净释放速率的大幅度升高。
4 结论当温度从20℃升高到25℃, 三种藻的生长趋势大致相同, 但对三种硅藻的生长影响明显不同, 说明不同种类硅藻具有不同的适应温度能力。
在20℃和25℃条件下, 三种硅藻从指数生长期生长到衰亡期, 藻细胞生长速率变慢, NO净吸收或净释放速率下降, 说明NO可能与三种硅藻的生长代谢相关。
与20℃相比, 25℃条件下三角褐指藻对NO的净吸收速率在指数生长期、生长平台期和衰亡期分别升高了40.2%、98.2%和16.0%, 小新月菱形藻对NO的净吸收速率和中肋骨条藻对NO的净释放速率在平台期分别增加了5.7倍和11.5倍。升高温度, 不同种类的硅藻对NO的净吸收或净释放速率有不同程度的升高, 说明全球变暖会促进硅藻代谢NO。
| [1] |
Pugnetti A, Camatti E, Mangoni O, et al. Phytoplankton production in Italian freshwater and marine ecosys- tems: State of the art and perspectives[J]. Chemistry & Ecology, 2006, 22(sup1): S49-S69. |
| [2] |
Luo D. Study on the distribution of dissolved oxygen in Shenhu Bay and its relationship with phytoplankton and suspended matter[J]. Marine Science Bulletin, 2002, 21(1): 31-36. |
| [3] |
Parab S G, Matondkar S G. Primary productivity and nitrogen fixation by Trichodesmium spp. in the Arabian Sea[J]. Journal of Marine Systems, 2012, 105: 82-95. |
| [4] |
Raven J A. Carbon fixation and carbon availability in marine phytoplankton[J]. Photosynthesis Research, 1994, 39(3): 259-273. DOI:10.1007/BF00014587 |
| [5] |
Zhang Z, Lin C, Liu C, et al. Study on patterns and chemical features of NO effect on marine phytoplankton growth[J]. Science China Chemistry, 2005, 48(4): 376-384. DOI:10.1360/03yb0166 |
| [6] |
Zhang Z, Xing L, Wu Z, et al. Discovery of nitric oxide in marine ecological system and the chemical characteristics of nitric oxide[J]. Science China Chemistry, 2006, 49(5): 475-480. DOI:10.1007/s11426-006-2017-6 |
| [7] |
Gross L. Modeling alien invasions: plasticity may hold the key to prevention[J]. Plos Biology, 2006, 4(11): e411. DOI:10.1371/journal.pbio.0040411 |
| [8] |
Zhang Z, Lin C, Liu C, et al. The effect of nitric oxide on the growth of marine phytoplankton[J]. Journal of Ocean University of Qingdao, 2003, 2(2): 185-188. |
| [9] |
Clarke A, Desikan R, Hurst R D, et al. NO way back: nitric oxide and programmed cell death in Arabidopsis thaliana suspension cultures[J]. Plant Journal, 2000, 24(5): 667-677. DOI:10.1046/j.1365-313x.2000.00911.x |
| [10] |
Vardi A, Formiggini F, Casotti R, et al. A stress surveillance system based on calcium and nitric oxide in marine diatoms[J]. Plos Biology, 2006, 4(3): e60. DOI:10.1371/journal.pbio.0040060 |
| [11] |
Liu C, Zhang Z, Chen X. Mutual effects of nitric oxide and iron on the growth of marine microalgae[J]. Acta Oceanologica Sinica, 2005, 24(5): 100-109. |
| [12] |
Liu C Y, Kieber D J, Yang G P, et al. Evidence for the mutual effects of dimethylsulfoniopropionate and nitric oxide during the growth of marine microalgae[J]. Nitric Oxide, 2014, 42: 54-61. DOI:10.1016/j.niox.2014.09.003 |
| [13] |
Lobysheva I I, Vanin A F, Sineshchekov O A, et al. Nitric oxide modulates phototaxis of Chlamydomonas reinhardtii[J]. Biophysics, 1996, 41(2): 538-541. |
| [14] |
Kim D, Yamaguchi K, Oda T. Nitric oxide synthase like enzyme mediated nitric oxide generation by harmful red tide phytoplankton, Chattonella marina[J]. Journal of Plankton Research, 2006, 28(6): 613-620. DOI:10.1093/plankt/fbi145 |
| [15] |
Kim D, Kang Y S, Lee Y, et al. Detection of nitric oxide (NO) in marine phytoplankters[J]. Journal of Bioscience & Bioengineering, 2008, 105(4): 414-417. |
| [16] |
Law C S. Air–sea transfer: N2O, NO, CH4, CO[M]. Encyclopedia of Ocean Sciences, San Diego, USA: Academic Press, 2001.
|
| [17] |
Yoshihara K I, Nagase H, Eguchi K, et al. Biological elimination of nitric oxide and carbon dioxide from fluegas by marine microalga NOA-113 cultivated in a long tubular photobioreactor[J]. Journal of Fermentation & Bioengineering, 1996, 82(4): 351-354. |
| [18] |
Nagase H, Yoshihara K, Eguchi K. Uptake pathway and continuous removal of nitric oxide from flue gas using microalgae[J]. Biochemical Engineering Journal, 2001, 7(3): 241-246. |
| [19] |
张正斌, 李培峰, 刘春颖. 一氧化氮在浮游植物中的研究进展[J]. 中国海洋大学学报(自然科学版), 2006, 36(1): 37-41. Zhang Zhengbin, Li Peifeng, Liu Chunying. Researchadvances in nitric oxide in phytoplankton[J]. Periodical of Ocean University of China, 2006, 36(1): 37-41. |
| [20] |
刘春颖.海水中一氧化氮对浮游植物生长影响的规律研究[D].山东青岛: 中国海洋大学, 2006. Liu Chuying. Study on the effect of nitric oxide in seawater on the growth of phytoplankton[D]. Qingdao, Shandong Province: Ocean University of China, 2006. http://cdmd.cnki.com.cn/article/cdmd-10423-2006181462.htm |
| [21] |
Mallick N, Rai L C, Mohn F H, et al. Studies on nitric oxide (NO) formation by the green alga Scenedesmus obliquus and the diazotrophic cyanobacterium Anabaena doliolum[J]. Chemosphere, 1999, 39(10): 1601-1610. DOI:10.1016/S0045-6535(99)00058-2 |
| [22] |
Mallick N, Mohn L C, Soeder C J. Evidence for the non-involvement of nitric oxide synthase in nitric oxide production by the green alga Scenedesmus obliquus[J]. Journal of Plant Physiology, 2000, 156(3): 423-426. DOI:10.1016/S0176-1617(00)80084-X |
| [23] |
Meyer C, Lea U S, Provan F, et al. Is nitrate reductase a major player in the plant NO (nitric oxide) game?[J]. Photosynthesis Research, 2005, 83(2): 181-189. DOI:10.1007/s11120-004-3548-3 |
| [24] |
Thompson P A, Guo M, Harrison P J, et al. Effects of variation in temperature on the fatty acid composition of eight species of marine phytoplankton[J]. Journal of Phycology, 1992, 28(4): 488-497. DOI:10.1111/j.0022-3646.1992.00488.x |
| [25] |
Reay D S, Nedwell D B, Priddle J, et al. Temperature dependence of inorganic nitrogen uptake: reduced affinity for nitrate at suboptimal temperatures in both algae and bacteria[J]. Applied & Environmental Microbiology, 1999, 65(6): 2577-2584. |
| [26] |
Whalen S C, Alexander V. Influence of temperature and light on rates of inorganic nitrogen transport by phytoplankton in an arctic lake[J]. Canadian Journal of Fisheries & Aquatic Sciences, 1984, 41(9): 1310-1318. |
| [27] |
陈芸燕, 孙晓霞, 朱明亮. 基于浮游植物流式细胞仪对胶州湾春季浮游植物的研究[J]. 海洋科学, 2017, 41(6): 72-78. Chen Yunyan, Sun Xiaoxia, Zhu Mingliang. High resolution analysis of Jiaozhou Bay phytoplankton community structure based on automated submerged flow cytometer during spring[J]. Marine Sciences, 2017, 41(6): 72-78. |
| [28] |
Lomas M W, Glibert P M. Temperature regulation of nitrate uptake: A novel hypothesis about nitrate uptake and reduction in cool-water diatoms[J]. Limnology & Oceanography, 1999, 44(3): 556-572. |
| [29] |
Lomas M W, Glibert P M. Interactions between NH4+ and NO3– uptake and assimilation: comparison of diatoms and dinoflagellates at several growth temperatures[J]. Marine Biology, 1999, 133(3): 541-551. DOI:10.1007/s002270050494 |
| [30] |
Olasehinde E F, Takeda K, Sakugawa H. Development of an analytical method for nitric oxide radical determination in natural waters[J]. Analytical Chemistry, 2009, 81(16): 6843-6850. DOI:10.1021/ac901128y |
| [31] |
Ouyang Z R, Wen X B, Geng Y H, et al. The effects of light intensities, temperatures, pH and salinities on photosynthesis of Chlorella[J]. Journal of Wuhan Botanical Research, 2010, 28(1): 49-55. |
| [32] |
Eppley R W. Temperature and phytoplankton growth in the sea[J]. Fishery Bulletin, 1972, 70(4): 1063-1085. |
| [33] |
Bonggil H, Keunhyung C, Pungguk J, et al. Effects of increased CO2 and temperature on the growth of four diatom species (Chaetoceros debilis, Chaetoceros didymus, Skeletonema costatum and Thalassiosira nordenskioeldii) in laboratory experiments[J]. Journal of Environmental Science International, 2014, 23(6): 1003-1012. DOI:10.5322/JESI.2014.23.6.1003 |
| [34] |
Lancaster J R. A tutorial on the diffusibility and reactivity of free nitric oxide[J]. Nitric Oxide, 1997, 1(1): 18-30. DOI:10.1006/niox.1996.0112 |
| [35] |
Vanderkooi J M, Wright W W, Erecinska M. Nitric oxide diffusion coefficients in solutions, proteins and membranes determined by phosphorescence[J]. Biochim Biophys Acta, 1994, 1207(2): 249-254. DOI:10.1016/0167-4838(94)00073-5 |
| [36] |
Sakihama Y, Nakamura S, Yamasaki H. Nitric oxide production mediated by nitrate reductase in the green alga Chlamydomonas reinhardtii: an alternative NO production pathway in photosynthetic organisms[J]. Plant & Cell Physiology, 2002, 43(3): 290-297. |
| [37] |
Sandnes J M, Kallqvist T, Wenner D, et al. Combined influence of light and temperature on growth rates of Nannochloropsis oceanica: linking cellular responses to large-scale biomass production[J]. Journal of Applied Phycology, 2005, 17(6): 515-525. DOI:10.1007/s10811-005-9002-x |
| [38] |
戴爱泉, 石晓勇, 丁雁雁, 等. 温度对旋链角毛藻(Chaetoceros curvisetus)和米氏凯伦藻(Karenia mikimotoi)生长及硝酸还原酶活力的影响[J]. 生物化学与生物物理进展, 2014, 41(9): 896-903. Dai Aiquan, Shi Xiaoyong, Ding Yanyan, et al. Effect of temperature on the growth and nitrate reductase activity of Chaetoceros curvisetus and Karenia mikimotoi[J]. progress in Biochemistry and Biophysics, 2014, 41(9): 896-903. |
| [39] |
Venturini G, Colasanti M, Fioravanti E, et al. Direct effect of temperature on the catalytic activity of nitric oxide synthases types Ⅰ, Ⅱ, and Ⅲ[J]. Nitric Oxide, 1999, 3(5): 375-382. DOI:10.1006/niox.1999.0250 |
| [40] |
林彩, 孙秀武, 林辉, 等. 不同水温、pH条件下一氧化氮对中肋骨条藻生长的影响[J]. 应用海洋学学报, 2009, 28(4): 492-495. Lin Cai, Sun Xiuwu, Lin Hui, et al. Nitric oxide effect on the growth of Skeletonema costatum at different water temperature and pH[J]. Journal of Applied Oceanography, 2009, 28(4): 492-495. |
 2019, Vol. 43
2019, Vol. 43


