文章信息
- 周爽男, 蒋霞敏, 吕腾腾, 彭瑞冰, 韩庆喜. 2019.
- ZHOU Shuang-nan, JIANG Xia-min, LV Teng-teng, PENG Rui-bing, HAN Qing-xi. 2019.
- 头足类眼睛的研究综述
- Review of the research on the cephalopod eye
- 海洋科学, 43(11): 111-119
- Marine Sciences, 43(11): 111-119.
- http://dx.doi.org/10.11759/hykx20190417004
-
文章历史
- 收稿日期:2019-04-17
- 修回日期:2019-05-21
头足类是软体动物门的重要组成部分, 被联合国粮农组织确定为人类未来重要的蛋白质来源, 资源蕴藏量大, 在世界海洋捕捞业中的地位越来越重要。它们位居海洋营养级金字塔的中层, 具有承上启下的作用, 在世界海洋生态系统中扮演着非常重要的角色[1-2]。头足类主要包括乌贼(Sepiidae)、枪乌贼(Loliginidae)、柔鱼(Ommastrephidae)、蛸(Octopodidae)四大类, 全部海产, 大部分都生命周期短(通常为1年), 世代更新快, 生长迅速、种类较多, 种群结构也较为复杂[3]。头足类的眼睛为头部的重要结构, 是头足类信息交换和传导的重要介质, 与耳石、内壳、角质颚、齿舌等其他组织一样, 具有相对的稳定性, 因此也是分类学上的重要组织。通过对头足类视觉系统的研究, 对于拓展头足类的基础生物学知识, 探究头足类的栖息、洄游和摄食等生活史信息, 以及保护、合理开发头足类资源有着重要的意义。
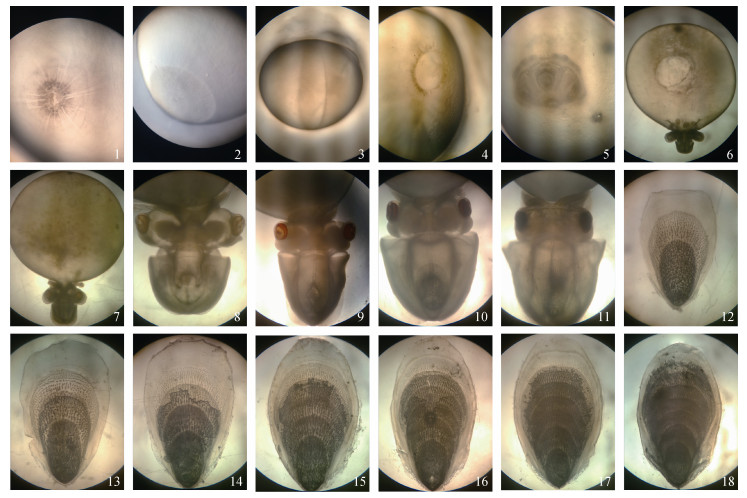
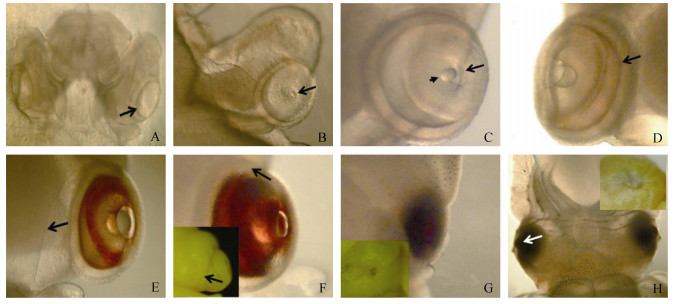
1 头足类的眼睛 1.1 头足类胚胎发育过程中眼睛的形成不同于一些水生脊椎动物在孵化时眼睛的视觉性能较差, 之后在整个生命过程中不断发育完善, 头足类眼睛的视觉性能在胚胎发育过程中就已经逐渐形成。有研究表明, 头足类刚孵化出时生长速度极快, 对营养有巨大的需求, 因此在胚胎发育时眼睛就已经逐渐发育完善, 并具备了良好的视觉能力, 而且在胚胎发育时就已经开始对周围环境进行预先观察, 为的是稚体孵出时能尽快的捕获开口饵料进行摄食以供生长需要[4-6]。例如虎斑乌贼(Sepia pharaonis), 眼睛主要在胚胎发育的中期(胚体形成期—色素形成期)形成(图 1)[7], 当初孵乌贼一破膜便能捕捉猎物。虎斑乌贼在胚胎发育过程中眼睛的形成主要有8个较为显著的特点: ①半透明的环状视囊(箭头所示)初现(图 2A); ②视囊中心的虹膜隔膜(箭头所示)开始发育(图 2B); ③晶状体(短箭头所示)和虹膜(长箭头所示)形成(图 2C); ④虹彩光圈(箭头所示)出现(图 2D); ⑤视网膜颜色逐渐加深, 角膜(箭头所示)持续覆盖眼球(图 2E); ⑥视网膜颜色持续加深, 角膜(箭头所示)发育完全(图 2F); ⑦眼球被角膜完全覆盖住, 整个眼睛变为暗红色(图 2G); ⑧晶状体(箭头所示)向眼眶突出, 整个眼睛变成黑色(图 2H)[8]。
头足类的眼睛位于头部的两侧, 绝大多数种类眼睛晶体侧视, 因此双眼视野重叠的角度很小, 这使得它们能及时发现两侧和身后的猎物及捕食者, 极少数种类晶体突出前视, 如深海乌贼(Bathyteuthis abyssicola)[9]。眼睛通常不具柄, 但不少种类幼体时期具眼柄, 到成体时逐渐消失, 且眼睛向腹部突出, 如小头乌贼科(Cranchiidae)多数种类[10], 更有些种类早期个体发育过程中眼睛形态不断变化, 如履乌贼(Sandalops melancholicus)的眼睛有从“履形—管形—半球形”的巨大变化[11]。头足类的眼睛通常左右对称, 不同的种类眼睛的大小有很大区别, 乌贼的眼睛很大, 直径与头长相近, 枪乌贼, 柔鱼和蛸的眼睛相对较小[12]; 但是帆乌贼科(Histioteuthidae)种类有一对大小眼, 它们左眼明显较右眼大, 左眼半管状, 主要用来过滤蓝光, 观察较明亮处区域, 而右眼半球形, 不过滤各色光线, 主要观察黑暗区域[13]。
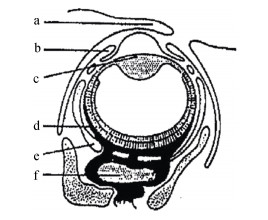
1.3 头足类眼睛的内部结构头足类具有一对发达的眼睛, 结构复杂, 属于典型的“相机型”眼, 与脊椎动物类似, 但两者在胚胎发生中有较大差异, 并非是同源的[14], 因此被认为是趋同进化的结果[15]。头足类眼睛最前面为透明的角膜, 控制眼球与外界的相通, 具有保护眼球, 防止眼球直接接触海水的作用(其中柔鱼类和鹦鹉螺无角膜, 为开眼类)。角膜后为透明的晶状体, 是屈光的主要部位, 具有折射光线的作用, 通常为球状或椭球状, 晶状体的两侧有睫状肌牵引, 其前缘两侧还有虹膜, 虹膜可调节瞳孔的大小, 控制进光量[16]; 头足类各生物的瞳孔在形态上各不相同, 柔鱼类生物的瞳孔呈现出一条矩形的缝隙, 多数乌贼类的瞳孔是呈现类似于字母“W”, 少数乌贼科种类的瞳孔呈字母“U”形或波浪形, 而枪乌贼类的瞳孔跟人类的瞳孔相似, 近似圆形[17-18]。虹膜下缘为巩膜, 起保护整个眼球的作用[19]。晶状体后为玻璃液所填充, 玻璃液是一种极具黏性的胶状液体, 具有辅助屈光和固定视网膜位置的作用[20]。眼球的底部为视网膜, 是产生视觉的部位, 形成物像, 由含有色素的杆状细胞组成, 视网膜外为视神经[21]。视信息在视网膜上生成神经冲动, 通过视神经上的视路将信息传递至头足类大脑(图 3)[22-23]。但与其他头足类不同的是, 鹦鹉螺为环状空腔眼, 缺少晶状体, 结构原始, 仅具眼囊、杆状体层、色素细胞层和网膜细胞层等, 它们依靠该针孔大小的空腔眼, 通过小孔成像的原理形成视觉, 因此鹦鹉螺眼睛的功能类似于针孔相机, 视觉分辨率和成像效果都很差, 它们看到的只是一个昏暗的世界。但鹦鹉螺并不仅仅依靠视觉, 更多的利用嗅觉作为觅食的基本感觉[24]。
头足类是无脊椎动物界眼睛进化程度最高的动物, 已经分化出了具有完善的折光与感光系统的眼睛。头足类眼球的晶状体为球形晶状体, 相当于透镜, 通常来说, 球形透镜无法使穿过的光线聚焦于一点上, 因此产生的图像是模糊的, 而矫正的唯一方法就是将落于晶状体表面不同地方的光线分别进行不同程度的弯曲。头足类眼球的晶状体由一种名叫S-晶体蛋白(S-crystallin)的蛋白质组成, 这种蛋白质起源于谷胱甘肽S-转移酶(GST)蛋白家族[25], 是进化过程中经过定向选择的产物[26]。S-晶体蛋白特有一对担任蛋白粘连部位的肽环, 同时和其他S-晶体蛋白的肽环相互吸引。在头足类胚胎发育阶段, S-晶体蛋白分子以每六个为一单位聚集起来凝胶形成蛋白团, 之后随着蛋白团的增加, 凝胶密度越来越大, 直到连较小的微粒都难以渗透出来时, 就会形成一种新的每个单位少于六个S-晶体蛋白的蛋白质膜, 这就构成了致密的晶状体内核, 即晶状体的中央部分。接着沿着晶状体内核发散出去的S-晶体蛋白分子的连接方式变得逐渐稀疏简单, 呈现径向递减的趋势, 一直持续到最外层为止, 在最外层, S-晶体蛋白分子仅仅两两相连形成晶状体的外层, 此时整个的凸透镜也就发育完全了——中间最密, 边缘稀疏[27]。这种晶状体密度的径向变化使得穿过透镜中心与边缘的光的弯曲方式不同(折射率呈梯度变化), 因此本来模糊的图像就可以聚焦清楚[28]。头足类眼睛的调焦方式和脊椎动物不同, 脊椎动物对不同距离物体的焦距调节是以改变整个晶状体的曲度来完成的, 而头足类则通过调整眼球和视网膜之间的距离来完成, 如同照像机转动镜头一般[29]。通过以上发现, 一般认为头足类眼睛的晶状体可以逐渐用简单的材料复制, 从而用于光学仪器研究和临床诊治。
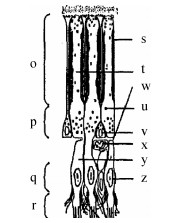
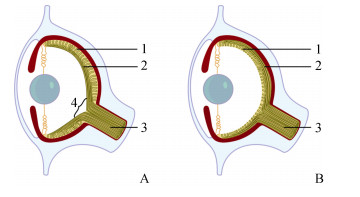
1.5 头足类眼睛的视网膜头足类视觉成像的位置在视网膜, 视网膜由头足类头部区域的外胚层内陷发育而来, 主要由感光细胞、支持细胞和神经胶质细胞组成[30]。和脊椎动物相比, 头足类视网膜结构分化相对简单, 被认为是研究视网膜比较生理学的极佳材料[31]。头足类视网膜主要分为四层, 由外向内依次为感杆层、黑色色素层、视细胞核层和神经纤维层[32]。其中在感杆层上分布有能感知光照强弱的圆柱形的视感细胞, 不同头足类感杆层上分布的视感细胞的密度和排列顺序并不一样, 即使是同种头足类, 在不同生长时期感杆层上的视感细胞的密度和排列顺序也会发生变化, 因此同种头足类不同发育时期, 不同头足类之间的视敏度均不同。但和脊椎动物相比, 头足类感杆层上缺少能辨别光色的圆锥形的视锥细胞, 所以一般认为头足类为色盲, 但它们又具有相当敏锐的对比视觉, 视网膜上的视感细胞数量极多, 达10×104 cell/mm2以上, 可媲美大部分的脊椎动物, 同时对光照强弱也极为敏感[33-34]。黑色色素层上分布有大量的黑色色素颗粒, 黑色色素颗粒可以在感杆层中上下移动, 当光线过强时可用来遮蔽视细胞, 调节视觉感度。视细胞核层中有大量的视细胞的细胞核, 且细胞核有向神经纤维层挤压的趋势。神经纤维层为视网膜的最底层, 视细胞的树突状络蔓延伸至此, 同时长的轴突纤维继续向里延伸而生成视神经, 因此神经纤维层为光信号转换为视神经传播信号的部位(图 4)[35-36]。此外, 脊椎动物的视网膜是反向的, 其感光细胞位于视网膜的反面。光要穿过整个视网膜才能到达感光细胞, 使成像变得模糊; 头足类的视网膜是正向的, 它们的感光细胞位于视网膜的最前面, 神经位于感光细胞后面, 因此头足类没有盲点。从这些意义上来说, 头足类视网膜的层次结构更为合理, 而脊椎动物的视网膜层次分布顺序颠倒而无益, 且可能出现盲点、感光能力略低、视网膜脱落、眼底出血等问题(图 5)[37]。同时头足类视网膜上还有两个集中的传感器细胞点, 称为中央凹(fovea centralis), 一个向前, 另一个向后, 这使得它们能同时观察到前方和后方的情况[38]。
头足类视网膜内含有两种用于光接收的光敏色素, 感杆层中视细胞外节(outer segment)的光敏色素组成是视紫红质, 视细胞内节(inter segment)的髓磷脂小体膜上, 是视网膜色素[39]。视紫红质的光谱吸收峰值在475~500 nm, 视网膜色素为490~522 nm, 依种类不同会存在差异[20]。表 1列举了一些常见头足类的视紫红质与视网膜色素的吸收峰值[40], 对于同一种头足类, 视网膜色素的吸收峰值比视紫红质的吸收峰值向长波段方向移动了15~20 nm, 但这并不意味着头足类具有感知色觉的能力。视紫红质和视网膜色素都为色素蛋白, 这两种色素通过不断地光解、漂白和再生参与视色素循环过程, 因此两者具有相辅相成的功能[41]。但也有一个特例, 在荧光乌贼(Watasenia scintillans)的视网膜上具有以4-羟基视黄醛作为生色团的第三种光敏色素, 荧光乌贼作为头足类中唯一被证明有彩色视觉的生物, 因此科学家们推测这第三种光敏色素可能跟其具备区分光谱的能力有关[42-43]。
| 种类 | 太平洋褶柔鱼 (Ommastrephes sloani pacificus) |
金乌贼 (Sepia esculenta) |
曼氏无针乌贼 (Sepiella japonica) |
真蛸 (Octopus vulgaris) |
短蛸 (Octopus ocellatus) |
| 视紫红质 | 480 | 486 | 500 | 475 | 477 |
| 视网膜色素 | 495 | 508 | 522 | 490 | 490 |
虽然头足类眼睛的结构和视觉机能在胚胎时期就已经发育完全, 但在其整个生活史中眼睛对光的视敏度依然会有很大改变。在头足类早期阶段, 主要生活在较明亮、浅水区的水域, 对营养有巨大的需求, 此时其已经具有良好的视敏度, 并且此时的眼睛直径与胴长的比值较大, 尤其是一些乌贼类, 眼睛直径接近于头长, 这就保证了苗种时期的头足类能尽快的捕获猎物, 以供生长之需。之后随着头足类个体的生长, 在水中的活动范围逐渐向下迁移, 眼睛直径逐渐变大, 并伴随着视网膜和感杆层面积的增大, 同时感杆层上的视感细胞会不断增加和变大导致感杆层加厚和视感细胞越来越致密, 如玻璃乌贼(Teuthowenia pellucida)的感杆层厚度占整个视网膜厚度的比例由早期的50%增加到了成熟时期的89%~97%, 因此视网膜的视敏度也逐渐提高[44]。因此, 头足类生活史中该视敏度的变化趋势和其生活环境的变化相适应, 成体的头足类则已经迁移至更暗、更深的水域, 但同时也已经具备了非常高的视敏度用以发现、感知和吸收深海中的微光及生物发光, 进而促进其捕食, 避敌和进行种内之间的相互交流[45]。
3 头足类对偏振光的感知偏振敏感度, 即对线性偏振光的E矢量轴的敏感度。头足类的眼睛能够分辨偏振光的方向, 这种敏感性来源于它们视网膜上独特的视感细胞上的微绒毛排列方式。脊椎动物视网膜上的视感细胞和视锥细胞上的微绒毛的排列方式是半随机的, 当任何的偏振光进入眼睛时, 偏振光的E矢量轴及传播方向(偏振光的E矢量轴和传播方向相互垂直)都无法与感杆上微绒毛的方向完全一致, 因此对光的偏振差异不敏感, 而头足类眼睛视网膜上的视感细胞上微绒毛呈正交排列, 当视感细胞上微绒毛方向与偏振光的E矢量轴方向及传播方向正确对齐时, 头足类就具有最高的光吸收度, 从而允许对光的偏振差异产生敏感性[46-48]。目前对头足类该功能的确切作用尚未得到证实, 但据推测, 该功能可用于定位、导航, 识别隐藏或伪装的猎物, 并可能帮助头足类之间进行交流[49-50]。
4 头足类的趋光性大部分头足类喜弱光怕强光, 具有一定的趋光性。郑美丽等在研究曼氏无针乌贼(Sepiella maindroni)的趋光特性时, 通过电生理法测定其视网膜电图, 发现其属于趋弱光类型[51]; 何大仁等观察杜氏枪乌贼(Uroteuthis duvaucelii)趋光行为中表明其适宜的光照范围为0.1-1 Lx[52]; 王萍等发现真蛸(Octopus vulgaris)对三种不同光强(200、1300、2100 Lx)都有反应, 而且都表现出正趋性[53]。一般认为在强光下, 头足类活动激烈, 群体分散逃逸; 而在弱光下, 头足类活动较为稳定, 群体集中趋前。但不同头足类趋光性的强弱有所差异, 柔鱼科、枪乌贼科的趋光性强于乌贼科, 它们的适宜光照强度为0.1~10 Lx。这种不同的趋光性, 不仅与它们的栖息环境有关, 而且与视感细胞的数量有联系, 柔鱼科和枪乌贼科的眼睛视网膜上的视感细胞数目约为16×104 cell/mm2, 而乌贼科眼睛视网膜上的视感细胞数目约为10×104 cell/mm2[54]。头足类的趋光行为也会受到月相的影响, 在自然海区, 月暗之夜, 背景光弱, 光诱效果好; 月明之夜, 背景光强, 则会降低人工光源照明的强度, 因此光诱效果被抵消了。从总的情况来看, 月明时光诱的捕获量一般低于月暗时。头足类趋光的意义, 主要是追逐为灯光诱集的沙丁鱼、磷虾和其他大型浮游动物, 进行捕食。但渔民也是充分利用头足类的该趋光性来进行围网光诱, 通过配置不同的光源设备和调整不同的光照强度来提高光诱产量。
5 头足类的眼外光感受器头足类除了眼睛这一光感受器之外, 还有一种起辅助作用的眼外光感受器——感光囊(photosensitive vesicles), 感光囊位于头足类的眼睛后面, 靠近嗅叶的位置, 呈浅橙色, 通常由4至5个感光囊泡组成, 单个感光囊泡直径为200~500 μm, 具有很精确的感光性[55]。海洋中由于进入的光照较少, 是一个昏暗的环境, 当上方的光照照射下来, 头足类在水中游动时由于身形遮挡住部分照射下来的微光, 就会产生影子暴露而极易成为被捕食的对象, 因而头足类已经进化出了发光器, 发光器发出的光可以弥补由于身形遮挡住的微光, 使生物发光和周围光照融为一体, 从而形成一个生光消影(Counter-illumination)的假象, 也就不会轻易暴露[56]。而在此过程中感光囊主要用于探测周围环境光的强度, 然后反馈至头足类的大脑, 使头足类发光器发出相同强度的光照, 同时头足类的感光囊也能探测到自身发光器发出的光照, 当头足类所处的环境光照强度发生变化时, 自身发光器发出的光照与周围的环境光就会出现差异, 感光囊便会反馈大脑调整发光器发光的强度。目前常见大部分的头足类和鱼类都能通过感光囊和发光器来生光消影, 从而来伪装避敌[57]。
6 总结与展望头足类作为高级进化的软体动物, 具有发达的眼睛。通过研究头足类眼睛的结构和视觉特征, 对于了解它们的生活习性和在不同时期的生态适应性, 以及对于其作为动物分类学研究的依据具有重要意义。头足类的眼睛视网膜上并没有能感知光色的视锥细胞, 因此头足类是色盲, 这一点和低等无脊椎动物相同; 但头足类视网膜上分布密集的视感细胞使得它们对光照极为敏感, 以及它们的“相机型”眼, 这些又和高等脊椎动物相似; 而不存在盲点、对偏振光的感知等特点则优于高等脊椎动物。因此, 同它们在动物进化学上的分类地位一样, 头足类的眼睛也处于动物由低等进化到高等的一个过渡型的地位。就目前对于头足类眼睛的研究程度上, 头足类眼睛已经可以初步应用于头足类在科的分类水平上, 若要细化至属、种水平, 则还需加强对它们细微结构的分析、提炼和归纳。在以后的研究中, 应当在现有的基础上, 尽快建立世界各大洋、各海区头足类眼睛分类特征的检索, 这将为以后世界头足类的分类及其管理与合理开发提供一个基础资料。
| [1] |
宋旻鹏, 汪金海, 郑小东. 中国经济头足类增养殖现状及展望[J]. 海洋科学, 2018, 42(3): 149-156. Song Minpeng, Wang Jinhai, Zheng Xiaodong. Present situation and prospect of economic cephalopod aquaculture in China[J]. Marine Sciences, 2018, 42(3): 149-156. |
| [2] |
Clarke M R. The role of cephalopods in the world's oceans: general conclusion and the future[J]. Philosophical Transactions Biological Sciences, 1996, 351(1343): 1105-1112. |
| [3] |
吴强, 王俊, 李忠义, 等. 黄海中南部头足类的群落结构与生物多样性[J]. 海洋科学, 2015, 39(8): 16-23. Wu Qiang, Wang Jun, Li Zhongyi, et al. The community structure and biodiversity of cephalopoda in central and southern Yellow Sea[J]. Marine Sciences, 2015, 39(8): 16-23. |
| [4] |
Wells M J. Factors affecting reactions to mysis by newly hatched sepia[J]. Behaviour, 1958, 13(1/2): 96-111. |
| [5] |
Groeger G, Chrachri A, Williamson R. Changes in cuttlefish retinal sensitivity during growth[J]. Vie Et Milieu-Life and Environment, 2006, 56(2): 167-173. |
| [6] |
Darmaillacq A S, Lesimple C, Dickel L, et al. Embryonic visual learning in the cuttlefish, Sepia officinalis[J]. Animal Behaviour, 2008, 76(1): 131-134. |
| [7] |
周爽男, 吕腾腾, 陈奇成, 等. 光照强度与光周期对虎斑乌贼胚胎发育的影响[J]. 应用生态学报, 2018, 29(6): 2059-2067. Zhou Shuangnan, Lv Tengteng, Chen Qicheng, et al. Effects of light intensity and photoperiod on the embryonic development of Sepia pharaonis[J]. Chinese Journal of Applied Ecology, 2018, 29(6): 2059-2067. |
| [8] |
Lee M F, Lin C Y, Chiao C C, et al. Reproductive behavior and embryonic development of the pharaoh cuttlefish, Sepia pharaonis (Cephalopoda: Sepiidae)[J]. Zoological Studies, 2016, 55(41): 41-57. |
| [9] |
Roper C F E. Preliminary descriptions of two new species of the bathypelagic squid Bathyteuthis (Cephalopoda: Oegopsida)[J]. Proceedings of the Biological Society of Washington, 1968, 81: 161-172. |
| [10] |
Herring P J, Dilly P N, Cope C. The photophores of the squid family Cranchiidae (Cephalopoda: Oegopsida)[J]. Journal of Zoology, 2002, 258(1): 73-90. |
| [11] |
Young R E. Transitory eye shapes and the vertical distribution of two midwater squids[J]. Pacific Science, 1975, 29(3): 243-255. |
| [12] |
陈新军, 刘必林, 王尧耕. 世界头足类[M]. 北京: 海洋出版社, 2009: 17. Chen Xinjun, Liu Bilin, Wang Yaogeng. Cephalopods of the World[M]. Beijing: China Ocean Press, 2009: 17. |
| [13] |
Thomas K N, Robison B H, Johnsen S. Two eyes for two purposes: in situ evidence for asymmetric vision in the cockeyed squids Histioteuthis heteropsis and Stigmatoteuthis dofleini[J]. Philosophical Transactions of the Royal Society of London, 2017, 372(1717): 1-9. |
| [14] |
Packard A. Cephalopods and fish: the limits of convergence[J]. Biological Reviews, 1972, 47(2): 241-307. |
| [15] |
Fernald R D. Casting a genetic light on the evolution of eyes[J]. Science, 2006, 313(5795): 1914-1918. |
| [16] |
刘凌云, 郑光美. 普通动物学[M]. 第四版. 北京: 高等教育出版社, 2009: 218-219. Liu Lingyun, Zheng Guangmei. General zoology[M]. 4th ed. Beijing: Higher Education Press, 2009: 218-219. |
| [17] |
Schaeffel F, Murphy C J, Howland H C. Accommodation in the cuttlefish (Sepia officinalis)[J]. Journal of Experimental Biology, 1999, 202(22): 3127-3134. |
| [18] |
Murphy C J, Howland H C. The functional significance of crescent-shaped pupils and multiple pupillary apertures[J]. Journal of Experimental Zoology, 1990, 256(5): 22-28. |
| [19] |
Budelmann B U. Cephalopod sense organs, nerves and the brain: adaptations for high performance and life style[J]. Marine Behaviour and Physiology, 1995, 25(1/3): 13-33. |
| [20] |
钱卫国.鱿钓渔业中集鱼灯的优化配置研究[D].上海: 上海海洋大学, 2005. Qian Weiguo. Study on the optimal allocation of fish aggregation lamps in squid jigging fisheries[D]. Shanghai: Shanghai Ocean University, 2005. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y773292 |
| [21] |
Borradaile L A, Potts F A. The invertebrata: a manual for the use of students[J]. Quarterly Review of Biology, 1959, 34(2): 156-157. |
| [22] |
邬云鹏. 3种枪形目鱿鱼的视细胞分布和其视觉机能关系的相关研究[D].舟山: 浙江海洋大学, 2016. Wu Yunpeng. Studies on topographical distribution of rhabdom in the retinato estimate the visual function of three species of Teuthida[D]. Zhoushan: Zhejiang Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10340-1017015604.htm |
| [23] |
Stewart D E. The eye in evolution[M]. London: Henry Kimpton Publisher, 1958: 144.
|
| [24] |
董正之. 中国动物志, 软体动物门, 头足纲[M]. 北京: 科学出版社, 1988: 4. Dong Zhengzhi. Fauna Sinica, Mollusca, Cephalopods[M]. Beijing: Science Press, 1988: 4. |
| [25] |
Tomarev S I, Zinovieva R D, Piatigorsky J. Characterization of squid crystallin genes. Comparison with mammalian glutathione S-transferase genes[J]. Journal of Biological Chemistry, 1992, 267(12): 8604-8612. |
| [26] |
Sweeney A M, Des Marais D L, Ban Y E, et al. Evolution of graded refractive index in squid lenses[J]. Journal of the Royal Society Interface, 2007, 4(15): 685-698. |
| [27] |
Cai J, Townsend J P, Dodson T C, et al. Eye patches: protein assembly of index-gradient squid lenses[J]. Science, 2017, 357(6351): 564-569. |
| [28] |
Sweeney A M, Marais D L. Evolution of graded refractive index in squid lenses[J]. Journal of the Royal Society Interface, 2007, 4(15): 685-698. |
| [29] |
Yamamoto M. Ontogeny of the visual system in the cuttlefish, Sepiella japonica. Ⅰ. Morphological differentiation of the visual cell[J]. Journal of Comparative Neurology, 1985, 232(3): 347-361. |
| [30] |
Newth D R. The anatomy of the nervous system of Octopus vulgaris[J]. Journal of Neurology Neurosurgery and Psychiatry, 1981, 35(5): 65-102. |
| [31] |
Blaxter J H S, Jones M P. The development of the retina and retinomotor responses in the herring[J]. Journal of the Marine Biological Association of the United Kingdom, 1967, 47(3): 677-697. |
| [32] |
Zonana H. Fine structure of the squid retina[J]. Bulletin of the Johns Hopkins Hospital, 1961, 109: 185-205. |
| [33] |
Yamamoto M, Takasu N. Membrane particles and gap junctions in the retinas of two species of cephalopods, Octopus ocellatus and Sepiella japonica[J]. Cell and Tissue Research, 1984, 237(2): 209-218. |
| [34] |
Tonosaki A. The fine structure of the retinal plexus in Octopus vulgaris[J]. Zeitschrift fur Zellforschung, 1965, 67(4): 521-532. |
| [35] |
Young J Z. The retina of cephalopods and its degeneration after optic nerve section[J]. Philosophical Ttransactions of the Royal Society of London. Series B, Biological Sciences, 1962, 245(718): 1-18. |
| [36] |
Yamamoto T, Tasaki K, Sugawara Y, et al. Fine structure of the octopus retina[J]. Journal of Cell Biology, 1965, 25(2): 345-359. |
| [37] |
Gregory T R. The evolution of complex organs[J]. Evolution Education and Outreach, 2008, 1(4): 358-389. |
| [38] |
Young J Z. Light and dark adaptation in the eyes of some cephalopods[J]. Proceedings of the Zoological Society of London, 1963, 140(2): 255-272. |
| [39] |
Hara T, Hara R. New photosensitive pigment found in the retina of the squid Ommastrephes[J]. Nature, 1965, 206(4991): 1331-1334. |
| [40] |
Hara T, Hara R, Takeuchi J. Vision in octopus and squid: rhodopsin and retinochrome in the octopus retina[J]. Nature, 1967, 214(5088): 573-575. |
| [41] |
蔡浩然, 马万禄. 视觉的分子生理学基础[M]. 北京: 科学出版社, 1978: 101. Cai Haoran, Ma Wanlu. Molecular physiological basis of vision[M]. Beijing: Science Press, 1978: 101. |
| [42] |
Matsui S, Seidou M, Uchiyama I, et al. 4-Hydroxyretinal, a new visual pigment chromophore found in the bioluminescent squid, Watasenia scintillans[J]. Biochimica et Biophysica Acta (BBA) -General Subjects, 1988, 966(3): 370-374. |
| [43] |
Michinomae M, Masuda H, Seidou M, et al. Structural basis for wavelength discrimination in the banked retina of the firefly squid Watasenia scintillans[J]. Journal of Experimental Biology, 1994, 193(1): 1-12. |
| [44] |
Evans A B, Acosta M L, Bolstad K S, et al. Retinal development and ommin pigment in the cranchiid squid Teuthowenia pellucida (Cephalopoda: Oegopsida)[J]. Plos One, 2015, 10(5): 1-11. |
| [45] |
Hao Z L, Zhang X M, Kudo H, et al. Development of the retina in the cuttlefish Sepia esculenta[J]. Journal of Shellfish Research, 2010, 29(2): 463-470. |
| [46] |
Möthger L M, Shashar N, Hanlon R T. Do cephalopods communicate using polarized light reflections from their skin?[J]. Journal of Experimental Biology, 2009, 212(14): 2133-2140. |
| [47] |
Saidel W M, Lettvin J Y, Macnichol E F. Processing of polarized light by squid photoreceptors[J]. Nature, 1983, 304(5926): 534-536. |
| [48] |
Moody M F, Parriss J R. The discrimination of polarized light by Octopus: a behavioural and morphological study[J]. Journal of Comparative Physiology, 1961, 44(3): 268-291. |
| [49] |
Shashar N, Rutledge P, Cronin T. Polarization vision in cuttlefish in a concealed communication channel?[J]. Journal of Experimental Biology, 1996, 199(9): 2077-2084. |
| [50] |
Schwind R. Spectral regions in which aquatic insects see reflected polarized light[J]. Journal of Comparative Physiology A, 1995, 177(4): 439-448. |
| [51] |
郑美丽, 肖金华, 郑微云, 等. 曼氏无针乌贼的趋光特性[J]. 厦门大学学报:自然科学版, 1980, 19(3): 91-99. Zheng Meili, Xiao Jinhua, Zheng Weiyun, et al. Studies on the phototactic behaviour of cuttlefish (Sepiella maindroni de Rochebrune)[J]. Journal of Xiamen University: Natural Science, 1980, 19(3): 91-99. |
| [52] |
何大仁, 肖金华, 罗会明, 等. 杜氏枪乌贼趋光行为的研究[J]. 厦门大学学报:自然科学版, 1979(3): 99-104. He Daren, Xiao Jinhua, Luo Huiming, et al. Study on the phototactic behaviour of squid (Lollgo duvaucelii d'orbigny)[J]. Journal of Xiamen University: Natural Science, 1979(3): 99-104. |
| [53] |
王萍, 贾丽红, 桂福坤, 等. 光照对章鱼行为习性影响的研究[J]. 齐鲁渔业, 2009, 26(9): 3-6. Wang Ping, Jia Lihong, Gui Fukun, et al. Study on the influence of light on the behaviour of octopus[J]. Shandong Fisheries, 2009, 26(9): 3-6. |
| [54] |
董正之. 世界大洋经济头足类生物学[M]. 济南: 山东科学技术出版社, 1991: 27. Dong Zhengzhi. Economic Cephalopod Biology of The World Ocean[M]. Jinan: Shandong Science and Technology Press, 1991: 27. |
| [55] |
Perrelet A, Mauro A. Ultrastructurc of nerves associated with the epistellar body of the octopod Eledone moschata and the parolfactory vesicles of the squid Todarodes sagittatus[J]. Brain Research, 1972, 37: 161-171. |
| [56] |
Clarke W D. Function of bioluminescence in mesopelagic organisms[J]. Nature, 1963, 198(4887): 1244-1246. |
| [57] |
Young R E, Roper C F E, Walters J F. Eyes and extraocular photoreceptors in midwater cephalopods and fishes: Their roles in detecting downwelling light for counterillumination[J]. Marine Biology, 1979, 51(4): 371-380. |
 2019, Vol. 43
2019, Vol. 43