文章信息
- 方涛, 刘凯, 冯志华, 李游. 2019.
- FANG Tao, LIU Kai, FENG Zhi-hua, LI You. 2019.
- 春季海州湾临洪河口浮游植物粒级结构及环境因素
- Phytoplankton size structure and environmental factors in the Linhong estuary of Haizhou Bay
- 海洋科学, 43(12): 67-73
- Marine Sciences, 43(12): 67-73.
- http://dx.doi.org/10.11759/hykx20190528003
-
文章历史
- 收稿日期:2019-05-28
- 修回日期:2019-08-30
2. 华东师范大学 河口海岸学国家重点实验室, 上海 200062
2. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China
浮游植物根据其粒径大小可以分为微微型浮游植物(picophytoplankton, < 2 μm)、微型浮游植物(nanophytoplankton, 2 μm~20 μm)和小型浮游植物(microphytoplankton, 20 μm~200 μm), 微型和微微型浮游植物在大洋及外海水域是生物量和生产力的主要贡献者[1-3], 在海洋营养盐再生及碳循环中发挥相应的作用[4-8]。但以往其在河口生态系统中的重要作用并未得到重视, 认为个体大的浮游植物营养盐吸收速率明显高于个体小者, 因此前者在富营养化的河口具有更强的竞争力[9-11]。然而近年来有证据表明, 在特定季节和环境条件下, 微微型浮游植物也是富营养化河口水域生物量和生产力的主要贡献者[12-14], 如在美国北卡罗莱纳的Neuse河口大量的微微型浮游植物生长出现在春季, 夏季达到高峰, 其对叶绿素a的贡献率达到35%~44%, 对初级生产力的贡献率为42%~55%[12]。而在弗吉尼亚的York河口微微型的聚球藻(Synechococcus spp.)是浮游植物生物量的重要贡献者[10]。珠江口近岸海域在春季浮游植物的主要类群是小型和微型, 而在夏季则是微微型, 其丰度比春季高2个数量级[14]。
临洪河口是江苏连云港市主要入海河口, 近年来由于河口过流能力大幅度降低, 导致污水交换能力受到影响, 加上连云港港30万吨级航道工程建设和运行, 直接破坏或减少了水生生物赖以生存的栖息地, 进而影响到整个海州湾生态系统的结构和功能。浮游植物群体的粒径分布是海洋生态系统中的一个重要生物学因子, 目前国内有关浮游植物粒级结构的研究, 在台湾海峡、长江口、胶州湾、珠江口、东海和黄海等有大量的报道[15-18], 而海州湾很少, 本项目在海州湾临洪河口海域开展了大面调查, 分析浮游植物粒级结构(微微型、微型和小型)空间的分布变化以及与环境因子的相互关系, 旨在为临洪河河口海域生态环境变化及保护提供重要参考依据。
1 研究站位与方法 1.1 研究站位本研究于2017年4月通过租用连云港渔政船只在海州湾临洪河口附近进行了水样的采集工作, 样品采集依据临洪河口海域5条不同断面共预先设置了20个采样站位, 在实际调查中, 有4个采样点由于水深浅和紫菜养殖网的原因, 调查船无法靠近而被迫放弃, 本研究保留了其余的16个站点(图 1), 并对这些站位表层水的温度、盐度、pH、溶解氧、COD、悬浮物、浮游植物等进行了调查和分析。
 |
| 图 1 研究区域站位布设 Fig. 1 Geographic visualization of sampling stations |
水样的采集使用普通玻璃采水器, 由于临洪河口海域水深较浅, 水样以表层海水为主, 采样深度多为海面以下0.5 m左右。在采集水样的同时, 使用Eutech Salt6+便携式盐度测量仪对各站位的盐度、温度进行了测量并作记录; 使用雷磁JPB-607A型便携式溶解氧测定仪调查了各站点的溶解氧水平; OAKTON pHTestr 20型精密酸度计现场测定pH值(精度±0.01), 并根据情况进行温度校正; 悬浮物的测定采用重力法, 以0.45 μm的滤膜结合真空泵抽滤水样, 截留出原本悬浮在水中的固体物质, 最后经103℃~105℃的温度反复烘干至恒质量并称量。
1.2.2 浮游植物分级叶绿素分析本次调查对浮游植物粒级结构的研究采取叶绿素a粒级分级法。现场用量筒量取500 mL水样后, 用200 μm的筛绢和20、2、0.2 μm的核孔滤膜, 对其进行分级过滤, 以获取不同粒径的浮游植物:小型浮游植物(20 μm~200 μm, Micro级); 微型浮游植物(2 μm~ 20 μm, Nano级); 微微型浮游植物(0.2 μm~2 μm, Pico级)。现场过滤后, 滤膜折叠放入10 mL离心管中, 写上标签, 置于装有冰袋的保温盒里, 带回实验室后, 立即用90%丙酮溶液在4℃萃取24 h, 离心后的上清液在荧光分光光度计上测量(Hitachi F-2500)。方法参照《海洋调查规范海洋生物调查》GB12763.6- 91/11。
1.2.3 数据分析利用EXCEL软件制作浮游植物粒级叶绿素组成图; 使用sufer8软件制作等值线图; 相关性分析采用将原始数据汇集成表后, 导入到SPSS软件进行双变量相关分析以及Pearson法的双侧检验。
2 结果及讨论 2.1 临洪河口附近海域常规理化因子分布调查海域表层水盐度分布特征较为规律, 呈现从近岸到离岸逐渐升高的趋势, 其盐度平均值是35.2, 变化范围在31.5~36.6, 最高值和最低值分别出现在最内侧的S3号站位和最外侧的S16号站位, 沿岸河流入海口淡水的汇入导致附近海域盐度低于外海, 临洪河口附近有明显的低盐舌, 盐度沿陆源冲淡水的扩展方向而逐渐升高, 且在外海变化幅度逐渐趋缓(表 1, 图 2)。
| 项目 | 盐度 | 温度(℃) | 悬浮物(mg/L) | DO (mg/L) | pH | COD (mg/L) |
| 最大值 | 36.6 | 11.9 | 137.6 | 10.8 | 8.35 | 6.55 |
| 最小值 | 31.5 | 10.3 | 3.4 | 9.3 | 8.21 | 0.34 |
| 平均值 | 35.2 | 11.2 | 22.8 | 9.8 | 8.29 | 3.42 |
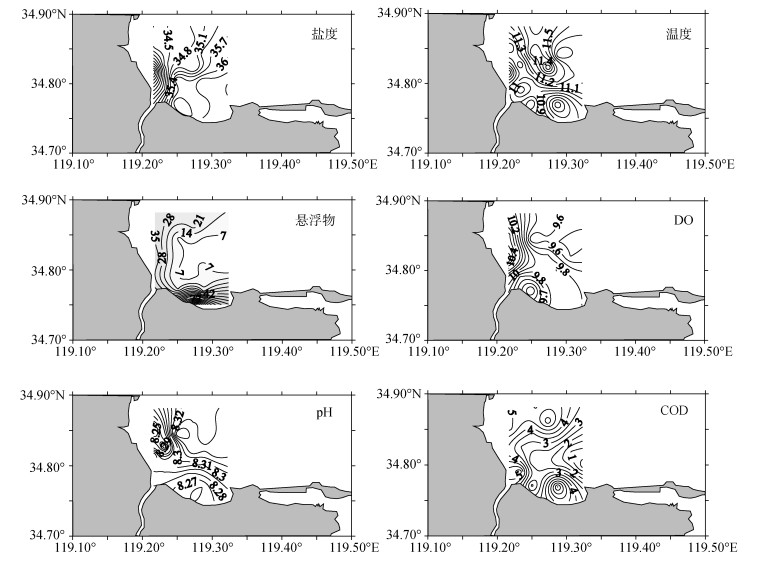 |
| 图 2 临洪河口附近海域盐度、温度、悬浮物、DO、pH、COD分布 Fig. 2 Distribution of salinity, temperature, suspended Solids, DO, pH and COD in Linhong estuary |
温度平均值约为11.2℃, 最高值为位于采样海区中部的S8号站位的11.9℃, 最低值为10.3℃, 出现在沿岸的S15号站位, 值得注意的是, 温度低于平均值的站点均位于河口附近及沿岸, 该海域温度的分布规律大致为近岸河口较低、外海较高, 近岸海水温度主要受到了陆地的影响, 因为此时陆地气温较海水(水的比热大)低, 由于热传导的效应, 越靠近陆地海水温度越低(表 1, 图 2)。
水中悬浮物含量是衡量水污染程度的指标之一。悬浮物是造成水浑浊的主要原因, 从而影响浮游植物光合作用和初级生产力。本次调查中临洪河口海域悬浮物浓度平均水平约为22.8 mg/L, 其中处于沿岸和河口的9个站点超过平均值, 最高值和最低值分别出现在S14号和S13号站位, 分别为137.6 mg/L和3.4 mg/L, 在近岸一侧水体的悬浮物含量较高, 而在远岸附近水体含量出现最小值, 且大体上呈现出随着与海岸线的距离增大, 其海水悬浮物显著下降, 水体逐渐清澈(表 1, 图 2)。
海洋水体中的溶解氧(DO)含量不仅仅是表明了该水体的溶解氧水平, 也是用来衡量海水的自净能力的标准, 同时它也反映了海洋生物在海水中的生长状况和海水的环境质量, 从整个调查海域来看, 溶解氧的分布基本表现为近入海口高, 远入海口低, 调查海区的西北部溶氧水平高于东南侧, 平均浓度为9.8 mg/L, 在距离临洪河口较近的S3号站位检测到最大溶氧浓度, 为10.8 mg/L, 河口另一侧的S10号站位却表现为最低, 为9.3 mg/L(表 1, 图 2)。
海水的pH值直接影响到海洋中各种各样元素的存在形态、形式以及它们在进行变化时所经历的过程, 也直接关系到海洋生物的生存环境, 临洪河口海域pH变化在8.21~8.35, 平均值为8.29, 符合海水弱碱性的特点, 离河口较远的外海域盐度升高, 离子强度也升高, 碳酸的电离度下降, 氢离子活度下降, 所以pH升高, 同时受陆地径流的影响, 淡水的酸碱性要比海水偏小一些, 河流入海时会使其周边水体的pH值稍低于距离河口较远的海域(表 1, 图 2)。
化学需氧量(COD)是评价水体有机污染程度的综合指标, 也是水质监测的一个重要参数。调查海域COD在0.34 mg/L~6.55 mg/L变化, 平均值为3.42 mg/L, 高值区位于出海口附近以及研究区域的北部, 而低值区位于研究海域的东部, 无明显分布规律(表 1, 图 2)。
2.2 临洪河口海域各粒级浮游植物叶绿素a分布调查海域微微型浮游植物的叶绿素a密度变化范围不大, 其含量平均值只有0.27 μg/L, 最高值出现在S13号站点(0.65 μg/L), 最低值出现在S2号站点(0.14 μg/L), 微微型叶绿素a浓度以S12、S13号站位为中心向周围逐渐递减, 中间高四周低, 大致呈现出河口附近海域相对较低的特征(图 3)。
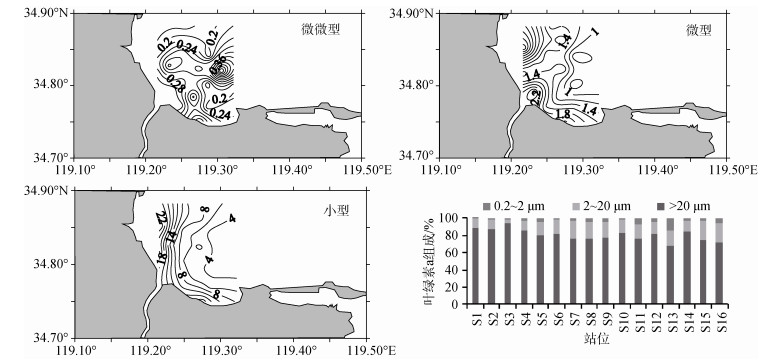 |
| 图 3 临洪河口附近海域微微型、微型和小型浮游植物叶绿素a分布及组成 Fig. 3 Distribution of picophytoplankton, nanophytoplankton, microphytoplankton and size structure near the Linhong estuary |
微型浮游植物的叶绿素a在分布上呈块状分布, 与微微型浮游植物的分布相比较, 其分布与微微型浮游植物的分布特点相反, 靠近河流入海口区域的浓度明显高于远离入海口区域, 其含量平均值和范围为1.48 μg/L(0.68 μg/L~3.13 μg/L), S1号站点的微型叶绿素a含量最高, 而S10号站点处为最低。从小范围来看, 微型浮游植物叶绿素a浓度在临洪河口处的分布相对较有规律, 随冲淡方向递减, 说明陆地径流对微型浮游植物分布的影响较为显著(图 3)。
小型浮游植物的分布在所有粒级的浮游植物中最为规律, 明显呈梯度式的近岸高远岸低的趋势, 与微型浮游植物叶绿素a浓度分布特点有一定的相似。其叶绿素a含量平均值为9.15 μg/L, 最高值同微型叶绿素a一样出现在S1号站点, 高达25.50 μg/L, 显著高于外部海区的站位, 临近外海的S9号、S16号站都远低于平均值, 最低值则出现在S16号站点, 为2.69 μg/L(图 3)。
小型浮游植物在各站位叶绿素a浓度粒级组成中占有绝对的优势, 对总叶绿素a的平均贡献率约为83.85%, 是主要贡献者。贡献率最高的5号站位高达94.65%, 最低的16号站位也达到了67.30%。其贡献率自沿岸河口至外部海域略有下降, 这种大粒径浮游植物占优势的程度在靠近外海的几个站位中稍有缓和(图 3)。
2.3 叶绿素a与环境因子的相关性通过对浮游植物样品的采集、分级分析, 并将原始数据汇集成表后, 导入到SPSS软件中进行各粒径浮游植物分布特征与各环境因子的相关性分析, 结果如表 2所示。
| 环境因子 | 小型浮游植物叶绿素a | 微型浮游植物叶绿素a | 微微型浮游植物叶绿素a |
| 悬浮物 | 0.54* | 0.43 | 0.16 |
| 盐度 | –0.66** | –0.20 | 0.094 |
| 温度 | –0.01 | –0.32 | 0.032 |
| DO | 0.73** | 0.23 | –0.13 |
| pH | –0.51* | –0.46 | 0.07 |
| COD | 0.39 | 0.37 | –0.46 |
| *.相关性显著(P < 0.05); **.相关性极为显著(P < 0.01) | |||
由表 2可以看出, 在海州湾临洪河口海域, 悬浮物浓度与小型浮游植物叶绿素a含量的相关系数为0.54(P值为0.026), 表明悬浮物浓度与小型浮游植物生物量呈显著正相关, 可能是由于悬浮物表面吸附的大量营养物质促进了浮游植物的生长; 盐度和小型浮游植物叶绿素a含量相关系数为–0.66(P值为0.004), 两者关系为极显著负相关, 可判断盐度越小小型浮游植物贡献率越高, 也就是说其更宜在低盐度的近岸河口区域生长, 而近岸营养物质丰富, 这也恰好说明了个体大的浮游植物在富营养化的河口更具有竞争力[9-11]; 盐度升高, pH值也会升高, 因此pH值也表现出与小型浮游植物的负相关关系, 相关系数和P值分别为–0.51和0.035;溶氧水平以高达0.73的相关系数与小型浮游植物叶绿素a呈现出极为显著的关系, 且P值低至0.001, 溶氧浓度越高, 小型浮游植物生物量也越高, 两者实际上是一种相互促进关系, 浮游植物生物量高, 光合作用产生的氧气也多, 而溶氧含量高反映了水质良好, 也更适宜藻类的生长。在此次相关性分析中, 以上各环境因子与微型、微微型浮游植物叶绿素a浓度的相关性并不明显, 但由于小型浮游植物对浮游植物总量贡献率占绝对优势, 各环境因子对浮游植物总量也表现出各自与小型浮游植物相近的相关性。
近岸海域环境因子对浮游植物粒级结构的影响机制是一个艰巨而重要的课题, 目前还很缺乏相关的研究来论证各项环境因子对于浮游植物粒级结构的作用机制及各环境因子之间的关联性, 不过由于各项与浮游植物存在明显相关性的环境因子都受陆地径流所调控, 因此陆地径流对近岸海域浮游植物粒级结构有着深远的影响。
3 结论临洪河口海域浮游植物的组成以小型浮游植物为主, 微型浮游植物次之, 微微型浮游植物叶绿素a的含量极其微小, 三者对该海域浮游植物总叶绿素a的贡献率依次为83.89%、13.60%、2.52%;小型浮游植物叶绿素a的分布呈现出从沿岸到外海逐渐下降的趋势; 微型浮游植物靠近河流入海口区域的叶绿素a浓度明显高于远离入海口区域; 微微型浮游植物的分布规律较不明显, 其在河流入海口附近的叶绿素a浓度水平要低于海州湾外部海区。
通过相关性分析发现环境因子主要作用于在该海域浮游植物中占绝对优势的小型浮游植物, 其中盐度与pH两项因子与浮游植物的相关性表现为:盐度或酸碱度越低浮游植物生物量越高; 悬浮物、溶解氧对浮游植物分布水平均表现出正相关性。
| [1] |
Schloss I R, Nozais C, Mas S, et al. Picophytoplankton and nanophytoplankton abundance and distribution in the southeastern Beaufort Sea (Mackenzie Shelf and Amundsen Gulf) during fall 2002[J]. Journal of Marine Systems, 2008, 74(3-4): 978-993. DOI:10.1016/j.jmarsys.2008.01.004 |
| [2] |
Bouteiller A L, Blanchot J, Rodier M. Size distribution patterns of phytoplankton in the western Pacific:towards a generalization for the tropical open ocean[J]. Deep Sea Research Part A. Oceanographic Research Papers, 1992, 39(5): 805-823. DOI:10.1016/0198-0149(92)90123-B |
| [3] |
Zubkov M, Fuchs B M, Tarran G A, et al. High rate of uptake of organic nitrogen compounds by Prochlorococcus cyanobacteria as a key to their dominance in oligotrophic oceanic waters[J]. Applied and Environmental Microbiology, 2003, 69: 1299-1304. DOI:10.1128/AEM.69.2.1299-1304.2003 |
| [4] |
Calvo-Díaz A, Morán X, Suárez L. Seasonality of picophytoplankton chlorophyll a and biomass in the central Cantabrian Sea, southern Bay of Biscay[J]. Journal of Marine Systems, 2008, 72(1-4): 271-281. DOI:10.1016/j.jmarsys.2007.03.008 |
| [5] |
Landry M R, Selph K E, Taylor A G, et al. Phytoplankton growth, grazing and production balances in the HNLC equatorial Pacific[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2011, 58(3-4): 524-535. DOI:10.1016/j.dsr2.2010.08.011 |
| [6] |
Mitbavkar S, Raghu C, Rajaneesh K M, et al. Picophytoplankton community from tropical marine biofilms[J]. Journal of Experimental Marine Biology and Ecology, 2012, 426: 88-96. |
| [7] |
Stambler N. Relationships between picophytoplankton and optical properties in the Azores Front region in the Atlantic Ocean[J]. Journal of Sea Research, 2014, 85: 144-154. DOI:10.1016/j.seares.2013.04.016 |
| [8] |
Denaro G, Valenti D, La Cognata A, et al. Spatio-temporal behaviour of the deep chlorophyll maximum in Mediterranean Sea:Development of a stochastic model for picophytoplankton dynamics[J]. Ecological Complexity, 2013, 13: 21-34. DOI:10.1016/j.ecocom.2012.10.002 |
| [9] |
Agawin N S R, Duarte C M, Agusti S. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production[J]. Limnology and Oceanography, 2000, 45: 591-600. DOI:10.4319/lo.2000.45.3.0591 |
| [10] |
Sin Y, Wetzel R L, Anderson I C. Seasonal variations of size-fractionated phytoplankton along the salinity gradient in the York River Estuary, Virginia (USA)[J]. Journal of Plankton Research, 2000, 22: 1945-1960. DOI:10.1093/plankt/22.10.1945 |
| [11] |
Ning X, Cloern J E, Cole B E. Spatial and temporal variability of picocyanobacteria Synechococcus sp. in San Francisco Bay[J]. Limnology and Oceanography, 2000, 45: 695-702. DOI:10.4319/lo.2000.45.3.0695 |
| [12] |
Gaulke A, Wetz M, Paerl H. Picophytoplankton:a major contributor to planktonic biomass and primary production in a eutrophic, river-dominated estuary[J]. Estuarine, Coastal and Shelf Science, 2010, 90(1): 45-54. DOI:10.1016/j.ecss.2010.08.006 |
| [13] |
马玉, 汪岷, 夏骏, 等. 秦皇岛褐潮期超微型浮游生物丰度及多样性研究[J]. 中国海洋大学学报, 2016, 46(6): 142-150. Ma Yu, Wang Min, Xia Jun, et al. Studies in abundance and dversity of microplankton during brown tide around Qinhuangdao area[J]. Periodical of Ocean University of China, 2016, 46(6): 142-150. |
| [14] |
Qiu D, Huang L, Zhang J, et al. Phytoplankton dynamics in and near the highly eutrophic Pearl River Estuary, South China Sea[J]. Continental Shelf Research, 2010, 30(2): 177-186. DOI:10.1016/j.csr.2009.10.015 |
| [15] |
黄邦钦, 洪华生, 王大志, 等. 台湾海峡浮游植物生物量和初级生产力的粒级结构及碳流途径[J]. 台湾海峡, 2002, 21(1): 23-30. Huang Bangqin, Hong Huasheng, Wang Dazhi, et al. Size-fraction of phytoplankton biomass and productivity and photosynthetic carbon flow in Taiwan Strait[J]. Journal of oceanography in Taiwan strait, 2002, 21(1): 23-30. DOI:10.3969/j.issn.1000-8160.2002.01.005 |
| [16] |
邓春梅, 于志刚, 姚鹏, 等. 东海、南黄海浮游植物粒级结构及环境影响因素分析[J]. 中国海洋大学学报自然科学版, 2008, 38(5): 791-798. Deng Chunmei, Yu Zhigang, Yao Peng, et al. Size-fractionated phytoplankton in the the East China and Southern Yellow Seas and its environmental factors in autumn 2000[J]. Periodical of Ocean University of China, 2008, 38(5): 791-798. |
| [17] |
张武昌, 王荣. 渤海微型浮游动物及其对浮游植物的摄食压力[J]. 海洋与湖沼, 2000, 31(3): 252-258. Zhang Wuchang, Wang Rong. Microzooplankton and their grazing pressure in phytoplankton in Bohai Sea[J]. Acta Oceanologica Sinica, 2000, 31(3): 252-258. DOI:10.3321/j.issn:0029-814X.2000.03.004 |
| [18] |
马艳娥, 柯志新, 黄良民, 等. 夏冬两季大亚湾典型海域浮游植物粒级结构特征[J]. 热带海洋学报, 2013, 32(3): 40-46. Ma Yane, Ke Zhixin, Huang Liangmin, et al. Phytoplankton biomass size structure in Daya Bay during summer and winter[J]. Journal of Tropical Oceanography, 2013, 32(3): 40-46. DOI:10.3969/j.issn.1009-5470.2013.03.006 |
 2019, Vol. 43
2019, Vol. 43

