文章信息
- 卢霞, 林雅丽, 赵倩, 顾杨, 吴亚楠, 王晓静. 2019.
- LU Xia, LIN Ya-li, ZHAO Qian, GU Yang, WU Ya-nan, WANG Xiao-jing. 2019.
- 盐度对滨海湿地盐地碱蓬生理指标和反射光谱的响应分析
- Effects of salinity on physiological indicators and reflectance spectra of Suaeda salsa in coastal wetlands
- 海洋科学, 43(2): 41-50
- Marine Sciences, 43(2): 41-50.
- http://dx.doi.org/10.11759/hykx20180510001
-
文章历史
- 收稿日期:2018-05-10
- 修回日期:2018-07-25
碱蓬属(Suaeda)植物是重要的盐生植物资源, 主要分布在世界各地的海滨、荒漠、湖边及盐碱土地区[1]。盐地碱蓬(Suaeda salsa)是研究比较深入的品种[2]。碱蓬属植物是一类典型的真盐生植物, 无沁盐结构, 叶片肉质化程度高, 主要通过稀释方式使得体内的盐分不致发生毒害, 具有较高的耐盐性[3]。盐地碱蓬是沿海滩涂、盐沼、湿地和潮滩等高碱生境的重要植被之一, 具有维持湿地正常演替、防风固堤、调节气候等多重功能[4], 它还具有清热、降糖、降压等保健作用以及抗氧化、抗肿瘤等药用功效。
自20世纪70年代起, 国外学者就开始研究碱蓬属植物耐盐性机理, 内容主要涉及叶片结构[5]、光合特性[6-7]、水分和离子平衡[8-9]、抗氧化系统和渗透调节[10-11]、耐盐蛋白质学[12]。国内学者对碱蓬属植物的耐盐机理研究则始于20世纪90年代[13-23], 主要通过盐胁迫处理(室内实验)或盐碱土生长(野外实验)观察盐地碱蓬的生理反应。有些学者还研究了碱蓬属植物对重金属的吸收累积效应或高盐碱湿地等的净化作用[24-30]。结果表明:翅碱蓬对Cu、Zn、Pb、Cd、As、Cr和Ni等重金属具有不同程度的累积吸收能力, 且与生长发育期、发育器官、潮滩位置、季节变化、重金属种类、土壤重金属含量及理化性质等因素密切相关。然而, 水盐等胁迫下植物的光谱研究成果较少[31-33]。Maria等[31]探讨了山毛榉和杜鹃花在水分和压力胁迫下叶片含水量、角质层厚度等生理指标和光谱的变化情况。2014年, Max等[32]以马铃薯为实验对象, 利用各项水分胁迫指数(CWSI、MSI、PRI)和光谱反射率计算分析了马铃薯对水分胁迫的敏感性。
本文拟以盐地碱蓬为试验材料, 探讨不同盐度对碱蓬生理指标和反射光谱的响应, 对未来退化海滨湿地生态修复研究具有重要的参考意义。
1 材料与方法 1.1 试验材料2017年4月采集江苏滨海湿地株高8.3 cm±1.20 cm, 根长10.5 cm±2.17 cm左右的碱蓬幼苗, 装入聚乙烯袋中, 封口并标记带回实验室。将碱蓬幼苗根上的土洗净, 栽种于塑料盆(内口直径20 cm, 高14 cm)中, 每个梯度设置3盆, 共24盆, 每盆种植碱蓬3~5株, 株间距为3~5 cm。以石英粗砂为栽培基质, 采用自然光照及大气环境温度、湿度等条件进行盆栽试验。
1.2 试验设计为探讨在不同盐度下, 碱蓬生长发育过程中生理指标的变化特征及其反射光谱的诊断特征, 依据前人研究的碱蓬耐盐极限(盐度35)设置8个盐度梯度[0 (CK), 5, 10, 15, 20, 25, 30, 35], 每个梯度记为一组, 每组3个重复。对照组采用改良的霍格兰氏Hoagland营养液(pH=6.7)浇灌, 而其他盐度梯度组均分别采用5, 10, 15, 20, 25, 30, 35的Hoagland营养液进行处理。在盆栽试验过程中, 不同盐度的营养液浇灌时间和量均保持一致。
当高盐度下的碱蓬枯竭, 盆栽试验结束, 试验总周期为53 d。试验结束时, 测定盆栽碱蓬的株高、叶片叶绿素含量和冠层反射光谱; 之后将碱蓬取出, 不破坏其原有根系结构, 并用蒸馏水冲洗干净后, 部分鲜样用来测量植物叶片的可溶性总糖和蛋白质质量比; 部分样品用于测量鲜质量, 再将植物样品先于105℃下杀青, 后于80℃下烘干至恒质量, 称量干质量。
1.3 生理指标测定采用CCM-300叶绿素含量测量仪测定碱蓬叶片叶绿素含量。CCM-300利用Gitelson方程[34](式(1))直接给出叶绿素含量[m(Chl)], 单位为(mg/m2), 也可使用叶绿素发射荧光的荧光比率F735/F700。可溶性糖含量测定采用蒽酮比色法, 可溶性蛋白质质量比的测定采用考马斯亮蓝G250染色法[35]。
| $ m\left( {{\rm{Chl}}} \right) = 634\left( {{F_{735}}/{F_{700}}} \right) + 391. $ | (1) |
盐度处理下的碱蓬在物理、化学或生物学形状方面存在差异, 从而导致对自然入射或自身发出的电磁波的响应也有所不同, 形成具有鉴别特征的“指纹效应”[36]。碱蓬冠层反射光谱由Spectra Vista公司的SVC HR-1024I便携式地物光谱仪(350~2500 nm)测定。为减少大气辐射和太阳高度角的影响, 选择晴朗无云风小的天气, 在盆栽试验培养期内2017年5月30日的10:00~14:00期间测定盆栽碱蓬的冠层反射光谱。测量时选用4°光谱仪视场角, 光谱仪距碱蓬冠层顶部的垂直距离为20 cm。首先测定标准白板的反射率, 然后测定碱蓬冠层光谱, 连续测5次, 取平均值作为盆栽碱蓬的反射光谱曲线。
1.5 数据处理应用SPSS软件进行分析, 采用单因素方差分析和Tukey两两比较法进行盆栽碱蓬各生理指标差异的多重比较。
2 结果与讨论 2.1 盐度对碱蓬生理指标的响应 2.1.1 盐度对碱蓬株高和生物量的响应由图 1可知:不同盐度对碱蓬株高的响应主要体现在: 5~25盐度下, 盐度对株高有促进作用; 在30~35高盐度下, 盐度对碱蓬株高存在抑制作用。25盐度下的碱蓬株高达到峰值。各盐度下的碱蓬株高与对照组存在显著差异(P < 0.01); 5~25盐度下, 碱蓬株高之间差异显著(P < 0.01), 而30与35盐度下, 碱蓬株高差异不显著(P > 0.05)。
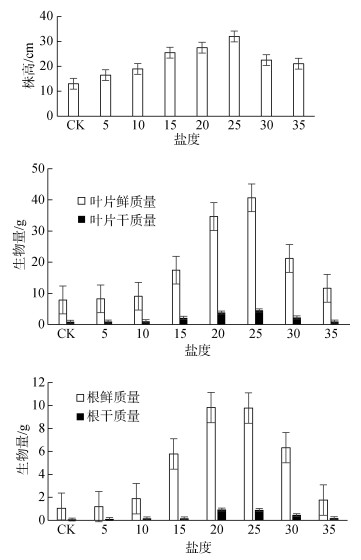 |
| 图 1 盐度对碱蓬株高、鲜质量和干质量的响应 Fig. 1 Response of shoot height and biomass of Suaeda salsa to salinity |
不同盐度对碱蓬鲜质量、干质量的响应主要体现在:碱蓬叶片鲜质量和干质量受盐度的影响显著。在5~25盐度下, 碱蓬叶片和根部的鲜质量和干质量随着盐度的增高而增加; 在25~35盐度下, 碱蓬叶片和根部的鲜质量和干质量随着盐度的增高而逐渐减少。在25盐度下, 碱蓬根部鲜质量和干质量达到峰值。叶片鲜质量除5、10盐度之外, 与对照组存在显著差异(P < 0.01);根鲜质量除盐度5之外, 与对照组存在显著差异(P < 0.01)。各盐度下, 碱蓬叶片和根部的鲜质量与干质量之间的差异显著性表现出不一致性。以上分析表明:高盐度对盐地碱蓬根系的生长起抑制作用; 这与戈良朋和王祖伟[37]的研究结果一致。
2.1.2 盐度对碱蓬叶绿素含量的响应从图 2可看出:在5~25盐度下, 碱蓬叶片叶绿素含量随盐度的增高而增加, 在25盐度下, 叶片叶绿素含量达到峰值。在30~35盐度下, 随着盐度的增加, 碱蓬叶片叶绿素含量逐渐减小; 35盐度下的碱蓬植株因受枯萎影响, 叶绿素含量急剧下降。盐度处理下的碱蓬叶片叶绿素含量都与对照组之间存在显著差异(P < 0.01), 除15与30盐度下, 碱蓬叶绿素含量响应不显著(P > 0.05)之外, 其他均存在显著差异(P < 0.01)。滨海湿地盐地碱蓬叶绿素含量在高盐环境下显著下降, 这与尹海龙和田长彦[19]的研究结果一致; 但盐地碱蓬在轻度和中度盐度环境下, 碱蓬叶片光合色素含量存在显著差异的论点与尹海龙和田长彦[19]研究结果不一致, 可能是由于试验方案和测定方法的不同而导致。
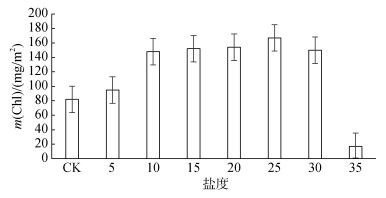 |
| 图 2 盐度对盆栽碱蓬叶片叶绿素含量的响应 Fig. 2 Response of chlorophyll content of Suaeda salsa to salinity |
盐度下碱蓬叶片和根部的可溶性总糖质量比测定结果如图 3所示。从图 3可见:盐度对碱蓬叶片和根部的可溶性总糖质量比的影响显著。在5~25盐度下, 叶片的可溶性总糖质量比随着盐度的增加而增加。在10~25盐度下, 根部可溶性总糖质量比随着盐度的增加而增加。当盐度达到25时, 根与叶片的可溶性总糖质量比均达到峰值。在30~35盐度下, 叶片与根的可溶性总糖质量比随着盐度的增加而减少。盐度处理下的叶片可溶性总糖质量比与对照组存在显著差异(P < 0.01);除15和30盐度之外, 叶片可溶性总糖质量比之间存在显著差异(P < 0.01)。盐度胁迫加剧时, 盐地碱蓬可溶性糖含量逐渐提高, 抗逆能力不断增强[36]。
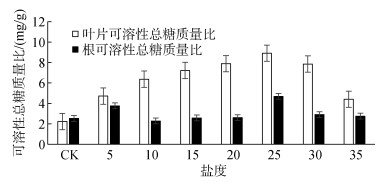 |
| 图 3 盐度对碱蓬叶片和根部可溶性总糖质量比的响应 Fig. 3 Response of soluble sugar content of Suaeda salsa leaf and root to salinity |
不同盐度下盆栽碱蓬叶片和根部的蛋白质质量比测定结果如图 4所示。由图 4可知:盐度处理下, 盆栽碱蓬植株的蛋白质质量比呈起伏演变规律。经过盐度处理的碱蓬根部蛋白质质量比均高于参照组。盐度处理下的碱蓬叶片和根部蛋白质质量比与对照组之间存在显著差异(P < 0.01)。其他盐度之间(除30和35之间), 对叶片蛋白质质量比响应显著(P < 0.01);其他盐度之间(除10和30之间、20和25之间、20和30之间), 对根部蛋白质质量比响应显著(P < 0.01)。
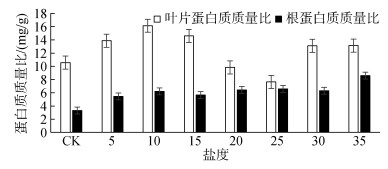 |
| 图 4 盐度对碱蓬叶片和根部蛋白质质量比的响应 Fig. 4 Response of protein content of Suaeda salsa leaf and root to salinity |
对照组和5~30盐度下碱蓬植株冠层反射光谱如图 5所示。从图 5可看出:除盐度35处理下的碱蓬枯萎之外, 其他盐度处理下的碱蓬植株冠层反射光谱曲线呈现一致的起伏规律, 仅在各波段处的反射率大小存在差异。随着盐度的增加, 碱蓬植株在绿光波段550 nm附近的反射峰和近红外波段范围(745~1 410 nm)的光谱反射率越低; 1 811~1 947 nm波段范围内的碱蓬光谱反射率因受大气水汽的影响显著而剔除。
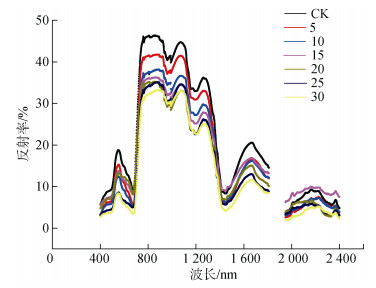 |
| 图 5 盐度对碱蓬反射光谱的响应 Fig. 5 Response of reflectance spectra of Suaeda salsa at canopy level to salinity |
为探讨盐度对碱蓬植株反射光谱的定量响应, 分析了不同盐度下的碱蓬植株反射光谱与生理指标(株高、鲜质量、干质量、叶片叶绿素含量、可溶性总糖和蛋白质质量比)之间的相关系数, 结果如图 6所示。从图 6可知:不同盐度处理下, 蛋白质与反射光谱之间的相关系数呈现规律与其他指标不同, 对蛋白质质量比比较敏感的波段是2 300 nm, 相关系数为0.58(p < 0.01);株高、鲜质量、干质量、叶片叶绿素含量、可溶性总糖质量比与反射光谱之间的相关系数曲线呈现一致的起伏规律, 其对应敏感波段分别为547, 555, 548, 556和546 nm, 对应的相关系数(p < 0.01)依次为–0.73, –0.64, –0.63, –0.83, –0.89。
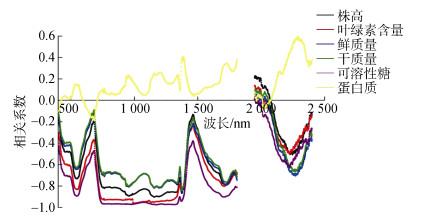 |
| 图 6 盐度下碱蓬反射光谱与生长指标之间的相关系数 Fig. 6 Correlation between reflectance spectra of Suaeda salsa and physiological indicators |
为定量分析不同盐度下, 盆栽碱蓬植株的高光谱特征指数随盐度的增加而呈现的响应模式, 本文选用对植被生理指标比较敏感的植被指数、红边位置以及敏感波段反射率作为高光谱特征指数[38-41](表 1)。基于不同盐度下的碱蓬植被高光谱特征指数依据公式计算, 并分析其与盐度之间的关系, 结果如图 7所示。从图 7可知: MNDVI1、MNDVI8、ZM、VoGD、MENDVI、RI、NDVI、VREI、MRESRI和REP光谱特征指数随着盐度的增加而呈现先递增后递减再递增的趋势; MTCI、Datt99、DD、DCNI、TCARI/ OSAVI、NIR/G、GNDVI、REIP光谱特征指数随着盐度的增加而呈现先递增后递减再递增再递减的趋势; R2300随着盐度的增加而呈现先递减后递增再递减再递增的趋势; Macco1随着盐度的增加而呈现先递增后递减再递增再递减的趋势; NPCI、R546随着盐度的增加而呈现先递减后递增再递减的趋势。
| 光谱特征指数 | 定义 | 表述 |
| TCARI(transformed chlorophyll absorption in reflectance index)/OSAVI(optimized soil adjusted vegetation index), 该指数可以有效去除土壤影响。 | ||
| MNDVI1 | (R755 − R745)/(R755 + R745) | MNDVI(modified normalized difference vegetation index), 改进的归一化植被指数。 |
| MNDVI8 | (R755 − R730)/(R755 + R730) | 改进的归一化植被指数。 |
| Macco1 | (R780 − R710)/(R780 − R680) | Maccioni (maccioni index)指数。 |
| MTCI | (R754 − R709)/(R709 − R681) | MTCI(MERIS terrestrial chlorophyll index), 中分辨率陆地叶绿素成像指数。 |
| ZM | R750/R710 | ZM (Zarco and Miller)指数。 |
| VoGD | D715/D705 | VoGD (VoGDelmann index)指数。 |
| Datt99 | (R850 − R710)/(R850 − R680) | Datt99指数。 |
| DD | D754/D704 | Datt99指数。 |
| MRESRI | (R750–R445)/(R705–R445) | MRESRI(modified red edge simple ratio index), 修正红边单比指数。 |
| MRENDVI | (R750–R705)/ (R750+2R445) | MRENDVI(modified red edge normalized difference vegetation index), 修正红边归一化指数。 |
| NPCI | (R680–R430)/ (R680+R430) | NPCI(normalized pigment chlorophyll index), 叶绿素归一化植被指数。 |
| VREI | R740/R720 | Vogelmann 2 (Vogelmann index), Vogelmann红边指数。 |
| REIP | 700+40{[(R670+ R780)/2]–R700}/(R740–R700) | REIP (red edge inflection point), 线性内插法红边位置。 |
| NDVI | (R810–R690)/(R810+R690) | NDVI(normalized difference vegetation index), 归一化植被指数。 |
| GNDVI | (R810–R560)/ (R810+R560) | GNDVI (green normalized difference vegetation index), 绿色归一化植被指数。 |
| NIR/G | R810/R560 | NIR/G(near infrared/green)近红外波段与绿光波段的反射率比值。 |
| DCNI | (R720–R700)/(R700–R670)/ (R720–R670+0.03) | DCNI(double-peak canopy nitrogen index), 双峰冠层氮指数。 |
| R2300 | R2300 | R2300为2 300 nm波段处的光谱反射率。 |
| R546 | R546 | R546为546 nm波段处的光谱反射率。 |
| REP | 在680~760 nm波段范围内, 植被反射光谱一阶导数的最大值所对应的波长位置 | REP(red edge position)红边位置。 |
| RI | R735/R720 | R735/R720植被指数。 |
| 注:高光谱特征指数计算表达式中的Rλ表示原始光谱反射率, Dλ表示一阶导数光谱, 下标表示波段。 | ||
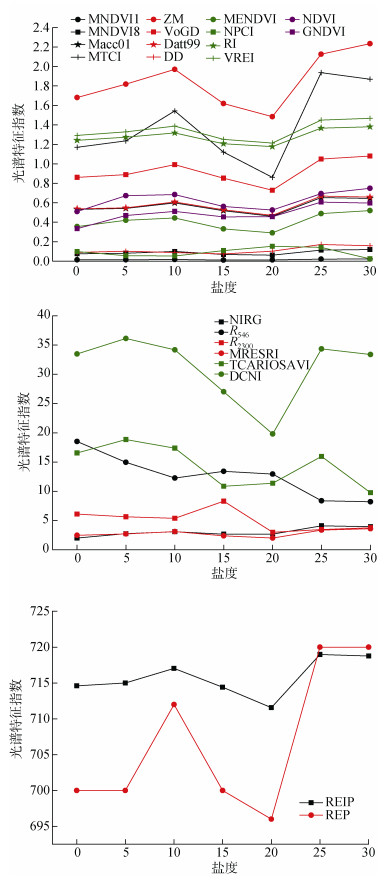 |
| 图 7 碱蓬高光谱特征指数与盐度的关系 Fig. 7 Scatter plots of hyperspectral characteristic variables of Suaeda salsa and salinity |
DCNI光谱特征指数在盐度5和20分别达到最大值和最小值; TCARI/OSAVI光谱特征指数在盐度5和15分别达到最大值和最小值; R2300光谱特征指数在盐度15和20分别达到最大值和最小值; R546光谱特征指数在对照组和盐度30分别达到最大值和最小值; MNDVI1光谱特征指数在盐度30和15分别达到最大值和最小值; MRESRI、MNDVI8、ZM、VoGD、MENDVI、RI和VREI光谱特征指数在盐度30和20分别达到最大值和最小值; Macco1、MTCI、Datt99、REP和REIP光谱特征指数在盐度25和20分别达到最大值和最小值; DD光谱特征指数在盐度25和15分别达到最大值和最小值; NPCI光谱特征指数在盐度20和30分别达到最大值和最小值; GNDVI和NIR/G光谱特征指数在盐度25和对照组分别达到最大值和最小值; NDVI光谱特征指数在盐度30和对照组分别达到最大值和最小值。
2.2.4 讨论盐地碱蓬是生长于盐碱地和滨海湿地的真盐生植物, 由于盐地碱蓬叶片可积累大量的Na+和Cl–, 其具有很高的抗盐性, 且可将这些离子区隔化在液泡中作为渗透调节物质[42]。
本研究表明, 盐地碱蓬幼苗在高盐环境下(30~ 35)下, 株高的生长受到了不同程度的抑制作用; 根部的鲜质量和干质量在高盐环境胁迫下生长比叶片更易受到抑制, 35盐度处理下的碱蓬植株表现出枯萎、脱落、甚至死亡等现象。因此, 随着盐处理时间的推进, 碱蓬渗透调节对盐分的响应存在明显变化。中低盐度(5~25)处理碱蓬植株经一段时间适应后, 生长受到促进; 高盐度(30~35)处理对碱蓬植株的影响则随时间的推移而抑制作用加剧, 对植物生长造成不利影响。可见, 碱蓬植株株高、鲜质量和干质量等生长量是植物对盐胁迫反应的综合体现, 也是植物耐盐性的直接指标。
可溶性糖是许多盐生植物体内的渗透调节剂[43]。本研究表明:中低盐度(5~25)环境处理下, 可溶性总糖质量比随着盐度胁迫强度的增强而增加, 但在高盐度(30~35)环境处理下呈下降趋势, 这可能是由于高盐胁迫导致盐地碱蓬的渗透调节能力降低或丧失, 从而导致可溶性总糖质量比的下降; 同时由于高盐胁迫降低叶绿体保护系统的作用, 光合速率降低, 导致糖的合成减少。
本研究发现, 低盐度(5~10)处理下, 碱蓬植物蛋白质质量比不断增加; 中盐度(15~25)处理下, 植物细胞中蛋白质的合成不断减少; 高盐度(30~35)处理下, 植物细胞中蛋白质的合成不断增加; 且碱蓬叶片比根部蛋白质质量比在盐度处理下的演变规律更为显著。蛋白质质量比在高盐胁迫下较高, 可认为是碱蓬适应高盐环境的一种自我保护机制; 而在中盐环境下, 蛋白质质量比降低原因有待深入研究。
本研究表明, 在不同盐分浓度下MTCI、MNDVI1、DCNI、TCARI/OSAVI和R546光谱特征指数值之间差异较大; 但光谱特征指数随着盐分胁迫的增加而没有呈现逐渐递增或递减的趋势, 其原因可能是碱蓬冠层反射光谱受叶片、茎、花、穗以及下垫面等多种因素影响而导致。
3 结论通过分析8种盐度下盆栽碱蓬生长过程中盐分胁迫对碱蓬生理指标和冠层反射光谱的响应, 得到以下结论:
(1) 盐度对盆栽碱蓬生理指标(株高、鲜质量、干质量、叶绿素含量、可溶性总糖和蛋白质质量比)存在比较明显的响应作用。25盐度处理下, 碱蓬株高、叶片叶绿素含量、鲜质量和干质量、可溶性总糖质量比均达到峰值, 且与对照组差异显著。盐分处理下, 碱蓬植株的蛋白质质量比均高于对照组。
(2) 盐度对盆栽碱蓬冠层反射光谱存在显著响应。盐度越大, 碱蓬冠层反射光谱在绿光反射率和近红外反射坪台的反射率就越小。不同盐度处理下, 碱蓬植株生理指标株高、鲜质量、干质量、叶绿素含量、可溶性总糖和蛋白质质量比均在反射光谱中存在敏感波段, 分别是547, 555, 548, 556, 546和2 300 nm。
(3) 碱蓬光谱特征指数随盐度的增加而呈现特定的演变规律, 但规律存在不一致性; DCNI、R2300、MRESRI、MNDVI8、ZM、VoGD、MENDVI、RI、VREI、Macco1、MTCI、Datt99、REP和REIP光谱特征指数在20盐度下达最小值; 在不同盐度下MTCI、MNDVI1、DCNI、TCARI/OSAVI和R546光谱特征指数值之间存在明显差异, 可作为碱蓬植株盐分胁迫的高光谱响应特征指标。
(4) 未来研究中, 需深入研究盐分胁迫下碱蓬叶片中的Na+和Cl–在叶片反射光谱中是否存在诊断波段, 从而进一步丰富盐分胁迫碱蓬高光谱响应机理。
| [1] |
赵可夫, 李法曾. 中国盐生植物[M]. 北京: 科学出版社, 1999: 17-91. Zhao Kefu, Li Fazeng. Chinese Halophyte[M]. Beijing: Science Press, 1999: 17-91. |
| [2] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 第25卷第二分册. 北京: 科学出版社, 1979: 115-135. Editorial Committee of Chinese Botany of the Chinese Academy of Sciences. Chinese flora[M]. Volume 25, Division Ⅱ. Beijing: Science Press, 1979: 115-135. |
| [3] |
Flowers T J, Colmer T D. Plant salt tolerance:adaptations in halophytes[J]. Annals of Botany, 2015, 115(3): 327-331. DOI:10.1093/aob/mcu267 |
| [4] |
丁海荣, 洪立洲, 杨智青, 等. 盐生植物碱蓬及其研究进展[J]. 江西农业学报, 2008, 20(8): 35-37. Ding Hairong, Hong Lizhou, Yang Zhiqing, et al. Progress of study on halophyte Suaeda salsa[J]. Acta Agriculture Jiangxi, 2008, 20(8): 35-37. DOI:10.3969/j.issn.1001-8581.2008.08.012 |
| [5] |
Williams M D, Ungar I A. The effect of environmental parameters on the germination, growth, and development of Suaeda depressa (Pursh) Wats[J]. American Journal of Botany, 1972, 59(9): 912-918. DOI:10.1002/j.1537-2197.1972.tb10166.x |
| [6] |
Flowers T J. Salt tolerance in Suaeda martima (L.) Dum:The effect of sodium chloride on growth, respiration, and soluble enzymes in a comparative study with Pisum sativum L[J]. Journal of Experimental Botany, 1972, 23(2): 310-321. DOI:10.1093/jxb/23.2.310 |
| [7] |
Lu C M, Qiu N W, Wang B S, et al. Salinity treatment shows no effects on photosystem Ⅱ photochemistry, but increases the resistance of photosystem Ⅱ to heat stress in halophyte Suaeda salsa[J]. Journal of Experimental Botany, 2003, 54(383): 851-860. DOI:10.1093/jxb/erg080 |
| [8] |
Yeo A R, Flowers T J. Ion transport in Suaeda maritima:its relation to growth and implications for the pathway of radial transport of ions across the root[J]. Journal of Experimental Botany, 1986, 37(2): 143-159. DOI:10.1093/jxb/37.2.143 |
| [9] |
Rehmans, Harris P J C, Bourne W F. The effect of sodium chloride on the Ca2+, K+ and Na+ concentrations of the seed coat and embryo of Acacia tortillas[J]. Annuals of Applied Biology, 1998, 133: 269-279. DOI:10.1111/aab.1998.133.issue-2 |
| [10] |
Maathuis F J M, Flowers T J, Yeo A R, et al. Sodium chloride compartmentation in leaf vacuoles of the halophyte Suaeda maritima (L.) Dum, and its relation to tonoplast permeability[J]. Journal of Experimental Botany, 1992, 43(9): 1219-1223. DOI:10.1093/jxb/43.9.1219 |
| [11] |
Wetson A M, Flowers T J. The effect of saline hapoxia on growth and ion uptake in Suaeda maritime[J]. Functional Plant Biology, 2010, 37(7): 646-655. DOI:10.1071/FP09270 |
| [12] |
Ayarpadikannan S, Chung E S, Cho C W, et al. Exploration for the salt stress tolerance genes from a salt-treated halophyte, Suaeda asparagoides[J]. Plant Cell Reports, 2012, 31(1): 35-48. DOI:10.1007/s00299-011-1137-4 |
| [13] |
刘家尧, 衣艳军, 赵可夫. 盐分对碱蓬幼苗离子含量、甜菜碱水平和BADH活性的效应[J]. 植物学报, 1994, 36(8): 622-626. Liu Jiayao, Yi Yanjun, Zhao Kefu. Effects of salinity onion contents, betaine level and betaine-aldehyde dehydrogenase activity in seepweed (Suaeda Salsa) seedlings[J]. Acta Botanica Sinica, 1994, 36(8): 622-626. |
| [14] |
Song J, Chen M, Feng G, et al. Effects of salinity on growth, ion accumulation and the roles of ions in osmotic adjustment of two populations of Suaeda salsa[J]. Plant and Soil, 2009, 314(1/2): 133-141. |
| [15] |
Wang B S, Luttge U, Ratajczak R. Effects of salt treatment and osmotic stress on V-ATPase and V-PPase in leaves of the halophyte Suaeda salsa[J]. Journal of Experimental Botany, 2001, 52(365): 2355-2365. DOI:10.1093/jexbot/52.365.2355 |
| [16] |
Zhang L, Ma X L, Zhang Q, et al. Expressed sequence tags from a NaCl-treated Suaeda salsa cDNA library[J]. Gene, 2001, 267(2): 193-200. DOI:10.1016/S0378-1119(01)00403-6 |
| [17] |
Williams T P, Bubb J M, Lester J N. Metal accumulation within salt marsh environment:A review[J]. Marine Pollution Bulletin, 1994, 28(5): 277-290. DOI:10.1016/0025-326X(94)90152-X |
| [18] |
王茜, 校亮, 唐翔宇, 等. 盐碱胁迫和氮素供给对盐地碱蓬种子发芽与幼苗生长的影响[J]. 草业学报, 2015, 24(9): 216-222. Wang Qian, Xiao Liang, Tang Xiangyu, et al. Effects of saline alkali stress and nitrogen supply on germination and seedling growth of Suaeda salsa[J]. Acta Prataculturae Sinica, 2015, 24(9): 216-222. |
| [19] |
尹海龙, 田长彦. 不同盐度环境下盐地碱蓬幼苗光合生理生态特征[J]. 干旱区研究, 2014, 31(5): 850-855. Yin Hailong, Tian Changyan. Photosynthetic characteristics of Suaeda salsa seedlings under different salt conditions[J]. Arid Zone Research, 2014, 31(5): 850-855. |
| [20] |
李爱卿, 赵晓东, 冯玉兰, 等. 不同浓度NaCl处理对盐地碱蓬萌发及生长的影响[J]. 西北民族大学学报, 2017, 38(4): 41-45. Li Aiqing, Zhao Xiaodong, Feng Yulan, et al. Effect of NaCl stress with different concentrations on seed germination and seedlings growth of Suaeda salsa[J]. Journal of Northwest Minzu University, 2017, 38(4): 41-45. DOI:10.3969/j.issn.1009-2102.2017.04.010 |
| [21] |
李艳迪, 郭建荣, 王宝山. 钠盐和氯化物对真盐生植物盐地碱蓬营养生长的影响[J]. 植物生理学报, 2018, 54(3): 421-428. Li Yandi, Guo Jianrong, Wang Baoshan. Effects of sodium salt and chloride on vegetative growth of euhalophyte Suaeda salsa[J]. Plant Physiology Journal, 2018, 54(3): 421-428. |
| [22] |
彭斌, 许伟, 绍荣, 等. 不同生境种源盐地碱蓬幼苗生长发育对盐分胁迫的响应和适应[J]. 草业学报, 2016, 25(4): 81-90. Peng Bin, Xu Wei, Shao Rong, et al. Growth of Suaeda salsa tin response to salt stress in different habitats[J]. Acta Prataculturae Sinica, 2016, 25(4): 81-90. |
| [23] |
彭斌, 许伟, 邵荣, 等. 盐胁迫对不同生境种源盐地碱蓬幼苗生长、光合色素及渗透调节物质的影响[J]. 海洋湖沼通报, 2017(1): 63-72. Peng Bin, Xu Wei, Shao Rong, et al. Effects of salt stress on growth, photosynthetic pigments and osmotic adjustment substances of Suaeda Salsa from different habitats[J]. Transactions of Oceanology and Limnology, 2017(1): 63-72. |
| [24] |
刘晓光, 缪锦来, 李光友, 等. 天津市清净黄河口河岸翅碱蓬的重金属富集特性[J]. 应用与环境生物学报, 2006, 12(1): 25-29. Liu Xiaoguang, Miao Jinlai, Li Guangyou, et al. Cumulation properties of heavy metals by Suaeda heteorptera on estuary banks of river Qingjinghuanghe in Tianjin[J]. Chinese Journal of Environmental Biology, 2006, 12(1): 25-29. DOI:10.3321/j.issn:1006-687X.2006.01.006 |
| [25] |
朱鸣鹤, 丁永生, 郑道昌, 等. 潮滩盐沼植物翅碱蓬对常见重金属的累积吸收及其机制[J]. 环境污染与防治, 2005, 27(2): 84-87. Zhu Minghe, Ding Yongsheng, Zheng Daochang, et al. Accumulation and absorption and its mechanism of heavy metals in salt marsh plants of tidal flat[J]. Environmental Pollution and its Prevention, 2005, 27(2): 84-87. DOI:10.3969/j.issn.1001-3865.2005.02.002 |
| [26] |
朱鸣鹤, 丁永生, 郑道昌, 等. 潮滩植物翅碱蓬对Cu、Zn、Pb和Cd的累积吸收及其重金属耐性[J]. 海洋环境科学, 2005, 24(2): 13-16. Zhu Minghe, Ding Yongsheng, Zheng Daochang, et al. Accumulation and tolerance of Cu, Zn, Pb and Cd in plant Suaeda heteroptera Kitag in tideland[J]. Marine Environmental Science, 2005, 24(2): 13-16. DOI:10.3969/j.issn.1007-6336.2005.02.004 |
| [27] |
朱鸣鹤, 丁永生, 丁德文. 翅碱蓬根际与非根际沉积物常见重金属总量及化学形态变化[J]. 海洋与湖沼, 2006, 37(5): 393-400. Zhu Minghe, Ding Yongsheng, Ding Dewen. Heavy metal compositions in the soils of rhizosphere and non-rhizosphere for Suaeda Heteroptera[J]. Oceanologia et Limnologia Sinica, 2006, 37(5): 393-400. DOI:10.3321/j.issn:0029-814X.2006.05.002 |
| [28] |
何洁, 陈旭, 王晓庆, 等. 翅碱蓬对滩涂湿地沉积物中重金属Cu、Pb的累积吸收[J]. 大连海洋大学学报, 2012, 27(6): 539-546. He Jie, Chen Xu, Wang Xiaoqing, et al. The absorption and accumulation of heavy metals Cu, and Pb in tidal wetland sediments by plant Suaeda heteroptera Kitag[J]. Journal of Dalian Ocean University, 2012, 27(6): 539-546. DOI:10.3969/j.issn.2095-1388.2012.06.010 |
| [29] |
王摆, 韩家波, 董颖, 等. 大凌河口湿地翅碱蓬体内重金属的分布特征[J]. 水产科学, 2013, 32(6): 316-320. Wang Bai, Han Jiabo, Dong Ying, et al. Distribution characteristics of heavy metals in saline plant Suaeda heteroptera Kitagawa at Daling River estuary[J]. Fisheries Science, 2013, 32(6): 316-320. DOI:10.3969/j.issn.1003-1111.2013.06.002 |
| [30] |
王耀平, 白军红, 肖蓉, 等. 黄河口盐地碱蓬湿地土壤-植物系统重金属污染评价[J]. 生态学报, 2013, 33(10): 3083-3091. Wang Yaoping, Bai Junhong, Xiao Rong, et al. Assessment of heavy metal contamination in the soil-plant system of the Suaeda salsa wetland in the Yellow River Estuary[J]. Acta Ecologica Sinica, 2013, 33(10): 3083-3091. |
| [31] |
Buitrago M F, Groen T A, Hecker C A, et al. Skidmore. Changes in thermal infrared spectra of plants caused by temperature and water stress[J]. ISPRS Journal of Photogrammetry and Remote Sensing, 2016, 111: 22-31. DOI:10.1016/j.isprsjprs.2015.11.003 |
| [32] |
Gerhards M, Rock G, Schlerf M, et al. Water stress detection in potato plants using leaf temperature, emissivity, and reflectance[J]. International Journal of Applied Earth Observation and Geoinformation, 2016, 53: 27-39. DOI:10.1016/j.jag.2016.08.004 |
| [33] |
刘庆生, 张敏, 宁吉才, 等. 翅碱蓬高光谱植被指数对土壤化学性质的响应[J]. 地理与地理信息科学, 2011, 27(3): 86-89. Liu Qingsheng, Zhang Min, Ning Jicai, et al. Hyperspectral vegetation indices of Suaeda Salsa in response to changes of soil chemical properties[J]. Geography and Geo-information Science, 2011, 27(3): 86-89. |
| [34] |
Gitelson A A, Buschmann C, Lichtenlhaler H K, et al. The chlorophyll fluorescence ratio F735/F700 as an accurate measure of the chlorophyll content in plants[J]. Remote Sensing of Environment, 1999, 69(3): 296-302. DOI:10.1016/S0034-4257(99)00023-1 |
| [35] |
李悦, 陈忠林, 王杰, 等. 盐胁迫对翅碱蓬生长和渗透调节物质浓度的影响[J]. 生态学杂志, 2011, 30(1): 72-76. Li Yue, Chen Zhonglin, Wang Jie, et al. Effects of salt stress on Suaeda heteroptera Kitagawa growth and osmosis regulating substance concentration[J]. Chinese Journal of Ecology, 2011, 30(1): 72-76. |
| [36] |
卢霞, 王春艳, 谢宏全, 等. 浒苔水体光谱特征参量时间序列数据拟合研究[J]. 海洋科学, 2015, 39(4): 92-100. Lu Xia, Wang Chunyan, Xie Hongquan, et al. Fitting study of time series spectral variables of Enteromorpha prolifera water body[J]. Marine sciences, 2015, 39(4): 92-100. |
| [37] |
戈良朋, 王祖伟. 盐胁迫下3种滨海盐生植物的根系生长和分布[J]. 生态学报, 2011, 31(5): 1195-1202. Yi Liangpeng, Wang Zuwei. Root system characters in growth and distribution among three littoral halophytes[J]. Acta Ecologica Sinica, 2011, 31(5): 1195-1202. |
| [38] |
Lu X, Peng H. Predicting cherry leaf chlorophyll concentrations based on foliar reflectance spectra variables[J]. Journal of the Indian Society of Remote Sensing, 2015, 43(1): 109-120. DOI:10.1007/s12524-014-0397-1 |
| [39] |
Cui S, Zhou K. A comparison of the predictive potential of various vegetation indices for leaf chlorophyll content[J]. Earth Science Informatics, 2017, 10(2): 169-181. |
| [40] |
Zou X, Hernández-Clemente R, Tammeorg P, et al. Retrieval of leaf chlorophyll content in field crops using narrow-band indices:Effects of leaf area index and leaf mean tilt angle[J]. International Journal of Remote Sensing, 2015, 36(24): 6031-6055. DOI:10.1080/01431161.2015.1110262 |
| [41] |
贾学勤, 冯美臣, 杨武德, 等. 基于多植被指数组合的冬小麦地上干生物量高光谱估测[J]. 生态学杂志, 2018, 37(2): 424-429. Jia Xueqin, Feng Meichen, Yang Wude, et al. Hyperspectral estimation of aboveground dry biomass of winter wheat based on the combination of vegetation indices[J]. Chinese Journal of Ecology, 2018, 37(2): 424-429. |
| [42] |
王长泉, 赵吉强, 陈敏, 等. 盐地碱蓬甜菜红素苷的鉴定及环境因素对其积累的影响[J]. 植物生理与分子生物学报, 2006, 32(2): 195-201. Wang Changquan, Zhao Jiqiang, Chen Min, et al. Identification of betacyanin and effects of environmental factors on its accumulation in Halophyte Suaeda salsa[J]. Journal of Plant Physiology and Molecular Biology, 2006, 32(2): 195-201. |
| [43] |
王景艳, 张高华, 苏乔, 等. 植物跨膜离子转运蛋白与其耐盐性关系研究进展[J]. 西北植物学报, 2006, 26(3): 635-640. Wang Jingyan, Zhang Gaohua, Su Qiao, et al. Research advances about the relation between membrane spanned ion transporter and salt tolerance in plants[J]. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(3): 635-640. DOI:10.3321/j.issn:1000-4025.2006.03.035 |
 2019, Vol. 43
2019, Vol. 43

