文章信息
- 佘智彩, 贾真, 彭业韶, 喻达辉. 2019.
- SHE Zhi-cai, JIA Zhen, PENG Ye-shao, YU Da-hui. 2019.
- 盐度胁迫对香港牡蛎部分生化指标的影响
- Effects of salinity stress on partial biochemical indicators of the Hong Kong oyster Crassostrea hongkongensis
- 海洋科学, 43(3): 40-45
- Marine Sciences, 43(3): 40-45.
- http://dx.doi.org/10.11759/hykx20181031001
-
文章历史
- 收稿日期:2018-10-31
- 修回日期:2018-12-16
2. 北部湾大学 食品工程学院, 广西 钦州 535011
2. College of Food Engineering, Beibu Gulf University, Qinzhou 535011, Guangxi, China
香港牡蛎(Crassostrea hongkongensis), 又名“大蚝”, 分布在我国长江以南, 核心区为广东和广西, 喜好高温低盐环境, 是我国南方主要的经济种[1-2]。其营养丰富, 味道鲜美, 素有“海中牛奶”之称, 同时还具有多种药理功能[3-4]。香港牡蛎因具有体大肉肥, 适应性强、经济价值高等特点, 在我国牡蛎养殖业中占有重要地位[5-6]。
盐度作为一种与水产动物渗透压调节密切相关的环境因素, 对水产动物的生长和代谢等具有重要影响。盐度变化迫使水产动物机体通过一系列的生理响应, 适应体内外渗透压的动态平衡, 致使其呼吸代谢、能量收支等相关指标产生相应的变化。环境胁迫会影响动物的能量代谢, 糖原是牡蛎体内参与能量代谢的重要物质, 腺苷酸激活的蛋白激酶(AMPK)和组蛋白/蛋白去乙酰化酶(SIRT1)是动物体内同时共存且和能量代谢密切相关的两种酶, 可以作为衡量动物能量平衡和逆境耐受性的有效生物标记[7-8]。因此, 牡蛎的糖原、AMPK和SIRT1可能与其盐度适应能力密切相关。抗氧化酶可清除超氧阴离子自由基, 减少逆境条件下活性氧对自身的伤害[9], 机体的总抗氧化能力(Total antioxidant capacity, T-AOC)也会影响自身的盐度适应能力。She Zhicai等[10]在进行长牡蛎盐度适应相关基因的筛选时, 也鉴定出了与活性氧代谢相关的基因。在环境盐度发生变化时, 多种动物的细胞和组织内的无机离子浓度都会发生显著的变化[11-12], Na+/K+-ATP酶的主要功能是维持细胞胞质膜的离子通透性, 保持细胞内环境中各种离子浓度的相对稳定以及细胞内环境与体外环境的渗透压平衡, 因此Na+/K+-ATP酶活力常被用作研究水产动物渗透压调节的评价指标[13]。
本实验分析了急性盐度胁迫对香港牡蛎代谢过程中部分生化指标的影响, 旨在揭示香港牡蛎适应急性盐度胁迫过程中生化指标的变化规律, 为香港牡蛎的养殖推广以及海洋贝类的盐度适应性研究积累资料。
1 材料与方法 1.1 实验材料实验所用香港牡蛎取自广西钦州茅尾海养殖区, 实验个体为同一环境条件下养殖的2龄牡蛎, 体质量为(138.46±36.05) g。实验在广西钦州市海华蚝业科技开发有限公司进行。实验前于养殖车间自然海水盐度下(盐度24)暂养3 d, 暂养水体大小为20 m3, 水温为29.8℃, 遮光, 暂养期间连续充气, 每天定时投饵、换水。
1.2 实验方法 1.2.1 实验设计实验设置6个盐度梯度: 0、8、16、24、32、40, 其中盐度24为对照组, 其余盐度为处理组, 每个盐度均设3个平行组。高盐实验水体(32和40)由自然海水加海水晶混匀调制, 低盐实验水体(0、8、16)由自然海水与自来水混匀调制, 其中盐度0的水体为自来水, 实验前水体均充分曝气。实验于80 L的水体中进行。每个实验盐度组150只香港牡蛎, 设3个平行, 实验期间的管理与暂养期相同。
1.2.2 样品采集与保存各处理组分别在胁迫后的第8、24、48、72、96、120 h时取样, 对照组取0、8、24、48、72、96、120 h样品。取样时, 从每个平行组中随机取5只香港牡蛎, 分离出鳃和闭壳肌, 放入1.8 mL冻存管内, 标记编号后投入液氮中速冻, 而后置于–80℃冰箱内保存备用。
1.2.3 样品生化指标测定糖原含量检测采用闭壳肌组织, AMPK酶活力、SIRT1酶活力、Na+/K+-ATP酶活力及T-AOC检测采用鳃组织。糖原含量检测采用南京建成生物工程研究所的糖原检测试剂盒, 具体操作步骤按照说明书并参照Zhicai She等[14]的检测方法进行。AMPK酶活力、SIRT1酶活力、Na+/K+-ATP酶活力及T-AOC委托上海酶联生物科技有限公司检测, 采用酶联免疫分析试剂盒的方法, 具体操作按照说明书步骤进行。
1.2.4 统计分析实验数据采用SPSS 22软件进行单因素方差分析(One-Way ANOVA)和Duncan氏检验, 数据统计的显著性水平定为P < 0.05。
2 结果 2.1 盐度胁迫下香港牡蛎糖原含量的变化不同盐度下香港牡蛎闭壳肌中糖原含量在0~8 h内均呈现下降趋势, 除了盐度8处理组, 其余各处理组表现为与对照组盐度差值越大糖原含量降幅越大。8~96 h内各处理组糖原含量并无明显的变化趋势, 但各组的糖原含量均高于对照组, 且在48 h时, 32和40处理组糖原含量显著高于对照组(P < 0.05), 分别为(7.70±1.40) mg/g和(7.67±1.48) mg/g, 对照组糖原含量为(5.73±0.68) mg/g。在96~120 h, 0、8、32和40盐度糖原含量呈现下降趋势, 16和24盐度组糖原含量则呈现上升趋势(图 1)。
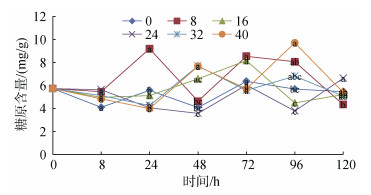 |
| 图 1 盐度胁迫对糖原含量的影响 Fig. 1 Effects of salinity stress on glycogen content 注:不同字母表示同一时间不同盐度下含量差异显著(P < 0.05), 下同 |
盐度0处理组香港牡蛎AMPK酶活力在0~8 h内逐渐下降, 在8~24 h内又逐渐上升, 而后维持相对稳定。在24~120 h内, AMPK酶活力低于其他盐度组, 其中在48~96 h差异达到显著水平(P < 0.05)。盐度40实验组香港牡蛎AMPK酶活力表现为在0~ 8 h内轻微下降, 在8~72 h内逐渐上升, 72 h后又呈逐渐下降趋势, 与其他盐度组相比, AMPK酶活力在48~120 h都保持在最高状态, 其中在72 h上升到最大值(1.01±0.05) U/g, 上升幅度达51.38%, 显著高于对照组及其他盐度组(P < 0.05)。盐度32实验组与盐度0实验组的变化相反, 在0~8 h内逐渐上升, 在8~24 h内逐渐下降, 而后维持相对稳定。盐度8、16实验组和对照组AMPK酶活力变化趋势相似, 均呈现在0~8 h内逐渐下降, 在8~48 h内又逐渐上升, 而后维持平稳状态(图 2)。
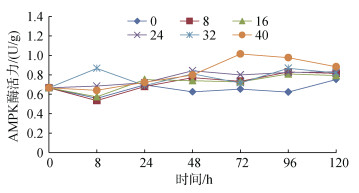 |
| 图 2 盐度胁迫对AMPK酶活力的影响 Fig. 2 Effects of salinity stress on AMPK activity |
盐度16实验组和24对照组在整个盐度胁迫过程中的变化一致, 在0~8 h有所升高, 8 h后维持基本稳定状态。盐度0和8、32和40实验组在0~48 h内的变化分别相同, 酶活力逐渐升高且大小相近。48 h后, 盐度8实验组基本维持稳定状态, 盐度0和32实验组在48~72 h下降, 72 h后呈现基本稳定趋势, 盐度40实验组有轻微的上升但也基本稳定(图 3)。与其他盐度组相比, 盐度40实验组SIRT1酶活力维持在最高水平, 最大值达(0.94±0.15) U/g, 盐度0实验组维持在最低水平, 最小值达(0.44±0.09) U/g, 且差异达到显著水平(P < 0.05)。
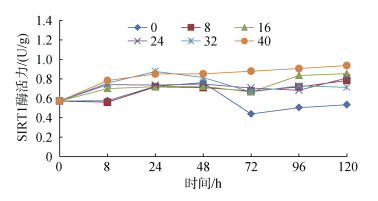 |
| 图 3 盐度胁迫对SIRT1酶活力的影响 Fig. 3 Effects of salinity stress on SIRT1 activity |
在0~48 h内, 不同盐度下香港牡蛎Na+/K+-ATP酶活力变化趋势基本相似, 在0~8 h逐渐下降, 8~48 h逐渐上升。48 h后, 盐度40实验组Na+/K+-ATP酶活力上升后又下降, 在96 h上升到最大值(1.30±0.04) U/g, 上升幅度达39.40%, 且酶活力显著高于其他盐度组(P < 0.05)。盐度0实验组Na+/K+-ATP酶活力在72~ 120 h维持在最低水平, 且在72 h下降到最小值(0.64±0.06) U/g, 下降幅度达31.43% (图 4)。
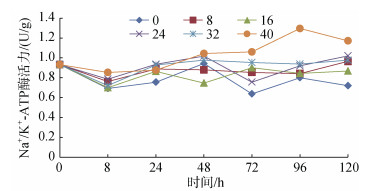 |
| 图 4 盐度胁迫对Na+/K+-ATP酶活力的影响 Fig. 4 Effects of salinity stress on Na+/K+-ATP activity |
在整个盐度胁迫过程中, 盐度32和40实验组香港牡蛎T-AOC整体呈现出上升趋势, 且盐度越高, 上升幅度越大; 盐度0实验组香港牡蛎T-AOC整体呈现出下降趋势; 盐度8和16实验组及对照组整体呈现相对稳定的平衡状态(图 5)。盐度越高, T-AOC值越大。盐度40实验组香港牡蛎T-AOC在120 h上升到最大值(174.47±27.34) U/g, 上升幅度达70.88%, 且在96~120 h与其他盐度组的差异均达到显著水平(P < 0.05)。盐度0实验组香港牡蛎T-AOC在120 h下降到最小值(88.99±27.08) U/g, 下降幅度达12.84%。
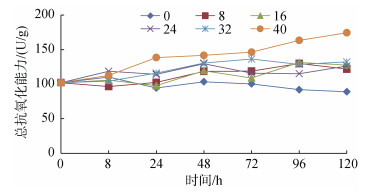 |
| 图 5 盐度胁迫对总抗氧化能力的影响 Fig. 5 Effects of salinity stress on T-AOC |
糖原是牡蛎体内的主要能量物质来源, 与其能量代谢密切相关[15]。本研究发现, 香港牡蛎在不同盐度胁迫幅度下, 其闭壳肌中糖原含量在0~8 h内均呈现下降趋势, 且大多实验组表现为与对照组盐度差值越大糖原含量降幅越大。这可能是因为盐度的急剧变化引起牡蛎的短期应激反应, 使能量代谢更加活跃, 需消耗糖原来维持自身的渗透平衡, 抵抗外界环境的变化所致[16]。盐度胁迫8 h后, 各盐度组的变化不同, 且无明显的规律可循。这与刘旭佳等[17]的研究结果类似, 可能与牡蛎中糖原含量的个体差异较大有关[14]。其中对照组24虽未经历盐度胁迫, 但其糖原含量也随时间出现明显的变化, 这可能是由于取样时不同个体间的差异所致, 也可能是操作过程中的系统误差所致。但我们重点关注的是不同盐度组之间糖原含量的差异情况, 对照组糖原含量虽出现明显变化, 但其与低盐组的差异并不明显, 主要与高盐组之间有显著差异, 这也与香港牡蛎具有广盐且偏低盐的盐度适应性一致。AMPK和SIRT1是与能量代谢密切相关的两种酶, 其酶活力在盐度胁迫前期上升, 也说明牡蛎在盐度胁迫前期的能量代谢更加活跃。徐志鑫等[18]研究发现, 尼罗罗非鱼(Oreochromis niloticus)在高盐胁迫下, 肌糖原和肝糖原含量随时间增加而降低, 与本研究糖原的前期变化一致。王雅倩等[19]探讨了长竹蛏(Solen gouldi)在不同环境条件下的能量收支规律, 发现在体液等渗盐度时其用于生长的能量比例显著大于其他盐度组, 说明在盐度胁迫下, 长竹蛏用于生长的能量减少, 用于应激反应的能量代谢增加, 也支持了本研究的结果。
3.2 盐度对香港牡蛎酶活力的影响酶活力是研究水产动物重要的生理学指标, 对于评价水产动物的健康状况、营养状况及对外界环境的适应状况有重要意义。研究发现, 盐度对多种酶的活力都会产生影响[13]。本研究发现, 在盐度胁迫下, 各盐度组香港牡蛎鳃中Na+/K+-ATP酶活力在0~8 h内均急剧下降; 8~48 h内, 酶活力上升; 48~120 h内, 酶活力逐渐趋于平稳状态。其中对照组Na+/K+-ATP酶活力也随时间出现了明显的变化, 这可能与对照组糖原含量出现变化的原因相同。各盐度组总体表现为盐度越高, 酶活力越强, 并与初始状态有明显差异, 且盐度突变幅度越高, 差异越明显。这与柳旭东等[13]总结的水产动物随外界环境盐度变化自身的渗透压调节过程基本相符。推测香港牡蛎在盐度胁迫下, 0~8 h属于应激阶段, Na+/K+-ATP酶活力降低, 8~48 h为适应阶段, 酶活力主动调节, 经过适应期后, 酶活力在48 h后趋向稳定。酶活力最终达到稳定状态所需的时间与牡蛎的大小、健康状况以及盐度变化幅度有密切关系。
3.3 盐度对香港牡蛎抗氧化能力的影响本研究发现, 在盐度胁迫下, 香港牡蛎鳃的总抗氧化能力T-AOC随盐度突变幅度的不同呈现出不同的变化规律。总体表现为:高盐胁迫下随时间的增加而升高, 低盐胁迫下随时间的增加而降低的变化趋势, 且盐度偏离正常值越高, T-AOC的变化幅度越大。周东等[20]研究发现, 三疣梭子蟹(Portunus trituberculatus)在低盐胁迫下鳃中与抗氧化相关的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活力均呈下降趋势, 这与本研究的结果一致。但是张琴星等[21]发现, 随着盐度降低, 多鳞四指马鲅(Eleutheronema rhadinum)幼鱼SOD和CAT活性在7 d时显著升高, 28 d后下降并趋于稳定; 杨健等[22]研究发现, 盐度因子可诱导军曹鱼(Rachycentron canadum)的抗氧化应激反应, 但是其肌肉中抗氧化酶活力随盐度升高而降低。这与本文的盐度可引起抗氧化应激反应一致, 但是, 抗氧化能力的变化趋势却相反。这可能是因为物种不同、组织不同, 由盐度引起的抗氧化应激反应也不同导致的。
| [1] |
张跃环, 王昭萍, 闫喜武, 等. 香港巨牡蛎与长牡蛎种间杂交及早期杂种优势分析[J]. 水产学报, 2012, 36(9): 1358-1366. Zhang Yaohuan, Wang Zhaoping, Yan Xiwu, et al. Analysis of early heterosis for interspecific hybrids between Crassostrea hongkongensis and C. gigas[J]. Journal of Fisheries of China, 2012, 36(9): 1358-1366. |
| [2] |
常亚青. 贝类增养殖学[M]. 北京: 中国农业出版社, 2007: 207-213. Chang Yaqing. Shellfish Breeding Science[M]. Beijing: China Agriculture Press, 2007: 207-213. |
| [3] |
秦艳平, 张跃环, 周颖力, 等. CB与6-DMAP诱导香港牡蛎三倍体的效果比较[J]. 水产学报, 2017, 41(2): 250-257. Qin Yanping, Zhang Yaohuan, Zhou Yingli, et al. Comparative studies on triploidy induction using CB and 6-DMAP in Crassostrea hongkongensis[J]. Journal of Fisheries of China, 2017, 41(2): 250-257. |
| [4] |
陈惠源, 蔡俊鹏. 牡蛎的营养药用价值及其开发利用[J]. 中药材, 2005, 28(3): 172-174. Chen Huiyuan, Du Junpeng. Nutritional and medicinal value of oyster and its exploitation and utilization[J]. Chinese Medicinal Materials, 2005, 28(3): 172-174. DOI:10.3321/j.issn:1001-4454.2005.03.004 |
| [5] |
张跃环, 王昭萍, 闫喜武, 等. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状[J]. 生态学报, 2012, 32(4): 1105-1114. Zhang Yaohuan, Wang Zhaoping, Yan Xiwu, et al. Phenotypic traits of both larvae and juvenile Crasstrea hongkongensis and C. gigas[J]. Acta Ecologica Sinica, 2012, 32(4): 1105-1114. |
| [6] |
谢忠明. 海水经济贝类养殖技术[M]. 北京: 中国农业出版社, 2003: 557-578. Xie Zhongming. Marine economic shellfish culture technology[M]. Beijing: China Agriculture Press, 2003: 557-578. |
| [7] |
Hardie D G, Sakamoto K. AMPK:A Key Sensor of Fuel and Energy[J]. Physilology, 2006, 21: 48-60. |
| [8] |
Ruderman N B, Xu X J, Nelson L, et al. AMPK and SIRT1:a long-standing partnership?[J]. American Journal of Physiology-Endocrinology and Metabolism, 2010, 298: E751-760. DOI:10.1152/ajpendo.00745.2009 |
| [9] |
张峰, 李光友. 贝类血细胞活性氧体内防御作用的研究进展[J]. 海洋科学, 1999, 2: 16-19. Zhang Fwng, Li Guangyou. Progress on researches of reactive oxygen intermediates of molluscs hemocytes in internal defense[J]. Marine Science, 1999, 2: 16-19. |
| [10] |
She Z C, Li L, Meng J, et al. Population resequencing reveals candidate genes associated with salinity adaptation of the Pacifc oyster Crassostrea gigas[J]. Scientific Reports, 2018, 8: 8683. DOI:10.1038/s41598-018-26953-w |
| [11] |
Meng J, Qi H G, Zhu Q H, et al. Genome and transcriptome analyses provide insight into the euryhaline adaptation mechanism of Crassostrea gigas[J]. Plos One, 2013, 8(3): e58563. DOI:10.1371/journal.pone.0058563 |
| [12] |
Zhao X L, YU H, Kong L F, et al. Transcriptomic Responses to Salinity Stress in the Pacific Oyster Crassostrea gigas[J]. Plos One, 2012, 7(9): e46244. DOI:10.1371/journal.pone.0046244 |
| [13] |
柳旭东, 张利民, 王际英, 等. 盐度对水产动物组织中酶活力的影响[J]. 养殖与饲料, 2008, 11: 68-71. Liu Xudong, Zhang Limin, Wang Jiying, et al. Effect of salinity on enzyme activity in aquatic animal tissues[J]. Animals Breeding and Feed, 2008, 11(11): 68-71. DOI:10.3969/j.issn.1671-427X.2008.11.031 |
| [14] |
She Z C, Li L, Qi H G, et al. Candidate gene polymorphisms and their association with glycogen content in the Pacific oyster Crassostrea gigas[J]. Plos One, 2015, 10(5): e0124401. DOI:10.1371/journal.pone.0124401 |
| [15] |
Samain J F. Review and perspectives of physiological mechanisms underlying genetically-based resistance of the Pacific oyster Crassostrea gigas to summer mortality[J]. Aquatic Living Resources, 2011, 24(3): 227-236. DOI:10.1051/alr/2011144 |
| [16] |
Berger V J, Kharazova A D. Mechanisms of salinity adaptations in marine molluscs[J]. Hydrobiologia, 1997, 355: 115-126. DOI:10.1023/A:1003023322263 |
| [17] |
刘旭佳, 黄国强, 李洁, 等. 褐牙鲆幼鱼GH、IGF-I、STC、RNA/DNA和糖原含量对盐度操作的响应[J]. 广西科学, 2013, 20(2): 171-175. Liu Xujia, Huang Guoqiang, Li Jie, et al. Response of GH, IGF-I, glycogen content and RNA/DNA ratio of juvenile Paralichthys olivaceus to salinity manipulation[J]. Guangxi Sciences, 2013, 20(2): 171-175. DOI:10.3969/j.issn.1005-9164.2013.02.023 |
| [18] |
徐志鑫.盐度胁迫下尼罗罗非鱼的能量代谢及其胆固醇营养的研究[D].上海: 华东师范大学, 2017. Xu Zhixin. Energy metabolism and cholesterol nutrition of nile tilapia Oreochromis niloticus under salinity stress[D]. Shanghai: East China Normal University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10269-1017088382.htm |
| [19] |
王雅倩, 刘永波, 赵文, 等. 长竹蛏的能量收支研究[J]. 渔业研究, 2018, 40(3): 203-208. Wang Yaqian, Liu Yongbo, Zhao Wen, et al. Study on energy budget of Solen strictus Gould[J]. Journal of Fisheries Research, 2018, 40(3): 203-208. |
| [20] |
周东, 母昌考, 宋微微, 等. 低盐胁迫对三疣梭子蟹组织中抗氧化酶和ATP酶活力的影响[J]. 生态科学, 2014, 33(4): 698-703. Zhou Dong, Mu Changkao, Song Weiwei, et al. Effects of low salinity stress on the antioxidant enzyme and ATPase activities in tissues of swimming crab Portunus trituberculatus[J]. Ecological Science, 2014, 33(4): 698-703. |
| [21] |
张琴星, 张涛, 侯俊利, 等. 盐度变化对多鳞四指马鲅幼鱼鳃丝Na+/K+-ATP酶及肝脏抗氧化酶活性的影响[J]. 海洋渔业, 2013, 35(3): 324-330. Zhang Qinxing, Zhang Tao, Hou Junli, et al. Effects of salinity on activities of gill Na+/K+-ATPase and liver antioxidase in juvenile Eleutheronema rhadinum[J]. Marine Fisheries, 2013, 35(3): 324-330. DOI:10.3969/j.issn.1004-2490.2013.03.010 |
| [22] |
杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J]. 广东海洋大学学报, 2007, 27(4): 25-29. Yang Jian, Chen Gang, Huang Jiansheng, et al. Effects of Temperature and Salinity on the Growth and Activities of Antioxidant Enzymes of Cobia (Rachycentron canadum) Juveniles[J]. Journal of Guangdong Ocean University, 2007, 27(4): 25-29. DOI:10.3969/j.issn.1673-9159.2007.04.006 |
 2019, Vol. 43
2019, Vol. 43

