
文章信息
- 王瑞, 于佳佳, 王鸿霞, 刘保忠. 2019.
- WANG Rui, YU Jia-jia, WANG Hong-xia, LIU Bao-zhong. 2019.
- 副溶血弧菌攻毒过程中文蛤肝胰腺弧菌载量变化的分析
- Vibrio load variation in the hepatopancreas of clam (Meretrix petechialis) under Vibrio parahaemolyticus challenge
- 海洋科学, 43(4): 29-35
- Marine Sciences, 43(4): 29-35.
- http://dx.doi.org/10.11759/hykx20190118001
-
文章历史
- 收稿日期:2019-01-18
- 修回日期:2019-03-29
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266273, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
文蛤(Meretrix petechialis)又名短文蛤, 属于软体动物门(Mollusca)、双壳纲(Bivalvia)、帘蛤目(Veneroida)、帘蛤科(Veneridae)、文蛤属(Meretrix), 是一种重要的海水养殖贝类。近年来养殖文蛤的流行性疾病和规模性死亡屡有发生, 其中, 弧菌性疾病最为常见, 流行最为广泛并且导致的死亡最为严重, 已成为制约文蛤养殖产业发展的瓶颈问题之一[1-2]。目前报道较多的文蛤弧菌病主要是由副溶血弧菌、弗尼斯弧菌、溶藻弧菌、哈氏弧菌等引起的, 致病过程通过黏附、侵袭、体内增殖及产生毒力因子等步骤, 对宿主机体产生损害以及对代谢产生影响[3-4]。弧菌在水体环境和生物体内广泛分布, 其致病性受宿主的生理状态及水体环境条件等综合因素影响[5]。因此, 研究弧菌感染和致病机制, 筛选和培育抗弧菌病的优良种质, 是降低贝类养殖过程病害发生的有效途径。
在宿主遭受病原感染的过程中, 生物的免疫系统主要通过检测和消除入侵的病原体来保护自身免受感染。为了应对病原感染, 宿主必须要控制病原菌在体内的负荷, 来保证机体各项功能的正常运行[5]。免疫抗性作为宿主响应病原体感染的机制之一, 反应了宿主清除病原体的能力, 它通过杀死或者降低靶组织中病原体的增殖来控制宿主体内病原菌的载量[6-7]。免疫抗性通常用感染后宿主体内病原体载菌量来衡量, 即以载菌量的倒数来对抗性进行表示[8]。因此, 载菌量的变化反应了病原菌入侵后, 宿主与外源病原菌之间的相互作用, 是重要的免疫抗性相关指标。
在育种实践中通常需要对文蛤进行人工浸泡感染实验, 来模拟文蛤可能遭遇的弧菌胁迫环境, 从而实现对抗性的评价和筛选。本研究中, 我们首先监测了攻毒水体中24小时内弧菌数量的变化, 分析了攻毒后不同时间点文蛤体内载菌量的变化趋势及不同个体间的载菌量差异, 并进一步在群体水平上研究了弧菌不同感染强度下, 环境水体含菌量和宿主体内的载菌量的变化及相关性。期望通过上述研究, 为进一步研究文蛤弧菌抗性相关机制提供基础。
1 材料与方法 1.1 实验材料从养殖群体中随机选取1 200只健康的2年龄文蛤, 在实验开始前两周进行净化暂养, 净化的过程主要通过将文蛤暂养在自然砂滤海水中, 定时投喂人工培养的饵料来实现。期间每天更换海水, 早晚各投喂人工培养的金藻一次, 每次投喂后保证水体中金藻浓度为50万个/mL, 以保证文蛤正常生长需要。
实验中攻毒所用的副溶血弧菌(Vibrio parahae molyticus)菌株是本实验室2007年从江苏海域规模性死亡的文蛤中分离并放于–80℃冰箱中长期保存[9]。从冰箱取出的弧菌划线于2216E固体培养基上活化, 28℃培养24~48 h, 之后挑取单菌落接种于5 mL小体系2216E液体培养基中, 28℃摇床中培养12 h, 然后将其接种于大体积的2216E液体培养基中批量培养。为了快速直接测定培养基中弧菌的浓度, 我们利用血球计数板计数确定弧菌浓度, 在用血球计数板对弧菌进行计数时, 取3~5个重复, 每一个重复计数3次。
1.2 弧菌攻毒实验 1.2.1 副溶血弧菌攻毒实验(1) 将已知浓度的副溶血弧菌, 按照设定浓度1×107 CFU/mL添加到砂滤海水中。500 L海水中放入500只文蛤, 攻毒期间海水温度保持28℃, 持续充分充气, 确保水体中的菌是均匀的, 每天早晚各投喂金藻一次。分别在添加前和添加后0 h, 6 h, 12 h, 24 h对水体进行取样, 每次在不同位置、不同深度随机取3个水样检测水体中的副溶血弧菌数量。24时后更换培育海水并重新添加弧菌, 所有设置和取样时间同第一次实验, 重复一次检测水体中副溶血弧菌的数量变化。
(2) 实验设置攻毒浓度为1×107 CFU/mL, 对500只文蛤进行连续7天的副溶血弧菌感染, 期间海水温度保持28℃, 持续充气, 每24小时更换海水和弧菌。在攻毒第d0, d1, d3, d6相应时间点分别取64只文蛤的肝胰腺用于载菌量检测, 分析攻毒期间文蛤体内载菌量的变化。
(3) 实验设置1×105, 1×106, 1×107, 3×107 CFU/mL四个不同强度的副溶血弧菌刺激。每个浓度设置3个重复, 每个重复50只文蛤, 保持海水温度28℃条件下进行连续攻毒7天, 攻毒期间每24小时更换海水和副溶血弧菌。停止攻毒后继续24小时更换海水。在攻毒d1和d5, 每个浓度3个重复中分别随机取4个文蛤, 即每个浓度共取12个文蛤, 用于检测文蛤体内的载菌量。同时对每一天的存活和死亡情况进行监测记录。
1.2.2 副溶血弧菌数量检测使用弧菌选择性培养基TCBS, 通过涂板计数方式检测载菌量。文蛤肝胰腺组织用分析天平称重后加入500 μL灭菌海水匀浆, 将原液和梯度稀释10×, 100×, 1 000×, 10 000×的匀浆液, 分别吸取50 μL涂于TCBS平板上。28℃过夜培养, 选择合适的稀释倍数的平板, 即细菌菌落在30~300的稀释度平板进行菌落计数, 根据该稀释倍数、组织重将载菌量换算成CFU/mg。
1.2.3 弧菌种类检测我们挑取TCBS平板上的长出的绿色和黄色克隆, 分别提取DNA, 以DNA作为PCR模板进行16SrDNA序列的PCR扩增。扩增所用的正向引物选用27f(AGAGTTTGATCTTGGCTCAGA), 反向引物选用1 492r(TACGGTTACCTTGTTACGACTT)。PCR产物送上海生工双向测序。测序结果得到的序列在NCBI数据库进行BLAST比对分析。
1.3 数据分析攻毒前后不同时间点载菌量数据差异显著性检验采用One-way ANOVA的Tukey’s方法, 显著性水平设定为P < 0.05;文蛤肝胰腺与水体环境中弧菌含量的相关关系, 使用Spearman秩相关性分析; 攻毒后d1天载菌量在进行lg转换后进行正态性检验; 以上分析均使用SPSS 19.0统计分析软件完成。
2 结果 2.1 副溶血弧菌TCBS检测TCBS为特异性培养弧菌的培养基, 实验体系中对添加副溶血弧菌的海水进行TCBS平板培养发现, 平板上除了生长大量的绿色菌落外, 还生长了少量的黄色菌落(图 1 a)。在TCBS平板上随机选取了30个绿色菌落和3个黄色菌落分别进行16S的扩增和测序, NCBI中对测序结果BLAST比对发现, 所有绿色菌落的16S序列(1 444 bp)与副溶血弧菌比对相似性达到99%, 另外2个黄色菌落16S序列(1 448 bp)与弗尼斯弧菌(Vibrio furnissii)比对相似性均为99%, 1个黄色菌落16S序列(1 447 bp)比对为罗尼氏弧菌(Vibrio shilonii)。我们进一步检测了不加副溶血弧菌的对照组, 即砂滤海水养殖相同数量的文蛤, 取相同体积的水样进行TCBS平板培育, 发现平板中偶尔会检测到黄色菌落的生长(图 1b)。表明实验体系中海水本底的弧菌数量较少, 因此对绿色菌落进行计数, 可以较准确的反应水体中副溶血弧菌的数目。
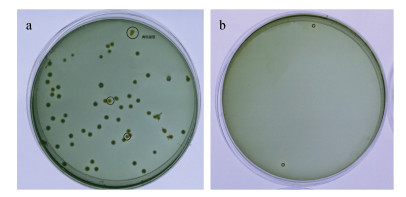 |
| 图 1 TCBS平板上菌落生长情况 Fig. 1 Characteristics of Vibrio colony on TCBS plate 注: a.攻毒组; b.对照组 |
在文蛤弧菌抗性的评价过程中, 需要对文蛤培养水体中人工添加副溶血弧菌进行攻毒实验。为了检测攻毒实验海水中弧菌的实际浓度能否达到设计浓度, 我们监测了攻毒过程中弧菌在水体中的生长变化。两次检测结果显示, 按照设计浓度添加副溶血弧菌, 0 h刚加入弧菌的海水中活菌初始浓度为(5.05±0.15)× 105~(6.25±0.35)×105 CFU/mL, 低于1×107 CFU/mL的设定浓度; 加入弧菌后6h检测海水中含活的弧菌浓度为(2.46±0.09)×107~(2.74±0.20)×107 CFU/mL, 约是期望浓度的两倍; 水体菌量在12 h下降至(1.86± 0.11)×106~(4.70±0.28)×106 CFU/mL, 24 h达到低点(6.85±0.97)×105~(7.77±0.97)×105 CFU/mL(图 2)。从整体看, 攻毒水体中添加弧菌后, 两次实验弧菌数值基本一致, 菌含量呈现出一个升高、维持、降低的趋势, 反应了弧菌在水体中一致的动态变化过程。检测周期内超过1/3的时间里海水中弧菌的有效浓度是在1×107 CFU/mL附近变化, 实际攻毒浓度能够符合预期的浓度要求。
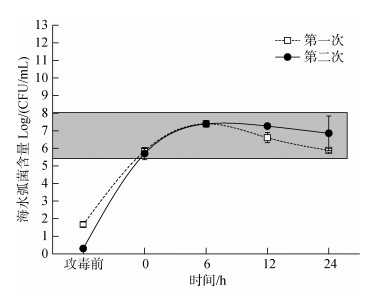 |
| 图 2 攻毒水体中副溶血弧菌数量的日变化 Fig. 2 Daily variation of bacterial number in seawater under Vibrio parahaemolyticus challenge |
实验明确了攻毒水体中副溶血弧菌的生长变化规律后, 我们进一步分析经过副溶血弧菌连续浸泡过程中文蛤体内载菌量的变化趋势。结果显示, 在一段时间的净化养殖后, 即副溶血弧菌攻毒前(d0天) 64个文蛤个体只有12个个体能够检测到副溶血弧菌负载, 而81%的个体副溶血弧菌的载量为0。攻毒后d1天的副溶血弧菌载量与感染前相比有显著的增高, 平均载菌量为(2 369.65±4 838.93)CFU/mg; 而在持续感染的d3天, 即使外界海水的副溶血弧菌保持较高浓度, 宿主体内载菌量表现为急剧下降, 平均载菌量为(6.67±17.32)CFU/mg; 持续感染d6天文蛤体内载菌量仍处于一个较低的水平, 主要分布在0~ 121.87 CFU/mg, 与d3天没有显著差异。弧菌载量总体变化趋势表现为在d1天急剧上升, 在d3天迅速下降, 并在后期维持一个较低的水平。
另外, 从图 3中也可以发现, 攻毒后在同一个时间点文蛤不同个体副溶血弧菌载量存在很大差异。在感染后d1天, 载菌量分布在3~20 833 CFU/mg之间, 载菌量在102 CFU/mg肝胰腺数量级的个体最多, 占比53.13%, 104数量级的个体占比为6.25%, 而且64个个体的载菌量在lg转换后服从正态分布(P > 0.05)。在攻毒d3天, 载菌量为0的个体占总数的64.01%。在攻毒d6天, 载菌量为0的个体占到46.87%。这种个体水平的载菌量差异为我们进行免疫抗性的筛选提供了素材。
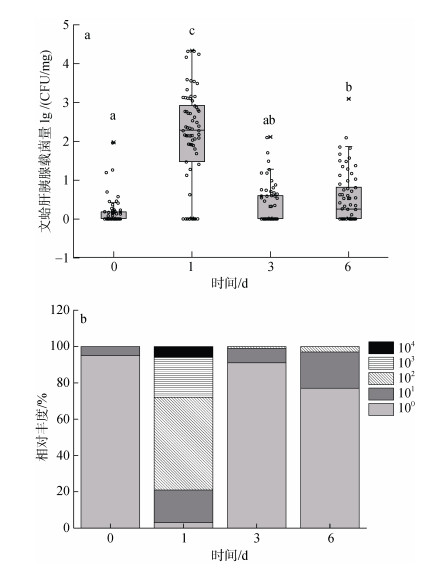 |
| 图 3 副溶血弧菌攻毒过程中文蛤体内载菌量的变化和分布 Fig. 3 Dynamics and distribution of Vibrio load in the clam M. petechialis under Vibrio parahaemolyticus challenge |
通过设计不同浓度的副溶血弧菌浸泡攻毒实验, 分析攻毒过程中文蛤体内载菌量的变化及其与攻毒强度的关系。结果发现, 在攻毒前期(d1), 随着攻毒强度的增大, 文蛤体内载菌量也呈现出升高的趋势, 且文蛤与水体环境的弧菌含量之间呈显著的正相关(Spearman’s ρ=0.899, P=0.000)。在攻毒中后期(d5), 4个不同攻毒强度组文蛤体内载菌量与第一天相比均明显回落, 低浓度组d1天的弧菌载量是d5天的1.35倍, 高浓度组d1天则为d5天的348.50倍。从图 4中可以看出, 攻毒中后期文蛤体内载菌量在4个不同攻毒强度组之间无显著差异, 且呈现出一个较低水平, 为0~205 CFU/mg。与此同时我们对不同强度副溶血弧菌感染导致的累积死亡率进行了统计分析(图 5), 结果显示, 在1×105 CFU/mL的感染条件下, 文蛤中没有出现死亡的个体, 在1×106 CFU/mL条件下, 累积死亡率为7.50%, 而在1×107 CFU/mL条件下, 累积死亡率为58.06%, 3×107 CFU/mL条件下文蛤累积死亡率高达100%。以上结果表明弧菌感染导致死亡是一个阈值性状。而文蛤不同时期体内弧菌载量与文蛤健康状态或死亡之间的关系, 还需要进一步研究。
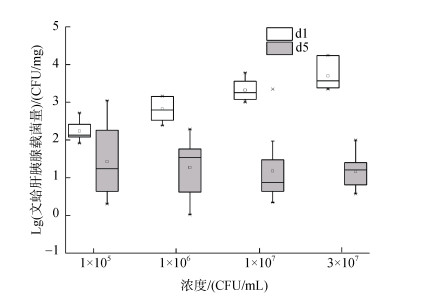 |
| 图 4 不同浓度副溶血弧菌感染后第1天和第5天文蛤肝胰腺副溶血弧菌的载量变化 Fig. 4 Bacterial load of M. petechialis challenged using different doses of Vibrio parahaemolyticus at 1 and 5 days post infection |
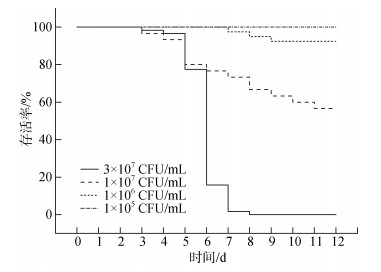 |
| 图 5 不同浓度副溶血弧菌感染下文蛤存活率 Fig. 5 Survival rate of M. petechialis challenged using different doses of Vibrio parahaemolyticus |
在水产动物的免疫学研究中, 经常采用外界病原生物刺激的方法模拟宿主在自然条件下的胁迫环境, 而宿主体内的病原菌含量是激活宿主免疫系统和影响宿主存活的重要因素。在文蛤等贝类免疫研究和抗性选育中, 为了模拟自然环境条件下的病原感染过程, 获得同自然死亡相同或相似的症状, 我们在攻毒实验中采用了浸泡感染的方法。同注射攻毒相比, 浸泡法实验时间长, 耗菌量大, 并且浓度较难控制[10]。为了明确人工培养的弧菌在攻毒水体中的生长繁殖规律, 本实验采用经典的TCBS涂平板的方法, 检测了实验水体中添加的弧菌活菌的数量。结果显示, 弧菌添加到攻毒水体后实测的初始浓度, 明显低于设定浓度, 可能是因为从培养基到海水环境的剧烈转换导致弧菌不适应所致。弧菌在海水中经过一段时间的适应和生长, 弧菌的实测浓度可以达到并维持在预期浓度附近变动。12小时后, 活菌的浓度呈出下降的趋势。上述结果明确了水体中弧菌的生长和繁殖规律, 我们通过对菌液添加浓度、添加时间和培养温度等条件进行控制, 可以实现弧菌浸泡攻毒的标准化和有效性, 为模拟文蛤在自然条件下的弧菌胁迫环境, 深入研究载菌量及文蛤弧菌抗性相关机制提供了可能。
在对宿主感染过程中, 病原菌的入侵会激发宿主的免疫系统的反应。弧菌的致病性取决于弧菌与宿主细胞间的相互作用, 弧菌的致病过程首先通过吸附宿主细胞, 侵入细胞中并在体内大量进行增殖, 释放出有毒的物质进而导致宿主死亡[11]。Brown和Losee通过研究美洲牡蛎(Crassostrea virginica)幼体弧菌病证实了这种致病过程, 在长牡蛎(C. gigas)、硬壳蛤(Mercenaria mercenaria)的许多研究也都证实了类似的疾病发展过程[12-13]。我们的弧菌浸泡实验也检测到了弧菌在文蛤肝胰腺组织中大量增殖的过程, 与未感染组比, 感染后d1天弧菌的平均数量增加了890倍。但随着宿主免疫防御系统的被激活, 体内多数病原菌被杀灭, 随后的时间我们检测到宿主肝胰腺组织弧菌载量迅速下降, 并维持一个较低的水平。曾有研究证明, 一定浓度的鳗弧菌(V. anguillarum)胁迫青蛤(Cyclina sinensis)后, 使宿主体内相关免疫基因的表达发生一定程度的上调, 并产生大量免疫相关的活性物质[14]。在病原菌入侵激活宿主免疫反应后, 除了通过吞噬作用完成免疫作用外, 贝类还会产生释放溶酶体、凝集素、非特异性抗菌肽等各类抗菌物质来杀灭病原菌[15-16]。另外, 已有研究表明, 宿主体内已有的微生物群落相对稳定的结构, 可以抵抗病原菌的侵染[17-18]。因此, 我们推测文蛤肝胰腺组织弧菌载量的迅速下降, 可能与宿主免疫系统和宿主肝胰腺微生物群落具有较强的缓冲能力来维持微生物群落稳定性有关。
通过改变水体的弧菌感染浓度, 我们发现感染的早期阶段, 随着水体中弧菌浓度的升高, 通过文蛤滤食作用, 相应的文蛤体内载菌量也更高, 意味着海水弧菌浓度越高的组, 有更多的弧菌黏附、侵袭、并在宿主体内增殖。而在感染的中后期, 可能是由于宿主免疫系统以及肝胰腺微生物群落的缓冲作用[18], 早期具有不同弧菌载量的文蛤体内, 此时的弧菌载量无显著差异, 都呈现出一个较低水平。与之相对应在1×105 CFU/mL的感染条件下, 文蛤死亡率为0, 而3×107 CFU/mL条件下, 文蛤感染后的累积死亡率100%。有研究人员在凡纳滨对虾(Litopenaeus vannamei)病原菌感染的研究中也发现, 不同的弧菌攻毒浓度会对宿主的死亡率有极大影响, 高浓度的弧菌刺激会提前宿主大规模死亡时间, 且导致更高的死亡率[19]。另外, 高、低不同的病原菌攻毒浓度会影响宿主产生不同的免疫应答, 例如当用高浓度弧菌感染桡足类虎斑猛水蚤(Tigriopus japonicus)时, 高浓度组水蚤体内重要的免疫调节因子NF-κB抑制剂(IκB)和LPS诱导的TNF-α因子(LITAF)水平显著升高[20]。据此, 我们推测不同的弧菌攻毒强度所导致的感染前期文蛤体内载菌量的差异, 可能会引发文蛤免疫系统反应强度的差异, 而过强的免疫反应在清除病原微生物的同时, 对宿主的健康也会造成严重的伤害, 受到病原侵染的宿主会产生多种免疫反应, 这种免疫反应将消耗大量的能量, 并产生大量活性氧, 这些活性氧分子在杀灭入侵的病原微生物的同时也会对宿主的细胞、组织和器官造成严重伤害, 进而导致宿主生理机能的损伤和免疫系统的破坏, 这可能是除了高浓度致病菌对宿主的伤害外, 另一个造成高死亡率的原因[21]。
4 结语本研究中我们通过浸泡攻毒实验模拟了文蛤在自然条件下的弧菌胁迫环境, 连续监测了水体中弧菌的生长和变化情况, 进而分析了不同攻毒时间文蛤体内载菌量的变化和个体差异, 并通过不同浓度的弧菌攻毒实验, 研究了宿主体内载菌量与攻毒强度的相关性。上述研究结果将为深入了解贝类对致病菌侵染的免疫响应机制和抗性品种选育提供科学基础。
| [1] |
刘连生, 闫茂仓, 林志华, 等. 引起文蛤暴发性死亡病原菌的分离和鉴定[J]. 微生物学通报, 2009, 36(1): 71-77. Liu Liansheng, Yan Maocang, Lin Zhihua, et al. Pathogens isolation and identification of eruptive epidemic disease in Meretrix meretrix[J]. Acta microbiologica Sinica, 2009, 36(1): 71-77. |
| [2] |
张彬, 黄婷, 熊建华, 等. 文蛤主要弧菌性病害研究进展[J]. 广东农业科学, 2012, 39(17): 128-130. Zhang Bin, Huang Ting, Xiong Jianhua, et al. Research progress of vibriosis in hard calm, Meretrix meretrix Linnaeus[J]. Guangdong Agricultural Sciences, 2012, 39(17): 128-130. DOI:10.3969/j.issn.1004-874X.2012.17.044 |
| [3] |
王凤青, 孙玉增, 任利华, 等. 海水养殖中水产动物主要致病弧菌研究进展[J]. 中国渔业质量与标准, 2018, 8(2): 49-56. Wang Fengqing, Sun Yuzeng, Ren Lihua, et al. Research progress on the main pathogenic Vibrio affecting aquatic animals in mariculture[J]. China Fishery Quality And Standards, 2018, 8(2): 49-56. DOI:10.3969/j.issn.2095-1833.2018.02.007 |
| [4] |
李国, 闫茂仓, 常维山, 等. 我国海水养殖贝类弧菌病研究进展[J]. 浙江海洋学院学报(自然科学版), 2008, 27(3): 327-334. Li Guo, Yan Maocang, Chang Weishan, et al. Review on studing of Vibriosis of shellfish farming in China[J]. Journal of Zhejiang Ocean University (Natural Science), 2008, 27(3): 327-334. DOI:10.3969/j.issn.1008-830X.2008.03.014 |
| [5] |
Howick V, Lazzaro B. The genetic architecture of defense as resistance to and tolerance of bacterial infection in Drosophila melanogaster[J]. Molecular Ecology, 2017, 26(6): 1533. DOI:10.1111/mec.14017 |
| [6] |
Boots M, Bowers R G. Three mechanisms of host resistance to microparasites-avoidance, recovery and tolerance-show different evolutionary dynamics[J]. Journal of Theoretical Biology, 1999, 201(1): 13-23. DOI:10.1006/jtbi.1999.1009 |
| [7] |
Roy B A, Kirchner J W. Evolutionary dynamics of pathogen resistance and tolerance[J]. Evolution, 2000, 54(1): 51-63. DOI:10.1111/j.0014-3820.2000.tb00007.x |
| [8] |
Malo D, Skamene E. Genetic control of host resistance to infection[J]. Trends in Genetics, 1994, 10(10): 365-371. DOI:10.1016/0168-9525(94)90133-3 |
| [9] |
Yue X, Liu B, Xiang J, et al. Identification and characterization of the pathogenic effect of a Vibrio parahaemolyticus-related bacterium isolated from clam Meretrix meretrix with mass mortality[J]. Journal of Invertebrate Pathology, 2010, 103(2): 0-115. |
| [10] |
王段香, 余志坚, 朱学春, 等. 鱼害粘球菌对兴国红鲤和彭泽鲫致病性[J]. 南昌大学学报(理科版), 2003, 27(3): 288-291. Wang Duanxiang, Yu Jianzhi, Zhu Xuechun, et al. The pathogenic ability of Mayxococcus pisicola to xingguo red carp (Cyprinus carpio var. singuonensis) and pengzecrucian carp (Carassius auratus var. pengzenensis)[J]. Journal of Nanchang University(Natural Science), 2003, 27(3): 288-291. DOI:10.3969/j.issn.1006-0464.2003.03.022 |
| [11] |
Elston R, Leibovitz L. Pathogenesis of experimental Vibriosis in larval American oysters, Crassostrea virginica[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(6): 964-978. DOI:10.1139/f80-126 |
| [12] |
Tubiash H S, Colwell R R, Sakazaki R. Marine Vibrios associated with bacillary necrosis a disease of larval and juvenile bivalve mollusks[J]. Journal of Bacteriology, 1970, 103(1): 271-272. |
| [13] |
Brown C, Losee E. Observations on natural and induced epizootics of vibriosis in Crassostrea virginica larvae[J]. Journal of Invertebrate Pathology, 1978, 31(1): 41-47. DOI:10.1016/0022-2011(78)90107-6 |
| [14] |
丁丹, 潘宝平, 王玉梅, 等. 青蛤(Cyclina sinensis) AP-1基因的克隆及在鳗弧菌(Vibrio anguillarum)侵染下的表达分析[J]. 海洋与湖沼, 2018, 49(1). Ding Dan, Pan Baoping, Wang Yumei, et al. Cloning and expression of Ap-1 gene from Cyclina sinensis infection by Vibrio anguillarum[J]. Oceanologia et Limnologia Sinica, 2018, 49(1). |
| [15] |
Taylor S W, Tincu J A. Antimicrobial peptides from marine invertebrates[J]. Antimicrobial Agents & Chemotherapy, 2004, 48(10): 3645. |
| [16] |
Mitta G, Hubert F, Noel T, et al. Myticin, a novel cystein-rich antimicrobial peptide isolated from haemocytes and plasma of the mussel Mytilus galloprovincialis[J]. European Journal of Biochemistry, 2010, 265(1): 71-78. |
| [17] |
Wang X W, Wang J X. Crustacean hemolymph microbiota:Endemic, tightly controlled, and utilization expectable[J]. Molecular Immunology, 2015, 68(2): 404-411. DOI:10.1016/j.molimm.2015.06.018 |
| [18] |
Rungrassamee W, Klanchui A, Maibunkaew S, et al. Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure[J]. Journal of Invertebrate Pathology, 2016, 133: 12-19. DOI:10.1016/j.jip.2015.11.004 |
| [19] |
Phuoc L H, Corteel M, Thanh N C, et al. Effect of dose and challenge routes of Vibrio spp. on co-infection with white spot syndrome virus in Penaeus vannamei[J]. Aquaculture, 2009, 290(1-2): 0-68. |
| [20] |
Kim B M, Jeong C B, Rhee J S, et al. Transcriptional profiles of Rel/NF-κB, inhibitor of NF-κB (IκB), and lipopolysaccharide-induced TNF-α factor (LITAF) in the lipopolysaccharide (LPS) and two Vibrio sp.-exposed intertidal copepod, Tigriopus japonicus[J]. Developmental & Comparative Immunology, 2014, 42(2): 229-239. |
| [21] |
Yu B P. Cellular defenses against damage from reactive oxygen species[J]. Physiological Reviews, 1994, 74(1): 139-162. DOI:10.1152/physrev.1994.74.1.139 |
 2019, Vol. 43
2019, Vol. 43


