文章信息
- 黄建盛, 陆枝, 张健东, 陈刚, 潘传豪, 邓文鑫. 2019.
- HUANG Jian-sheng, LU Zhi, ZHANG Jian-dong, CHEN Gang, PAN Chuan-hao, DENG Wen-xin. 2019.
- 人工养殖军曹鱼亲鱼不同组织氨基酸含量的分析
- Analysis of amino acid composition of different tissues collected from cultured cobia (Rachycentron canadum) broodstock
- 海洋科学, 43(4): 61-69
- Marine Sciences, 43(4): 61-69.
- http://dx.doi.org/10.11759/hykx20181022003
-
文章历史
- 收稿日期:2018-10-22
- 修回日期:2019-01-21
2. 广东粤海饲料集团, 广东 湛江 524000
2. Guangdong Yuehai Feed Group, Zhanjiang 524000, China
优质苗种生产是海水鱼养殖业健康持续发展的关键, 而亲鱼营养储备状态是影响苗种质量的重要因素之一。已有研究表明, 亲鱼营养储备状态不仅影响性腺发育, 而且还影响受精卵及仔鱼的发育[1, 2]。蛋白质作为鱼类重要的营养素之一, 不仅提供亲鱼自身生理代谢需求的营养, 还为亲鱼性腺发育、受精卵及仔鱼的早期发育提供所需的必需氨基酸, 从而会影响到鱼类的繁殖性能。因此, 氨基酸作为蛋白质的重要组成, 组织中的氨基酸含量与亲鱼的繁殖性能具有一定的相关性。Harle等[3]发现饲料中添加必需氨基酸含量会提高金头鲷(Sparus aurata)仔鱼的成活率及生长速度; Tandler等[4]研究也发现投喂必需氨基酸组成平衡饲料会显著提高金头鲷受精卵的质量。Shim等[5]投喂缺少部分氨基酸的亲鱼饲料, 结果发现拉利毛足鲈(Colisa lalia)受精卵孵化率受到抑制。Akiyama等[6]的研究结果表明, 提高色氨酸含量对香鱼(Plecoglossus altivelis)雄鱼血清睾酮水平有显著促进作用。已有研究证实, 一些特定功能性的非蛋白氨基酸也会影响鱼类的繁殖性能, 如在饲料中补充牛磺酸不仅能提高雌性亲鱼的产卵性能[7, 8], 而且对雄性亲鱼精子发生也有重要的作用[9]。另外, 在饲料中添加足够的精氨酸对于雄性亲鱼精子发生也是很有必要的[10]。在配制亲鱼饲料时, 一般以受精卵氨基酸组成[11]或以亲鱼肌肉氨基酸组成[12]作为其中氨基酸配比的参考依据。因此, 研究亲鱼性腺发育过程中不同组织氨基酸组成的变化, 对科学配制亲鱼饲料具有指导价值, 对于优质苗种培育具有重要的实践指导意义。
军曹鱼(Rachycentron canadum)分布于中国热带、亚热带海区, 具有个体大、生长速度快、经济值价高、肉质细嫩、味道鲜美等特点。近年来, 军曹鱼全人工繁殖及规模化育苗关键技术获得突破, 从而成功解决了其种苗来源问题。军曹鱼已成为中国南方沿海一带网箱养殖的重要对象之一。在实际生产中, 军曹鱼亲鱼培育多采用冰鲜杂鱼投喂。但由于冰鲜杂鱼未经消毒处理且供应不稳定, 会影响规模化人工培育优质亲鱼。迄今, 军曹鱼亲鱼营养生理和代谢需求尚未见报道。本研究选取的人工养殖军曹鱼雌雄亲鱼, 其性腺发育处于Ⅳ-Ⅴ期, 通过检测性腺发育过程中其肌肉、肝脏及性腺的氨基酸组成变化情况, 分析亲鱼营养储备情况与性腺发育的相关性, 为亲鱼营养生理需求、配制亲鱼饲料及苗种培育提供参考。
1 材料与方法 1.1 亲鱼来源及培育实验用人工养殖军曹鱼亲鱼为广东海洋大学水产学院鱼类种子工程与养殖团队繁育群体。该群体为2017年11月从湛江徐闻军曹鱼深水网箱养殖基地收购的3龄(9 kg以上)、无病无伤、个体健壮的繁育群体。
将亲鱼移入广东海洋大学东海岛海洋生物研究基地室内水泥池进行培育。长方形去内角亲鱼池, 面积12 m2, 水深1.7 m, 培育密度1.5条/m2, 采取每天微流水和换水200%措施保持水质清新, 换水时刷洗池底和池壁。温度控制在26~30℃, 盐度28~31, 光照强度1 500 lx ~2 000 lx, pH7.8~8.1, 溶解氧5.2 mg/L~ 6.1 mg/L。每天上、下午各投喂冰鲜杂鱼1次, 依据亲鱼体质量的5%~8%进行投喂, 并于投喂后0.5 h将沉于池底的残饵捞出。每隔3 d, 在冰鲜杂鱼中加入营养强化剂(维生素E及卵磷脂)进行亲鱼强化培育。
1.2 实验亲鱼性腺分期判定依据性腺的体积、色泽指标, 采用目测法及性腺成熟系数对军曹鱼亲鱼性腺分期判定。Ⅳ期精巢:呈乳白色, 表面充满血管, 挤压腹部无精液流出。Ⅴ期精巢:轻压腹部有大量黏稠乳白色精液从泄殖孔流出。Ⅳ期卵巢:体积很大, 占据腹腔的大部分, 卵巢呈深黄色, 血管十分发达, 卵巢有弹性, 卵粒大而饱满, 卵质充满卵黄颗粒。Ⅴ期卵巢:卵在卵巢囊内呈流动状态, 卵巢松软, 轻压腹部有成熟卵流出。成熟卵透明, 圆形。
1.3 样品采集及氨基酸测定在繁殖季节, 在军曹鱼繁育群体中选取性腺发育处于Ⅳ期和Ⅴ期的亲鱼共15尾, 深度麻醉后立即逐一测量体长、体质量等基本生物学特征, 随后现场解剖, 分别取其性腺、肝脏和部分轴上肌组织。其中, 4尾雄鱼的精巢发育处于Ⅳ期、4尾处于Ⅴ期; 3尾雌鱼的卵巢发育处于Ⅳ期、4尾处于Ⅴ期。所有组织样品作好标记、经冷藏后带回实验室用于氨基酸含量测定。依据GB/T 18654.11-2008的方法, 使用日立835-50型氨基酸自动分析仪测定氨基酸含量。色氨酸因测定过程酸水解时被破坏, 故未做检测。
1.4 数据分析本试验每个样品3次重复, 取平均值±标准差。测定数据用SPSS软件做单因素方差分析(ANOVA), 并用Duncan氏进行多重比较, P < 0.05表示显著差异; P > 0.05表示无显著性差异。
2 结果与分析 2.1 军曹鱼亲鱼基本生物学特征本实验测定了8尾雄鱼和7尾雌鱼的基本生物学特征(表 1)。军曹鱼雄亲鱼体质量范围为8 220 g~ 12 000 g, 平均体质量为9 780 g, 全长范围为102 cm~ 109.5 cm, 平均全长为105.7 cm, 4尾精巢发育处于Ⅳ期的雄鱼, 平均性腺成熟系数为1.0%, 4尾精巢发育处于Ⅴ期的雄鱼, 平均性腺成熟系数为1.6%。雌亲鱼体质量范围为11 250 g~13 960 g, 平均体质量为12 512 g, 全长范围为102.5 cm~113.5 cm, 平均全长为109.9 cm, 3尾亲鱼卵巢发育处于Ⅳ期, 平均性腺成熟系数为1.7%, 4尾亲鱼卵巢发育处于Ⅴ期, 平均性腺成熟系数为2.5%。
| 生物学特性 | 雄性 | 雌性 |
| 样本数量(条) | 8 | 7 |
| 体质量(g) | 9780.0±1546.6 | 12512.0±1197.4 |
| 全长(cm) | 105.7±3.0 | 109.9±4.9 |
| 体长(cm) | 83.9±3.1 | 89.9±4.9 |
| 叉长(cm) | 91.8±2.15 | 92.4±1.63 |
| 体高(cm) | 16.7±0.4 | 19.4±1.3 |
| 体厚(cm) | 13.3±1.6 | 16.3±2.2 |
| 头长(cm) | 21.6±1.5 | 24.7±1.4 |
| 眼后头长(cm) | 11.5±0.7 | 13.9±0.9 |
| 尾柄长(cm) | 5.0±0.9 | 6.7±0.8 |
| 尾柄高(cm) | 5.6±1.1 | 7.8±0.9 |
| 肥满度 | 1.7±0.2 | 1.7±0.2 |
| 肝指数(%) | 1.9±0.4 | 2.2±0.3 |
军曹鱼亲鱼牛磺酸含量在不同组织间存在显著差异(P < 0.05), 以Ⅴ期雌鱼肌肉含量最低, 为1.73 mg/g; 以Ⅴ期精巢含量最高, 为28.68 mg/g(图 1)。在雄性亲鱼精巢中牛磺酸含量显著高于肝脏(P < 0.05), 而且精巢从Ⅳ期发育到Ⅴ期的过程中, 精巢与肝脏均呈显著增加变化。雌性亲鱼肝脏组织中牛磺酸的含量显著高于卵巢(P < 0.05), 卵巢从Ⅳ期发育到Ⅴ期的过程中, 卵巢组织中牛磺酸含量无显著变化, 肝脏中牛磺酸呈显著增加。
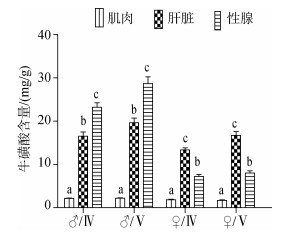 |
| 图 1 军曹鱼亲鱼不同组织中的牛磺酸含量 Fig. 1 Taurine levels in different tissues of the cultured broodstocks of cobia (Rachycentron canadum) 不同小写字母表示同一性腺时期不同组织有显著性差异 Different lowercase letters showed significant differences in different tissues at the same gonad stage (P > 0.05) |
军曹鱼亲鱼总氨基酸含量、必需氨基酸含量在不同组织间均存在显著差异(P < 0.05)。表现为肌肉最高, 性腺次之, 肝脏最低(图 2)。军曹鱼亲鱼肌肉、肝脏及性腺中必需氨基酸含量差异变化规律与总氨基酸含量的差异规律类似(图 3A), 必需氨基酸占总氨基酸酸的百分含量在性腺中略高, 与肌肉和肝脏之间无显著性差异(图 3B)。
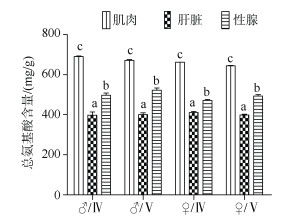 |
| 图 2 军曹鱼亲鱼不同组织中的总氨基酸含量 Fig. 2 Total amino acid content in different tissues of the cultured broodstocks of cobia (Rachycentron canadum) 图中总氨基酸含量不包括牛磺酸 The total amino acids in the figure do not contain taurine |
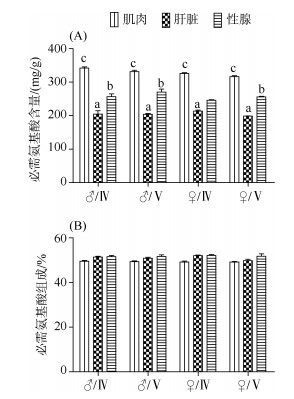 |
| 图 3 军曹鱼亲鱼不同组织中的必需氨基酸含量(A)和组成(B) Fig. 3 Essential amino acid content (A) and essential amino acid percentage (B) in different tissues of the cultured broodstocks of cobia (Rachycentron canadum) |
表 2列出Ⅳ期和Ⅴ期性腺的军曹鱼亲鱼肌肉的氨基酸组成。分析结果显示, 军曹鱼亲鱼肌肉中, 谷氨酸含量最高, 次之为天冬氨酸含量, 再次之为赖氨酸; 半胱氨酸含量最低。含量较高的必需氨基酸依次赖氨酸、亮氨酸和精氨酸, 含量最低的为蛋氨酸。从Ⅳ期和Ⅴ期的亲鱼比较可以看出, Ⅳ期亲鱼肌肉必需氨基酸总量和氨基酸总量显著高于Ⅴ期亲鱼(P < 0.05), 而氨基酸组成无显著的变化(P > 0.05)。从同期性腺的雌雄亲鱼比较来看, 雄性亲鱼肌肉必需氨基酸总量和氨基酸总量显著高于雌性亲鱼(P < 0.05), 除苏氨酸、异亮氨酸、亮氨酸、酪氨酸存在显著差异(P < 0.05), 大部分氨基酸含量无显著差异(P > 0.05)。
| 氨基酸 | 雄亲鱼/Ⅳ期 | 雄亲鱼/Ⅴ期 | 雌亲鱼/Ⅳ期 | 雌亲鱼/Ⅴ期 |
| 苏氨酸Thr* | 30.48±0.68b | 29.23±1.30b | 26.57±0.86a | 25.70±1.04a |
| 精氨酸Arg* | 45.97±1.70b | 44.15±2.13ab | 43.15±2.13ab | 42.48±0.45a |
| 缬氨酸Val* | 35.71±0.97c | 34.22±0.90bc | 33.75±0.80b | 31.99±0.80a |
| 蛋氨酸Met* | 20.79±0.99 | 19.74±0.89 | 20.57±0.94 | 19.74±1.04 |
| 异亮氨酸Ile* | 35.72±1.03c | 34.33±0.82bc | 33.69±0.89ab | 32.56±.084a |
| 亮氨酸Leu* | 59.32±1.33c | 58.27±1.26bc | 56.55±0.70ab | 55.47±0.98a |
| 苯丙氨酸Phe* | 30.24±1.60 | 29.37±1.17 | 28.62±0.80 | 27.57±1.08 |
| 赖氨酸Lys* | 64.55±1.54 | 63.42±1.35 | 63.71±1.20 | 62.75±0.75 |
| 组氨酸His* | 19.54±0.69 | 18.75±0.77 | 19.25±1.04 | 18.53±1.24 |
| 天冬氨酸Asp | 72.88±2.47 | 71.83±2.74 | 73.73±0.86 | 72.77±0.97 |
| 谷氨酸Glu | 108.97±1.51 | 107.06±1.68 | 106.71±1.22 | 104.72±1.06 |
| 丝氨酸Ser | 27.31±1.60 | 26.44±1.36 | 25.98±1.18 | 25.15±1.14 |
| 甘氨酸Gly | 38.63±2.17 | 37.03±2.12 | 35.72±0.81 | 34.41±0.98 |
| 丙氨酸Ala | 43.32±2.10 | 42.38±2.35 | 41.97±1.02 | 41.08±1.06 |
| 脯氨酸Pro | 27.66±0.96 | 26.35±0.96 | 25.64±0.81 | 24.78±0.96 |
| 半胱氨酸Cys | 5.33±0.20 | 5.14±0.10 | 4.95±0.24 | 4.72±0.41 |
| 酪氨酸Tyr | 23.85±1.36c | 23.45±1.58bc | 21.35±0.56ab | 19.75±0.95a |
| 必需氨基酸总量∑EAA | 342.32±3.65c | 331.48±4.17b | 326.02±2.33b | 316.77±2.94a |
| 氨基酸总量∑AA | 690.27±3.40d | 671.15±4.04c | 662.07±4.50b | 644.14±10.25a |
| 注: *.必需氨基酸; 表中数据为平均值±标准差。表中同行数据右上标字母不同表示组间差异显著(P < 0.05), 表 3、表 4同 | ||||
| 氨基酸 | 雄亲鱼/Ⅳ期 | 雄亲鱼/Ⅴ期 | 雌亲鱼/Ⅳ期 | 雌亲鱼/Ⅴ期 |
| 苏氨酸Thr* | 18.42±0.80b | 19.28±0.95b | 19.57±1.14b | 16.53±0.75a |
| 精氨酸Arg* | 24.12±1.38ab | 22.80±1.11a | 25.82±1.00b | 23.69±0.99ab |
| 缬氨酸Val* | 31.28±2.10 | 32.25±1.57 | 32.46±1.77 | 32.60±0.99 |
| 蛋氨酸Met* | 7.97±0.83ab | 7.76±0.76ab | 8.88±0.50b | 7.29±0.37a |
| 异亮氨酸Ile* | 19.67±1.84 | 19.65±1.00 | 20.69±2.05 | 18.96±1.51 |
| 亮氨酸Leu* | 38.10±2.61 | 38.22±1.25 | 38.59±2.12 | 37.09±1.75 |
| 苯丙氨酸Phe* | 17.58±0.69a | 17.54±1.08a | 19.76±1.03b | 17.50±0.94a |
| 赖氨酸Lys* | 38.69±2.19 | 39.00±1.43 | 38.51±1.19 | 36.96±2.31 |
| 组氨酸His* | 8.68±0.56bc | 7.19±0.31a | 9.34±1.08c | 7.98±0.47ab |
| 天冬氨酸Asp | 42.78±2.18ab | 40.70±0.96a | 43.22±1.62ab | 44.30±2.01b |
| 谷氨酸Glu | 59.47±2.30 | 60.94±1.61 | 58.52±2.10 | 60.66±2.06 |
| 丝氨酸Ser | 15.59±0.81a | 16.75±1.03ab | 17.81±0.90b | 16.52±0.89ab |
| 甘氨酸Gly | 20.23±1.35 | 21.32±1.39 | 20.60±1.00 | 22.60±1.94 |
| 丙氨酸Ala | 24.95±1.38 | 26.28±1.24 | 25.78±0.90 | 25.71±0.93 |
| 脯氨酸Pro | 11.59±0.88 | 12.41±0.50 | 12.44±0.61 | 12.68±0.74 |
| 半胱氨酸Cys | 1.37±0.30a | 1.86±0.18b | 1.91±0.19b | 1.78±0.12b |
| 酪氨酸Tyr | 16.94±1.61 | 16.26±1.49 | 16.91±1.34 | 15.89±0.90 |
| 必需氨基酸总量∑EAA | 204.50±10.29ab | 203.68±2.96ab | 213.63±3.17b | 198.59±1.06a |
| 氨基酸总量∑AA | 397.42±17.22 | 400.19±9.50 | 410.82±5.86 | 398.73±4.59 |
| 氨基酸 | 雄亲鱼/Ⅳ期 | 雄亲鱼/Ⅴ期 | 雌亲鱼/Ⅳ期 | 雌亲鱼/Ⅴ期 |
| 苏氨酸Thr* | 24.04±1.49 | 25.08±1.43 | 23.58±1.20 | 23.88±1.64 |
| 精氨酸Arg* | 44.53±2.01a | 48.47±2.52b | 43.57±0.66a | 44.87±2.00a |
| 缬氨酸Val* | 42.67±1.94ab | 43.97±2.16b | 40.33±1.53a | 42.17±1.48ab |
| 蛋氨酸Met* | 10.40±1.67ab | 11.65±2.00b | 8.79±0.81a | 9.92±0.71ab |
| 异亮氨酸Ile* | 20.26±1.55ab | 21.91±2.24b | 18.12±1.26a | 19.22±1.30ab |
| 亮氨酸Leu* | 38.69±1.96 | 40.49±2.57 | 39.13±1.55 | 40.07±1.03 |
| 苯丙氨酸Phe* | 18.00±1.44 | 19.29±1.17 | 17.60±0.85 | 19.01±1.55 |
| 赖氨酸Lys* | 47.07±2.11 | 47.31±1.81 | 44.90±1.24 | 46.60±2.04 |
| 组氨酸His* | 10.77±0.77a | 13.90±1.15b | 9.86±0.91a | 10.17±1.40a |
| 天冬氨酸Asp | 54.57±1.96 | 55.37±2.08 | 53.48±0.77 | 55.15±1.52 |
| 谷氨酸Glu | 72.63±2.22bc | 74.24±2.45c | 67.47±0.86a | 69.10±2.21ab |
| 丝氨酸Ser | 17.72±0.80bc | 18.57±0.83c | 15.57±0.81a | 16.66±0.91ab |
| 甘氨酸Gly | 24.03±1.38 | 25.27±1.73 | 23.67±0.93 | 25.30±1.41 |
| 丙氨酸Ala | 30.68±1.88ab | 31.97±2.66b | 26.91±1.38a | 27.84±1.65a |
| 脯氨酸Pro | 16.10±1.11ab | 17.17±1.97b | 14.56±0.83a | 16.89±1.97ab |
| 半胱氨酸Cys | 2.49±0.39a | 2.86±0.26ab | 2.21±0.16a | 3.15±0.26b |
| 酪氨酸Tyr | 22.31±1.27ab | 23.39±1.08b | 21.63±0.84a | 23.77±0.91b |
| 必需氨基酸总量∑EAA | 256.43±8.68a | 270.07±9.39b | 245.88±1.62a | 255.92±1.96a |
| 氨基酸总量∑AA | 496.96±11.24b | 522.22±11.23c | 471.37±4.65a | 493.78±6.53b |
表 3为不同性腺发育阶段军曹鱼肝脏组织氨基酸组成。对于总氨基酸含量而言, 性腺发育处于Ⅳ期和Ⅴ期的亲鱼肝脏中总氨基酸含量无显著性差异(P > 0.05)。在氨基酸组成上, 雌雄亲鱼肝脏中含量比较高的氨基酸依次为谷氨酸、天冬氨酸、赖氨酸、亮氨酸和缬氨酸, 而组氨酸、蛋氨酸和半胱氨酸含量相对较低。Ⅳ期和Ⅴ期雄性亲鱼肝脏大部分氨基酸含量差异不显著(P > 0.05), 只是在组氨酸、半胱氨酸含量上存在显著差异(P < 0.05)。随着雌鱼性腺由Ⅳ期发育至Ⅴ期, 肝脏苏氨酸、蛋氨酸、苯丙氨酸、组氨酸含量显著下降(P < 0.05), 其他氨基酸含量无显著变化(P > 0.05)。从同期性腺的雌雄亲鱼比较来看, 雌雄亲鱼之间的必需氨基酸总量无显著性变化(P > 0.05)。
2.6 军曹鱼不同性腺发育阶段性腺氨基酸组成表 4为不同性腺发育阶段军曹鱼性腺氨基酸组成。对总氨基酸含量而言, 发育处于Ⅴ期精巢中总氨基酸含量最高, 显著高于Ⅳ期精巢(P < 0.05)。卵巢发育处于Ⅳ期和Ⅴ期亲鱼, 其卵巢中总氨基酸含量表现出随卵巢发育而显著增加的变化(P < 0.05)。在必需氨基酸总量上, 发育处于Ⅴ期精巢显著高于发育处于Ⅳ期(P < 0.05), 卵巢发育处于Ⅳ期和Ⅴ期的亲鱼, 其卵巢中必需氨基酸总量含量无显著变化(P > 0.05), 但表现出随卵巢发育呈递增的趋势。在必需氨基酸组成上, 处于Ⅳ期发育至Ⅴ期精巢, 其含量虽无显著性变化(P > 0.05), 但表现出上升的趋势, 卵巢的差异变化情况与精巢类似。处于Ⅳ期发育至Ⅴ期精巢, 非必需氨基酸含量则差异不显著(P > 0.05)。卵巢的差异变化规律与精巢类似。发育处于Ⅳ期和Ⅴ期精巢、卵巢含量比较高的氨基酸依次为谷氨酸、天冬氨酸、赖氨酸、精氨酸和缬氨酸, 而组氨酸、蛋氨酸和半胱氨酸含量相对较低。从同期性腺的雌雄亲鱼比较来看, 谷氨酸、丝氨酸含量表现出显著差异(P < 0.05), 其他大部分氨基酸含量无显著性差异(P > 0.05)。
3 讨论 3.1 军曹鱼亲鱼不同发育阶段牛磺酸的比较牛磺酸主要以游离形式存在于动物体内各组织中, 在中枢神经系统、肝脏、心脏等易兴奋组织中含量较高, 对于维持这些组织细胞的稳定性具有一定作用[13]。已有研究表明, 牛磺酸不仅影响鱼类正常生长发育, 而且还影响亲鱼的繁殖性能、受精卵以及仔鱼质量。赵敏等[14]研究发现, 饲料中添加0.5%的牛磺酸不仅提高了半滑舌鳎(Cynoglossus semilaevis)亲鱼卵子的浮卵率、受精卵和孵化率, 作为评价卵子质量指标的油球和卵子蛋白含量均显著高于对照组。Matsunari等[7]发现, 牛磺酸对黄尾鰤(Seriola quinqueradiata)亲鱼卵子质量有显著性影响。本研究中, 军曹鱼亲鱼性腺从Ⅳ期发育到Ⅴ期的过程中, 肝脏组织中牛磺酸含量均呈显著增加, 这与牛磺酸的生理作用有关。黄旭雄等[15]在银鲳(Pampus argenteus)中也得到相似的研究结果。鱼类性腺发育成熟要求体内必须有一定量的脂肪储存[16], 肝脏作为脂肪的主要储存器官, 其沉积的脂肪会被转移到性腺, 从而促进性腺的发育[17]。肝脏中, 牛磺酸和甘氨酸能与胆酸和鹅脱氧胆酸等游离胆酸形成结合胆汁酸, 并以胆汁酸盐的形式参与脂肪的消化吸收[18]。因此可见, 肝脏的牛磺酸对性腺脂肪储存发挥着重要的生理作用。
此外, 杨建成等[19]发现牛磺酸能显著促进雄性大鼠促黄体生成素、促卵泡雌激素和睾酮的分泌, 促进精子生长与成熟, 并通过提高精液质量来增强雄性大鼠的生殖机能。在鱼类中, 牛磺酸不仅可显著提高半滑舌鳎亲鱼[14]血清中睾酮含量, 而且亦是日本鳗鲡(Anguillajaponica) [9]的精子发生的必需成分。本研究也发现, 军曹鱼Ⅴ期精巢牛磺酸含量最高, 推测牛磺酸可能会促进雄性军曹鱼亲鱼精子生成及成熟。因此, 很有必要针对军曹鱼亲鱼繁殖期间牛磺酸的最适需要量开展进一步探究。
3.2 军曹鱼亲鱼不同发育阶段肌肉氨基酸的比较鱼类肌肉的氨基酸含量较高且在不同条件下相对稳定, 常用作鱼类饲料配制的参考[20]。在繁殖期间, 亲鱼不仅在正常的生理代谢活动消耗能量, 性腺的发育也需要消耗大量的营养物质, 因此, 在亲鱼性腺发育过程中, 肌肉储存的营养物质常被用来进行“母体补偿”[21]。本研究中, 人工养殖军曹鱼亲鱼肌肉中氨基酸的组成与含量分布与其不同生长阶段鱼体中的肌肉氨基酸含量[22, 23]分析结果一致, 这反映了鱼类肌肉的种属的稳定性和保守性。军曹鱼亲鱼性腺从Ⅳ期发育到Ⅴ期过程中, 肌肉必需氨基酸总量和氨基酸总量呈显著下降, 据此推测, 性腺发育过程中, 可能从肌肉中转运必需的营养物质来满足性腺发育的需求。这与对银鲳亲鱼的研究结果一致[15]。对同期性腺的雌雄亲鱼肌肉氨基酸总量比较发现, 雄性亲鱼高于雌性亲鱼。推测差异产生的原因可能是雌雄亲鱼在肌肉中氨基酸向性腺发生转移方面存在差异, 雌鱼发育需要更多的营养物质往卵巢转移; 雌雄亲鱼在繁殖过程中耗能方式存在差异。此外, 饵料组成[24]、盐度[25]、养殖模式[26]等多方面因素也会影响鱼类肌肉氨基酸含量, 因此, 在军曹鱼亲鱼饲养过程中, 有必要为亲鱼提供适宜的水质环境和营养。
3.3 军曹鱼亲鱼不同发育阶段肝脏氨基酸的比较肝脏是鱼类卵黄蛋白原合成组织[27-29]。肝脏合成的卵黄蛋白原通过血液循环运输至卵巢, 最后储存在卵母细胞中为胚胎发育提供能量[30]。关于鱼类亲鱼肝脏氨基酸组成的报道较少, 仅对褐牙鲆(Paralichthys olivaceus)[20]、银鲳[15]、大鳍鱯(Mystus macropterus)[31]、黄颡鱼(Pelteobagrus f ulvidraco)[32]亲鱼肝脏的氨基酸组成和含量进行过研究。有研究表明, 野生亲鱼肝脏的氨基酸总量显著低于人工养殖亲鱼[20]。本研究中, 人工养殖军曹鱼亲鱼性腺从Ⅳ期发育到Ⅴ期过程中, 肝脏总氨基酸含量无显著性变化, 而且肝脏总氨基酸含量低于性腺及肌肉, 据此推迟军曹鱼雌雄亲鱼不需动用肝脏储存的营养物质来满足性腺发育的需求。这与对银鲳[15]、褐牙鲆[20]的研究存在差异, 推测造成差异的原因可能一方面是不同鱼类性腺发育所需要的营养物质储存策略不同; 另一方面是亲鱼的饲养及营养强化方式不同。
3.4 亲曹鱼亲鱼不同发育阶段性腺氨基酸的比较饲料蛋白和氨基酸组成[33]、脂肪和脂肪酸组成[34]、糖类[35]、维生素[36]等均可影响鱼类的性腺发育, 但针对鱼类性腺氨基酸组成与含量的报道较少。本研究中, 军曹鱼亲鱼性腺从Ⅳ期发育至Ⅴ期, 其氨基酸总量显著升高, 表明精巢内精细胞或卵巢内卵细胞在发育过程中不断地进行营养物质的积累。营养物质的积累不仅为受精卵发育阶段提供能量消耗来源, 还可为前期仔鱼发育需要提供必需氨基酸[17]。例如, 在小麦面筋基础饲料中添加必需氨基酸使之与卵细胞氨基酸组成相似, 可使金头鲷仔鱼的成活率增加1倍, 生长速度提高50%[3]; 金头鲷亲鱼饲料中氨基酸组成与其卵中的氨基酸组成类似, 会显著提高受精卵的质量[4]。因此, 建议军曹鱼亲鱼饲料氨基酸组成应与其卵巢或卵的氨基酸组成相一致。
对比Ⅳ期和Ⅴ期精巢氨基酸的变化可以看出, 精氨酸、组氨酸含量的显著升高可能与精子形成过程有关。鱼精蛋白以精氨酸和组氨基酸为主要氨基酸组成, 是精细胞中主要的核蛋白, 存在于精子头部, 对精子DNA的正确包裹和精子正常功能的维持至关重要[37]。因此, 在雄性军曹鱼亲鱼饲料中, 有必需添加足够的精氨酸和组氨酸含量。本实验中, 由于采样所限, 未能获得野生军曹鱼亲鱼, 野生与人工养殖军曹鱼在不同组织氨基酸组成的差异有待进一步研究。
| [1] |
Izquierdo M S, Fernández-palacios H, Tacon A G J. Effect of broodstock nutrition on reproductive performance of fish[J]. Aquaculture, 2001, 197(1-4): 25-42. DOI:10.1016/S0044-8486(01)00581-6 |
| [2] |
Watanabe T, Vassallo-Agius R. Broodstock nutrition research on marine finfish in Japan[J]. Aquaculture, 2003, 227(1-4): 35-61. DOI:10.1016/S0044-8486(03)00494-0 |
| [3] |
Harel M, Tandler A, Kissil G W, et al. The role of broodstock dietary protein in vitellogenin synthesis and oocyte development, and its effect on reproductive performance and egg quality in gilthead seabream Sparus aurata[C]//Proceeding of the fifth international symposium on the reprodective physiology of fish. Texas: The University of Texas at Austin, 1995.
|
| [4] |
Tandler A, Harel M, Koven W M, et al. Broodstock and larvae nutrition in gilthead seabream Sparus aurata - new findings on its mode of involvement in improving growth, survival and swimbladder inflation[J]. The Israeli Journal of Aquaculture Bamidgeh, 1995, 47(3): 95-111. |
| [5] |
Shim K F, Lam T J, Landesman L. Effect of deletion of amino acid from supplement on the growth and reproductive performance of the dwarf gourami, Colisa lalia (Hamilton)[J]. Journal of Aquaculture in the Tropics, 1990, 5: 149-154. |
| [6] |
Akiyama T, Shiraishi M, Yamamoto T, et al. Effect of dietary tryptophan on maturation of ayu Plecoglossus altivelis[J]. Fisheries Science, 1996, 62(5): 776-782. DOI:10.2331/fishsci.62.776 |
| [7] |
Matsunari H, Hamada K, Mushiake K, et al. Effects of taurine levels in broodstock diet on reproductive performance of yellowtail Seriola quinqueradiata[J]. Fisheries Science, 2006, 72(5): 955-960. DOI:10.1111/j.1444-2906.2006.01243.x |
| [8] |
Al-Feky S S A, El-Sayed A F M, Ezzat A A. Dietary taurine improves reproductive performance of Nile tilapia (Oreochromis niloticus) broodstock[J]. Aquacult Nutrition, 2016, 22(2): 392-399. DOI:10.1111/anu.12256 |
| [9] |
Higuchi M, Celino F T, Miura C, et al. The synthesis and role of taurine in the Japanese eel testis[J]. Amino Acids, 2012, 43(2): 773-781. |
| [10] |
Lewis J D, Saperas N, Song Y, et al. Histone H1 and the origin of protamines[J]. Proceedings of the National Academy of Sciences of the United Sates of America, 2004, 101(12): 4148-4152. DOI:10.1073/pnas.0308721101 |
| [11] |
Ketola H G. Amino acid nutrition of fishes:Requirements and supplementation of diets[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1982, 73(1): 17-24. DOI:10.1016/0305-0491(82)90197-3 |
| [12] |
Ramseyer L J, Garling Jr D L. Amino acid composition of the ovaries, muscle, and whole body of yellow perch[J]. The Progressive Fish-Culturist, 1994, 56(3): 175-179. DOI:10.1577/1548-8640(1994)056<0175:AACOTO>2.3.CO;2 |
| [13] |
于道德, 郑永允, 宁璇璇, 等. 牛磺酸在鱼类中的生物学功能[J]. 海洋科学, 2010, 34(2): 86-91. Yu Daode, Zheng Yongyun, Ning Xuanxuan, et al. The biological functions of taurine on fish[J]. Marine Sciences, 2010, 34(2): 86-91. |
| [14] |
赵敏, 梁萌青, 郑珂珂, 等. 牛磺酸对半滑舌鳎(Cynoglossus semilaevis)亲鱼繁殖性能及仔鱼质量的影响[J]. 渔业科学进展, 2015, 36(3): 101-108. Zhao Min, Liang Mengqing, Zheng Keke, et al. Effects of dietary taurine on the reproductive performance and the larval quality in tongue sole Cynoglossus semilaevis[J]. Progress in Fishery Sciences, 2015, 36(3): 101-108. |
| [15] |
黄旭雄, 施兆鸿, 李伟微, 等. 银鲳亲鱼不同组织的氨基酸及其随性腺发育的变化[J]. 水产学报, 2009, 33(2): 278-287. Huang Xuxiong, Shi Zhaohong, Li Weiwei, et al. The amino acids in different tissues of silver pomfret (Pampus argenteus) broodstock and their change with the gonad development[J]. Journal of Fisheries of China, 2009, 33(2): 278-287. |
| [16] |
Quillet E, Guillou S L, Aubin J, et al. Two-way selection for muscle lipid content in pan-size rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2005, 245(1-4): 49-61. DOI:10.1016/j.aquaculture.2004.12.014 |
| [17] |
谭青松, 吴凡, 杜浩, 等. 饲料营养对亲鱼生殖性能的影响研究进展[J]. 水生态学杂志, 2016, 37(4): 1-9. Tan Qingsong, Wu Fan, Du Hao, et al. Effects of broodstock nutrition on reproductive performance of fish:a review[J]. Journal of Hydroecology, 2016, 37(4): 1-9. |
| [18] |
王和伟, 叶继丹, 陈建春. 牛磺酸在鱼类营养中的作用及其在鱼类饲料中的应用[J]. 动物营养学报, 2013, 25(7): 1418-1428. Wang Hewei, Ye Jidan, Chen Jianchun. Taurine:Effect in fish nutrition and application in fish feed[J]. Chinese Journal of Animal Nutrition, 2013, 25(7): 1418-1428. DOI:10.3969/j.issn.1006-267x.2013.07.004 |
| [19] |
杨建成, 冯颖, 孙长勉, 等. 牛磺酸对雄性大鼠生殖激素分泌水平的影响[J]. 安徽农业科学, 2007, 35(11): 3283-3284. Yang Jiancheng, Feng Ying, Sun Changmian, et al. Effect of taurine on the secretion of reproductive hormone of male rat[J]. Journal of Anhui Agriculture Sciences, 2007, 35(11): 3283-3284. DOI:10.3969/j.issn.0517-6611.2007.11.074 |
| [20] |
王际英, 李培玉, 宋志东, 等. 野生和人工养殖褐牙鲆亲鱼不同组织氨基酸的比较[J]. 水产学报, 2010, 34(11): 1736-1743. Wang Jiying, Li Peiyu, Song Zhidong, et al. Comparsion of amino acid composition in different tissues of the wild and the cultured Paralichthys olivaceus broodstock[J]. Journal of Fisheries of China, 2010, 34(11): 1736-1743. |
| [21] |
Gunasekera R M, Shim K F, Lam T J. Influence of dietary protein content on the distribution of amino acids in oocytes, serum and muscle of Nile tilapia, Oreochromis niloticus (L.)[J]. Aquaculture, 1997, 152(1-4): 205-221. DOI:10.1016/S0044-8486(96)01526-8 |
| [22] |
刘书成, 李德涛, 洪鹏志, 等. 军曹鱼各部位蛋白质营养价值评价[J]. 食品科技, 2010, 35(5): 158-160. Liu Shucheng, Li Detao, Hong Pengzhi, et al. Evaluation of protein nutritional value in different tissues of cobia[J]. Food Science and Technology, 2010, 35(5): 158-160. |
| [23] |
李刘冬, 陈毕生, 冯娟, 等. 军曹鱼营养成分的分析及评价[J]. 热带海洋学报, 2002, 21(1): 76-82. Li Liudong, Chen Bisheng, Feng Juan, et al. Analysis and evaluation in nutritive value of Rachycentron canadum (Linnaeus)[J]. Journal of Tropic Oceanology, 2002, 21(1): 76-82. DOI:10.3969/j.issn.1009-5470.2002.01.011 |
| [24] |
彭士明, 施兆鸿, 孙鹏, 等. 饲料组成对银鲳幼鱼生长率及肌肉氨基酸、脂肪酸组成的影响[J]. 海洋渔业, 2012, 34(1): 51-56. Peng Shiming, Shi Zhaohong, Sun Peng, et al. Effects of diet composition on growth rate, muscle amino acid and fatty acid composition of juvenile silver pomfret (Pampus argenteus)[J]. Marine Fisheries, 2012, 34(1): 51-56. DOI:10.3969/j.issn.1004-2490.2012.01.008 |
| [25] |
曾霖, 刘滨, 洪万树, 等. 盐度对大菱鲆幼鱼肌肉氨基酸和脂肪酸组成的影响[J]. 海洋科学, 2014, 38(12): 40-47. Zeng Lin, Liu Bin, Hong Wangshu, et al. Effects of salinities on muscle amino acid and fatty acid composition of juvenile turbot (Scophthalmus maximus)[J]. Marine Sciences, 2014, 38(12): 40-47. DOI:10.11759/hykx20130615001 |
| [26] |
颜孙安, 林香信, 林虬. 不同养殖模式大黄鱼肌肉的游离氨基酸含量及组成分析[J]. 福建分析测试, 2013, 22(5): 10-13. Yan Sunan, Lin Xiangxin, Lin Qiu. Analysis of free amino acid content and composition in muscle of Pseudosciaena crocea (Richardson) different aquaculture models[J]. Fujian Analysis & Testing, 2013, 22(5): 10-13. DOI:10.3969/j.issn.1009-8143.2013.05.02 |
| [27] |
Tong Y, Shan T, Poh Y K, et al. Molecular cloning of zebrafish and medaka vitellogenin genes and comparison of their expression in response to 17β-estradiol[J]. Gene, 2004, 328(17): 25-36. |
| [28] |
刘春, 李凯彬, 王芳, 等. 剑尾鱼卵黄蛋白原C(Vg C)全长cDNA的克隆及表达[J]. 水产学报, 2011, 35(10): 1441-1449. Liu Chun, Li Kaibin, Wang Fang, et al. The full length cDNA cloning and expression profile of vitellogenin C(Vg C) gene from swordtail fish Xiphophorus helleri[J]. Journal of Fisheries of China, 2011, 35(10): 1441-1449. |
| [29] |
余露军, 蔡磊, 李舸, 等. 诸氏鲻虾虎鱼卵黄蛋白原基因全长cDNA的克隆及表达[J]. 海洋科学, 2016, 40(9): 23-31. Yu Lujun, Cai Lei, Li Ke, et al. Full-length cDNA cloning and expression analysis of vitellogenin gene in Mugilogobius chulae[J]. Marine Sciences, 2016, 40(9): 23-31. |
| [30] |
Nath P, Sahu R, Kabita S, et al. Vitellogenesis with special emphasis on Indian fishes[J]. Fish Physiology and Biochemistry, 2007, 33(4): 359-366. DOI:10.1007/s10695-007-9167-0 |
| [31] |
姚俊杰, 安苗, 姜海波, 等. 大鳍鳠繁殖期主要组织器官的氨基酸和脂肪酸组成[J]. 铜仁学院学报, 2009, 11(2): 79-83. Yao Junjie, An Miao, Jiang Haibo, et al. Amino acid and fatty acid composition in Mystu macropterus during reproducing stage[J]. Journal of Tongren University, 2009, 11(2): 79-83. DOI:10.3969/j.issn.1673-9639.2009.02.022 |
| [32] |
姚俊杰, 姜海波, 胡先成, 等. 黄颡鱼繁殖期主要组织器官中氨基酸和脂肪酸的组成[J]. 贵州农业科学, 2009, 37(5): 115-118. Yao Junjie, Jiang Haibo, Hu Xiancheng, et al. Amino acid and fatty acid composition in Pelteobagrus fiulvidraco during reproducing period[J]. Guizhou Agricultural Sciences, 2009, 37(5): 115-118. DOI:10.3969/j.issn.1001-3601.2009.05.039 |
| [33] |
Masrizal, Udin Z, Zein M, et al. Effect of energy, lipid and protein content in broodstock diets on spawning fecundity and eggs quality of giant gourami (Ospheronemus gouramy Lac)[J]. Pakistan Journal of Nutrition, 2015, 14(7): 412-416. DOI:10.3923/pjn.2015.412.416 |
| [34] |
Liang M Q, Lu Q K, Qian C, et al. Effects of dietary n-3 to n-6 fatty acid ratios on spawning performance and larval quality in tongue sole Cynoglossus semilaevis[J]. Aquacult Nutrition, 2014, 20(1): 79-89. DOI:10.1111/anu.12054 |
| [35] |
Garcia-Rejón L, Sanchez-Muros M J, Cerdá J, et al. Fructose 1, 6 bisphosphatase activity in liver and gonads of sea bass (Dicentrarchus labrax). Influence of diet composition and stage of the reproductive cycle[J]. Fish Physiology and Biochemistry, 1997, 16(2): 93-105. DOI:10.1007/BF00004667 |
| [36] |
Furuita H, Ishida T, Suzuki T, et al. Vitamin content and quality of eggs produced by broodstock injected with vitamins C and E during artificial maturation in Japanese eel Anguilla japonica[J]. Aquaculture, 2009, 289(3-4): 334-339. DOI:10.1016/j.aquaculture.2009.01.032 |
| [37] |
范丽娟, 尹苗, 仲跻峰, 等. 鱼精蛋白与雄性生殖[J]. 生命科学, 2015, 27(4): 433-438. Fan Lijuan, Yin Miao, Zhong Jifeng, et al. Protamines and male fertility[J]. Chinese Bulletin of Life Sciences, 2015, 27(4): 433-438. |
 2019, Vol. 43
2019, Vol. 43


