文章信息
- 刘思迅, 周胜杰, 韩明洋, 王一福, 洪嘉炜, 顾志峰, 马振华. 2019.
- LIU Si-xun, ZHOU Sheng-jie, HAN Ming-yang, WANG Yi-fu, HONG Jia-wei, GU Zhi-feng, MA Zhen-hua. 2019.
- 密度胁迫对卵形鲳鲹鱼苗运输水质、存活率、免疫酶活力和血清指标的影响
- Effects of density stress on water quality, survival rate, immune enzyme activities, and serotonation index of Trachinotus ovatus
- 海洋科学, 43(4): 70-80
- Marine Sciences, 43(4): 70-80.
- http://dx.doi.org/10.11759/hykx20181021001
-
文章历史
- 收稿日期:2018-10-21
- 修回日期:2018-12-10
2. 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300;
3. 海南大学 海洋学院, 海南 海口 570228
2. Key Laboratory of South China Sea Fishery Resources Development and Utilization, Ministry of Agriculture, Guangzhou 510300, China;
3. Ocean College, Hainan University, Haikou 570228, China
鱼类作为水生的变温动物, 其与陆生动物不同, 生活于水环境中, 直接与水接触, 容易受到周围水环境因素的影响(温度、盐度等)。不同的生长发育阶段、不同的品种, 甚至可能是相同品种的鱼、相同的生长阶段, 但不同的个体对于其所处的环境胁迫的抵抗能力依旧存在着很明显的差异[1]。当环境对鱼本身的生存产生压力时, 不同的应激因子会使鱼发生不一样的应激表现。如果使鱼类长时间的处于应激环境下, 尤其是在多种应激因子的综合刺激下, 鱼体会产生一系列变化, 如能耗加快, 生长速率减慢, 机体的特异性和非特异性免疫受到冲击, 导致自身正常的生理生化反应发生紊乱, 免疫能力下降[2-4]。通常状态下, 鱼体本身会为了适应新的环境, 对自身代谢相关的酶活性进行自我调节[5]。当超过自我调节范围时, 会导致肌肉退化, 影响溶血及细胞代谢, 最终可导致细胞的死亡[6]。运输集合了捕捞、密度改变、震荡、水环境等一些列胁迫因子, 但又是水产品增殖放流工作中必需的一步, 会让机体产生一系列的生理生化反应[7]。尤其是鱼苗阶段是生长的关键时期, 但免疫抵抗的能力较弱, 更容易因外界环境的改变而产生应激反应, 这样会影响运输的质量与成活率。因此, 确定并研究运输胁迫因子对运输水体和鱼类自身免疫及代谢能力的影响, 更有助于确定并优化苗种最适合的运输方式, 提高运输成活率和质量。关于水产品保活运输, 国内外已有很多学者开展了相关方面的研究, 大部分研究主要集中在运输后鱼体肝脏组织内抗氧化酶活力的变化, 其中主要关注超氧化物歧化酶、过氧化氢酶、谷胱甘肽转移酶等酶的活力[8-11]。孙鹏等[9]曾以箱式货车连续运输日本黄姑鱼(Nibea japonica)6 h进行探究, 结果表明, 运输胁迫可以通过氧化应激反应对其产生影响, 并选取SOD和CAT活力指标评价了鱼体应激反应情况。孙鹏等[8]研究了在不同盐度条件下条石鲷(Oplegnathus fasciatus)幼鱼肝脏的SOD、CAT等抗氧化酶的活力变化。刘奇奇等[10]采用塑料袋密闭充氧运输方式, 研究了此运输模式对四指马鲅(Eleutheronema tetradactylum)幼鱼的SOD、CAT等酶的活力及其总抗氧化能力(T-AOC)的影响, 结果表明运输胁迫下, 鱼体应激反应显著, 抗氧化系统受到影响。另一方面研究主要集中于鱼体血清中的皮质醇、血糖、乳酸及游离脂肪酸等的含量变化[12-16], 其主要原因在于血清生化指标的变化不仅仅可以广泛用于评价鱼体环境胁迫后的应激反应情况, 同时亦可以作为鱼体重要的生理、病理和毒理学指标。洪磊等[12]研究发现, 许氏平鲉(Sebastes schlegelii)和花鲈(Lateolabrax japonocus)在运输前24 h停喂, 运输后进行密闭充氧运输, 两种鱼类的血糖含量均比运输前的高。高金伟等[13]采用模拟运输的方式, 探究了经过运输胁迫后长江刀鲚(Coilia nasus)血浆内的渗透压、皮质醇、血糖和肝糖原的变化规律和恢复情况。张伟等[15]通过运输试验探究了不同的运输密度和盐度对大黄鱼(Larimichthys crocea)幼鱼体内的血清生化指标的影响, 具体指标包括鱼体体内的皮质醇、糖元和乳酸含量。彭士明等[17]研究表明, 银鲳(Pampus argenteus)幼鱼在不同的运输密度的胁迫下进行12 h的运输后, 不同密度组血清内的皮质醇、血糖和肌肉乳酸含量全部显著升高, 但肝脏和肌肉组织中的糖元含量却显著降低。卵形鲳鲹, 分类上属硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、鲹科(Carangidae)、鲳鲹属(Trachinotus), 俗名又叫鲳鲹、金鲳, 其肉质鲜美, 拥有鲮类所独有特的香味, 是南方等沿海地区名贵的海产品经济鱼类之一[18-20], 但未见运输胁迫对运输水体水质和卵形鲳鲹鱼苗影响的相关报道。以卵形鲳鲹鱼苗为研究对象, 采用塑料袋密闭充氧的运输方式, 运输8 h对比不同运输密度的卵形鲳鲹鱼苗对运输水质温度(T)、酸碱度(pH)、溶解氧(DO)和氨氮(NH4-N)的影响。同时通过测定不同密度胁迫对卵形鲳鲹鱼苗肝脏组织中各免疫酶活力的变化, 以及血清生化指标的前后变化, 明确卵形鲳鲹的应激反应程度, 以期确定卵形鲳鲹鱼苗最优的运输密度, 为其科学、高效的运输提供理论支持。
1 材料与方法 1.1 试验材料卵形鲳鲹鱼苗取自中国水产科学研究院南海水产研究所热带水产研究开发中心, 选取体质健康、体表无伤、活力强、规格相近的卵形鲳鲹鱼苗, 鱼体体长为(5.36±0.60)cm/尾, 鱼体质量为(3.04±0.71)g/尾。塑料袋密封充氧运输方式常用于养殖生产和增殖放流中, 塑料袋尺寸为48 cm×37 cm×22.5 cm, 每袋装入育苗池海水4 400 mL(水温29.5℃, 盐度32, pH7.96)。
1.2 模拟运输试验试验共设置3个密度组(D1=9 kg/m3、D2=12 kg/m3、D3=15 kg/m3), 即每袋对应装入黑鲷(Acanthopagrus schlegelii)鱼苗15、20和25尾, 每组设置3个平行。每袋将金鲳鱼苗放入后, 排掉多余空气, 充氧至饱和后立即用橡皮筋封闭, 试验过程中每1 h晃动5下以便氧气与海水混合。金鲳鱼苗装袋后与冰袋共同密封于泡沫箱内, 自然降温。试验共进行8 h, 全程禁开泡沫箱, 运输时间根据之前完成的关于最佳运输时长的实验确定。待运输结束取样完毕后, 将各密度组剩余鱼苗分别暂养于循环水系统中(水温28.5℃, 盐度32, pH 7.92)。
1.3 样品采集与检测分析在运输开始时采集样品作为对照组, 在8 h结束运输时, 取3个不同密度组的样品作为实验组。样品采集分为3部分:水样、肝脏样品和血清样品。水样在用于测定运输水体中T、pH、DO和NH4-N的含量变化。将Hitachi探头深入塑料袋中测定pH、DO和T; 测定完毕后, 取500 mL水样存于水样瓶中, NH4-N采用国标法测定。鱼经丁香酚麻醉后, 于冰上断尾取1 mL血液, 取完后, 放入EXPERT 18K-R冷冻离心机离心, 3 500 r/min, 离心10 min, 得到血清样品。肝脏样品于碎冰上进行解剖并摘取肝脏组织, 用万分天平称重, 按1︰9(g/mL)比例加入9倍的0.86%生理盐水, 用DREAMEL研磨仪研磨, 后放入EXPERT 18K-R冷冻离心机, 2 500 r/min离心10 min, 收集上清液, 置于–80℃冻存。使用南京建成生物工程研究所研发的试剂盒检测分析肝脏内的总超氧化物歧化酶(T-SOD)、乳酸脱氢酶(LDH)、过氧化氢酶(CAT)、和过氧化物酶(POD)活力以及血清中的肌酐(CRE)含量、谷丙转氨酶(GPT)和谷草转氨酶(GOT)活力; 测定血清中皮质醇(COR)含量试的剂盒选用江苏科特生物科技有限公司, 测定血清中葡萄糖(GLU)含量测定试剂盒选用上海荣盛生物药业有限公司。
1.4 统计分析实验数据采用SPSS 18.0进行单因素方差分析(one-way ANOVA analysis), 用Tukey法比较运输胁迫后各运输密度组间的肝脏免疫酶活性及血液生理生化指标的差异显著性, 显著性水平设置为P < 0.05。
2 结果 2.1 密度胁迫运输后卵形鲳鲹鱼苗的存活率模拟运输实验进行8 h后, D1、D2、D3不同密度组的卵形鲳鲹的鱼苗存活率均为100%。运输结束后, 放入循环水系统内暂养, 恢复良好, 72 h后不同密度组的存活率仍为100%。
2.2 不同卵形鲳鲹运输密度胁迫后对运输水质的影响经塑料袋密闭充氧运输8 h后, D1、D2、D3不同密度组的运输水体中的DO含量较运输前水体中DO含量无显著变化(图 1)。T(图 2)和pH(图 3)值随运输密度的增加较对照组呈降低趋势。不同密度组中的NH4-N(图 4)含量随运输密度的增加高于对照组, 其中NH4-N的含量显著高于对照组(P < 0.05, 下同)。
 |
| 图 1 不同卵形鲳鲹运输密度胁迫后运输水体中DO含量的变化规律 Fig. 1 Variation of DO in water under different transportation density stress of Trachinotus ovatus |
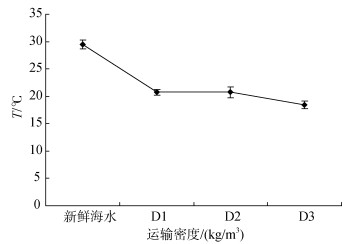 |
| 图 2 Variation of DO in water under different transportation density stress of Trachinotus ovatus Fig. 2 Variation of water temperature under different transportation density stress of Trachinotus ovatus |
 |
| 图 3 不同卵形鲳鲹运输密度胁迫后运输水体pH的变化规律 Fig. 3 Variation of pH in water under different transportation density stress of Trachinotus ovatus |
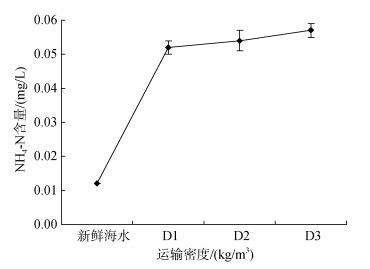 |
| 图 4 不同卵形鲳鲹运输密度胁迫后运输水体中NH4-N含量的变化规律 Fig. 4 Variation of NH4-N content in water under different transportation density stress of Trachinotus ovatus |
经塑料袋密闭充氧运输后, D1和D2密度组的卵形鲳鲹鱼苗肝脏组织中的T-SOD活力与对照组无显著差异, D3组与对照组存在显著差异, D3组显著低于对照组(图 5)。
 |
| 图 5 不同运输密度胁迫后卵形鲳鲹鱼苗肝脏组织T-SOD活力的变化规律 Fig. 5 Effects of different transport densities on T-SOD activity in the liver of Trachinotus ovatus |
经塑料袋密闭充氧运输后, 运输鱼苗的LDH活力如图 6所示, 密度运输胁迫组D1、D2、D3的LDH活力显著高于对照组水平, D2、D3无显著差异, 显著差异于D1组, 总体随着运输密度的增加, LDH活力逐渐增加。
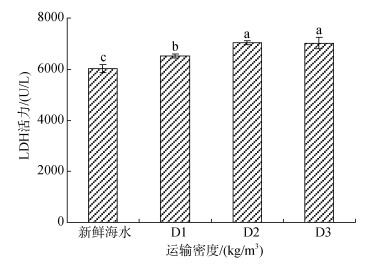 |
| 图 6 不同运输密度胁迫后卵形鲳鲹鱼苗肝脏组织LDH活力的变化规律 Fig. 6 Effects of different transport densities on LDH activity in the liver of Trachinotus ovatus |
经塑料袋密闭充氧运输后, 各组的POD活力如图 7所示, D1、D2、D3组的POD活力无显著差异, 但均显著低于对照组。运输后, 鱼体的POD活力显著降低。
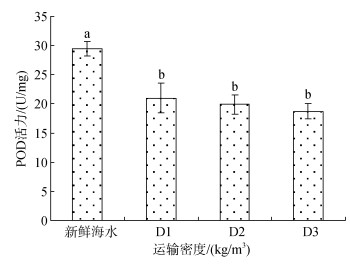 |
| 图 7 不同运输密度胁迫后卵形鲳鲹鱼苗肝脏组织POD活力的变化规律 Fig. 7 Effects of different transport densities on POD activity in the liver of Trachinotus ovatus |
经塑料袋密闭充氧运输后, D1、D2、D3组CAT活力均显著高于对照组且D1、D2、D3组无显著差异(图 8), 结果说明经过运输后, 鱼苗的CAT活力显著增加, 但是实验运输浓度下增加量差异不大。
 |
| 图 8 不同运输密度胁迫后卵形鲳鲹鱼苗肝脏组织CAT活力的变化规律 Fig. 8 Effects of different transport densities on CAT activity in the liver of Trachinotus ovatus |
运输胁迫下, 鱼苗血液中CRE含量的变化情况如图 9所示, D1、D2运输密度组中鱼体血清中的CRE含量与对照组相比, 显著低于对照组, 而高密度组(D3)的CRE含量显著高于对照组。结果表明, 运输胁迫下, 鱼苗血液中CRE含量发生了显著的变化, 且随着运输浓度的增加, CRE含量逐渐增加。
 |
| 图 9 不同运输密度胁迫后卵形鲳鲹血清中CRE含量的变化规律 Fig. 9 Effects of different transport densities on CRE activity in the serum of Trachinotus ovatus |
经密闭充氧运输后, 血清中卵形鲳鲹鱼苗D1、D2、D3组的COR活力无显著差异, 但都略高于对照组, 说明在运输胁迫下, 鱼苗的COR含量会有显著的增加(图 10)。
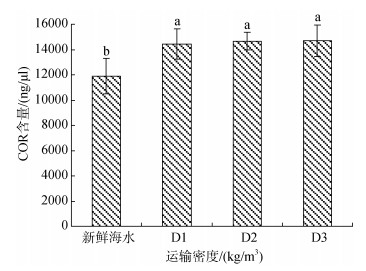 |
| 图 10 不同运输密度胁迫后卵形鲳鲹血清中COR含量的变化规律 Fig. 10 Effects of different transport densities on COR activity in the serum of Trachinotus ovatus |
各组经装袋密闭充氧运输后, 卵形鲳鲹鱼苗血液中的葡萄糖含量变化情况如图 11所示。D2、D3运输密度组鱼体血清中的GLU含量与对照组相比显示无显著差异, 但是D1组的GLU含量显著低于对照组。总体来说, 鱼苗血液中的葡萄糖含量与运输密度呈正相关。
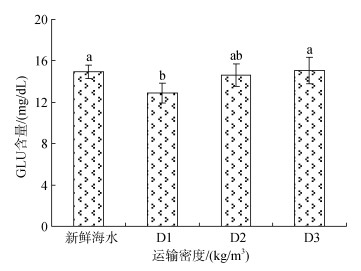 |
| 图 11 不同运输密度胁迫后卵形鲳鲹血清中GLU含量的变化规律 Fig. 11 Effects of different transport densities on GLU activity in the serum of Trachinotus ovatus |
经塑料袋密闭充氧运输后, D1、D2、D3组的GPT活力显著高于对照组, 且D3组又显著高于D1和D2组(图 12)。从图中结果我们可以得到:运输后, 各组GPT活力相较于对照组均显著增加, 且随着运输密度的增加, 有上升趋势。
 |
| 图 12 不同运输密度胁迫后卵形鲳鲹血清中GPT活力的变化规律 Fig. 12 Effects of different transport densities on GPT activity in the serum of Trachinotus ovatus |
经塑料袋密闭充氧运输后, D1、D2、D3组的GOT活力显著高于对照组, D1和D2组GOT活力无显著变化, D1和D2显著高于对照组(图 13)。
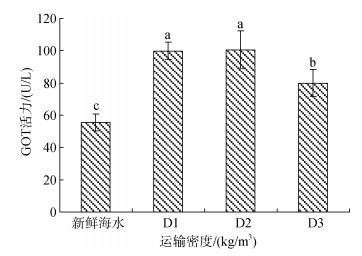 |
| 图 13 不同运输密度胁迫后卵形鲳鲹血清中GOT活力的变化规律 Fig. 13 Effects of different transport densities on GOT activity in the serum of Trachinotus ovatus |
每一种水生生物都有其生存的最适温度范围, 在此范围内生物可保持自身内环境稳定同时维持较高的新陈代谢水平。朱健康等[21]研究表明在运输过程中, 适当地降低环境温度, 可以使水产动物新陈代谢水平有效地降低, 减少其耗氧、呼吸排放和排泄, 防止长时间运输中水产动物高密度导致的氧气消耗过快的问题以及减轻排泄废物对运输水体污染, 另一方面, 降低水温还可以降低生物活力, 避免发生因碰撞而造成的体表损伤, 提高运输的成活率。卵形鲳鲹的适温范围在18℃~36℃。本实验运输水体初始温度为29.5℃, 加入冰袋进行密闭充氧运输8 h后, D1、D2、D3组的温度分别降至20.7℃、20.7℃和18.5℃。King[22]在其运输的水产品的生存的温度可适范围内, 降低10℃运输水体水温, 结果减少了水产品50%左右的耗氧量以及水产品氨类物质等排泄量。本试验的温度变化范围在10℃左右, 并且仍在其温度可适范围内, 适宜卵形鲳鲹鱼苗的运输。
3.1.2 水质水体是鱼类进行气体交换和离子交换的主要媒介, 同时也是代谢鱼体废物的净化剂, 水质是否优良是水生生物能否健康生存的必须条件。运输水体需根据所运输的鱼类选择合适的水源, 要注意水体中的溶解氧、酸碱度和氨氮类物质。鱼类以水为媒介, 消耗氧气来进行新陈代谢, 要保证不缺氧、不多氧。缺氧会导致鱼体呼吸困难, 而多氧(即过饱和状态)则会导致鱼体生病[23]。因此, 在运输过程中应使溶解氧含量尽量维持在完全饱和状态。本试验中, 卵形鲳鲹鱼苗不耐低氧, 但在运输过程中并未生病, 溶氧含量未有显著变化, 且试验后暂养72 h存活率仍为100%。但鱼类进行新陈代谢后, 主要产物为二氧化碳, 与水反应会生成弱酸, 降低水体pH值。通常来说, 鲜活水产品pH值得可适范围在6.5~9.0。在运输8 h后, D1、D2、D3组pH值均有所下降, 即相同的运输胁迫情况下, pH值的降低范围与运输密度呈负相关。在长时间的运输过程中, 由于小水体中高密度鱼体的新陈代谢, 鱼体的排泄物及黏液等在水中迅速累积, 如果不能被及时地净化或者是稀释, 则会使运输水体变得浑浊, 形成的悬浊物会附着在鱼的鳃部附近, 增加鱼体摄氧阻力, 从而导致呼困难, 并且其中具有毒性的物质还会让鱼出现氨中毒等现象, 严重可导致死亡。本试验中, D1、D2、D3氨氮的含量比对照组均有增加, 且与运输密度呈正相关, 氨氮含量较对照组存在显著差异(P<0.05)。在长距离运输过程中, 要注意氨氮含量的变化, 可采用中途换水, 或者使用过滤装置减缓水质恶化, 保证运输成活率与质量。
3.2 密度运输胁迫对卵形鲳鲹鱼苗肝脏组织的影响 3.2.1 T-SOD、POD、CAT活力在新陈代谢过程中脊椎动物体会产生活性氧自由基(reactive oxygen species, ROS), 在适宜生存环境条件下ROS的产生和清除会处于平衡状态, 不会对机体产生损伤, 并且在维护细胞活性方面发挥作用。假使鱼类在缺氧、高温和水质恶劣的条件下, 会产生的大量ROS, 而这些ROS如果不能有效地被分解, 就会导致细胞受损, 从而使鱼体本身进行氧化应激反应[24]。氧化应激是研究鱼体自身进行应激反应的重要组成部分。目前氧化应激主要以丙二醛、酶抗氧化系统及相关酶的基因表达(如SOD、CAT、POD)、非酶抗氧化系统(如谷胱甘肽)等作为量化指标来准确反映鱼类氧化应激反应状况[25]。机体在应激条件下, SOD会将机体内产生的ROS分解成H2O2, 而CAT又可以将H2O2还原成氧分子和水, 从而消除ROS对机体的影响, 从而维持细胞或机体的正常生理活动[26], CAT又是POD的一种。本试验测定了T-SOD、CAT和POD的活力, D3组与D1、D2组的T-SOD活力与对照组存在显著差异, D1、D2、D3组的CAT活力显著高于对照, 但POD活力显著低于对照组。结果表明卵形鲳鲹鱼苗经塑料袋密闭充氧运输后, 卵形鲳鲹鱼苗能通过机体自身及时清除胁迫产生的自由基, 从而维持正常的生理代谢; 但高密度组中, 可能因为其机体内累积了大量自由基, 致使机体损伤, 致使其抗氧化能力下降[27], 导致D3组的T-SOD活力显著低于D1、D2和对照组。CAT含量显著增多和POD含量显著降低猜测是由于运输胁迫致使ROS过量, 增加应激蛋白的表达, 激活CAT等抗氧化酶, 使其活性增强[28]。
3.2.2 LDH活力LDH是参与糖酵解途径与柠檬酸循环的关键酶, 不仅关系到细胞代谢, 还可以通过催化丙酮酸与乳酸直接转化而产生能量[29-30]。LDH活力的高低本质上来说, 取决于细胞内氧分压的高低。当氧分压降低时, 合成LDH的速度会加快且活力会增强, 因此LDH可作为一种衡量无氧代谢水平的指标[31]。LDH在评价鱼类健康方面具有重要意义[32], 过高的LDH不利于健康[33]。本试验中, 经运输胁迫8 h后, D1、D2、D3组LDH活力均显著高于对照组, 表示卵形鲳鲹鱼苗肝脏因运输胁迫而造成损伤。
3.3 密度运输胁迫对卵形鲳鲹鱼苗血清化指标的影响 3.3.1 COR皮质醇可以抑制肌肉组织对氨基酸的提取, 加快脂肪的氧化过程, 造成生长滞缓, 发育不良, 甚至死亡。血液中的皮质醇含量, 可以作为鱼类应激反应的重要指标。李亚男等[34]动物在受到环境胁迫后, 其体内的肾上腺皮质分泌活力上升, 导致皮质醇激素浓度升高, 但这也是造成动物抗病力下降的重要原因。皮质醇会降低机体的特异性和非特异性免疫能力, 还会增加机体对病原的敏感程度。Rotllant等[35]在对赤鲷(Pagrus pagrus)的研究中, 测定了其在拥挤胁迫23 d后皮质醇含量的变化情况, 结果表明其皮质醇含量对胁迫刺激敏感, 胁迫处理后含量显著提高。Barnett等[36]在对野生绿背菱鲽(Rhombosoiea tapirina)的研究中也得出了相同的结论, 其体内的皮质醇含量经过捕捞、运输、密度等胁迫刺激后, 也都出现了显著增加的现象。本试验中, D1、D2和D3组的皮质醇含量无显著差异, 但显著高于对照组, 证明运输胁迫会对鱼体造成一定的影响。
3.3.2 GLU血清中的葡萄糖, 即为血糖。鱼类的血糖含量, 与鱼体本身的运动、摄食、生物学特学、生活方式和环境更迭有关。葡萄糖是人体重要的组成部分, 也是能量的主要来源。血糖升高是因为遭受到环境胁迫后应激, 致使肝糖原分解加快, 脂肪加速分解, 保证在应急情况下对讷讷更亮的需求。Chen等[37]以寄生虫(Lepeophtheirus salmonis)作为生物胁迫因子对虹鳟鱼(Oncorhynchus mykiss)进行实验, 虹鳟血液中的血糖含量都较对照组高。而Grutter[38]研究表明, 寄生虫(Gnathiid isopods)并不能使黑鳍厚唇鱼(Hemigymnus melapterus)血糖含量发生显著变化, 认为这种寄生虫并不能产生明显的胁迫, 进而不存在有效的应激反应。本试验中, 历经8 h充氧密闭运输胁迫后, D1、D2、D3组并未增加血糖含量, 可能是因为运输胁迫的影响不足以使其消耗更多的能量, 便可以自我调节。
3.3.3 CRE、GPT、GOT肌酸不可逆的非酶脱水反应是CRE产生的主要途径, 其存在于肌肉组织中, 可作为肾功能障碍的指示指标。GPT主要在肝脏中合成, 是肝脏是否受损的可见指标之一, 肝功能出现障碍或发生病变时, GPT向血液中不断释放, 致使血清中的GPT不断上升。GOT主要存在于心肌细胞中, 通常作为心肌是否受损的指示酶, 在心肌细胞受到损伤或者通透性增加时, 会释放到血液中。经过8 h密闭充氧运输胁迫后, D1、D2、D3组的GPT活力和GOT活力均显著高于对照组, 且D3组的CRE含量显著高于对照组和D1、D2组。结果表明, 运输8 h对D1、D2和D3组的卵形鲳鲹均产生一定的影响, 甚至在肝脏和心肌都有一定的损伤; 且D3的卵形鲳鲹在肾功能上受损较严重。
4 结论密度胁迫对卵形鲳鲹的存活率无影响, 但对鱼体品质有影响, 其免疫酶活力和代谢能力均收到影响。在实际生活中, 需分清运输目的。若将运输鱼体(体长为5.36 cm/尾±0.60 cm/尾, 鱼体质量为3.04 g/尾±0.71 g/尾)作为种鱼进行保种育种工作, 封闭充氧运输时间在8 h之内, 建议运输密度小于12 kg/m3; 若将运输鱼体(体长为5.36 cm/尾±0.60 cm/尾, 鱼体质量为3.04 g/尾±0.71g/尾)作为商品, 在市场流通, 封闭充氧运输时间在8 h之内, 最大密度可为15 kg/m3。
| [1] |
洪磊, 张秀梅. 环境胁迫对许氏平鮋和花鲈血糖、血沉降的影响[J]. 中国水产科学, 2005, 12(4): 414-418. Hong Lei, Zhang Xiumei. Effects of environmental stress on plasma levels of glucose and ESR of Sebastes schlegeli and Lateolabrax maculates[J]. Journal of Fishery Sciences of China, 2005, 12(4): 414-418. DOI:10.3321/j.issn:1005-8737.2005.04.008 |
| [2] |
王文博, 李爱华. 环境胁迫对鱼类免疫系统影响的研究概况[J]. 水产学报, 2002, 26(4): 368-374. Wang Wenbo, Li Aihua. Changes of cortisol and lysozyme levels in Carassius auratus blood after crowding stress and the fish sensitivity to pathogen[J]. Journal of Fishery Sciences of China, 2002, 26(4): 368-374. |
| [3] |
Tort L. Stress and immune modulation in fish[J]. Developmental & Comparative Immunology, 2011, 35(12): 1366-1375. |
| [4] |
王丽娜, 申玉春, 叶宁, 等. 养殖密度对珍珠龙胆石斑鱼行为活动和生长性能的影响[J]. 南方农业学报, 2017, 48(5): 920-925. Wang Lina, Shen Yuchun, Ye Ning, et al. Effects of stocking density on behavior and growth performance of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂[J]. Journal of Southern Agriculture, 2017, 48(5): 920-925. DOI:10.3969/j.issn.2095-1191.2017.05.027 |
| [5] |
Couto A, Enes P, Peres H, et al. Effect of water temperature and dietary starch on growth and metabolic utilization of diets in gilthead sea bream (Sparus aurata) juveniles[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 2008, 151(1): 45-50. |
| [6] |
Zhang J, Shen H, Wang X, et al. Effect of chronic exposure of 2, 4-dichlorophenol on the antioxidant system in liver of freshwater fish Carassius auratus[J]. Chemosphere, 2004, 55(2): 167-174. DOI:10.1016/j.chemosphere.2003.10.048 |
| [7] |
Koolhaas J M, Bartolomucci A, Buwalda B, et al. Stress revisited:A critical evaluation of the stress concept[J]. Neuroscience & Biobehavioral Reviews, 2011, 35(5): 1291-1301. |
| [8] |
孙鹏, 尹飞, 彭士明, 等. 盐度对条石鲷幼鱼肝脏抗氧化酶活力的影响[J]. 海洋渔业, 2010, 32(2): 154-159. Sun Peng, Yin Fei, Peng Shiming, et al. Effects of salinity on the activity of antioxidant enzymes in livers of juvenile Oplegnathus fasciatus[J]. Marine Fisheries, 2010, 32(2): 154-159. DOI:10.3969/j.issn.1004-2490.2010.02.007 |
| [9] |
孙鹏, 尹飞, 王建建, 等. 操作胁迫对云纹石斑鱼肝脏抗氧化和鳃Na+.K+. ATPase活力的影响[J]. 海洋渔业, 2014, 36(3): 247-251. Sun Peng, Yin Fei, Wang Jianjian, et al. Responses of antioxidant system to transport stress in the liver of Nibea japonica[J]. Marine Fisheries, 2014, 36(3): 247-251. DOI:10.3969/j.issn.1004-2490.2014.03.008 |
| [10] |
刘奇奇, 温久福, 区又君, 等. 塑料袋包装充氧运输胁迫对四指马鲅幼鱼抗氧化系统的影响及抗应激剂的作用[J]. 动物学杂志, 2018, 1: 82-91. Liu Qiqi, Wen Jiufu, OU Youjun, et al. Effects of packing in plastic bags and oxygenating transport stress on antioxidant system and effects of anti-stress agent in juvenile Eleutheronema tetradactylum[J]. Chinese Journal of Zoology, 2018, 1: 82-91. DOI:10.3969/j.issn.1671-7856.2018.07.014 |
| [11] |
Almeida J A, Diniz Y S, Marques S F, et al. The use of the oxidative stress responses as biomarkers in Nile tilapia (Oreochromis niloticus) exposed to in vivo cadmium contamination[J]. Environment International, 2002, 27(8): 673-679. DOI:10.1016/S0160-4120(01)00127-1 |
| [12] |
洪磊, 张秀梅. 环境胁迫对鱼类生理机能的影响[J]. 海洋科学进展, 2004, 22(1): 114-121. Hong Lei, Zhang Xiumei. Effects of environmental stress on physiological function of fish[J]. Advances in Marine Science, 2004, 22(1): 114-121. DOI:10.3969/j.issn.1671-6647.2004.01.017 |
| [13] |
高金伟, 杜富宽, 顾若波, 等. 运输应激对刀鲚生理生化指标和HPI轴基因表达影响及甘草甜素的作用[J]. 上海海洋大学学报, 2015, 24(6): 817-825. Gao Jinwei, Du Fukuan, Gu Ruobo, et al. Effect of transport stress on physiological-biochemical indices and expression of HPI genes and roles of glycyrrhizin on transport response in Coilia nas[J]. Journal of Shanghai Fisheries University, 2015, 24(6): 817-825. |
| [14] |
周传朋, 刘波, 谢骏, 等. 抗应激制剂对运输团头鲂血清生化和肝抗氧化指标的影响[J]. 水产科学, 2014, 33(1): 8-14. Zhou Chuanpeng, Liu Bo, Xie Jun, et al. Effects of anti-stress agents on serum biochemical parameters and hepatic antioxidant parameters in Wuchang bream (Megalobrama amblycephala) during long-distance transportation[J]. Fisheries Science, 2014, 33(1): 8-14. |
| [15] |
张伟, 王有基, 李伟明, 等. 运输密度和盐度对大黄鱼幼鱼皮质醇、糖元及乳酸含量的影响[J]. 水产学报, 2014, 38(7): 973-980. Zhang Wei, Wang Youji, Li Weiming, et al. Effects of transportation density and salinity on cortisol, glycogen and lactate of large yellow croaker (Larimichthys crocea) juveniles[J]. Journal of Fisheries of China, 2014, 38(7): 973-980. |
| [16] |
Honryo T, Oakada T, Kawahara M, et al. Estimated time for recovery from transportation stress and starvation in juvenile Pacific bluefin tuna Thunnus orientalis[J]. Agriculture, 2018, 484(1): 175-183. |
| [17] |
彭士明, 施兆鸿, 李杰, 等. 运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J]. 水产学报, 2011, 35(6): 831-837. Peng Shiming, Shi Zhaohong, Li Jie, et al. Effect of transportation stress on serum cortisol, glucose, tissue glycogen and lactate of juvenile silver pomfret(Pampus argenteus)[J]. Journal of Fisheries of China, 2011, 35(6): 831-837. |
| [18] |
戚常乐, 林黑着, 黄忠, 等. 亚麻酸对卵形鲳鲹幼鱼生长性能、消化酶活性及抗氧化能力的影响[J]. 南方水产科学, 2016, 12(6): 59-67. Qi Changle, Lin Heizhao, Huang Zhong, et al. Effects of linolenic acid level on growth performance, digestive enzymes and antioxidant capacity of juvenile golden pompano (Trachinotus ovatus)[J]. South China Fisheries Science, 2016, 12(6): 59-67. DOI:10.3969/j.issn.2095-0780.2016.06.008 |
| [19] |
区又君, 陈世喜, 王鹏飞, 等. 低氧环境下卵形鲳鲹的氧化应激响应与生理代谢相关指标的研究[J]. 南方水产科学, 2017, 13(3): 120-124. OU Youjun, Chen Shixi, Wang Pengfei, et al. Study on oxidative stress response and physiological metabolism related indices of Trachinotus ovatus under hypoxia stress[J]. South China Fisheries Science, 2017, 13(3): 120-124. DOI:10.3969/j.issn.2095-0780.2017.03.016 |
| [20] |
陈世喜, 王鹏飞, 区又君, 等. 急性和慢性低氧胁迫对卵形鲳鲹鳃器官的影响[J]. 南方水产科学, 2017, 13(1): 124-130. Chen Shixi, Wang Pengfei, OU Youjun, et al. Acute and chronic hypoxia effect on gills of golden pompano (Trachinotus ovatus)[J]. South China Fisheries Science, 2017, 13(1): 124-130. DOI:10.3969/j.issn.2095-0780.2017.01.016 |
| [21] |
朱健康, 丁兰. 一种海水活鱼运输装置的水体降温技术[J]. 渔业现代化, 2006, 6: 40-41. Zhu Jiankang, Ding Lan. Water cooling technology for marine living fish transport device[J]. Fishery Modernization, 2006, 6: 40-41. |
| [22] |
King H R. Fish transport in the aquaculture sector:An overview of the road transport of Atlantic salmon in Tasmania[J]. Journal of Veterinary Behavior Clinical Applications & Research, 2009, 4(4): 163-168. |
| [23] |
Gomes L C, Edsandra C C, Richard P B, et al. Use of salt during transportation of air breathing pirarucu juveniles (Arapaima gigas) in plastic bags[J]. Aquaculture, 2006, 256(1): 521-528. |
| [24] |
Paital B, Chainy G B. Seasonal variability of antioxidant biomarkers in mud crabs (Scylla serrata)[J]. Ecotoxicology & Environmental Safety, 2013, 87(1): 33-41. |
| [25] |
Olsvik P A, Kai K L, Jordal A E O, et al. Evaluation of potential reference genes in real-time RT-PCR studies of Atlantic salmon[J]. BMC Molecular Biology, 2005, 6(1): 21. DOI:10.1186/1471-2199-6-21 |
| [26] |
Gupta I, Parihar A, Malhotra P, et al. Effects of Boswellia serrata gum resin in patients with ulcerative colitis[J]. European Journal of Medical Research, 1997, 2(1): 37-43. |
| [27] |
王庆奎, 陈成勋, 郭永军, 等. 7种中草药对斑点叉尾  生理生化指标的影响[J]. 安徽农业科学, 2011, 39(15): 9305-9308. 生理生化指标的影响[J]. 安徽农业科学, 2011, 39(15): 9305-9308.Wang Qingkui, Chen Chengxun, Guo Yongjun, et al. Seven Chinese herbal medicines affect physiological and biochemical indices in Ictalurus punctatus[J]. Journal of Anhui Agricultural Sciences, 2011, 39(15): 9305-9308. DOI:10.3969/j.issn.0517-6611.2011.15.176 |
| [28] |
彭翔, 宋文新, 周凡, 等. 发酵豆粕替代鱼粉对黑鲷胃肠道和血清指标的影响[J]. 江苏农业学报, 2012, 28(5): 1096-1103. Peng Xiang, Song Wenxin, Zhou Fan, et al. Effects of fermented soybean meal replacing fish meal on gastrointestinal tract and serum indexes in black sea bream[J]. Jiangsu Journal of Agricultural Sciences, 2012, 28(5): 1096-1103. |
| [29] |
Valarmathi S, Azariah J. Effect of copper chloride on the enzyme activities of the crab Sesarma quadratum (Fabricius)[J]. Turkish Journal of Zoology, 2003, 27(3): 253-256. |
| [30] |
Abdelmohsen H A. Assessment of respiratory and ion transport potential of Penaeus japonicus gills in response to environmental pollution[J]. Mediterranean Marine Science, 2012, 10(1): 5-18. |
| [31] |
赵伟民, 侯天德, 程昉. 温度对白条锦蛇SDH、LDH活性及LD含量的影响[J]. 四川动物, 2011, 30(1): 58-60. Zhao Weimin, Hou Tiandeng, Cheng Fang. Effect of temperature on SDH and LDH activities and LD contents in Elaphe dione[J]. Sichuan Journal of Zoology, 2011, 30(1): 58-60. DOI:10.3969/j.issn.1000-7083.2011.01.014 |
| [32] |
毛瑞鑫, 刘福军, 张晓峰, 等. 鲤鱼乳酸脱氢酶活性的QTL检测[J]. 遗传, 2009, 31(4): 407-411. Mao Ruixin, Liu Fujun, Zhang Xiaofeng, et al. Studies on quantitative trait loci related to activity of lactate dehydrogenase in common carp (Cyprinus carpio)[J]. Hereditas, 2009, 31(4): 407-411. |
| [33] |
李彦明, 赵炳芳, 武杰. 中药添加剂对肉杂鸡血清生化指标的影响[J]. 中国兽医杂志, 2008, 44(6): 46-47. Li Yanming, Zhao Bingfang, Wu Jie. Effect of traditional Chinese medicine additives on serum biochemical indexes in meat chicken[J]. Chinese Journal of Veterinary Medicine, 2008, 44(6): 46-47. DOI:10.3969/j.issn.0529-6005.2008.06.028 |
| [34] |
李亚南, 陈全震, 邵健忠, 等. 鱼类免疫学研究进展[J]. 动物学研究, 1995, 1: 83-94. Li Yanan, Chen Quanzhen, Shao Jianzhong, et al. Advances in research of fish immunology[J]. Zoological Research, 1995, 1: 83-94. |
| [35] |
Rotllant J, Pavlidis M, Kentouri M, et al. Non-specific immune responses in the red porgy Pagrus pagrus, after crowding stress[J]. Aquaculture, 1997, 156(3-4): 279-290. DOI:10.1016/S0044-8486(97)00075-6 |
| [36] |
Barnett C W, Pankhurst N W. The effects of common laboratory and husbandry practices on the stress response of greenback flounder Rhombosolea tapirina (Gunther, 1862)[J]. Aquaculture, 1998, 162(3-4): 313-329. DOI:10.1016/S0044-8486(98)00202-6 |
| [37] |
Chen X, Moon T W, Olson K R, et al. The effects of salt-induced hypertension on alpha1-adrenoreceptor expression and cardiovascular physiology in the rainbow trout (Oncorhynchus mykiss)[J]. American Journal of Physiology, 2007, 293(3): 1384-1392. |
| [38] |
Grutter A S. Infestation dynamics of gnathiid isopod juveniles parasitic on the coral-reef fish Hemigymnus melapterus, (Labridae)[J]. Marine Biology, 1999, 135(3): 545-552. DOI:10.1007/s002270050655 |
 2019, Vol. 43
2019, Vol. 43


