
文章信息
- 施琳妮, 于永翔, 姜勇, 张正, 王印庚, 廖梅杰, 荣小军. 2019.
- SHI Lin-ni, YU Yong-xiang, JIANG Yong, ZHANG Zheng, WANG Yin-geng, LIAO Mei-jie, RONG Xiao-jun. 2019.
- 不同来源美人鱼发光杆菌美人鱼亚种菌株表型差异性分析
- Studies on the phenotypic differences of different Photobacterium damselae subsp. damselae strains
- 海洋科学, 43(6): 15-24
- Marine Sciences, 43(6): 15-24.
- http://dx.doi.org/10.11759/hykx20190115001
-
文章历史
- 收稿日期:2019-01-15
- 修回日期:2019-03-16
2. 中国水产科学研究院 黄海水产研究所, 青岛海洋科学与技术国家实验室, 海洋渔业科学与食品产出过程功能实验室, 青岛 266071;
3. 青岛国家海洋科学研究中心, 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao, Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao, National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. National Marine Science Research Center, Qingdao 266071, China
美人鱼发光杆菌(Photobacterium damselae)是一种海洋生物致病菌, 包括美人鱼亚种以(Photobacterium damselae subsp. damselae)以及杀鱼亚种(Photobacterium damselae subsp. piscicida)两个亚种。美人鱼亚种1981年从患病的热带鱼类Chromis punctipinnis上首先分离得到, 最初被称为Vibrio damsela[1]。随后在海鲷、大菱鲆、鳗鱼[2-4]等多种生物中均有美人鱼发光杆菌引发疾病的报道。感染美人鱼发光杆菌美人鱼亚种后的典型特征一般表现为出血性败血症[5]。同时, 美人鱼发光杆菌美人鱼亚种亦会造成人类感染, 进而导致坏死性筋膜炎等疾病, 是一种人类和海洋生物的共同致病菌[6]。
同一种细菌的不同菌株间往往存在明显的表型差异, 这是微生物研究中普遍存在的现象。而对于病原菌而言, 研究其表型差异可以为解析其致病机制和进行菌株鉴定提供重要的依据。如对水稻白枯叶细菌[7]、油橄榄青枯病菌[8]等植物病原菌的研究发现, 生理生化表性特征差异明显的不同菌株, 其致病力也显著不同。本文选取的研究对象美人鱼弧菌美人鱼亚种是近二十年来海水养殖的新发病原之一。在美人鱼发光杆菌美人鱼亚种的致病性研究过程中, 溶血素是被报道最多的重要毒力因子之一。美人鱼发光杆菌美人鱼亚种的溶血素基因主要分为两类, 一类是质粒编码的溶血素Dly和Phly P, 一类是染色体编码的溶血素Phly C[9]。染色体编码的溶血素Phly C存在于所有具有溶血效应的美人鱼发光杆菌美人鱼亚种菌株中, 但其对溶血毒力的贡献较小[10], 而可以编码溶血素Dly和Phly P的质粒pPHDD1的存在则是美人鱼亚种中具有高溶血能力菌株的典型特征[11], 同时质粒上编码的溶血素与染色体编码的溶血素之间的协同和附加作用同样对菌株的溶血能力及毒力大小具有重要影响[12]。但不同美人鱼发光杆菌美人鱼亚种菌株间的是否存在溶血素相关基因的明显差异, 以及这种差异能否直接表现在表型特征上, 目前尚缺乏深入的研究。
近几年来, 在我国已经报道了银鲳、半滑舌鳎、龙胆石斑鱼[13-15]等多种海水养殖鱼类因感染美人鱼发光杆菌而发病的案例。美人鱼发光杆菌逐渐成为危害海水养殖的重要病原之一, 在南方和北方都对我国海水养殖产业的健康发展构成了新的威胁。但不同宿主和地域来源的美人鱼发光杆菌菌株是否存在明显的表型和致病性差异, 还没有相对全面的参考数据。本研究以实验室保存的分离自许氏平鲉Sebaste sschlegelii、大菱鲆Scophthalmus maximus、鲍鱼Albalone、大泷六线鱼Hexagrammos, 褐点石斑鱼Epinephelus、珍珠龙胆石斑鱼Epinephelus. Sp.、牙鲆Paralichthys olivaceus等不同养殖生物的多株美人鱼发光杆菌菌株为研究对象, 对它们的生理生化特征、药物敏感性以及溶血特性等多项表型特征的差异性进行了分析验证, 相关研究结果可为美人鱼发光杆菌病的快速检测、天然弱毒菌株的筛选以及疫苗的制备奠定工作基础。
1 材料与方法 1.1 试验菌株来源及亚种鉴定试验用美人鱼发光杆菌菌株来源于黄海水产研究所病原库内保存的菌株, 共25株, 其分离宿主和分离时间如表 1所示。所有菌株使用胰蛋白胨大豆肉汤(TSB)琼脂培养基进行活化待用。
| 菌株编号 | 宿主 | 分离区域 | 分离年份 |
| A | 大菱鲆 | 山东莱州 | 2013.05 |
| B | 许氏平鲉 | 山东长岛 | 2017.05 |
| C | 许氏平鲉 | 山东长岛 | 2016.06 |
| D | 许氏平鲉 | 山东长岛 | 2016.07 |
| E | 许氏平鲉 | 山东长岛 | 2016.09 |
| F | 许氏平鲉 | 山东长岛 | 2016.11 |
| G | 许氏平鲉 | 山东长岛 | 2016.08 |
| H | 许氏平鲉 | 山东长岛 | 2017.01 |
| I | 大菱鲆 | 江苏赣榆 | 2012.06 |
| J | 大菱鲆 | 江苏赣榆 | 2010.06 |
| K | 许氏平鲉 | 山东长岛 | 2017.06 |
| L | 许氏平鲉 | 山东长岛 | 2017.05 |
| M | 牙鲆 | 山东胶南 | 2009.05 |
| N | 牙鲆 | 山东胶南 | 2009.06 |
| O | 牙鲆 | 山东胶南 | 2009.07 |
| P | 许氏平鲉 | 山东长岛 | 2018.07 |
| Q | 大泷六线鱼 | 山东长岛 | 2018.07 |
| R | 许氏平鲉 | 山东长岛 | 2018.08 |
| S | 褐点石斑鱼 | 海南崖城 | 2016.11 |
| T | 珍珠龙胆石斑鱼 | 海南昌江 | 2016.11 |
| U | 珍珠龙胆石斑鱼 | 海南昌化 | 2016.11 |
| V | 褐点石斑鱼 | 海南万宁 | 2016.12 |
| W | 珍珠龙胆石斑鱼 | 海南昌江 | 2016.12 |
| X | 大菱鲆 | 河北黄骅 | 2009.06 |
| Y | 鲍鱼 | 山东青岛 | 2010.08 |
因美人鱼发光杆菌亚种之间理化指标差异过大, 没有对比的意义, 因此作者在进行表型差异研究之前, 用16S rRNA以及ureC基因对25株菌株进行美人鱼发光杆菌亚种鉴定[16]。其中16S rRNA基因的引物序列为: F 5′-GCTTGAAGAGATTCGAGT-3′R 5′-C ACCTCGCGGTCTTGCTG-3′, ureC基因的引物序列为: F5′-TCCGGAATAGGTAAAGCGGG-3′R 5′-CTTG AATATCCATCTCATCTGC-3′。PCR反应条件为: 95℃预变性4 min, 95℃变性1 min, 60℃复性1 min, 72℃延伸40 S, 30个循环, 最后72℃温育5 min, 4℃保存。以大肠杆菌DNA以及无酶超纯水做阴性及空白对照。
1.2 生理生化特性分析纯化后的菌株用革兰氏染色液试剂盒(购自北京索莱宝科技有限公司)进行染色后, 显微镜观察菌株形态。用购自青岛海博生物技术有限公司的细菌微量生化鉴定管进行不同菌株的生理生化特性测定, 28℃培养24~48 h后观察不同菌株的生理生化反应实验结果。
1.3 药物敏感性测试采用K-B纸片扩散法[17]进行不同菌株的抗生素药敏实验, 药敏纸片购自杭州微生物试剂有限公司, 以抑菌圈的直径与美国临床实验室标准化协会(CLSI)标准[18]对比来判断其药物敏感度。
1.4 溶血能力测定将活化菌株在TSB琼脂培养基上纯化培养, 分别挑取单菌落于1.5 % NaCl溶液中制成1×108 cfu/mL的菌悬液, 于无菌操作台上使用点种法点种于血平板之上(血平板由TSB琼脂培养基灭菌后降温至55℃再添加5%脱纤维绵羊血制成)。点种结束后, 将血平板倒置于恒温培养箱中, 28℃培养24~48 h, 记录溶血现象。
1.5 最小抑菌浓度检测根据K-B药敏纸片法的测试结果, 挑选多粘菌素B, 氧氟沙星, 环丙沙星, 洛美沙星以及萘啶酸5种美人鱼发光杆菌美人鱼亚种较为敏感的药物进行最小抑菌浓度的检测。
制备1×108 cfu/mL浓度的菌悬液, 并以10倍梯度稀释至107、106、105、104 cfu/mL共5个梯度, 分别接种于无菌酶标板孔内, 每孔180 μL, 每个梯度设置3个平行, 加入5 μL1% TTC溶液, 28℃恒温培养。为使药物对细菌生长抑制效果有足够时间得以体现[19], 每隔1.5 h观察TTC变色现象以确定接菌密度。
将筛选出的5种药物多粘菌素B、萘啶酸、氧氟沙星、环丙沙星、洛美沙星溶解制成320、320、80、80、80 μg/mL的原液, 以二倍稀释法进行梯度稀释, 分别稀释8个梯度, 用0.22 μm孔径滤膜过滤除菌。分别加20 μL到酶标板标定的药敏检测区域中, 每组设两个重复, 空白对照及阴性对照组中加入20 μL无菌纯水。将待测菌株制成1×106 cfu/mL菌悬液, 无菌操作下加入到药敏检测区域和阴性对照区中, 每孔加180 μL, 空白对照加无菌TSB培养基180 μL, 三个区域均加入5 μLTTC溶液。
2 实验结果 2.1 菌株形态及亚种鉴定25株菌株在TSB培养基上培养24~48 h后, 均呈白色不透明的圆形菌落, 表面光滑, 中部略微隆起, 直径多在1~2 mm(图 1-a), 革兰氏染色阴性(图 1-b)。测试的全部菌株均能在TCBS(图 1-c)上生长。透射电镜(图 1-d)下, 所有菌株都呈现杆状、单根极生鞭毛, 菌体大小约为(1.8~2.2)μm×(0.5~0.8)μm。25株菌利用16S rRNA以及ureC基因引物(图 2)扩增后均出现两条条带, 条带大小分别为267 bp和448 bp, 鉴定为美人鱼发光杆菌美人鱼亚种。
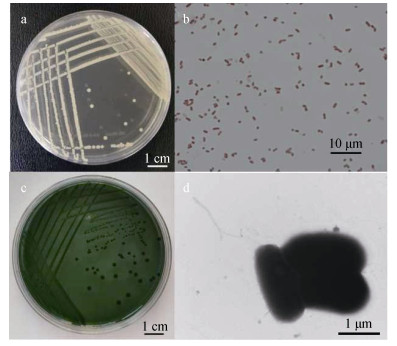 |
| 图 1 美人鱼发光杆菌美人鱼亚种菌株形态特征 Fig. 1 Morphological characteristics of Photobacterium damselae subsp. Damselae strains 注: a: TSB生长的菌落形态; b:革兰氏染色形态; c: TCBS生长的菌落形态; d:透射电镜下的菌株形态 |
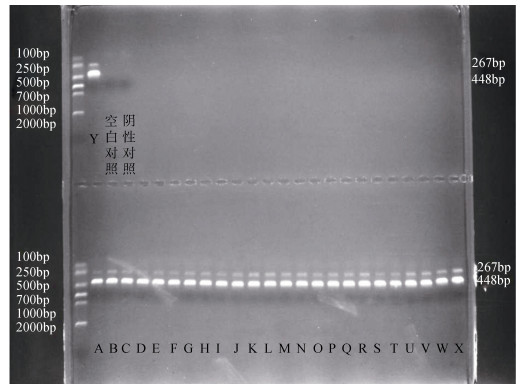 |
| 图 2 不同菌株多重PCR产物的琼脂糖电泳 Fig. 2 Agarose gel electrophoresis of the multiplex-PCR products obtained for the different strains 注: 267 bp和448 bp分别对应16s rRNA和ureC基因扩增片段大小; 编号A-Y代表不同菌株; 空白对照添加无酶超纯水; 阴性对照添加大肠杆菌DNA |
所测试的25株菌生理生化特性如表 2所示。25株菌对于3%胰胨水、无盐胰胨水、葡萄糖、肌醇、3% NaCl ONPG以及精氨酸双水解酶等22种生化试管的反应呈现了高度的一致性, 对于丙二酸盐、尿素酶、赖氨酸脱羧酶以及西蒙氏枸橼酸盐4种生化特性则呈现出较大的差异性。
| 项目 | 菌株编号 | |||||||||||||||||||||||||
| A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | ||
| 无盐胰胨水 | - | + | - | - | + | - | - | + | - | - | - | + | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl胰胨水 | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| 6%NaCl胰胨水 | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| 10%NaCl胰胨水 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl葡萄糖 | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| 3%NaCl蔗糖 | - | - | - | - | - | - | - | - | - | - | - | + | + | - | - | - | - | - | + | - | - | - | + | - | - | |
| 3%NaCl甘露醇 | - | - | - | - | - | - | - | - | - | - | - | - | + | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl阿拉伯糖 | - | - | - | - | - | + | + | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl乳糖 | - | - | - | - | - | + | + | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 山梨醇 | - | - | - | - | - | - | - | - | - | - | - | + | + | - | - | - | - | - | - | - | - | - | - | - | - | |
| 苦杏仁苷 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 肌醇 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 丙二酸盐 | - | - | - | - | - | + | + | - | - | - | - | - | - | + | - | + | - | - | - | + | + | + | + | + | - | |
| 鼠李糖 | - | - | - | - | - | + | + | - | - | - | - | - | - | - | - | - | - | - | - | + | - | - | - | - | - | |
| 蜜二糖 | - | - | - | - | - | + | + | - | - | - | - | + | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl ONPG | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl尿素酶 | + | + | - | + | + | + | + | + | + | + | + | + | + | + | + | + | - | + | + | - | - | - | - | + | + | |
| 木糖 | + | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl鸟氨酸脱羧酶 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl赖氨酸脱羧酶 | + | - | - | - | - | - | - | - | - | - | - | - | + | - | + | - | - | - | + | + | + | - | - | + | - | |
| 3%NaC精氨酸双水解酶 | + | + | + | + | + | + | + | + | + | + | + | + | - | + | + | + | + | + | + | + | + | + | + | + | + | |
| Kovacs试剂 | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| 3%NaCl MR-VP | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 3%NaCl明胶 | - | - | - | - | - | - | - | - | - | - | - | - | + | - | - | - | - | - | - | - | - | + | - | - | - | |
| 西蒙氏枸橼酸盐 | + | + | - | + | + | - | - | + | + | + | + | - | - | - | - | - | - | - | - | - | - | - | - | - | + | |
| 3%NaCl硫化氢产生 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| 注: “+”为阳性; “-”为阴性; A-Y为菌株编号 | ||||||||||||||||||||||||||
所有25株菌中, 仅有两株菌表现了极强的β溶血特性(图 3-a), 而其余23株菌均表现了α溶血即部分溶血特性(图 3-b)。
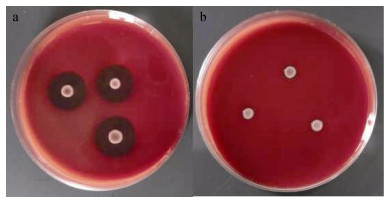 |
| 图 3 不同美人鱼发光杆菌美人鱼亚种菌株的溶血表现 Fig. 3 The hemolyzing characteristics of different strains of Photobacterium damselae subsp. Damselae a: β全溶血; b: α半溶血 |
25株菌抗生素药敏结果如表 3所示。在所测试的38种抗生素药物中, 25株菌对丁胺卡那、链霉素、复方新诺明、苯唑青霉素以及乙酰螺旋霉素5种抗生素均表现出了药物抗性; 对氟罗沙星、萘啶酸、洛美沙星、头孢胺噻肟、菌必治以及盖伯斯林6种抗生素均表现出高度或中度敏感; 对其余27种抗生素均有菌株的敏感性与大部分菌株呈现相反的现象, 菌株之间表现了明显的药物敏感差异性。
| 抗生素种类 | 菌株编号 | |||||||||||||||||||||||||
| A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | ||
| 丁胺卡那 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 链霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 苯唑青霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 复方新诺明 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 乙酰螺旋霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 氟罗沙星 | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ■ | ■ | |
| 萘啶酸 | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | |
| 洛美沙星 | ■ | ■ | ★ | ■ | ■ | ★ | ★ | ★ | ★ | ★ | ★ | ■ | ★ | ★ | ★ | ■ | ★ | ★ | ★ | ■ | ★ | ■ | ■ | ■ | ■ | |
| 头孢胺噻肟 | ■ | ■ | ★ | ■ | ★ | ■ | ■ | ★ | ■ | ■ | ★ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ■ | ★ | ■ | |
| 菌必治 | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ★ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | |
| 盖伯斯林 | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ★ | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ★ | ★ | ■ | ■ | ■ | ■ | ■ | |
| 氟苯尼考 | ■ | ■ | ■ | ■ | ★ | ■ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ◆ | ■ | ■ | ■ | ■ | ■ | ■ | |
| 氧氟沙星 | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ■ | ★ | ■ | ■ | ■ | ◆ | ■ | ■ | ■ | ■ | |
| 氟哌酸 | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ★ | ★ | ■ | ■ | ■ | ★ | ★ | ■ | ■ | ■ | ■ | ■ | ◆ | ■ | ■ | ■ | ■ | |
| 多粘菌素B | ■ | ★ | ■ | ■ | ★ | ★ | ★ | ★ | ★ | ★ | ★ | ◆ | ★ | ■ | ■ | ■ | ■ | ★ | ★ | ■ | ■ | ■ | ★ | ◆ | ■ | |
| 环丙沙星 | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ◆ | ■ | ■ | ■ | ★ | ★ | ■ | ★ | ■ | ■ | ★ | ◆ | ■ | ■ | ■ | ■ | |
| 头孢他啶 | ■ | ■ | ■ | ★ | ★ | ■ | ■ | ◆ | ★ | ★ | ◆ | ★ | ★ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ◆ | ■ | |
| 氯霉素 | ★ | ■ | ★ | ■ | ■ | ■ | ★ | ■ | ◆ | ◆ | ★ | ■ | ■ | ◆ | ◆ | ■ | ■ | ■ | ★ | ■ | ■ | ★ | ■ | ■ | ■ | |
| 先锋V | ■ | ★ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ■ | ◆ | ■ | ◆ | ★ | ★ | ■ | ■ | ■ | ◆ | ■ | ★ | ■ | ◆ | ◆ | ■ | |
| 新生霉素 | ■ | ★ | ◆ | ■ | ◆ | ★ | ■ | ★ | ◆ | ★ | ★ | ■ | ■ | ■ | ■ | ■ | ◆ | ★ | ◆ | ■ | ■ | ◆ | ★ | ★ | ■ | |
| 四环素 | ◆ | ■ | ★ | ■ | ■ | ■ | ■ | ■ | ◆ | ◆ | ■ | ■ | ■ | ◆ | ◆ | ■ | ★ | ■ | ◆ | ■ | ■ | ■ | ■ | ■ | ■ | |
| 强力霉素 | ◆ | ■ | ■ | ■ | ■ | ■ | ■ | ■ | ◆ | ◆ | ■ | ■ | ■ | ◆ | ◆ | ■ | ■ | ■ | ◆ | ■ | ■ | ■ | ■ | ■ | ■ | |
| 美满霉素 | ◆ | ★ | ★ | ★ | ★ | ★ | ◆ | ★ | ◆ | ◆ | ★ | ★ | ■ | ◆ | ◆ | ■ | ★ | ◆ | ◆ | ★ | ★ | ◆ | ■ | ★ | ■ | |
| 先锋IV | ■ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | ◆ | ★ | ★ | ★ | ★ | ★ | ◆ | ★ | ★ | ★ | ★ | ◆ | ■ | |
| 克拉霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 青霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | |
| 红霉素 | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | |
| 新霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | ◆ | ◆ | ◆ | |
| 氨苄青霉素 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | |
| 先锋必 | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ■ | |
| 卡那霉素 | ◆ | ★ | ◆ | ■ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | |
| 庆大霉素 | ◆ | ★ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | |
| 恩诺沙星 | ◆ | ★ | ◆ | ◆ | ★ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | |
| 痢特灵 | ★ | ■ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | ◆ | ◆ | ◆ | ◆ | ■ | |
| 利福平 | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | ◆ | ◆ | ◆ | ★ | |
| 阿奇霉素 | ◆ | ★ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ■ | ◆ | ★ | ◆ | ■ | |
| 先锋VI | ◆ | ★ | ◆ | ◆ | ★ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ◆ | ★ | ★ | ★ | ◆ | ★ | ★ | ★ | ◆ | ★ | ◆ | ◆ | ◆ | |
| 吡哌酸 | ◆ | ★ | ◆ | ★ | ◆ | ★ | ◆ | ◆ | ★ | ◆ | ◆ | ★ | ◆ | ★ | ◆ | ★ | ◆ | ◆ | ★ | ★ | ◆ | ◆ | ★ | ★ | ★ | |
| 注: ◆为抗性; ■为高度敏感; ★为中度敏感; A-Y为菌株编号 | ||||||||||||||||||||||||||
如表 4所示, 添加不同浓度的萘啶酸后, 多数菌株的最小抑菌浓度均在2.5~10 μg/mL, 菌株A最小抑菌浓度在20 μg/mL, 菌株K、T以及W的最小抑菌浓度则高于320 μg/mL。添加不同浓度的环丙沙星后, 除菌株K和W外, 其余24株菌株最小抑菌浓度均低于2.5 μg/mL之间。添加不同浓度的洛美沙星、氧氟沙星以及多粘菌素B后, 16株菌株的最小抑菌浓度差异较大, 其最小抑菌浓度从0.625~160 μg/mL均有分布。
| 菌株编号 | 抗生素种类 | ||||
| 萘啶酸 | 多粘菌素B | 氧氟沙星 | 环丙沙星 | 洛美沙星 | |
| A | 20 | 5 | 5 | 2.5 | 10 |
| B | 5 | 5 | 5 | 0.625 | 10 |
| C | 5 | 5 | 5 | 2.5 | 10 |
| D | 2.5 | 160 | 0.625 | ≤0.625 | 0.625 |
| E | 2.5 | 5 | 0.625 | ≤0.625 | 0.625 |
| F | 10 | 10 | 2.5 | ≤0.625 | 2.5 |
| G | 2.5 | 5 | 1.25 | ≤0.625 | 1.25 |
| H | 2.5 | 2.5 | 0.625 | ≤0.625 | 0.625 |
| I | 2.5 | 10 | 0.625 | ≤0.625 | 1.25 |
| J | 2.5 | 20 | ≤0.625 | ≤0.625 | ≤0.625 |
| K | ≥320 | 2.5 | ≥80 | ≥80 | ≥80 |
| L | 10 | 10 | 5 | 2.5 | 10 |
| M | 20 | 5 | 10 | 2.5 | 20 |
| N | 5 | 5 | 0.625 | ≤0.625 | 2.5 |
| O | 10 | 80 | 2.5 | ≤0.625 | 2.5 |
| P | 10 | 5 | 5 | 2.5 | 10 |
| Q | 10 | 10 | 5 | 2.5 | 10 |
| R | 2.5 | 40 | ≤0.625 | ≤0.625 | 1.25 |
| S | 10 | 20 | 2.5 | ≤0.625 | 2.5 |
| T | ≥320 | 160 | 5 | 2.5 | 20 |
| U | 10 | 20 | 5 | 2.5 | 20 |
| V | 5 | 10 | 2.5 | ≤0.625 | 1.25 |
| W | ≥320 | 2.5 | ≥80 | 40 | ≥80 |
| X | 2.5 | 80 | 0.625 | ≤0.625 | 2.5 |
| Y | 2.5 | 20 | 1.25 | ≤0.625 | 1.25 |
美人鱼发光杆菌美人鱼亚种是一种能感染多种海洋生物的致病菌, 自1981年首次从患病雀鲷科鱼中分离出来后, 陆续有多种海洋生物分离出美人鱼发光杆菌的报道。Hassanzadeh等[20]于伊朗波斯湾内的六带鲹(Caranx sexfasciatus)中分离出美人鱼发光杆菌美人鱼亚种, 且证实了其具有溶血性。Vaseeharan等[21]从印度东海岸患有黑腮症状的斑节对虾(Penaus monodon)中分离出的病原菌被证实为美人鱼发光杆菌美人鱼亚种。我国也曾有美人鱼发光杆菌感染不同养殖生物发病的报道, 如Liu等[22]报道美人鱼发光杆菌可感染脊尾白虾(Exopalaemon carinicauda)致使肝胰腺苍白、虾体呈白色并大量死亡; Zhao等[23]报道的美人鱼发光杆菌感染卵形鲳鲹(Trachinotus ovatus)幼鱼后, 使病鱼腹部膨大、腹鳍以及尾鳍等充血溃疡, 并大量死亡。在全球范围内, 美人鱼发光杆菌已成为一种可感染多种海水养殖生物发病的新兴病原, 对水产养殖的健康发展构成了新的威胁。
本研究采用的25株菌美人鱼发光杆菌美人鱼亚种菌株分别分离自我国的大菱鲆、许氏平鲉、石斑鱼、大泷六线鱼、牙鲆等不同海水养殖生物, 对这些菌株表型差异性进行分析, 有助于更好的了解我国美人鱼发光杆菌的分布情况, 为更加深入的研究其致病机理和进行科学的防控奠定基础。生理生化特性的检测结果表明, 25株菌对22种理化指标表现出了高度的一致性, 仅有4种理化指标存在差异, 证明美人鱼发光杆菌美人鱼亚种的生理生化表现特征相对稳定, 受不同分离地域和宿主的影响有限。而根据抗生素药物敏感性以及5种典型抗生素最小抑菌浓度的测试结果来看, 来源不同的25株菌株除对苯唑青霉素等11种抗生素的敏感性无较大差异外, 对其余27种抗生素的敏感性差异均较为明显。而25株菌对5种敏感抗生素的MIC也存在明显差异。这一现象表明, 不同宿主和不同养殖环境来源的同一种病原菌其药物敏感性相比自身的生理生化特性, 可能更容易受到外界环境的影响。潘琳等[24]针对26株乳球菌(Lactococcus)的MIC研究结果中指出, 养殖生物的地域环境、养殖模式、摄食习性、使用抗生素的种类和剂量等都会造成病原菌的耐药性差异。需要说明的是, 本实验所测试MIC的5种试验药物是依据抗生素药物敏感性的初步实验结果选取, 仅为进一步深入分析不同美人鱼发光杆菌菌株之间的药物敏感差异性, 其中的部分药物已被国家列为禁用渔药。因此, 相关研究结果仅做科研参考, 不具有生产指导意义。
本次研究发现, 不同美人鱼发光杆菌美人鱼亚种菌株之间的溶血能力差异显著, 25株菌株中仅有2株表现了极强的溶血性, 而其余的绝大部分菌株溶血能力并不突出。感染美人鱼发光杆菌后的主要症状为出血性败血症, 因此目前多数研究重点关注于美人鱼发光杆菌溶血素的产生机制, 溶血性是很多细菌性病原致病力的主要判断指标之一, 曾有多种弧菌被证实其感染养殖生物后引起败血症, 如牟海津等[25]发现副溶血弧菌(Vibrio Parahemolyticus)胞外产物中的溶血素导致对虾(Penaeus orientalis)败血症, 梁利国等[26]发现存在溶血素基因的温和气单胞菌(Aeromonas sobria)能引起黄金鲫(Carassius auratus auratus)患有体表出血等症状。多项研究表明美人鱼发光杆菌美人鱼亚种中存在着编码溶血素Dly、Phly P以及Phly C等[9]溶血基因以及编码磷脂酶Plp V等具有溶血活性物质的基因。对此, 本研究中有关美人发光杆菌菌株的致病力鉴定的重要依据就是表型溶血能力的差异。而明确溶血能力和菌株致病力之间的对应关系, 不仅可以快速进行高致病性美人鱼发光杆菌美人鱼亚种毒株的检测, 对于海水养殖产业中科学预防美人鱼发光杆菌的感染具有重要的指导意义; 同时可以以此筛选出天然的弱毒株, 以此为基础进行美人鱼发光杆菌疫苗的研究, 从而实现对美人鱼发光杆菌病更加高效、安全的预防。通过本研究, 证实了我国美人鱼发光杆菌美人鱼亚种不同菌株的分布存在表型特征的多样性, 而对其表型差异性产生的机制及影响因素进行深入研究, 这也是今后值得探究的科学问题。
| [1] |
Milton L, Teebken-Fisher D, Hose J E, et al. Vibrio damsela, a marine bacterium, causes skin ulcers on the damselfish Chromis punctipinnis[J]. Science, 1981, 214(4525): 1139-1140. DOI:10.1126/science.214.4525.1139 |
| [2] |
Vera P, Navas J I, Fouz B. First isolation of Vibrio damsela from sea bream (Sparus aurata)[J]. Bulletin of the European Association of Fish PathologisTS, 1991, 3(11): 112-113. |
| [3] |
Fouz B, Larsen J L, Nielsen B, et al. Characterization of Vibrio damsela strains isolated from turbot Scophthalmus maximus in Spain[J]. Diseases of Aquatic Organisms, 1992, 12(3): 155-166. |
| [4] |
Ketterer P J. Deaths in captive eels (Anguilla reinhardtii) due to Photobacterium (Vibrio) damsela.[J]. Australian Veterinary Journal, 1992, 69(8): 203-204. DOI:10.1111/j.1751-0813.1992.tb07528.x |
| [5] |
吴同垒, 靳晓敏, 王洪彬, 等. 美人鱼发光杆菌溶血素Hlych基因的原核表达及免疫血清制备[J]. 动物医学进展, 2018, 10(39): 31-35. Wu Tonglei, Jin Xiaomin, Wang Hongbin, et al. Prokaroytic expression and properation of immune serum of Hlych gene of Photobacterium damselae[J]. Progressin Veterinary Medicine, 2018, 10(39): 31-35. |
| [6] |
Rivas A J, Lemos M L, Osorio C R. Photobacterium damselae subsp. damselae, a bacterium pathogenic for marine animals and humans[J]. Frontiers in Microbiology, 2013, 4: 1-6. |
| [7] |
韦石泉, 郑怀民, 李桂珍. 水稻白叶枯细菌致病力差异的鉴别及其生理生化反应的研究[J]. 微生物学杂志, 1982, 1: 6-15. Wei Shiquan, Zhen Huaimin, Li Guizhen. Identification of pathogenicity differences of Xanthomonas oryzae and study on their physiological and biochemical reactions[J]. Journal of Microbiology, 1982, 1: 6-15. |
| [8] |
邓惠勤. 油橄榄青枯病菌菌落形态与致病关系[J]. 林业科技通讯, 1980, 8: 21-23. Deng Huiqin. Relationship between colony morphology and pathogenicity of Pseudomonas solanacarum[J]. Forest Science and Technology, 1980, 8: 21-23. |
| [9] |
陈吉祥, 杨慧, 颜显辉, 等. 致病性哈维氏弧菌溶血素基因克隆及其检测[J]. 中国水产科学, 2005, 12(5): 580-587. Chen Jixiang, Yang Hui, Yan Xianhui, et al. Cloning of hemolysin gene from a pathogenic Vibrio harveyi SF1 and its detection in diseased marine animals and marine environments[J]. Journal of Fishery Sciences of China, 2005, 12(5): 580-587. DOI:10.3321/j.issn:1005-8737.2005.05.009 |
| [10] |
Terceti M S, Rivas A J, Alvarez L, et al. RstB Regulates Expression of the Photobacterium damselae subsp. damselae Major Virulence Factors Damselysin, Phobalysin P and Phobalysin C[J]. Frontiers in Microbiology, 2017, 8: 1-11. |
| [11] |
Rivas A J, von Hoven G, Neukirch C, et al. Phobalysin, a small beta-Pore-Forming toxin of Photobacterium damselae subsp. damselae[J]. Infect Immun, 2015, 83(11): 4335-4348. DOI:10.1128/IAI.00277-15 |
| [12] |
Vences A, Rivas A J, Lemos M L, et al. Chromosome- encoded hemolysin, phospholipase, and collagenase in plasmidless isolates of Photobacterium damselae subsp. damselae contribute to virulence for fish[J]. Applied and Environmental Microbiology, 2017, 83(11): 1-16. |
| [13] |
Rivas A J, Balado M, Lemos M L, et al. Synergistic and additive effects of chromosomal and Plasmid-Encoded eemolysins contribute to hemolysis and virulence in Photobacterium damselae subsp. damselae[J]. Infection and Immunity, 2013, 81(9): 3287-3299. DOI:10.1128/IAI.00155-13 |
| [14] |
Tao Z, Shen C, Zhou S, et al. An outbreak of Photobacterium damselae subsp. damselae infection in cultured silver pomfret Pampus argenteus in Eastern China[J]. Aquaculture, 2018, 492: 201-205. DOI:10.1016/j.aquaculture.2018.04.013 |
| [15] |
杨楠, 张志强, 吴同垒, 等. 半滑舌鳎源美人鱼发光杆菌美人鱼亚种分离鉴定[J]. 中国兽药杂志, 2018, 52(2): 19-25. Yang Nan, Zhang Zhiqiang, Wu Tonglei, et al. Isolation and Identification of Photobacterium damselae subsp. Damselae from Tongue Sole[J]. Chinese Journal of Veterinary Drug, 2018, 52(2): 19-25. |
| [16] |
张晓君, 秦国民, 陈翠珍, 等. 龙胆石斑鱼源美人鱼发光杆菌的生物学特性与系统发育学分析[J]. 渔业科学进展, 2009, 30(3): 38-43. Zhang Xiaojun, Qin Guomin, Chen Cuizhen, et al. Biological characterization and phylogenetic analysis of Photobacterium damselae subsp. Damselae from diseased Epinephelus lanceolatus L.[J]. Progress in Fishery Sciences, 2009, 30(3): 38-43. DOI:10.3969/j.issn.1000-7075.2009.03.007 |
| [17] |
Osorio C R, Toranzo A E, Romalde J L, et al. Multiplex PCR assay for ureC and 16s rRNA genes clearly discriminates between both subspecies of Photobacterium damselae[J]. Diseases of Aquatic Organisms, 2000, 40: 117-183. DOI:10.3354/dao040117 |
| [18] |
崔惠敬, 孟玉霞, 冯文倩, 等. 养殖大菱鲆肠道中大菱鲆弧菌的分离鉴定及药敏试验[J]. 水产科学, 2017, 36(2): 125-131. Cui Huijing, Meng Yuxia, Feng Wenqian, et al. Identification and antimicrobial susceptibility test of Vibro Scophthalmi isolated from the intestine of cultured turbot Scophthalmus Maximus[J]. Fisheries Science, 2017, 36(2): 125-131. |
| [19] |
CLSI. Performance Standards for Antimicrobial Susceptibility Testing; Twenty-Fifth Informational Supplement[S]. CLSI document M100-S25, 2015.
|
| [20] |
刁菁, 杨秀生, 叶海斌, 等. 一种水产迟钝爱德华氏菌快速药敏检测方法的研究[J]. 水产科学, 2014, 33(1): 22-28. Diao Jing, Yang Xiusheng, Ye Haibin, et al. A rapid sensitive detection method of pathogen Edwardsiella tarda[J]. Fisheries Science, 2014, 33(1): 22-28. |
| [21] |
Hassanzadeh Y, Bahador N, Baseri-Salehi M. First time isolation of Photobacterium damselae subsp. damselae from Caranx sexfasciatus in Persian Gulf[J]. Iran J Microbiol, 2015, 3(7): 178-184. |
| [22] |
Vaseeharan B, Sundararaj S, Murugan T, et al. Photobacterium damselae ssp. damselae associated with diseased black tiger shrimp Penaeus monodon Fabricius in India[J]. Letters in Applied Microbiology, 2007, 45(1): 82-86. DOI:10.1111/j.1472-765X.2007.02139.x |
| [23] |
Liu F, Liu G X, Li F H. Characterization of two pathogenic Photobacterium strains isolated from Exopalaemon carinicauda causing mortality of shrimp[J]. Aquaculture, 2016, 464: 129-135. DOI:10.1016/j.aquaculture.2016.06.019 |
| [24] |
Zhao D H, Sun J J, Liu L, et al. Characterization of two phenotypes of Photobacterium damselae subsp. damselae isolated from diseased juvenile Trachinotus ovatus reared in Cage Mariculture[J]. Journal of the World Aquaculture Society, 2009, 40(2): 281-289. DOI:10.1111/j.1749-7345.2009.00251.x |
| [25] |
潘琳, 陈霞, 邵玉宇, 等. 乳球菌属对抗生素最小抑菌浓度的分析[J]. 现代食品科技, 2016, 32(12): 125-132. Pan Lin, Chen Xia, Shao Yuyu, et al. Analysis of minimum inhibitory concentration of antibiotics against Lactococcus strains[J]. Modern Food Science and Technology, 2016, 32(12): 125-132. |
| [26] |
牟海津, 李筠, 包振民, 等. 副溶血弧菌胞外产物对中国对虾的致病性分析[J]. 海洋与湖沼, 2000, 31(3): 273-280. Mu Haijin, Li Jun, Bao Zhenmin, et al. Pathogenicity of extracellular products of vibrio Parahaemolyticus to Penaeus Chinensis[J]. Oceanologia Et Limnoogia Sinica, 2000, 31(3): 273-280. DOI:10.3321/j.issn:0029-814X.2000.03.007 |
| [27] |
梁利国, 马昕羽, 谢骏. 西利鲟嗜水气单胞菌与其他3株气单胞菌间的免疫交叉反应[J]. 水生态学杂志, 2013, 34(5): 76-81. Liang Liguo, Ma Xiyu, Xie Jun. Isolation, Identification and detection of hemolysin of Aeromonas sobriafrom Carassius auratus auratus[J]. Journal of Hydroecology, 2013, 34(5): 76-81. DOI:10.3969/j.issn.1674-3075.2013.05.013 |
 2019, Vol. 43
2019, Vol. 43


