文章信息
- 王乐普, 解修俊, 王广策, 朱大玲. 2019.
- WANG Le-pu, XIE Xiu-jun, WANG Guang-ce, ZHU Da-ling. 2019.
- 光质对三角褐指藻光保护过程的影响
- Effect of light quality on the photoprotection process of Phaeodactylum tricornutum
- 海洋科学, 43(6): 42-47
- Marine Sciences, 43(6): 42-47.
- http://dx.doi.org/10.11759/hykx20190129004
-
文章历史
- 收稿日期:2019-01-29
- 修回日期:2019-03-04
2. 天津市卤水化工与资源生态化利用重点实验室, 天津 300457;
3. 中国科学院海洋研究所, 实验海洋生物学重点实验室, 山东 青岛 266071;
4. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室, 山东 青岛 266071
2. Tianjin Key Laboratory of Brine Chemical Engineering and Resource Eco-utilization, Tianjin 300457, China;
3. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. Laboratory for Marine Biology and Biotechnology; Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
硅藻是广泛分布的单细胞真核藻类, 贡献了大约全球海洋初级生产力的40%, 在海洋碳循环过程中发挥重要作用[1], 这与硅藻特殊的代谢机制和强大的适应能力密切相关。根据内共生理论, 硅藻的叶绿体是在二次吞噬过程中由一种原始红藻演化而来[2, 3], 同时, 硅藻细胞还在不断接受来自其他细菌基因的水平转移[4]。因此硅藻在核基因结构方面表现出不同的起源特征, 在某些代谢方式上似乎跟动物更类似。例如硅藻细胞具有尿素循环代谢途径, 因而能适应长期的氮限制逆境环境, 并在上升流期间实现快速增殖[5]。
硅藻的高度适应能力表现在对环境变化, 特别是光的变化的快速响应上。众所周知, 光能一方面驱动光合作用固定二氧化碳, 另一方面当光能过剩时也可能引发氧化性损伤, 甚至导致细胞死亡[6]。光合生物通过一种称为叶绿素荧光非光化学性淬灭(non-photochemical quenching of chlorophyll fluorescence, NPQ)的过程将吸收的过剩光能转化为无害的热[7, 8]。NPQ的形成主要受到类囊体腔酸化的激活, 类囊体膜上多种天线蛋白[9, 10]以及叶黄素循环[11, 12]构成了调控NPQ的复杂网络。硅甲藻黄素循环是调控硅藻NPQ的重要因素, 其正向和逆向反应非常迅速, 被认为是硅藻成功适应环境光波动变化的关键[13, 14]。目前对硅藻NPQ及硅甲藻黄素循环的研究主要集中在光强方面, 在响应环境光光谱变化的方面的研究还不多。
硅藻门(Bacillariophyta)、羽纹纲(Pennatae)的三角褐指藻(Phaeodactylum tricornutum)是目前研究硅藻生理生化及分子生物学的模式物种[4, 15]。作者以三角褐指藻为材料, 对不同光质下处理的三角褐指藻经历高光胁迫时的NPQ及硅甲藻黄素循环进行了研究, 研究结果表明蓝光对三角褐指藻NPQ的形成具有至关重要的作用。
1 材料与方法 1.1 材料培养及处理三角褐指藻在三角瓶中培养, 初始浓度OD(720 nm)为0.05, 培养温度为20±1℃, 光照强度约为80 μmol/(m2/s)~100 μmol/(m2/s), 光暗周期为12︰12。培养4 d到达指数生长期的三角褐指藻用于不同光质的处理和高光胁迫响应实验。实验中设置了3种不同波长的单色光LED光源, 分别为蓝光(B, 波长450 nm)、绿光(G, 波长520 nm)、红光(R, 波长630 nm), 以及包括红、绿、蓝3种单色LED的组合光(RGB)。不同光的波长使用光谱仪(EVERFINE, PLA-20, China)测定得出。不同光质处理实验中通过调节LED灯珠的个数调节至相同光强(80 μmol/(m2/s)~ 100 μmol/(m2/s))。
1.2 叶绿素荧光的测定收集处理不同时间的材料用于高光胁迫处理及叶绿素荧光的测定。不同光质处理的样品在实验前先测定藻液叶绿素a浓度, 测定方法参考文献[16]。测定叶绿素荧光前将不同处理组样品调整至相同叶绿素a浓度(10 μg/mL)。使用Imaging-PAM Maxi(Walz GmbH, Effeltrich, 德国)测定叶绿素荧光。将待测藻液注入比色皿中, 放在样品槽内暗适应5 min。通过非常微弱的红色测量光(< 0.01 μmol/(m2/s))测定藻液的最小荧光(Fo), 通过饱和脉冲(10 000 μmol/(m2/s))测定暗适应藻液的最大荧光(Fm)。然后打开光化光, 样品先后连续在高强度光化光(800 μmol/(m2/s))和低强度光化光下(80 μmol/(m2/s))照射30 min, 期间每隔1 min用饱和脉冲诱导处于照光状态下的材料的最大荧光(Fm′), 根据Fm和Fm′计算非光化学性淬灭(NPQ): NPQ=(Fm – Fm′)/Fm′[17]。将高光处理30 min的藻液以及低强度光化光恢复30 min后的藻液快速离心, 舍弃上层的培养液, 藻泥用液氮速冻, –80℃保存, 用于提取色素。
1.3 色素提取及含量测定从–80℃取出样品, 用预冷的甲醇︰丙酮(1︰1)混合液在低光、低温下提取色素。样品加入提取液后, 在漩涡混合仪上剧烈震荡, 使沉淀的藻细胞充分悬浮, 然后置于–20℃黑暗浸提30 min, 期间震荡1~2次。细胞悬液在4℃下离心(6 000 g, 1 min), 离心管底部沉淀的细胞为白色。吸取上层的提取液, 经过针头式一次性尼龙滤器(孔径0.22 μm)过滤后用于HPLC分析。利用Rigol高效液相色谱仪对提取的色素进行分离、定性和定量。色谱条件参考文献[18], 依据保留时间和硅甲藻黄素循环的激活状态以脱环氧比(de-epoxidation state, DEPS)表示, DEPS = Dtx/ (Ddx + Dtx), 其中Ddx指的是硅甲藻黄素(diadinoxanthin), Dtx指的是硅藻黄素(diatoxanthin)。
2 结果本研究考察了三角褐指藻光合作用生理过程对环境光变化的响应, 使用了不同的单色光LED灯源, 实验中所使用的3种单色光、组合光以及荧光灯管白光的光谱比较见图 1。由于LED光源与传统的荧光灯光源在光谱方面仍有一定差异, 因此在进行光质处理之前首先比较了普通荧光灯光源白光培养的三角褐指藻与红、绿、蓝单色LED光组合培养的三角褐指藻在光保护方面的差异, 结果见图 2和图 3。在高光(800 μmol/(m2/s))胁迫处理30 min后, 白光组的叶绿素荧光非光化学性淬灭(NPQ)达到了7.25 ± 0.31, 而RGB组的NPQ值7.56 ± 0.4, 与白光组之间没有显著性差异(P > 0.05)。低光(80 μmol/(m2/s))恢复30 min后, NPQ值分别降低至2.04 ± 0.21和2.03 ± 0.15(图 2)。在高光胁迫期间, 三角褐指藻的硅甲藻黄素循环被激活, 脱环氧比(DEPS)值分别升至0.71 ± 0.01(RGB组)和0.71 ± 0.06(WL组), 低光恢复30 min后该值均降至0.15 ± 0.02, 白光组和红绿蓝组之间没有显著性差异(图 3)。NPQ和DEPS的结果说明红绿蓝组与普通白光组在高光响应方面没有显著性差别。
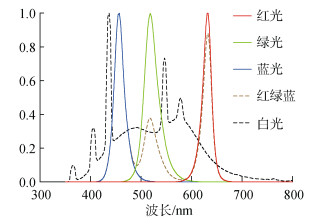 |
| 图 1 荧光灯管(白光)、3种单色光以及组合光(红绿蓝)的光谱归一化比较 Fig. 1 Comparison of the spectra of fluorescent white light (WL), three different monochromatic lights, and the combination of red, green, and blue LED lights (RGB) |
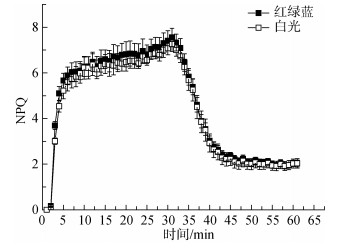 |
| 图 2 荧光灯白光(白光)、红绿蓝3种单色光组合(红绿蓝)培养的三角褐指藻NPQ的差异 Fig. 2 Comparison of the NPQ of Phaeodactylum tricornutum cultured under fluorescent white light (WL) and the combination of red, green, and blue LED lights (RGB) |
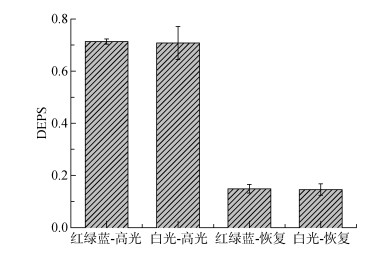 |
| 图 3 比较白光与红绿蓝3种单色光组合分别处理的三角褐指藻的硅甲藻黄素循环的差异 Fig. 3 Comparison of the diadinoxanthin cycle of P. tricornutum cultured under fluorescent white light and the combination of red, green, and blue LED lights 高光:高光(800 μmol/(m2·s))处理30 min, 恢复:高光30 min后在低光下(80 μmol/(m2·s))恢复30 min High light: Culture in μmol/(m2·s) for 30 min. Recover: Culture in 80 μmol/(m2·s) for 30 min after high light |
在不同光质下处理的三角褐指藻在强光和低光下的荧光淬灭及恢复情况见图 4。从图中可以看出, 3种不同波长单色光下适应的三角褐指藻对强光的响应(NPQ)明显不同。在红光和绿光下分别处理1 d的三角褐指藻在高光下形成的NPQ值与对照组没有显著差异, 但是在高光下形成的NPQ在低光后的恢复比对照组更慢。相比之下, 在蓝光下处理1 d的三角褐指藻在高光下形成的NPQ稍高于对照组, 且在低光下的恢复与对照接近。光质对三角褐指藻光保护的影响在处理3 d后变得更加显著(图 4中第二行)。与对照组相比, 红光组和绿光组三角褐指藻形成NPQ的能力明显下降, 且荧光的恢复更加缓慢, 而蓝光组材料的荧光淬灭水平高于对照组, 且在低光阶段荧光恢复得更快。处理至第5天, 这种差异性仍然非常明显。
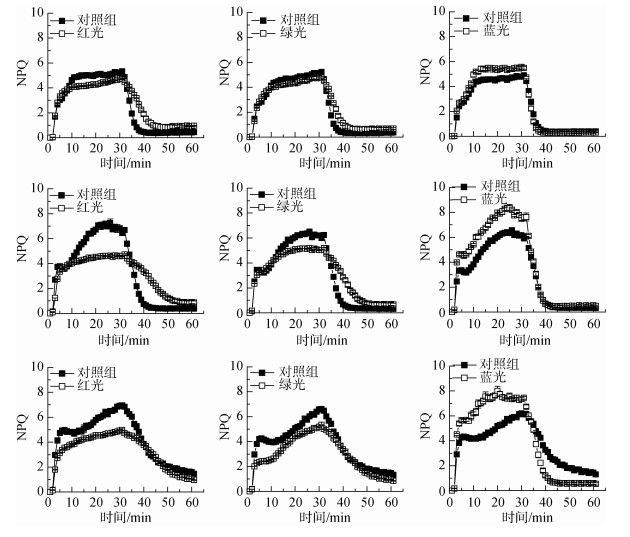 |
| 图 4 不同光质下处理的三角褐指藻响应高光形成NPQ的比较 Fig. 4 Development and relaxation of NPQ in P. tricornutum treated under different light qualities 在红光(左侧的3幅图)、绿光(纵向中间的3幅图)以及蓝光(右侧的3幅图)下处理1 d(上面的3幅图)、3 d(中间的3幅图)以及5 d(下面的3幅图)后的材料在高光下(800 μmol/(m2·s)和低光下(80 μmol/(m2·s))分别处理30 min, 以NPQ表征其光保护活性。每幅图中的黑色为对照组(RGB) Phaeodendron triconutum cultured under red light, green light and blue light was treated under high light and low light for 30 minutes respectively, its photoprotective activity was characterized by NPQ; The black part of each picture is the control group |
不同光质下培养的三角褐指藻其硅甲藻黄素对高光胁迫和低光恢复的响应见表 1。从表中的数据可以看出, 与对照组相比, 3种光质下培养的三角褐指藻在高光胁迫后积累的Dtx的相对含量并没有显著性的差异。特别是蓝光组, 虽然荧光淬灭的结果表明蓝光处理组在高光胁迫阶段形成的NPQ显著高于对照组, 但是其DEPS值与对照组却非常接近(对照组为0.75 ± 0.06, 蓝光组为0.68 ± 0.11)。
| 光质处理时间 | RGB | R | RGB | G | RGB | B | |
| 第一天 | 高光 | 0.82 ± 0.06 | 0.86 ± 0.03 | 0.79 ± 0.06 | 0.81 ± 0.03 | 0.83 ± 0.06 | 0.77 ± 0.07 |
| 低光恢复 | 0.07 ± 0.00 | 0.12 ± 0.00 | 0.06 ± 0.01 | 0.09 ± 0.01 | 0.06 ± 0.00 | 0.06 ± 0.00 | |
| 第三天 | 高光 | 0.78 ± 0.07 | 0.85 ± 0.02 | 0.74 ± 0.1 | 0.81 ± 0.03 | 0.76 ± 0.11 | 0.80 ± 0.07 |
| 低光恢复 | 0.05 ± 0.00 | 0.12 ± 0.01 | 0.05 ± 0.00 | 0.08 ± 0.01 | 0.05 ± 0.00 | 0.07 ± 0.10 | |
| 第五天 | 高光 | 0.73 ± 0.07 | 0.81 ± 0.03 | 0.72 ± 0.07 | 0.64 ± 0.1 | 0.75 ± 0.06 | 0.68 ± 0.11 |
| 低光恢复 | 0.13 ± 0.01 | 0.13 ± 0.01 | 0.12 ± 0.01 | 0.09 ± 0.01 | 0.11 ± 0.00 | 0.07 ± 0.00 | |
作者从非光化学性淬灭(NPQ)和硅甲藻黄素循环两个方面探讨了光质对三角褐指藻高光胁迫响应的影响。研究结果表明在不同单色光下培养的三角褐指藻响应高光胁迫时形成的NPQ具有显著的差异:红光及绿光下培养的三角褐指藻响应高光胁迫时形成的NPQ相对较低, 蓝光下培养的三角褐指藻响应高光胁迫时形成的NPQ相对较高。然而, 不同光质下培养的三角褐指藻在硅甲藻黄素循环方面却没有显著性差异。
硅藻与大型藻类多营固着性生长不同, 硅藻在海水中被动地随水流的运动不断移动。这一特征决定了硅藻细胞所处的环境始终处于多变的状态, 多种环境因子如光强、光质、温度、盐度等是持续波动变化的[19]。位于水体表层或上层时, 抵达细胞表面的直射光强可能远远高于细胞的光饱和点, 光能出现过剩; 位于较深水层时, 抵达细胞表明的光强可能远低于光补偿点, 光能出现限制。特别是在河口附近, 水体扰动频繁, 海水透明度低, 一次轻微的扰动都可能瞬间将硅藻细胞从光抑制(或光限制)环境推向光限制(或光抑制)环境。硅藻细胞必须既能在光抑制环境下耗散过剩光能, 在光限制环境下高效捕获光能, 同时又能在两种机制下快速切换, 才能保证光合固碳的高效运行[20]。
已有的研究报道表明, 硅藻中特殊的光保护调控机制可能与其高光适应密切相关[13, 14]。然而, 自然水体中除了光强骤变以外, 光质也经常发生变化。由于海水对不同波长光的吸收比率不同:对红光和远红光的吸收最强, 对紫外、蓝光和绿光的吸收则较弱[21], 因此, 处于水体较深处的硅藻细胞利用的光能主要是蓝光和绿光。我们的结果说明, 与红光相比蓝光更加有利于三角褐指藻的光保护能力的维持。这一特性有助于三角褐指藻在从底层被动迁移至表层时仍然保持有形成足够热耗散能力从而免受水体表层强光所导致的光损伤。这一生理特性对于三角褐指藻在自然界中更快速和更高效地利用光能进行光合固碳有积极作用。
蓝光与植物和藻类的多种生理过程密切相关。Petroutsos等[22]发现蓝光受体参与了绿藻光合作用的调控过程, 参与高能态淬灭(qE)调控的关键因子LHCSR3的表达受蓝光受体调控。硅藻中没有LHCSR蛋白, 功能类似的调控蛋白是LHCXs[23]。我们的研究结果表明, 蓝光培养的三角褐指藻与红光、绿光培养的三角褐指藻在硅甲藻黄素循环方面并没有显著性差异, 这暗示NPQ方面的差异可能与Lhcx的表达有关。然而, 这一结论还需要蛋白及分子生物学方面进一步实验数据的验证。
| [1] |
Bowler C, Vardi A, Allen A E. Oceanographic and biogeochemical insights from diatom genomes[J]. Annual Review of Marine Science, 2010, 2: 333-365. DOI:10.1146/annurev-marine-120308-081051 |
| [2] |
Keeling P J. The number, speed, and impact of plastid endosymbioses in eukaryotic evolution[J]. Annual Review of Plant Biology, 2013, 64: 583-607. DOI:10.1146/annurev-arplant-050312-120144 |
| [3] |
Gould S B, Waller R F, McFadden G I. Plastid evolution[J]. Annu Rev Plant Biol, 2008, 59: 491-517. DOI:10.1146/annurev.arplant.59.032607.092915 |
| [4] |
Bowler C, Allen A E, Badger J H, et al. The Phaeodactylum genome reveals the evolutionary history of diatom genomes[J]. Nature, 2008, 456: 239-244. DOI:10.1038/nature07410 |
| [5] |
Allen A E, Dupont C L, Obornik M, et al. Evolution and metabolic significance of the urea cycle in photosynthetic diatoms[J]. Nature, 2011, 473(7346): 203-209. DOI:10.1038/nature10074 |
| [6] |
Niyogi K K. Photoprotection revisited: genetic and molecular approaches[J]. Annual Review of Plant Biology, 1999, 50: 333-359. DOI:10.1146/annurev.arplant.50.1.333 |
| [7] |
Dall'Osto L, Cazzaniga S, Bressan M, et al. Two mechanisms for dissipation of excess light in monomeric and trimeric light-harvesting complexes[J]. Nat Plants, 2017, 3(5): 17033. DOI:10.1038/nplants.2017.33 |
| [8] |
Ruban A V. Nonphotochemical chlorophyll fluorescence quenching: mechanism and effectiveness in protecting plants from photodamage[J]. Plant Physiol, 2016, 170(4): 1903-16. DOI:10.1104/pp.15.01935 |
| [9] |
Dinc E L, Tian L, Roy M, et al. LHCSR1 induces a fast and reversible pH-dependent fluorescence quenching in LHCII in Chlamydomonas reinhardtii cells[J]. Proc Natl Acad Sci U S A, 2016, 113(27): 7673-7678. DOI:10.1073/pnas.1605380113 |
| [10] |
Sacharz J, Giovagnetti V, Ungerer P, et al. The xanthophyll cycle affects reversible interactions between PsbS and light-harvesting complex Ⅱ to control non-photochemical quenching[J]. Nature Plants, 2017, 3(2): 16225. DOI:10.1038/nplants.2016.225 |
| [11] |
Lavaud J, Materna A C, Sturm S, et al. Silencing of the violaxanthin de-epoxidase gene in the diatom Phaeodactylum tricornutum reduces diatoxanthin synthesis and non-photochemical quenching[J]. Plos One, 2012, 7(5): e36806. DOI:10.1371/journal.pone.0036806 |
| [12] |
Li Z R, Graham P, Dent R M, et al. Evolution of an atypical de-epoxidase for photoprotection in the green lineage[J]. Nature Plants, 2016, 2(10): 16140. DOI:10.1038/nplants.2016.140 |
| [13] |
Goss R, Lepetit B. Biodiversity of NPQ[J]. Journal of Plant Physiology, 2015, 172: 13-32. DOI:10.1016/j.jplph.2014.03.004 |
| [14] |
Wilhelm C, Jungandreas A, Jakob T, et al. Light acclimation in diatoms: from phenomenology to mechanisms[J]. Mar Genomics, 2014, 16: 5-15. DOI:10.1016/j.margen.2013.12.003 |
| [15] |
De Riso V, Raniello R, Maumus F, et al. Gene silencing in the marine diatom Phaeodactylum tricornutum[J]. Nucleic Acids Res, 2009, 37: e96. DOI:10.1093/nar/gkp448 |
| [16] |
Arnon D I. Copper enzymes in isolated chloroplasts-Polyphenol oxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24(1): 1-15. |
| [17] |
Maxwell K, Johnson G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany, 2000, 51: 659-668. DOI:10.1093/jexbot/51.345.659 |
| [18] |
Xie X, Gao S, Gu W, et al. Desiccation induces accumulations of antheraxanthin and zeaxanthin in intertidal macro-alga Ulva pertusa (Chlorophyta)[J]. Plos One, 2013, 8: e72929. DOI:10.1371/journal.pone.0072929 |
| [19] |
Schubert H, Forster R M. Sources of variability in the factors used for modelling primary productivity in eutrophic waters[J]. Hydrobiologia, 1997, 349: 75-85. DOI:10.1023/A:1003097512651 |
| [20] |
Macintyre H L, Kana T M, Geider R J. The effect of water motion on short-term rates of photosynthesis by marine phytoplankton[J]. Trends in Plant Science, 2000, 5(1): 12-17. DOI:10.1016/S1360-1385(99)01504-6 |
| [21] |
Depauw F A, Rogato A, d'Alcala M R, et al. Exploring the molecular basis of responses to light in marine diatoms[J]. J Exp Bot, 2012, 63(4): 1575-1591. DOI:10.1093/jxb/ers005 |
| [22] |
Petroutsos D, Tokutsu R, Maruyama S, et al. A blue-light photoreceptor mediates the feedback regulation of photosynthesis[J]. Nature, 2016, 537: 563-566. DOI:10.1038/nature19358 |
| [23] |
Bailleul B, Rogato A, de Martino A, et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(42): 18214-18219. DOI:10.1073/pnas.1007703107 |
 2019, Vol. 43
2019, Vol. 43


