
文章信息
- 王芳, 范嗣刚, 赵超, 王鹏飞, 闫路路, 邱丽华, 闫喜武. 2019.
- WANG Fang, FAN Si-gang, ZHAO Chao, WANG Peng-fei, YAN Lu-lu, QIU Li-hua, YAN Xi-wu. 2019.
- 斑节对虾TSG101基因的克隆及表达分析
- Characterization and expression analysis of TSG101 in black tiger shrimp (Penaeus monodon)
- 海洋科学, 43(7): 122-131
- Marine Sciences, 43(7): 122-131.
- http://dx.doi.org/10.11759/hykx20190321001
-
文章历史
- 收稿日期:2019-03-21
- 修回日期:2019-05-07
2. 中国水产科学研究院 南海水产研究所, 广东 广州 510300;
3. 农业农村部水生动物基因组学重点实验室 北京 100141
2. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China;
3. Key Laboratory of Aquatic Genomics, Ministry of Agriculture and Rural Affairs, Beijing 100141, China
肿瘤易感基因101(Tumor susceptibility gene 101, TSG101)是一种肿瘤抑制基因, 首次在小鼠(Mus musculus)成纤维细胞中发现。TSG101存在于细胞质和细胞核中。随着细胞周期的改变, TGS101的相对含量和位置也相应地发生变化[1]。TGS101是细胞内体分选转运复合物(endosomal sorting complexes required for transport, ESCRT)主要组成部分[2], 含有一些能与其他分子相互作用的独特结构域。这些结构域为非活性泛素结构域(Ubiquitin E2 variant, UEV)、脯氨酸富集区(proline-rich region, PRR)、稳定框(steadiness box, SB)和卷曲结构域(coiled coil, CC)[3]。UEV能与被泛素标记的底物[4]和病毒蛋白或是ESCRT-0中的肝细胞生长因子(Hepatocyte growth factor, Hrs)[5]相互结合。在细胞周期时, PRR与中心体蛋白55相互作用, 运输TSG101到中间体[6]。
TSG101参与了脊椎动物生长和增殖[7]等生物过程, 如肿瘤发生[8, 9], 细胞生长和增殖[10], 基因的表达和调控[11]。抑制TSG101可激活表皮生长因子受体蛋白和MAPK(丝裂原活化蛋白激酶)信号传导[12, 13]。TSG101可能与受体酪氨酸激酶信号传导的负调节有关[14, 15]。TSG101的失活, 抑制了EGF受体向溶酶体的转运, 导致下游信号级联的诱导延长。TSG101还与某些上皮肿瘤细胞中的肿瘤增强基因具有相反的作用[16, 17]。如Bieniasez[18]等利用Gag蛋白中的两种晚期结构域PTAP和YPLTSL分别和TSG101和ALG-2互作蛋白X(ALG-2 interacting protein X, Alix)相互作用进而启动ESCRT的相关分子帮助HIV-1完成组装和出芽过程。TSG101还参与DNA病毒的虎纹蛙病毒(Tiger frog virus, TFV)和其他RNA病毒的甲型流感病毒(Influenza A virus, IAV)、马尔堡病毒(Marburg virus, MARV)、禽类肉瘤病毒(Avian sarcoma virus, ASV)等病毒的出芽过程。在甲壳动物中, 日本囊对虾(Marsupenaeus japonicus)中的TSG101通过影响宿主细胞早期和晚期内体途径参与对虾白斑综合征病毒(White spot syndrome virus, WSSV)在宿主细胞内转运的过程, 在WSSV感染晚期, 日本囊对虾TSG101从细胞膜聚集状态转到细胞质附近, 推测在WSSV感染宿主过程中日本囊对虾的TSG101能够协同ESCRT中某些能与其发生相互组分来完成自身病毒的转运与释放[19]。TSG101在克氏原螯虾(Procambarus clarkii)中与Hrs相互作用形成ESCRT, 并识别凝集溶酶体中多囊泡体(Multivesicular bodies, MVBs)途径降解的转运分子[20], 表明克氏原螯虾中的TSG101是通过Toll途径参与克氏原螯虾的先天免疫[2]。
斑节对虾(Penaeus monodon)是中国重要的水产养殖物种。近年来, 斑节对虾深受病害的侵袭, 造成了严重的经济损失。研究斑节对虾先天免疫的分子机制对其病害防治有着重要的理论指导作用。哈维弧菌(Vibrio harveyi)为革兰氏阴性菌, 是海洋环境中广泛存在且能引起水生生物爆发大规模疾病的潜在弧菌之一[21]。养殖对虾中哈维弧菌是最早引起养殖对虾爆发发光病的主要病原菌, 不仅可以引发幼苗爆发疾病[22], 还能导致成虾死亡[19]; 金黄色葡萄球菌(Staphylococcus aureus)属于葡萄球菌属(Staphy lo coccus), 是一种革兰氏阳性菌, 同样是海洋动物爆发疾病的重要病原之一。这两种细菌常用于对虾的先天免疫分子机制研究中[20]。在斑节对虾中, TSG101抵御外界病菌刺激下的免疫应激机制却没有相关的研究报道, 其分子作用机制尚不明确。为探索TSG101在不同的免疫刺激下的不同的表达模式, 本研究克隆了斑节对虾TSG101基因的全长cDNA, 用实时荧光定量RT-PCR研究了TSG101 mRNA组织表达及其在细菌刺激下的表达情况, 以期能解析斑节对虾细菌刺激下的免疫机制奠定基础。
1 材料和方法 1.1 实验材料从广州市黄沙水产市场购买5只斑节对虾(体质量200 g±2 g)。在实验室暂养3 d后, 剪取每只虾的鳃、胃、性腺、肝胰腺、脑、淋巴、肠、心等组织, 液氮冷冻后保存, 用于斑节对虾TGS101序列克隆和组织表达分析。
在南海水产研究所珠海基地做斑节对虾的菌液注射实验。从基地池塘捕捞400只斑节对虾(体质量30 g±2 g), 随后转移到水桶中暂养3 d(海水盐度为5, 水温为25±1℃)。每天更换2/3的水, 及时清除池内的残留物, 并投喂商业饲料(广东双湖饲料有限公司)。
1.2 细菌刺激实验实验共有9组, 分为实验组1、2、3、4、5、6和对照组1、2、3, 每组各有30只虾。实验组注射的哈维弧菌和金黄色葡萄球菌浓度都是1×107个/mL, 实验组1、2、3里的每尾虾注射50 μL哈维弧菌悬液, 实验组4、5、6里每尾虾注射50 μL金黄色葡萄球菌悬液, 另对对照组1、2、3里的每尾虾注射同体积的磷酸缓冲液(PBS)。注射后的0、6、9、12、24、48、72 h每个时间点各取5尾虾的鳃和肝胰腺, 液氮冷冻后移至–80℃冰箱中保存。另取0 h的样品作为空白对照组。
1.3 RNA提取和cDNA合成用Trizol试剂(Invitrogen, 美国)提取上述样品的RNA, 按照说明书的试验步骤进行。RNA溶于DEPC处理过的ddH2O中。用2.0%的琼脂糖凝胶电泳检测RNA的完整性, 用NanoDrop 2000(美国)分光光度计对RNA浓度进行测定。以总RNA(1μg)为模板。脑等组织样品的RNA在反转录酶的M-MLV的作用下合成cDNA的第一条链, Oligo-dT为反转录引物。1.2中, 鳃和肝胰腺的RNA用PrimeScriptTM RT reagent Kit(Takara, 日本)进行逆转录, 获得cDNA, 浓度稀释至50ng/μL备用。
1.4 斑节对虾TSG101基因克隆和测序从笔者实验室的斑节对虾转录组数据中(未发表)获得PmTSG101基因cDNA序列。针对3'RACE设计引物TSG101-3race-F1和TSG101-3race-F2(表 1)的基因特异性, 使用SMARTTMRACE cDNA扩增试剂盒(Clontech, 美国)获得TSG101 cDNA序列的3′UTR。在3′末端, 用基因特异性引物TSG101- 3race-F1和通用引物UPM(UPX-long和UPX-short的混合物, 表 1)进行RACE PCR的降落PCR反应。PCR程序如下进行: 94℃初始变性3 min; 然后在进行30个循环的94℃ 30 s, 60℃ 30 s和72℃ 3 min; 最后一个循环是在72℃下延伸10 min。随后以上一轮的PCR产物为模板进行半巢式PCR, TSG101-3race- F2和通用引物NUP扩增, 程序为: 94℃ 3 min; 35个循环的条件为94℃ 30 s, 57℃ 30 s, 72℃ 3 min; 72℃ 10 min。PCR反应结束后将PCR反应产物连接到pMD18-T载体中、转化入大肠杆菌DH5a的感受态细胞, 含有3′RACE产物的重组质粒送广州擎科生物公司(广州, 中国)测序。
| 引物名称 | 序列(5′-3′) | 用途 |
| TSG101-F | ATGTCTCCTCAAAACCATGAACAAGTCG | TSG101 cDNA验证 |
| TSG101-R | TCAGCCAGCCATGTTCCCCTTT | TSG101 cDNA验证 |
| TSG101-3race-F1 | CGGCTGTAAGTGACCGTGTTCG | 3′RACE扩增 |
| TSG101-3race-F2 | GCCACTCAGGATGCCATTTATT | 3′RACE扩增 |
| TSG101-Qpcr-F | CCACTACATCCAGCGTCCCTA | 实时荧光定量PCR |
| TSG101-Qpcr-R | CTGCCGCAACACTGATACCTC | 实时荧光定量PCR |
| EF-1α-F | AAGCCAGGTATGGTTGTCAACTTT | 实时荧光定量PCR |
| EF-1α-R | CGTGGTGCATCTCCACAGACT | 实时荧光定量PCR |
利用ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找TSG101序列的开放阅读框; 使用Computer pI/Mw(http://web.expasy.org/compute_pi)分析TSG101氨基酸序列的等电点和分子量; 用SMART 4.0(http://smart.embl-heidelberg.de/)分析蛋白结构; 使用Swiss-model (http://swissmodel.expasy.org)对蛋白三级结构进行预测; 核苷酸序列同源性和相似性用MatGAT 2.01进行分析; 序列多重比对可以利用Clustal X 1.81和Bioedit软件进行比对; 进化树用MEGA 5.0的邻接法(Neighbor-joining, NJ)进行构建。
1.6 实时荧光定量PCR表达分析用PrimeScriptTM RT reagent Kit(Takara, 日本)将提取好的RNA逆转录成cDNA, 每个组织的cDNA设置3个重复, 并将浓度稀释至50 ng/μL备用。用引物TSG101-qpcr-F和TSG101-qpcr-R(表 1)进行荧光定量PCR, 以EF-1α为内参基因。用SYBR Premix Ex TaqTM试剂盒并根据其说明书进行实时荧光定量PCR, 每个组织的cDNA和内参均设置5个平行。数据分析处理采用相对CT法, 在mRNA水平上分析目的基因相对于内参基因的表达变化。
1.7 统计学分析实验数据使用SPSS 22.0进行单因素方差分析, 结果以“平均值±标准差(X±SD)”表示, 当P < 0.05时则认定为差异显著, P < 0.01则是极其显著的, 作图使用SigmaPlot软件。
2 结果 2.1 PmTSG101基因的生物信息学分析本研究用SMART RACE技术克隆出了斑节对虾TSG101基因的cDNA全长1 642 bp(GenBank号为MK069599)(图 1), 包括57 bp的5′非编码区(UTR)、1 323 bp的开放阅读框(ORF)和262bp的3′非编码区(UTR), 编码440个氨基酸, 理论分子量约为48.4 kda, 理论等电点为8.85。斑节对虾TSG101蛋白分析显示, 斑节对虾TSG101蛋白主要含有UEV结构域、CC结构域和SB结构域3个保守的功能结构域(图 1)。氨基酸序列比对, 结果显示斑节对虾TSG101序列与克氏原螯虾(AGZ84436.1)、麦茎蜂(Cephus cinctus, XP_015602525.1)、美洲鲎(Limulus polyphemus, XP_ 013789333.1)、内华达古白蚁(Zoo ter mopsis neva de nsis, XP_021914726.1)、干木白蚁(Cryptotermes secun dus, XP_023702457.1)、海岱果蝇(Drosophila hydei, XP_023164137.1)、威利斯托尼果蝇(Droso p hila willistoni, XP_002062519.1)、温室拟肥腹蛛(Para steatoda tepidariorum, XP_015920331.1)的TSG101序列同源性分别为82%、48%、53%、52%、53%、50%、50%、52%(图 2)。蛋白三级结构分析其单体由7个α折叠和6个无规则卷曲连接组成(图 3)。进化树结果表明, 斑节对虾与克氏原螯虾聚为一枝, 然后再与邻近的布氏果蝇(Drosophila busckii)在一起, 之后与龟壳攀鲈(Anabas testudineus)、大刺鳅(Ma sta cembelus armatus)、美妊丽鱼(Astatotilapia callip tera)、尼罗罗非鱼(Oreochromis niloticus)、花斑溪鱂(Kryptolebias marmoratus)等硬骨鱼类聚在一起, 与两栖类和哺乳动物的亲缘关系比较远(图 4)。
 |
| 图 1 斑节对虾TSG101 cDNA序列及其氨基酸序列 Fig. 1 Complete cDNA sequence and predicted amino acid sequence of TSG101 起始密码子(ATG)和终止密码子(TAG)用方框内; 灰色阴影表示UEV结构域; 波浪线表示CC结构域, 直线部分表示SB结构域 The start codon (ATG) and the stop codon (TGA) are marked in boxes; The UEV domain is shown in shadow; The CC domain is wavy underlined; The SB domain is underlined |
 |
| 图 2 斑节对虾TSG101氨基酸序列与其他物种TSG101氨基酸序列的比对结果 Fig. 2 Multiple alignment of deduced amino acid sequences of TSG101 from P. monodon and other species |
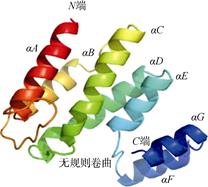 |
| 图 3 斑节对虾TSG101蛋白三级结构预测 Fig. 3 Tertiary structure prediction of P. monodon TSG101 |
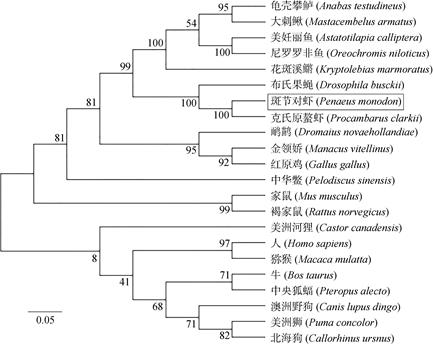 |
| 图 4 基于斑节对虾TSG101氨基酸序列构建NJ系统进化树 Fig. 4 NJ phylogenetic tree based on the amino acid sequence of TSG101 |
实时荧光定量PCR结果表明PmTSG101基因在斑节对虾的9个组织中均有表达, 表达量最高的是肝胰腺, 其次在胃和肠, 表达量最低的是性腺(图 5)。
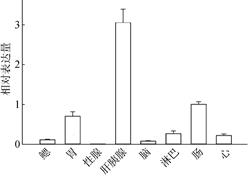 |
| 图 5 斑节对虾TSG101在各个组织中的相对表达 Fig. 5 Distribution of TSG101 mRNA expression in different tissues |
金黄色葡萄球菌和哈维弧菌刺激后, 另以PBS为对照组, 分别提取不同时间段(0、6、9、12、24、48、72 h)肝胰腺和鳃的RNA, qPCR检测斑节对虾TSG101在转录水平上的表达模式(图 6)。从结果分析可得, 在肝胰腺中, 斑节对虾TSG101在金黄色葡萄球菌刺激后的6 h~48 h表达水平都显著升高, 12 h达到最高水平, 72 h恢复正常; 在鳃中, 斑节对虾TSG101在细菌刺激后6 h和48 h表达水平都明显升高。另外, 在哈维弧菌的刺激对虾后, 肝胰腺中的斑节对虾TSG101仅在9 h表达水平明显上升; 而在鳃中, 斑节对虾TSG101的表达水平都为正常状态。
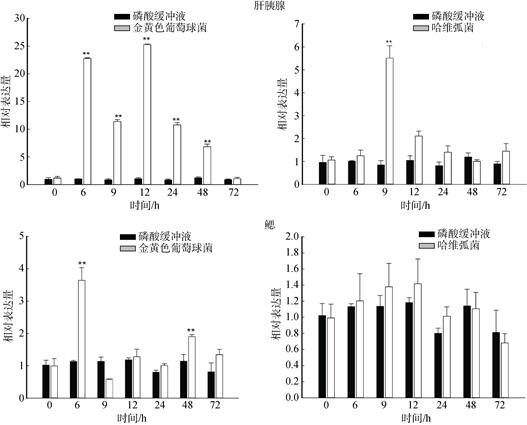 |
| 图 6 金黄色葡萄球菌和哈维弧菌刺激后斑节对虾TSG101在肝胰腺和鳃中的相对表达量 Fig. 6 Relative expression levels of PmTSG101 in the hepatopancreas and gill after challenge with S. aureus and V. harveyi “*”.差异显著(P < 0.05); “**”.极显著差异(P < 0.01) "*". significant difference at P < 0.05; "**". highly significant difference at P < 0.01 |
TSG101是组成ESCRT-Ⅰ的一个重要亚基, 参与膜蛋白分选和回收[23], 细胞周期[24]和自噬[25]等过程。本研究首次在斑节对虾中克隆并鉴定了TSG101序列, 将其命名为斑节对虾TSG101。TSG101蛋白序列保守性较高, 不同物种的结构域组成大都相似, 由UEV、脯氨酸富集区、CC以及一个SB结构域组成, 根据蛋白结构预测分析斑节对虾TSG101蛋白主要存在着UEV结构域和SB结构域。TSG101蛋白中的UEV结构域在克氏原螯虾和布氏果蝇等中都存在且保守性较强, 其中, UEV结构域由扭曲的四股反平行的β折叠组成, 具有曲折的拓扑结构, 其中4个α螺旋聚集在β折叠的一个面上[26]。UEV结构域是泛素化结合酶E2的一个变体, 它不具有催化泛素转运的功能, 是因为在其功能位点上缺少一个半胱氨酸残基, 但是可与泛素分子结合[26, 27]。
在无脊椎动物中, 先天免疫系统是抵御外界病原体的主要防御机制[28]。本研究主要对斑节对虾TSG101 mRNA在不同菌液刺激下的表达情况进行研究, 探讨斑节TSG101在斑节对虾中免疫应答的理论分子机制。斑节对虾TSG101在对虾中肝胰腺、肠、胃、淋巴、心、脑等均有表达, 但在肝胰腺中表达量最高, 表明TSG101参与了斑节对虾多个组织器官的转录调控作用; 克氏原螯虾[7]的TSG101在肝胰腺中表达量最高; 日本囊对虾[29]的TSG101在血细胞中表达量较高。研究表明, 肝胰腺和血细胞是对虾的非特异性免疫组织, 在机体受到应激反应时发挥重要的作用[30, 31]。因此, 可以初步推断斑节对虾TSG101有着免疫功能作用。
病原体的侵袭会对机体造成显著影响[32]。本研究将鳃和肝胰腺作为研究器官, 探讨在金黄色葡萄球菌和哈维弧菌刺激下斑节对虾TSG101 mRNA表达的变化情况, 了解该基因在斑节对虾中的免疫应答分子机制。在哈维弧菌刺激对虾后, 斑节对虾TSG101仅在肝胰腺中显著升高(P > 0.01)。在金黄色葡萄球菌刺激后的6、9、12、24、48 h, 斑节对虾TSG101在肝胰腺中的表达量显著升高(P < 0.01), 在鳃中6h和48h表达量明显上升(P > 0.01)。由此可知, 在菌液刺激下, 斑节对虾TGS101的表达量主要在肝胰腺有变化, 在鳃中的表达量和对照组大多无显著差异。另外, 在肝胰腺中, 金黄色葡萄球菌的刺激强于哈维弧菌刺激, 斑节对虾TGS101表达量明显上升。金色葡萄球菌是革兰氏阳性菌。哈维弧菌是革兰氏阴性菌。阳性菌和阴性菌对生物体刺激后, 激活的分子免疫通路有差别。本研究结果说明TGS101基因参与了革兰氏阳性菌引发的免疫信号通路。在对虾属中, Toll信号通路主要参与抗革兰氏阳性菌的免疫, IMD信号通路主要参与革兰氏阴性菌的免疫。Sun[7]等发现, 将克氏原螯虾的TGS101进行RNAi后, Toll信号通路中的一些基因(Crustin、ALF)表达量显著下降, 推测TGS101可能通过参与Toll信号通路参与了先天免疫过程。这说明斑节对虾TGS101可能也是通过Toll信号通路起作用, 不过这还需要进一步实验证明。
综上, 本研究克隆出了斑节对虾TSG101基因cDNA全长, 探讨了在哈维弧菌和金黄色葡萄球菌应激下斑节对虾TSG101 mRNA表达模式。该研究发现在上述细菌刺激下, 斑节对虾TSG101 mRNA表达量均出现不同程度的变化, 表明斑节对虾TSG101基因参与斑节对免疫应激反应, 为TSG101作为免疫功能基因提供了理论依据, 也为研究甲壳类动物的先天免疫应答奠定了基础。
| [1] |
Xie W, Li L, Cohen S N. Cell cycle-dependent subcellular localization of the TSG101 protein and mitotic and nuclear abnormalities associated with TSG101 deficiency[J]. Proceedings of the National Academy of Sciences, 1998, 95(4): 1595-1600. DOI:10.1073/pnas.95.4.1595 |
| [2] |
Lobert V H, Stenmark H. Cell polarity and migration:emerging role for the endosomal sorting machinery[J]. Physiology, 2011, 26(3): 171. DOI:10.1152/physiol.00054.2010 |
| [3] |
Li L, Liao J, Ruland J, et al. A TSG101/MDM2 regulatory loop modulates MDM2 degradation and MDM2/p53 feedback control[J]. Proceedings of the National Academy of Sciences, 2001, 98(4): 1619-1624. DOI:10.1073/pnas.98.4.1619 |
| [4] |
Sundquist W I, Schubert H L, Kelly B N, et al. Ubiquitin recognition by the human TSG101 protein[J]. Molecular Cell, 2004, 13(6): 783-789. DOI:10.1016/S1097-2765(04)00129-7 |
| [5] |
Bilodeau P S, Winistorfer S C, Kearney W R, et al. Vps27-Hse1 and ESCRT-I complexes cooperate to increase efficiency of sorting ubiquitinated proteins at the endosome[J]. Journal of Cell Biology, 2003, 163(2): 237-243. DOI:10.1083/jcb.200305007 |
| [6] |
Hyung Ho L, Natalie E, Rodolfo G, et al. Midbody targeting of the ESCRT machinery by a noncanonical coiled coil in CEP55[J]. Science, 2008, 322(5901): 576-580. DOI:10.1126/science.1162042 |
| [7] |
Sun Y X, Tang L, Gao J, et al. A role of tumor susceptibility gene 101(TSG101) in innate immune response of crayfish, Procambarus clarkii[J]. Developmental & Comparative Immunology, 2017, 76: 268-273. |
| [8] |
Garrus J E, Von Schwedler U K, Pornillos O W, et al. TSG101 and the vacuolar protein sorting pathway are essential for HIV-1 budding[J]. Cell, 2001, 107(1): 55-65. DOI:10.1016/S0092-8674(01)00506-2 |
| [9] |
Jiang Y, Ou Y, Cheng X. Role of TSG101 in cancer[J]. Frontiers in Bioscience, 2013, 18(1): 279-288. DOI:10.2741/4099 |
| [10] |
Wagner K U, Krempler A, Qi Y, et al. TSG101 is essential for cell growth, proliferation, and cell survival of embryonic and adult tissues[J]. Molecular and Cellular Biology, 2003, 23(1): 150. DOI:10.1128/MCB.23.1.150-162.2003 |
| [11] |
Sun Z, Pan J, Hope W Q X, et al. Tumor susceptibility gene 101 protein represses androgen receptor transactivation and interacts with p300[J]. Cancer, 2015, 86(4): 689-696. |
| [12] |
Dobrowolski R, De Robertis E M. Endocytic control of growth factor signalling:multivesicular bodies as signalling organelles[J]. Nature Reviews Molecular Cell Biology, 2012, 13(1): 53-60. |
| [13] |
Mattissek C, Teis D. The role of the endosomal sorting complexes required for transport (ESCRT) in tumorigenesis[J]. Molecular Membrane Biology, 2014, 31(4): 111-119. DOI:10.3109/09687688.2014.894210 |
| [14] |
Baldys A, Raymond J R. Critical role of ESCRT machinery in EGFR recycling[J]. Biochemistry, 2009, 48(40): 9321-9323. DOI:10.1021/bi900865u |
| [15] |
Lu Q, Hope L W, Brasch M, et al. TSG101 interaction with HRS mediates endosomal trafficking and receptor down-regulation[J]. Proceedings of the National Academy of Sciences, 2003, 100(13): 7626-7631. DOI:10.1073/pnas.0932599100 |
| [16] |
Zhang Y, Song M, Cui Z S, et al. Down-regulation of TSG101 by small interfering RNA inhibits the proliferation of breast cancer cells through the MAPK/ERK signal pathway[J]. Histology & Histopathology, 2011, 26(1): 87-94. |
| [17] |
Zhu G, Gilchrist R, Borley N, et al. Reduction of TSG101 protein has a negative impact on tumor cell growth[J]. International Journal of Cancer, 2004, 109(4): 541-547. DOI:10.1002/ijc.20014 |
| [18] |
Bieniasz P D. Late budding domains and host proteins in enveloped virus release[J]. Virology, 2006, 344(1): 55-63. |
| [19] |
刘问, 钱冬, 杨国梁, 等. 南美白对虾虾苗淡化期间发光病病原研究[J]. 集美大学学报(自然版), 2004, 9(4): 300-304. Liu Wen, Qian Dong, Yang Guoliang, et al. A study on the pathogen of luminous bacterial disease of penaeus vannamei post-larvae during desalinization[J]. Journal of Jimei University Natural Science, 2004, 9(4): 300-304. |
| [20] |
许森. L型凝集素和Toll、IMD信号通路关键因子在日本对虾先天免疫中的功能研究[D].济南: 山东大学, 2014: 50. Xu Sen. Function of L type lectin and key components of Toll and IMD signaling pathways in innate immunity of kuruma shrimp[D]. Jinan: Shandong University, 2014: 50. http://cdmd.cnki.com.cn/Article/CDMD-10422-1014310762.htm |
| [21] |
王瑞旋, 耿玉静, 冯娟, 等. 杂色鲍哈维弧菌耐药质粒的鉴定和分析[J]. 南方水产科学, 2012, 8(2): 1-6. Wang Ruixuan, Gen Yujing, Feng Juan, et al. Identification and analysis of resistant plasmid of pathogenic bacteria Vibrio harveyi isolated from Haliotis diversicolor[J]. South China Fisheries Science, 2012, 8(2): 1-6. DOI:10.3969/j.issn.2095-0780.2012.02.001 |
| [22] |
陈月忠, 钟硕良, 周宸. 成虾发光病病原体的分离鉴定及防治技术研究[J]. 中山大学学报(自然科学版), 2000, 39(s1): 218-223. Chen Yuezhong, Zhong Shuoliang, Zhou Chen. Prevention and treatment of luminous disease of adult prawns[J]. Actaentiarum Naturalium Universitatis Sunyatseni, 2000, 39(s1): 218-223. |
| [23] |
Bishop N. Mammalian class E vps proteins recognize ubiquitin and act in the removal of endosomal protein-ubiquitin conjugates[J]. The Journal of Cell Biology, 2002, 157(1): 91-102. DOI:10.1083/jcb.200112080 |
| [24] |
Hurley J H. ESCRTs are everywhere[J]. The EMBO Journal, 2015, 34(19): 2398-2407. DOI:10.15252/embj.201592484 |
| [25] |
Gessica S, Daniele M, Alessandro A, et al. Role of chaperone-mediated autophagy dysfunctions in the pathogenesis of Parkinson's disease[J]. Frontiers in Molecular Neuroscience, 2016, 9: 2623-27938. |
| [26] |
Pornillos O, Alam S L, Rich R L, et al. Structure and functional interactions of the TSG101 UEV domain[J]. EMBO (European Molecular Biology Organization) Journal, 2002, 21(10): 2397-2406. DOI:10.1093/emboj/21.10.2397 |
| [27] |
Teo H, Veprintsev D B, Williams R L. Structural insights into endosomal sorting complex required for transport (ESCRT-I) recognition of ubiquitinated proteins[J]. Journal of Biological Chemistry, 2004, 279(27): 28689-28696. DOI:10.1074/jbc.M400023200 |
| [28] |
Zeng Xianglan, Ye Haihui, Yang Ya'nan, et al. Molecular cloning and functional analysis of the fatty acid-binding protein (Sp-FABP) gene in the mud crab (Scylla paramamosain)[J]. Genetics and Molecular Biology, 2013, 36(1): 140-147. DOI:10.1590/S1415-47572013005000007 |
| [29] |
高洁.肿瘤易感基因101在白斑综合征病毒感染对虾过程中的功能研究[D].济南: 山东大学, 2018: 40. Gao Jie. Tumor susceptibility gene 101 function in the process of WSSV infection of Marsupenaeus japonicus[D]. Jinan: Shandong University, 2018: 40. |
| [30] |
Verri T, Mandal A, Zilli L, et al. D-glucose transport in decapod crustacean hepatopancreas[J]. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2001, 130(3): 585-606. DOI:10.1016/S1095-6433(01)00434-2 |
| [31] |
史进选, 傅明骏, 赵超, 等. 斑节对虾GRP94基因的克隆及其在不同应激条件下的表达与分析[J]. 南方水产科学, 2016, 12(5): 61-70. Shi Jinxuan, Fu Mingjun, Zhao Chao, et al. Characterization and expression analysis of GPP94 in black tiger shrimp (Penaeus monodon) under different acute stresses[J]. South China Fisheries Science, 2016, 12(5): 61-70. DOI:10.3969/j.issn.2095-0780.2016.05.008 |
| [32] |
朱鹏.日本沼虾生长蜕皮期同类相残而受生物胺胁迫的LC_(50)及鳃和肝胰腺的组织病理学研究[D].济南: 山东农业大学, 2017: 15. Zhu Peng. The research of LC50 and histopathology of gill and hepato-pancreas tissue of Macrobrachium Nipponense stressed by biogenic amines owing to cannibalism during ecdysis of growth[D]. Jinan: Shandong Agricultural University, 2017: 15. |
 2019, Vol. 43
2019, Vol. 43


