
文章信息
- 彭慧婧, 张守都, 郑德斌, 邹杰. 2019.
- PENG Hui-jing, ZHANG Shou-du, ZHENG De-bin, ZOU Jie. 2019.
- 施氏獭蛤全同胞家系建立及生长与存活性状分析
- Construction and comparison of growth and survival among full-sib families of Lutraria sieboldii
- 海洋科学, 43(7): 132-138
- Marine Sciences, 43(7): 132-138.
- http://dx.doi.org/10.11759/hykx20190124001
-
文章历史
- 收稿日期:2019-01-24
- 修回日期:2019-05-08
2. 青岛国家海洋科学研究中心, 山东 青岛 266071;
3. 天津渤海水产研究所, 天津 300457
2. National Oceanographic Center, Qingdao, 266071, China;
3. Tianjin Bohai Sea Fisheries Research Institute; Tianjin, 300457, China
施氏獭蛤(Lutraria sieboldii)隶属瓣鳃纲(Lame lli branchia)、异齿亚纲(Heterodonta)、帘蛤目(Ve neroida)、蛤蜊科(Mactridae)、獭蛤属(Lutraria), 与大獭蛤(中国)同物异名, 又叫象鼻螺。施氏獭蛤国内主要分布于广西、广东和海南沿海, 栖息于潮下带至20 m水深的近海区, 以海洋微藻和颗粒有机碎屑为食, 为重要的潮下带经济贝类。由于其味道鲜美, 生长周期短, 非常适合人工增养殖, 目前已成为北部湾海洋牧场和开放式养殖最佳底播增养殖品种之一, 养殖规模不断增长。
家系选择育种是培育新品种的有效方法, 通过优良性状的逐代选育, 达到目的基因的纯合, 最终获得优良品系。贝类的家系选育工作在马氏珠母贝(Pinctada martensii)[1]、海湾扇贝(Argopecten irradians)[2]、长牡蛎(Crassostrea gigas)[3]、文蛤(Meretrix meretrix)[4]等品种开展了家系生长、壳色等性状的研究工作。獭蛤类相关研究集中于幼体发育[5-9]、繁育[10]和种质资源[11]方面, 施氏獭蛤的选育工作尚处于起步阶段。本研究以2代家系选育的速生长系施氏獭蛤为亲本, 通过巢式平衡设计构建了30个全同胞家系, 分析比较各家系阶段生长和存活指标, 以期为施氏獭蛤良种培育提供参考。
1 材料与方法 1.1 家系建立参考王雪磊等[12]的研究方法, 2017年3月, 以经2代家系选育的速生长系施氏獭蛤为备选亲本, 选取性腺发育成熟、性状优良且大小均一的10个雄性个体和30个雌性个体, 采用巢式平衡设计, 将每个雄性个体精子随机与3个雌性个体卵子混合于含有体积分数约1.7×10–5氨水(28%)的4 L海水中受精, 孵化后共培养建立30个家系(A1、A2、A3、…、A30)。选择与家系亲本体型相近的自然个体, 以同样方法将3个雄性个体分别与9个雌性个体精卵混合受精孵化, 建立1个对照组。幼体培育在广西海洋研究所竹林海水增养殖试验基地进行, 中间培育和养殖在北海市铁山港海域进行。
幼体培育容器为200 L的玻璃钢黑桶, 为消除卵量差异和密度的影响, 保证幼体发育空间, 每个家系和对照组相同随机留取约50 000个D形幼虫进行幼体培育。培育过程中水温为22.4~25.8℃, 保持微充气, 镜检幼体出现棒状足时投放串板附着基, 附着后加大气量。幼体附着前每日换水量60%, 附着后逐渐加大换水量至400%。饵料为湛江等鞭金藻(Isochrysiszhanjiangensis)、牟氏角毛藻(Chaetocero s muelleri)和亚心型扁藻(Platymonassubcordiformis), 孵化后至壳顶期饵料以金藻为主, 以后增加投喂角毛藻和扁藻, 整个幼体培育阶段保持各组操作一致, 用水经紫外线消毒。
以初始孵化D形幼虫期为1 d, 幼体培育30 d后将幼苗收集以塑料筐装沙沉水方式投放海区(水深0.5 m)进行中间培育, 培育密度0.5个/cm2。培育60d后随机从各组选取2 000个体, 投放潮下带海区养殖, 养殖海区低潮水深3.6 m, 采用田块法将各组隔离, 以底桩、浮标标记, 养殖密度5~8个/m2。
1.2 指标测定与计算每组分别于3月、9月和15月龄随机获取30个体, 使用游标卡尺测量壳长和壳高, 使用分析天平称量体质量(湿质量), 精确到0.01 g。
分别统计计算幼体期(L, 1 d~30 d)、培育期(M, 31 d~90 d)和养殖期(F, 91 d~450 d)的阶段存活率RSL、RSM和RSF。
存活率计算公式: RS (100%) =Y/X,
式中: RS为存活率; Y为各组该阶段结束时全部存活个体数, 养殖期存活个体数以2次清捕后累计; X为各组该阶段初始个体数。
累积存活率计算公式: RSC(100%)=RSL×RSM×RSF,
式中: RSC为累积存活率。
相对提高率计算公式: P(100%)=(PA–PC)/PC,
式中: P为相对提高率; PA为各家系生长性状指标均值或存活率; PC为对照组生长性状指标均值或存活率。
1.3 数据处理采用SPSS 19.0软件进行GLM方差分析及事后检验(S-N-K法), 显著性水平a = 0.05, 使用excel 2010制图。
2 结果与分析 2.1 生长性状指标与分析比较实验结果显示, 3月、9月和15月龄的施氏獭蛤选育家系生长性状均高于对照组(P < 0.05, 图 1)。3月龄的家系壳长、壳高和体质量分别相对提高1.33%~ 9.33%、0.83%~15.83%和0.74%~25.19%; 9月龄的家系壳长、壳高和体质量分别相对提高1.83%~10.46%、3.95%~12.45%和6.01%~20.60%; 15月龄的家系壳长、壳高和体质量分别相对提高2.45%~25.62%、2.62%~15.01%和7.00%~28.73%。依据壳长、壳高和体质量生长性状进行家系排序(部分结果见表 1、表 2和表 3), 不同时期根据生长性状的家系排序不一致, 同一时期根据不同生长性状的家系排序也不一致。前8家系中, A5、A12、A15于不同时期均表现出稳定优异的生长性状, 其壳长、壳高和体质量的15个月累积增长量均值分别比家系平均提高7.65%、4.54%、5.73%, 比对照组相对提高22.87%、14.19%、24.15%。15个月壳长、壳高和体质量累积生长量前3家系分别比家系平均提高9.38%、5.07%、9.34%。对3月、9月和15月龄的家系生长性状进行系统分组的方差分析, 3月龄家系中, 变异来源于父系组间的壳长、壳高性状差异不显著, 母系组间的壳高性状差异不显著, 其余分组性状差异显著; 9月龄家系中, 父系组间的壳高性状差异不显著, 其余分组性状差异显著; 15月龄家系中, 父系组间的壳高性状差异不显著, 其余分组性状差异显著(P < 0.05);分组分析结果显示, 母系组间的变异大于父系组间, 试验中母本对家系的生长性状影响略高(表 4)。
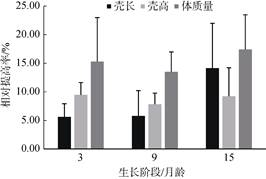 |
| 图 1 施氏獭蛤家系组生长性状相对提高率 Fig. 1 Relative increase rate of growth traits in family groups of Lutraria sieboldii |
| 组别 | 壳长(mm) | 组别 | 壳高(mm) | 组别 | 体质量(g) | |
| 前5家系 | A7 | 2.46±0.24a | A15 | 1.39±0.17a | A12 | 1.69±0.25a |
| A4 | 2.45±0.27ab | A6 | 1.38±0.15ab | A5 | 1.69±0.18a | |
| A11 | 2.45±0.22ab | A11 | 1.38±0.14ab | A21 | 1.68±0.25a | |
| A8 | 2.44±0.19abc | A7 | 1.37±0.13ab | A11 | 1.68±0.26a | |
| A12 | 2.43±0.20abc | A5 | 1.37±0.17ab | A19 | 1.68±0.22a | |
| 后5家系 | A14 | 2.31±0.20de | A28 | 1.24±0.15efg | A3 | 1.41±0.24bcd |
| A9 | 2.30±0.18e | A9 | 1.23±0.14fg | A29 | 1.41±0.22bcd | |
| A28 | 2.30±0.21e | A14 | 1.23±0.17fg | A7 | 1.39±0.23cd | |
| A29 | 2.29±0.29e | A29 | 1.22±0.15g | A25 | 1.37±0.25d | |
| A22 | 2.28±0.17e | A3 | 1.21±0.17g | A28 | 1.36±0.19d | |
| 家系均值 | 2.38 | 1.31 | 1.56 | |||
| 对照组 | 2.25±0.31 | 1.20±0.18 | 1.35±0.27 | |||
| 注:同列中, 不同上标字母表示差异显著(P < 0.05), 下同 | ||||||
| 组别 | 壳长(mm) | 组别 | 壳高(mm) | 组别 | 体质量(g) | |
| 前5家系 | A6 | 61.02 ± 1.34a | A11 | 31.88 ± 1.13a | A15 | 27.51 ± 1.59a |
| A15 | 60.91 ± 1.55a | A15 | 31.70 ± 1.19ab | A11 | 27.42 ± 1.19ab | |
| A2 | 60.36 ± 1.69ab | A8 | 31.37 ± 1.24abc | A8 | 27.39 ± 0.97ab | |
| A19 | 60.27 ± 1.46ab | A6 | 31.26 ± 1.20abcd | A20 | 27.33 ± 1.25abc | |
| A8 | 59.79 ± 1.27bc | A2 | 30.92 ± 1.15abcde | A12 | 27.13 ± 0.92abcd | |
| 后5家系 | A9 | 57.35 ± 1.43hij | A3 | 30.14 ± 1.21efgh | A29 | 24.41 ± 1.32k |
| A17 | 57.29 ± 1.64ij | A29 | 29.64 ± 1.12fgh | A9 | 24.37 ± 1.52k | |
| A23 | 57.25 ± 1.25ij | A28 | 29.62 ± 1.11gh | A18 | 24.36 ± 1.22k | |
| A3 | 56.71 ± 1.52j | A9 | 29.54 ± 1.76h | A3 | 24.25 ± 1.29k | |
| A29 | 56.25 ± 1.41j | A14 | 29.47 ± 1.28h | A14 | 24.18 ± 1.06k | |
| 家系均值 | 58.45 | 30.57 | 25.89 | |||
| 对照组 | 55.24 ± 2.57 | 28.35 ± 1.53 | 22.81 ± 1.65 |
| 组别 | 壳长(mm) | 组别 | 壳高(mm) | 组别 | 体质量(g) | |
| 前5家系 | A11 | 82.22 ± 1.34a | A5 | 42.15 ± 1.22a | A11 | 53.55 ± 1.82a |
| A15 | 81.44 ± 1.23ab | A12 | 42.14 ± 1.08a | A15 | 53.26 ± 1.78abc | |
| A6 | 81.47 ± 1.35ab | A19 | 41.90 ± 1.07ab | A8 | 53.38 ± 1.86ab | |
| A8 | 80.93 ± 1.29ab | A11 | 41.88 ± 1.08abc | A6 | 52.47 ± 1.69bc | |
| A5 | 80.13 ± 1.36bc | A21 | 41.45 ± 1.24bcd | A5 | 51.28 ± 1.46cd | |
| 后5家系 | A9 | 68.50 ± 1.35klm | A3 | 38.73 ± 1.08jk | A9 | 45.64 ± 2.00kl |
| A22 | 67.92 ± 1.32lm | A29 | 38.51 ± 1.05k | A22 | 45.27 ± 1.18l | |
| A3 | 67.34 ± 1.31m | A7 | 38.44 ± 0.93k | A3 | 44.85 ± 1.47l | |
| A28 | 67.31 ± 1.25m | A25 | 37.85 ± 1.18k | A1 | 44.82 ± 1.71l | |
| A29 | 67.11 ± 1.26m | A28 | 37.61 ± 0.98k | A29 | 44.51 ± 1.87l | |
| 家系均值 | 74.70 | 40.03 | 48.84 | |||
| 对照组 | 65.45 ± 4.55 | 36.65 ± 1.63 | 41.60 ± 5.16 |
| 时期 | 效应因子 | 自由度 | 壳长(mm) | 壳高(mm) | 体质量(g) | |||||
| MS | F | MS | F | MS | F | |||||
| 3月龄 | 父系 | 9 | 1.17 | 0.31 | 0.48 | 0.23 | 0.34 | 51.21* | ||
| 母系 | 20 | 4.28 | 8.37* | 1.55 | 0.34 | 1.04 | 18.45* | |||
| 9月龄 | 父系 | 9 | 89.62 | 73.29* | 3.38 | 1.30 | 35.90 | 19.41* | ||
| 母系 | 20 | 13.66 | 11.46* | 2.52 | 1.78* | 2.76 | 14.40* | |||
| 15月龄 | 父系 | 9 | 134.26 | 78.67* | 10.2 | 1.84 | 36.24 | 16.28* | ||
| 母系 | 20 | 15.88 | 14.05* | 6.85 | 4.96* | 12.45 | 23.13* | |||
| 注: *差异显著(P < 0.05) | ||||||||||
试验家系组平均存活率低于对照组, 阶段存活率RSL、RSM和RSF相对提高–5.61%、–2.45%和–2.08%, 累积存活率RSC相对提高–9.08%(图 2)。根据RSL、RSM、RSF和RSC排序(部分结果见表 5), 不同阶段根据存活性状的家系排序不一致, 家系A8、A15、A14、A28于不同阶段均具有稳定的存活性状。累积存活率前3家系A30、A15、A8的RSC均值比家系平均提高33.67%, 比对照组相对提高22.52%。
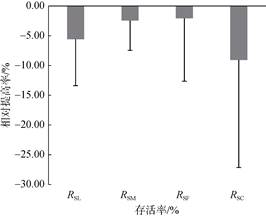 |
| 图 2 施氏獭蛤家系组存活性状相对提高率 Fig. 2 Relative increase rate of survival traits in family groups of Lutraria sieboldii |
| 组别 | RSL(%) | 组别 | RSM(%) | 组别 | RSF(%) | 组别 | RSC(%) | |
| 前5家系 | A15 | 74.38 | A28 | 91.02 | A12 | 61.4 | A30 | 36.05 |
| A30 | 73.44 | A6 | 90.24 | A11 | 59.05 | A15 | 35.94 | |
| A5 | 71.66 | A8 | 88.30 | A8 | 58.15 | A8 | 35.74 | |
| A6 | 70.83 | A14 | 86.52 | A30 | 58.05 | A28 | 35.31 | |
| A28 | 70.72 | A15 | 86.28 | A15 | 56.00 | A6 | 33.75 | |
| 后5家系 | A27 | 57.75 | A20 | 77.15 | A23 | 43.45 | A26 | 21.88 |
| A25 | 57.74 | A1 | 77.06 | A19 | 43.25 | A18 | 21.86 | |
| A17 | 57.68 | A23 | 76.12 | A2 | 42.85 | A2 | 21.12 | |
| A19 | 57.66 | A12 | 75.22 | A1 | 42.3 | A19 | 20.64 | |
| A1 | 57.50 | A13 | 75.02 | A18 | 40.8 | A1 | 18.74 | |
| 家系均值 | 64.47 | 82.43 | 50.13 | 26.87 | ||||
| 对照组 | 68.30 | 84.50 | 51.20 | 29.55 |
在家系选育过程中需要根据品种和养殖环境不同应建立相应机制。Refstie等[13]研究发现大西洋鲑(Salmo salar)家系性状差异是由基因和环境共同引起的, 证明在实际育种过程中, 家系饲养环境不同, 可能错误地放大了不同家系之间的表型及遗传差异, 从而降低选择的准确性, 但不同家系放于同一环境中养殖会增加区分难度。近年来发展的分子辅助育种[14]可以帮助家系个体区分, 但分子标记适用于具有一定选育阶段和一定研究基础的家系研究, 如果样本量较大, 则家系区分工作繁重。马氏珠母贝[15]和虾夷扇贝[16]等贝类采用集群系笼养建立家系, 由于养殖过程环境因素影响不可避免, 分笼养殖也会造成养殖环境略有差异, 但过程有效避免了家系混淆, 现已取得不错的选育成果。施氏獭蛤养殖模式属于潮下带大水体底播养殖, 幼体期和培育期可约束在一定的范围内进行管理, 但养殖期管理和采捕难度大, 家系混合养殖会造成系间混杂, 区分困难, 取样采捕量也存在不确定性, 不利于连续性状测定。本试验选取较稳定的海域以田块法分养家系, 将田块边缘一部分家系个体做壳体标记, 发现在试验养殖密度下, 个体无系间混杂现象, 从而减少了系间个体区分工作。由于潮下带大水体养殖环境的底质、水质和饵料等因素匀质化, 除不可避免随机因素(生物影响等)外, 采用小范围的区间隔离既能将家系间有效区分, 又一定程度上将环境因素影响降到最低, 是施氏獭蛤家系建立与比较的优先途径。
3.2 生长与存活性状分析与评价家系选育的目的是使控制经济性状的微效基因及显性基因快速聚合纯化, 生长性状是家系选育的重要经济指标。何毛贤等[15]在研究马氏珠母贝一代家系选育, 同批家系中已呈现明显的生长性状分化, 部分家系表现优势生长性状; 王雪磊等[12]在研究壳金长牡蛎4代选育的全同胞家系生长性状时, 所有家系壳高、壳长和总重量平均值均高于对照组, 分别提高10.04%~19.79%、6.56%~17.78%和10.44%~32.92%;本试验中, 各家系不同时期的生长性状均高于对照组, 以15月龄累积生长量比较, 前3家系的壳长、壳高和体质量均值比照组明显高出24.8%、14.77%、28.35%, 可见生长性状在施氏獭蛤的家系选育中也呈现明显优势, 体质量前3家系可优先作为速生长育种系材料。王雪磊等[12]发现壳金长牡蛎[12]所有家系不同阶段存活率平均值比对照组提高11.70%以上; Taris等[17]发现未经选育的长牡蛎比经选育的长牡蛎的死亡率高14.2%;彭张明等[1]也在研究12个红色闭壳肌马氏珠母贝全同胞家系中发现多个存活性状优良家系, 而试验中, 施氏獭蛤家系的幼体期、培育期和养成期存活率均值分别低于对照组5.61%、2.45%和2.08%, 可见施氏獭蛤试验选育家系组在存活率方面无明显优势。闫喜武等[18]研究菲律宾蛤仔家系早期生长发育发现稚贝期存活率趋于稳定且高于幼虫期, 并推测隐形致死基因的纯合会造成家系初期的存活率偏低, 试验家系幼体期平均存活率偏低, 中、后期平均存活率有所提升且与对照组接近, 两者试验结果中存活趋势相近。施氏獭蛤养殖效益与规格、产量大小呈正相关, 试验中施氏獭蛤家系养殖从规格和产量分析均对照组有提高, 综合产量和存活性状评价, 家系A15可作为育种开发材料。
3.3 施氏獭蛤家系选育策略分析贝类家系选育过程需维系大量的系群, 并耗费大量资源, 通过建立合适早期筛查机制, 将有利于节约后期养成与管理的成本。王庆志等[19]以存活率为指标开展了虾夷扇贝的耐高温品系选育工作, 发现不同家系的耐高温性存在显著差异, 耐高温性这一性状受遗传因素影响较大, 且家系的生长与存活无显著的相关性, 早期抗性筛查具有可行性。试验比较施氏獭蛤不同阶段的生长性状家系排序, 前期生长速度快的家系, 中、后期也具有一定的生长优势, 据此, 可结合施氏獭蛤繁育和养殖的阶段特点, 在其早期发育的幼体期和培育期进行性状筛查, 提前舍弃那些生长慢的不良系群。试验中, 家系的累计存活率均值低于对照组9.08%, 虽然有8个家系各阶段存活率高于对照组, 但家系整体存活能力偏低, 而存活率的高低反映了个体对环境的适应能力, 是抗病和抗逆能力的综合体现, 即使作为选育的优势性状也常常出现近交退化现象[20], 故难以保证施氏獭蛤选育家系后代仍具有稳定的存活能力, 所以施氏獭蛤在家系选育方面也应重点考虑存活性状。
不同家系间的表型差异不一定完全是由遗传因素造成的, 优良品系选育应该采用家系选择与家系内选择相结合的策略[21], 结合早期筛查, 以一定的选择压力从每个家系中选留家系内表型值最优秀的个体进行家系内选育, 可以作为施氏獭蛤选育的发展策略。
| [1] |
彭张明, 陶后全, 刘锦上, 等. 马氏珠母贝红色闭壳肌F1代的家系选育及家系评定[J]. 广东海洋大学学报, 2015, 35(4): 37-45. Peng Zhangming, Tao Houquan, Liu Jinshang, et al. Research on family selection and evaluation of Pinctada martensi with red adductor muscle[J]. Journal of Guangdong Ocean University, 2015, 35(4): 37-45. DOI:10.3969/j.issn.1673-9159.2015.04.006 |
| [2] |
张守都, 李莉, 张国范. "中科2号"海湾扇贝(Argopectenirradians)幼虫期壳长遗传力的估计[J]. 海洋科学, 2016, 40(7): 54-59. Zhang Shoudu, Li Li, Zhang Guofan. Heritability of larval shell length for Zhongke No.2 bay scallop (Argopecten irradians)[J]. Marine Sciences, 2016, 40(7): 54-59. |
| [3] |
任晶莹, 王卫军, 徐涛, 等. 长牡蛎(Crassostrea gigas)多代近交与自交家系遗传差异及生长性状比较[J]. 海洋与湖沼, 2018, 49(3): 630-637. Ren Jingying, Wang Weijun, Xu Tao, et al. Comparation of genetic diversity and growth of pacific oyster-Crassostrea gigas between different inbreeding selection and self-fertilization selection[J]. Oceanologia Et LimnologiaSinica, 2018, 49(3): 630-637. |
| [4] |
梁冰冰, 王鸿霞. 文蛤早期发育阶段生长性状遗传参数的估计[J]. 海洋科学, 2016, 40(3): 47-52. Liang Bingbing, Wang Hongxia. Genetic parameter estimation for growth traits in the earlylife history of Meretrix meretrix[J]. Marine Sciences, 2016, 40(3): 47-52. |
| [5] |
李琼珍, 童万平, 苏琼. 大獭蛤的胚胎、幼虫及稚贝的形态发育[J]. 广西科学, 2003, 10(4): 296-299. Li Qiongzhen, Tong Wanping, Su Qiong. The Morphogenesis of Lutraria maxima's Embryo, Larvae and Spat[J]. Guangxi Sciences, 2003, 10(4): 296-299. DOI:10.3969/j.issn.1005-9164.2003.04.016 |
| [6] |
刘永, 余祥勇, 梁飞龙, 等. 施氏獭蛤幼虫和稚贝发育及行为的研究[J]. 广东海洋大学学报, 2007, 27(1): 17-21. Liu Yong, Yu Xiangyong, Liang Feilong, et al. Development and behavior of the larvae and juveniles of Lutraria sieboldii Reeve[J]. Journal of Guangdong Ocean University, 2007, 27(1): 17-21. DOI:10.3969/j.issn.1673-9159.2007.01.004 |
| [7] |
李琼珍, 陈瑞芳, 童万平. 盐度对大獭蛤胚胎发育的影响[J]. 广西科学院学报, 2004, 20(1): 33-34. Li Qiongzhen, Chen Ruifang, Tong Wanping. Influence of salinity upon the embryogenesis of Lutraria maxima Janas[J]. Journal of Guangxi Academy of Sciences, 2004, 20(1): 33-34. DOI:10.3969/j.issn.1002-7378.2004.01.011 |
| [8] |
刘超, 彭张明, 黄佳, 等. 不同盐度对施氏獭蛤浮游期幼虫存活与生长的影响[J]. 海洋科学, 2015, 39(12): 65-69. Liu Chao, Peng Zhangming, Huang Jia, et al. Influence of different salinity levels on the survival andgrowth of Lutrariasieboldii floating larva[J]. Marine Sciences, 2015, 39(12): 65-69. DOI:10.11759//hykx20140819001 |
| [9] |
刘超, 郭景兰, 彭张明, 等. 施氏獭蛤稚贝对高温和干露的耐受性研究[J]. 水产科学, 2015, 34(3): 169-173. Liu Chao, Guo Jinglan, Peng Zhangming, et al. Tolerance of Juvenile Shellfish Lutrariasieboldii to high-temperature and dry exposure[J]. Fisheries Sciences, 2015, 34(3): 169-173. |
| [10] |
苏琼, 童万平, 李琼珍. 大獭蛤工厂化育苗技术研究[J]. 广西科学, 2009, 16(3): 342-345. Su Qiong, Tong Wanping, Li Qiongzhen. The technology for factory breeding of Lutraria(psammophila) maxima Jonas[J]. Guangxi Sciences, 2009, 16(3): 342-345. DOI:10.3969/j.issn.1005-9164.2009.03.034 |
| [11] |
李斌, 何俊锋, 区小玲, 等. 广西和广东地区施氏獭蛤3个自然群体的形态差异和遗传多样性分析[J]. 大连海洋大学学报, 2011, 26(5): 414-421. Li Bin, He Junfeng, Qu Xiaoling, et al. Morphological and genetic diversity analysis among three populations of clam Lutraria siebaldii in coastal Guangxi and Guangdong provinces[J]. Journal of Dalian University, 2011, 26(5): 414-421. DOI:10.3969/j.issn.1000-9957.2011.05.007 |
| [12] |
王雪磊, 李琪, 孔令锋, 等. 壳金长牡蛎家系的建立及生长和存活性状的比较[J]. 水产学报, 2016, 40(11): 1683-1693. Wang Xuelei, Li Qi, Kong Lingfeng, et al. Construction and comparison of growth and survival among different golden shell families of Pacific oyster (Crassostrea gigas)[J]. Journal ofFisheries of China, 2016, 40(11): 1683-1693. |
| [13] |
Refstie T, Steine T A. Selection experiments with salmon; Ⅲ. Genetic and environmental sources of variation in length and weight of Atlantic salmon in the freshwater phase[J]. Aquaculture, 1978, 14(3): 221-234. DOI:10.1016/0044-8486(78)90096-0 |
| [14] |
孙效文. 鱼类分子育种学[M]. 北京: 海洋出版社, 2010. Sun Xiaowen. Fish Molecular Breeding[M]. Beijing: China Ocean Press, 2010. |
| [15] |
何毛贤, 管云雁, 林岳光, 等. 马氏珠母贝家系的生长比较[J]. 热带海洋学报, 2007, 26(1): 39-43. He Maoxian, Guan Yunyan, Lin Yueguang, et al. Growth comparison between families of pearl oyster Pinctada martensii Dunker[J]. Journal of Tropical Oceanography, 2007, 26(1): 39-43. DOI:10.3969/j.issn.1009-5470.2007.01.007 |
| [16] |
张存善, 杨小刚, 宋坚, 等. 虾夷扇贝家系的建立及不同家系的早期生长研究[J]. 南方水产, 2008, 4(5): 44-50. Zhang Cunshan, Yang Xiaogang, Song Jian, et al. Establishment of families and their early growth of Japanese scallop (Patinopecten yessoensis)[J]. South China Fisheries Sciences, 2008, 4(5): 44-50. DOI:10.3969/j.issn.2095-0780.2008.05.007 |
| [17] |
Taris N, Ernande B, Mccombie H, et al. Phenotypic and genetic consequences of size selection at the larval stage in the Pacific oyster (Crassostrea gigas)[J]. Journal of Experimental Marine Biology and Ecology, 2006, 333(1): 147-158. DOI:10.1016/j.jembe.2005.12.007 |
| [18] |
闫喜武, 霍忠明, 张跃环, 等. 菲律宾蛤仔家系的建立及早期生长发育[J]. 水产学报, 2010, 34(1): 32-40. Yan Xiwu, Huo Zhongming, Zhang Yuehuan, et al. Preliminary study of establishment of families and their early growth and development for manila clam (Ruditapes philippinarum)[J]. Journal of Fisheries of China, 2010, 34(1): 32-40. |
| [19] |
王庆志, 李石磊, 付成东. 虾夷扇贝耐高温育种家系的建立与早期筛查[J]. 水产学报, 2014, 38(3): 371-377. Wang Qingzhi, Li Shilei, Fu Chengdaong. Establishment of high temperature resistance families and use of laboratory assays to predict subsequent survival in juvenile stage of the Japanese scallop (Patinopecten yessoensis)[J]. Journal of Fisheries of China, 2014, 38(3): 371-377. |
| [20] |
刘志刚, 章启忠, 朱晓闻, 等. 海湾扇贝南部亚种自交家系选育及其Kung育种值评价[J]. 中国水产科学, 2013, 20(2): 308-315. Liu Zhigang, Zhang Qizhong, Zhu Xiaowen, et al. Breeding of a self-fertilizing family and Kung breeding value evaluation of Argopecten irradians concentricus (Say)[J]. Journal of Fishery Sciences of China, 2013, 20(2): 308-315. |
| [21] |
户国, 谷伟, 王鹏, 等. 电子标记辅助虹鳟家系建立及快速生长家系筛选[J]. 中国水产科学, 2012, 19(1): 77-83. Hu Guo, Gu Wei, Wang Peng, et al. PIT marker assisted family establishment in rainbow trout and rapid growth families screening[J]. Journal of Fishery Sciences of China, 2012, 19(1): 77-83. |
 2019, Vol. 43
2019, Vol. 43


