文章信息
- 迟艳红, 王文章, 李菊, 齐继光, 王玮. 2019.
- CHI Yan-hong, WANG Wen-zhang, LI Ju, QI Ji-guang, WANG Wei. 2019.
- 不同条件因子对海月水母胃丝蛋白酶活性的影响
- Effects of different environmental factors on the activities of protease in the gastric cirrum of Aurelia aurita
- 海洋科学, 43(9): 88-93
- Marine Sciences, 43(9): 88-93.
- http://dx.doi.org/10.11759/hykx20190417002
-
文章历史
- 收稿日期:2019-04-17
- 修回日期:2019-07-26
2. 中国科学院 海洋研究所, 山东 青岛 266071
2. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
海月水母(Aurelia aurita)隶属于钵水母纲(Scy phozoa)、旗口水母目(Semaeostomeae)、洋须水母科(Ulmaridae)、海月水母属(Aurelia), 是一类非常常见的观赏品种, 也可以作为其他大型水母的饵料[1]。海月水母环境适应性良好, 全球分布广泛[2-5], 在中国常发现于黄海和渤海近岸水体[6]。近年来, 海月水母在中国沿海多次大规模暴发, 严重破坏了海洋浮游生态系统, 阻碍海洋航运, 影响沿海电力系统, 给海洋渔业造成重大损失[7-9]。
关于海月水母生活史和人工繁育、爆发的关键过程和生态环境效应已有许多报道[10-15]。了解其消化生理, 尤其是消化酶的种类构成及其对不同环境因子的响应对于深入了解海月水母的生理机制有重要意义。同时, 在海月水母人工养殖的过程中, 水母消化酶基础生物学理论的匮乏是制约海月水母饲养繁殖发展突破的重要因素。目前国内外有关水母消化酶的研究十分短缺, 仅有两篇涉及僧帽水母(Phy salia arethusa)、沙海蜇(Stomolophus meleagris)和海蜇(Rhopilema)消化酶研究的文献报道[16-17]。
本实验利用福林-酚法对海月水母胃丝中的蛋白酶活性进行测定, 初步研究了海月水母胃丝蛋白酶对不同温度、pH、金属离子等环境影响因子的响应规律, 为了解水母消化酶的生理生物学研究奠定基础, 也为海月水母饲养条件的优化提供理论依据。
1 材料与方法 1.1 实验材料实验用水母为取自青岛海产博物馆内繁殖饲养的同一批海月水母, 待胃丝生长明显时, 随机取10只, 伞径9.1 cm ± 0.5 cm。饲养用水为过滤处理的天然海水, 饲养温度25℃。盐度为33。投喂卤虫(Artemia parthenogenetica)无节幼体。
1.2 实验设计反应温度设置:实验温度共设置为6个温度梯度, 分别为4℃、15℃、25℃、37℃、50℃、60℃, 用恒温水浴锅进行控温。
pH系统设置: 37℃, 实验pH值范围为6.5~9.5, 组距设定为0.5。pH值6.5~8.0的溶液使用浓度为0.02 mol/L的NaH2PO4-Na2HPO4缓冲液调节, pH值8.5~9.5的溶液使用浓度为0.02 mol/L的Na2HPO4- NaoH缓冲液配制。
金属离子种类及浓度设置:温度为37℃, pH为8.0。金属离子种类及来源如表 1所示, 设置离子浓度梯度为0、0.1、0.3、0.5、1、2、3、4、5 mmol/L。
| 金属离子 | Ca2+ | Mg2+ | K+ | Zn2+ | Cu 2+ | Mn2+ |
| 来源化合物 | CaCl2 | MgSO4 | KCl | ZnSO4 | CuSO4 | MnCl2 |
将实验用海月水母停止喂食19 h后从饲养缸中小心取出, 放置于包裹灭菌锡箔纸的冰板上进行取样。用1 000 μL移液枪吸取海月水母胃丝, 利用灭菌后的玻璃匀浆器在冰上进行研磨匀浆, 将匀浆液置于离心管(冰上预冷)后5 000 r离心10 min, 取上清液, 即酶粗提液, 分装于200 μL的PCR管中后放入–80℃冰箱中保存备用。
1.3.2 蛋白酶活性的测定利用福林-酚试剂法进行蛋白酶活性的测定。试管中加入1 mL酶粗提液, 用移液枪注入0.5%的酪蛋白溶液2 mL, 37℃水浴反应15 min, 之后立即加入10%的三氯乙酸3 mL终止反应, 取出反应液常温离心(6 000 rpm, 2 min), 去除沉淀后吸取上清液1 mL, 向其中加入浓度为0.55 mol/L Na2CO3溶液5 mL, 再加入福林-酚试剂1 mL, 于37℃恒温水浴中显色15 min, 然后在680 nm波长下比色测定, 以蒸馏水作为对照, 读取反应液OD值。使用考马斯亮蓝蛋白定量测试盒(南京建成)进行样品中蛋白质浓度的测定。
在一定的pH和温度条件下, 每分钟酶粗提液水解酪素产生1 μg酪氨酸为1个蛋白酶活力单位(U= μg/min)。
酪氨酸标准曲线方程: Y=0.001 7X+0.003 6。
海月水母的蛋白酶活力以比活力表示, 即酶粗提液中每mg可溶性蛋白质所含有的酶活力单位(U/mg)。
2 结果 2.1 海月水母胃丝蛋白酶反应进程曲线以0.5%酪蛋白为底物, 在pH 8.0, 37℃实验条件下进行海月水母胃丝蛋白酶反应进程曲线绘制, 结果如图 1所示:在0~15 min内, 反应产物随时间持续增加, 15 min后由于底物浓度下降、产物浓度上升、逆反应趋势增强等原因, 反应曲线出现弯曲并逐渐趋于平缓, 表明反应速率逐渐降低。因此选取蛋白酶反应时间为15 min。
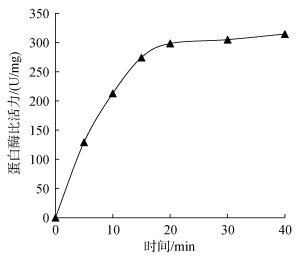 |
| 图 1 海月水母胃丝蛋白酶反应进程曲线 Fig. 1 The reaction curve of protease in the gastric cirrum of Aurelia aurita |
通过对不同温度下(4℃、15℃、25℃、37℃、50℃、60℃)海月水母胃丝中蛋白酶的活性测定结果显示(图 2):不同的反应温度对海月水母胃丝蛋白酶活力具有显著影响(P < 0.05), 具体表现为在4~25℃范围内, 海月水母胃丝蛋白酶维持在较低活力, 在37℃时蛋白酶活力急剧升高, 约为25℃条件下的3倍, 之后蛋白酶活力又随温度提升而迅速下降。结合实验室之前对海月水母胃丝中淀粉酶活性(碘比色法测定)(图 3)和脂肪酶活性(聚乙烯醇橄榄油乳化液水解法测定)(图 4)的相关研究显示, 海月水母淀粉酶和脂肪酶活力非常低, 最高值分别为1.80和3.33 U/mg, 与蛋白酶相比(比活力峰值408 U/mg), 这两种酶的活力几乎可以忽略不计。因此作者后期并未展开对淀粉酶和脂肪酶活力的相关研究实验。
 |
| 图 2 不同温度条件下的海月水母胃丝蛋白酶活性 Fig. 2 Activities of protease in the gastric cirrum of Aurelia aurita under different temperatures |
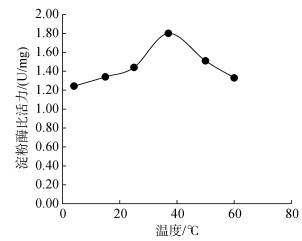 |
| 图 3 不同温度条件下的海月水母胃丝淀粉酶活性 Fig. 3 Activities of diastase in the gastric cirrum of Aurelia aurita under different temperatures |
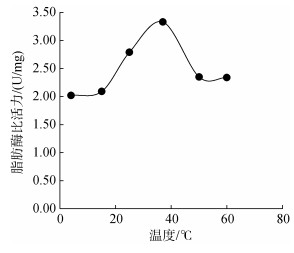 |
| 图 4 不同温度条件下的海月水母胃丝脂肪酶活性 Fig. 4 Activities of lipase in the gastric cirrum of Aurelia aurita under different temperatures |
图 5显示, pH对海月水母胃丝蛋白酶活力具有显著影响(P < 0.05)。通过实验结果显示:在pH 6.5~ 9.5条件下海月水母胃丝蛋白酶均具有活性, 在pH为6.5~8.5时, 蛋白酶活力随着pH的增大逐渐增强, 在pH 8.5时蛋白酶活力达到峰值, 随后随着pH值的增大蛋白酶活力迅速降低, 在pH 9.0~9.5范围时, 蛋白酶活力降低幅度趋缓。
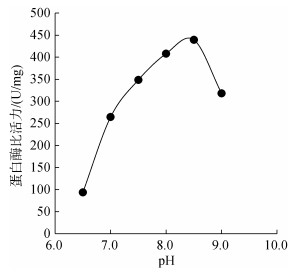 |
| 图 5 不同pH条件下的海月水母胃丝蛋白酶活性 Fig. 5 Activities of protease in the gastric cirrum of Aurelia aurita under different pH values |
在37℃和pH 8.0条件下, 以0.5%酪蛋白为底物进行反应。结果如图 6显示:随着Mn2+离子浓度的不断增大, 海月水母胃丝蛋白酶活力不断增强, 且蛋白酶活性与Mn2+浓度呈现出较好的线性相关性。Cu2+和Zn2+对蛋白酶具有明显抑制作用, 但两种离子不同浓度对蛋白酶抑制作用有所不同。Cu2+在低浓度(0.1 mmol/L~1 mmol/L)时抑制作用明显, 当离子浓度 > 2 mmol/L时对蛋白酶活性的抑制作用没有明显变化。Zn2+在低浓度(0.1 mmol/L~1 mmol/L)时, 随着离子浓度的不断增加蛋白酶活性迅速降低, 当离子浓度在1 mmol/L~4 mmol/L时, 蛋白酶活力随着Zn2+浓度的增加缓慢降低, 当离子浓度 > 4 mmol/L时, Zn2+对蛋白酶的抑制作用进一步增强。另外, 通过实验结果显示, 不同浓度的Mg2+、K+和Ca2+对海月水母胃丝蛋白酶均没有明显作用。
 |
| 图 6 不同金属离子条件下的海月水母胃丝蛋白酶活性 Fig. 6 Activities of protease in the gastric cirrum of Aurelia aurita under different mental ions |
经过实验发现, 海月水母胃丝中蛋白酶具有较高活性, 而淀粉酶和脂肪酶活性非常低。海月水母的高蛋白酶活性可能与其主要营养来源为蛋白质丰富的小型浮游生物密切相关。开放水体中的海月水母摄食桡足类、贝类幼体、鱼卵等, 主要捕食桡足类和桡足类无节幼体[18], 人工饲养海月水母的饵料则通常是卤虫无节幼体[1]。以往研究表明卤虫和大部分桡足类为高蛋白饵料, 平均粗蛋白干质量占比40%以上[19-23]。海月水母主要组成成分是水分和蛋白质, 糖类与脂肪成分极少, 可能与淀粉酶和脂肪酶活力过低有关。本研究结果与宋晶等[17]对海蜇消化酶的研究结果对比:后者蛋白酶比活力明显较低, 可能是物种差异所致; 由于计算方法不同, 后者淀粉酶活力较高, 修正后两者数值相近; 海蜇脂肪酶活力未检出, 与本研究结果相近。
3.2 海月水母胃丝蛋白酶的最适温度海月水母胃丝蛋白酶对温度非常敏感, 这可能是由酶的蛋白质性质决定的。在不同温度对海月水母胃丝多种消化酶影响的实验中, 海月水母胃丝蛋白酶随温度的逐渐升高, 酶催化反应速度逐渐加快, 在37℃时酶活力达到最大, 这表明该温度即海月水母胃丝蛋白酶的最适温度, 略低于海蜇胃丝蛋白酶最适温度(42℃)[17]。当温度超过37℃时, 酶反应速率迅速下降, 这可能是由于温度过高导致消化酶变性和失活。海月水母蛋白酶具有较好的热稳定性, 当温度升到60℃时, 蛋白酶仍保持一定的酶活力。海月水母胃丝主要消化酶蛋白酶的最适温度37℃高于日常海月水母日常饲养和栖息水温25℃, 与其他很多海洋生物有关的研究结论相似[24-26]。本实验所用的海月水母培养温度保持在24~25℃, 可以兼顾酶反应效率和水母正常的生理机能。同时, 在一定温度范围内, 温度越高, 消化酶活性越大, 代谢效率也更高。近年来温室效应导致海水温度升高, 也给海月水母的大量增殖和急剧爆发创造了条件[27]。
3.3 海月水母蛋白酶的最适pH值实验结果表明, pH对海月水母蛋白酶影响显著, 海月水母在碱性条件下具有较高酶活力(7.0~9.5), 在pH 8.5环境下达到峰值, 因此作者推测海月水母消化酶中可能含有胰蛋白酶(适应pH7.0~8.5)。Bodansky[16]研究发现, 沙海蜇和僧帽水母的蛋白酶在酸碱条件下均有较高活性, 认为两种水母具有胃蛋白酶和胰蛋白酶, 其中胰蛋白酶最适pH为7.3~ 7.6, 略低于海月水母胃丝蛋白酶, 宋晶等[17]发现海蜇胃丝蛋白酶最适pH值为9.0, 高于海月水母胃丝蛋白酶, 这些可能是由于物种之间的差异所致。另外, 有研究表明动物蛋白酶的最适pH值可能会随温度的升高而增大[28-30], 本实验的最适pH值是在37℃条件下测得, 而通常的饲养温度是24~25℃, 因此有可能在饲养条件下的海月水母胃丝蛋白酶最适pH值更接近海水的pH值(8.0)。
3.4 金属离子对海月水母胃丝蛋白酶的影响很多金属离子对蛋白酶和活力具有明显影响, 例如Mn2+是很多蛋白酶维持活性的重要物质或作为酶的激活剂。本研究结果表明, Mn2+离子能够增强海月水母胃丝蛋白酶活性, 推测其作用机制为与该蛋白酶松散或紧密结合, 激活酶的活性中心。Cu2+和Zn2+对该蛋白酶具有很强的抑制作用, 作用机制可能是与酶结合后破坏其蛋白结构, 抑制酶的活性或使酶失活[31]。Mg2+、K+、Ca2+对海月水母胃丝蛋白酶活性没有明显影响。因此在海月水母的饲养过程中可以考虑适量添加Mn2+, 尽量去除Cu2+和Zn2+离子等有害金属离子。不同种类的水母对金属离子的反应可能并不相同。Pan[32]发现肉质介穗水母(Podo coryne carne)体内有帮助消化的虾红素样金属蛋白酶PMP1, 这种酶是典型的Zn2+离子依赖内肽酶, 作者推测提高水体中Zn2+离子浓度可以促进肉质介穗水母的摄食效率, 从而促进个体生长。
| [1] |
陈华增, 齐继光, 王云忠, 等. 不同饵料组合对马来沙水母生长的影响[J]. 湖南农业科学, 2015, 10: 68-71. Chen Huazeng, Qi Jiguang, Wang Yunzhong, et al. Effects of different diets on the growth of jellyfish Sanderia malayensis[J]. Hunan Agricultural Sciences, 2015, 10: 68-71. |
| [2] |
Lucas C H, Williams J A. Population dynamics of the scyphomedusa Aurelia aurita in Southampton water[J]. Journal of Plankton Research, 1994, 16(7): 879-895. DOI:10.1093/plankt/16.7.879 |
| [3] |
Miyake H, Iwao K, Kakinuma Y. Life history and environment of Aurelia aurita[J]. South Pacific Study, 1997, 17(2): 273-285. |
| [4] |
Schneider G, Behrends G. Population dynamics and the trophic role of Aurelia aurita in the Kiel Bight and western Baltic[J]. JCES Journal of Marine Science, 1994, 51(4): 359-367. |
| [5] |
Yasuda T. Ecological studies on the jellyfish Aurelia aurita in Urazoko Bay, Fukui Prefecture. Ⅱ. Occurrence pattern of the phyrae[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1968, 34: 983-987. DOI:10.2331/suisan.34.983 |
| [6] |
高尚武, 洪惠馨, 张士美. 中国动物志[M]. 北京: 科学出版社, 2002: 30-34. Gao Shangwu, Hong Huixin, Zhang Shimei. Fauna Sinica[M]. Beijing: Science Press, 2002: 30-34. |
| [7] |
Dong Z, Liu D, Keesing J K. Jellyfish blooms in China: dominant species, causes and consequences[J]. Marine Pollution Bulletin, 2010, 60(7): 954-963. DOI:10.1016/j.marpolbul.2010.04.022 |
| [8] |
Dong Z, Liu D, Wang Y, et al. A report on a Moon Jellyfish Aurelia aurita bloom in Sishili Bay, northern Yellow Sea of China in 2009[J]. Aquatic Ecosystem Health and Management, 2012, 15(2): 161-167. DOI:10.1080/14634988.2012.689583 |
| [9] |
宋新华.入侵发电厂海蜇背黑锅专家鉴定为海月水母[N].青岛晚报, 2009-07-12(3). Song Xinhua. The jellyfish invaded the power plant was identified by experts as Aurelia other than Rhopilema[N]. Qingdao Evening News, 2009-07-12(3). |
| [10] |
陈学亮, 董少杰. 海月水母的人工饲养与繁殖技术[J]. 田间农业科学, 2007, 13(2): 5-6. Chen Xueliang, Dong Shaojie. Breeding and feeding of jellyfish[J]. Tianjian Agricultural Sciences, 2007, 13(2): 5-6. |
| [11] |
Barz K, Hirche H J. Seasonal development of scyphozoan medusae and the predatory impact of Aurelia aurita on the zooplankton community in the Bornholm Basin (Central Baltic Sea)[J]. Marine Biology, 2005, 147(2): 465-476. DOI:10.1007/s00227-005-1572-2 |
| [12] |
Brodeur R D, Sugisaki H, Hunt G L. Increases in jellyfish biomass in the Bering Sea: Implications for the ecosystem[J]. Marine Ecology Progress Series, 2002, 233: 89-103. DOI:10.3354/meps233089 |
| [13] |
Hansson I J, Moeslund O, Kiorboe T. Clearance rates of jellyfish and their potential predation impact on zooplankton and fish larvae in a neritic ecosystem (Limfjorden, Denmark)[J]. Marine Ecology Progress Series, 2005, 304: 117-131. DOI:10.3354/meps304117 |
| [14] |
Makabe R, Furukawa R, Takao M, et al. Marine artificial structures as amplifiers of Aurelia aurita s.l. blooms: a case study of a newly installed floating pier[J]. Journal of Oceanography, 2014, 70(5): 447-455. DOI:10.1007/s10872-014-0249-1 |
| [15] |
Pascual M, Fuentes V, Canepa A, et al. Temperature effects on asexual reproduction of the scyphozoan Aurelia aurita s.l.: differences between exotic (Baltic and Red seas) and native (Mediterranean Sea) populations[J]. Marine Ecology, 2015, 36(4): 994-1002. DOI:10.1111/maec.12196 |
| [16] |
Bodansky M, Rose W C. Comparative studies of digestion: I. The digestive enzymes of Coelenterates[J]. American Journal of Physiology-Legacy Content, 1922, 62(3): 473-481. DOI:10.1152/ajplegacy.1922.62.3.473 |
| [17] |
宋晶, 李晓东, 吴垠. 温度, pH对海蜇(Rhopilema esculenta)主要消化酶活力的影响[J]. 山西农业大学学报(自然科学版), 2015, 35(1): 398-403. Song Jing, Li Xiaodong, Wu Yin. Effects of temperature and pH on the activities of digestive enzymes in Rhopilema esculenta[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2015, 35(1): 398-403. |
| [18] |
Lo W T, Chen I L. Population succession and feeding of scyphomedusae, Aurelia aurita, in a eutrophic tropical lagoon in Taiwan[J]. Estuarine, Coastal and Shelf Science, 2008, 76(2): 227-238. DOI:10.1016/j.ecss.2007.07.015 |
| [19] |
Evjemo J O, Reitan K I, Olsen Y. Copepods as live food organisms in the larval rearing of halibut larvae (Hippoglossus hippoglossus L.) with special emphasis on the nutritional value[J]. Aquaculture, 2003, 227(1-4): 191-210. DOI:10.1016/S0044-8486(03)00503-9 |
| [20] |
彭瑞冰, 蒋霞敏, 乐可鑫, 等. 5种饵料动物的营养成分分析及评价[J]. 水产学报, 2014, 38(2): 257-264. Peng Ruibing, Jiang Xiamin, Le Kexin, et al. Nutritive composition and evaluation of five food animals[J]. Journal of Fisheries of China, 2014, 38(2): 257-264. |
| [21] |
奚秀秀, 张群飞, 邓吕, 等. 墨氏胸刺水蚤营养价值的评价[J]. 食品与生物技术学报, 2015, 34(1): 28-33. Xi Xiuxiu, Zhang Qunfei, Deng Lv, et al. Analysis and evaluation of the nutritional value about Centropages mcmurrichi[J]. Journal of Food Science And Biotecnology, 2015, 34(1): 28-33. |
| [22] |
徐秀兰, 蒋企洲. 卤虫中蛋白质和脂肪酸组成的研究[J]. 中国生化药物杂志, 1997, 6: 289-291. Xu Xiulan, Jiang Qizhou. Studies on the constituents of proteins and fatty acids in Arteam salmas sinnaeus[J]. Chinese Journal of Biochemical Pharmaceutics, 1997, 6: 289-291. |
| [23] |
曾庆华, 丁卓平. 我国六个产地卤虫初孵无节幼体的营养价值[J]. 上海海洋大学学报, 2001, 10(3): 213-217. Zeng Qinghua, Ding Zhuoping. Nutritional values of new hatched Artemia nauplii of six geographic strains in China[J]. Journal of Shanghai Fisheries University, 2001, 10(3): 213-217. DOI:10.3969/j.issn.1004-7271.2001.03.004 |
| [24] |
桂远明, 吴垠, 刘焕亮, 等. 温度对草鱼, 鲤, 鲢, 鳙主要消化酶活性的影响[J]. 大连海洋大学学报, 1993, 7(4): 1-8. Gui Yuanming, Wu Yin, Liu Huanliang, et al. The effect of temperature on the main disestive enzyme activites of grass crap, common carp, silver carp and bighead carp[J]. Journal of Dalian Fisheries College, 1993, 7(4): 1-8. |
| [25] |
沈文英, 胡洪国, 潘雅娟. 温度和pH值对南美白对虾(Penaeus vannmei)消化酶活性的影响[J]. 海洋与湖沼, 2004, 35(6): 543-548. Shen Wenying, Hu Hongguo, Pan Yajuan. Effect of temperature and pH on activity of digestive enzymes in shrimp Penaesu vannmei[J]. Oceanologia et Limnologia Sinica, 2004, 35(6): 543-548. DOI:10.3321/j.issn:0029-814X.2004.06.010 |
| [26] |
王吉桥, 唐黎, 许重, 等. 温度、pH和金属离子对仿刺参蛋白酶活力影响的研究[J]. 海洋科学, 2007, 31(11): 14-18. Wang Jiqiao, Tang Li, Xu Zhong, et al. Effects of temperature, pH value and metal ions on protease activities in the digestive tract from sea cucumber (Apostichopus japonicus)[J]. Marine Sciences, 2007, 31(11): 14-18. DOI:10.3969/j.issn.1000-3096.2007.11.004 |
| [27] |
Dawson M N, Jacobs D K. Molecular evidence for cryptic species of Aurelia aurita (Cnidaria, Scyphozoa)[J]. The Biological Bulletin, 2001, 200(1): 92-96. DOI:10.2307/1543089 |
| [28] |
黄耀桐, 刘永坚. 草鱼肠道肝胰脏蛋白酶活性初步研究[J]. 水生生物学报, 1988, 12(4): 328-333. Huang Yaotong, Liu Yongjian. Study on protease activity in the intestine and hepatopancreas of grass carp, Ctenopharyngodon idellus[J]. Acta Hydrobiologica Sinica, 1988, 12(4): 328-333. |
| [29] |
Maugle P D, Deshimaru O, Katayama T, et al. Characteristics of amylase and protease of the shrimp Penaeus japanius[J]. Bulletin of Japanese Society of Scientific Fisheries, 1982, 48(12): 1753-1757. DOI:10.2331/suisan.48.1753 |
| [30] |
Victor D V, Laurence T K. The appearance of α-amylase activity during get differentiation iation in sand Dollar putei[J]. Developmental Biology, 1971, 26(3): 293-299. |
| [31] |
李静, 张剑, 赵永祥. 金属离子对蛋白酶作用的研究进展[J]. 日用化学工业, 2017, 47(6): 345-351. Li Jing, Zhang Jian, Zhao Yongxiang. Progress in research work field with respect to effects of metal ions on protease[J]. China Surfactant Detergent & Cosmetics, 2017, 47(6): 345-351. |
| [32] |
Pan T L, Gröger H, Schmid V, et al. A toxin homology domain in an astacin-like metalloproteinase of the jellyfish Podocoryne carnea with a dual role in digestion and development[J]. Development Genes and Evolution, 1998, 208(5): 259-266. DOI:10.1007/s004270050180 |
 2019, Vol. 43
2019, Vol. 43

