
文章信息
- 刘杰, 聂鸿涛, 姜坤银, 王政兴, 孙晓彤, 霍忠明, 闫喜武. 2020.
- LIU Jie, NIE Hong-tao, JIANG Kun-yin, WANG Zheng-xing, SUN Xiao-tong, HUO Zhong-ming, YAN Xi-wu. 2020.
- LPS胁迫下五个群体菲律宾蛤仔TYR基因在鳃和肝胰腺中表达特性研究
- TYR gene expression in gills and hepatopancreas of five populations of Ruditapes philippinarum under LPS Stress
- 海洋科学, 44(1): 81-88
- Marine Sciences, 44(1): 81-88.
- http://dx.doi.org/10.11759/hykx20190715004
-
文章历史
- 收稿日期:2019-07-15
- 修回日期:2019-10-31
2. 大连海洋大学 辽宁省贝类良种繁育工程技术研究中心大连 116023
2. Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province, Dalian Ocean University, Dalian 116023, China
菲律宾蛤仔(Ruditapes philippinarum)是我国重要水产养殖贝类。2017年我国蛤仔年产量约为4 177 913万吨, 在贝类养殖中有着重要地位[1]。然而近年来, 弧菌病成为威胁养殖业的主要原因之一[2]。例如, 鳗弧菌和灿烂弧菌是我国海水养殖所面临的重要致病菌, 严重威胁经济贝类的养殖安全[3-4]。菲律宾蛤仔免疫与病害防治一直是菲律宾蛤仔养殖的重中之重。蛤仔的免疫力强弱即抵抗外来病原体胁迫能力的强弱直接决定着蛤仔的存活率。因此, 开展蛤仔免疫相关基因研究对提高蛤仔产量及经济效益有着重要意义。
酪氨酸酶(Tyrosinase, TYR)(E.C.1.14.18.1)是一种含铜元素氧化还原酶, 属于3型铜蛋白家族, 酪氨酸酶属于酚氧化酶的一种[5-6]。酪氨酸酶催化黑色素生物合成过程中的前两个反应, 包括从酪氨酸中产生的真黑色素和非黑色素, 即将酪氨酸羟基化为二羟基-L-苯丙氨酸(DOPA), 然后将DOPA氧化为多巴胺[7-8]。其参与生物体色素合成, 在软体动物中, 一些头足类动物被用作研究墨囊中黑色素生物合成的生化特性的良好模型[9-11]。在长牡蛎幼虫发育中酪氨酸酶参与了壳形成[12]。同时, 酪氨酸酶也是一种重要的免疫相关酶[13]。目前已发现其在多种海洋生物中参与免疫应答, 在无脊椎动物的先天免疫中也起着关键作用[13-15]。在贝类中, 长牡蛎和栉孔扇贝中含有酪氨酸酶, 它的活性被认为与长牡蛎和栉孔扇贝的免疫力有关[13, 16-19]。例如, LPS刺激后在栉孔扇贝血淋巴中TYR基因表达水平先显著下调后显著上调(P < 0.05), 在LPS刺激后3h, 血淋巴对大肠杆菌的抗菌活性也显著增加, 但在用TYR抑制剂处理血淋巴后, 其抗菌活性显著降低[20]。在翡翠贻贝中也有酪氨酸酶基因参与免疫应答的研究报道[21]。然而, 在蛤仔中对酪氨酸酶基因与免疫的潜在关联研究很少。
LPS是革兰氏染色阴性菌细胞壁上的脂多糖, 在许多双壳类免疫相关文献中记录了革兰氏染色阴性菌是影响双壳类存活的主要病原体[16]。在双壳类中, 鳃是与外界海水连续交换的器官, 是蛤仔第一道天然屏障, 因此容易受到病原体感染, 肝胰腺是贝类的重要的免疫器官[22-23]。本实验选取鳃和肝胰腺两个组织探究了TYR基因对菲律宾蛤仔的免疫应答, 利用荧光定量PCR分析了LPS胁迫下蛤仔TYR6和TYR10基因的表达特性。为深入探究菲律宾蛤仔免疫作用与TYR基因之间的关系提供理论支持。
1 材料与方法 1.1 材料来源用来进行实验的五个菲律宾蛤仔群体:野生群体(Wild Population)、养殖群体(Cultured Population)、斑马蛤(Zebra clam)、白斑马蛤(White Zebra clam)、白蛤(White clam)。斑马蛤由福建莆田野生菲律宾蛤仔群体选育而来, 白斑马蛤通过大连野生群体白蛤和斑马蛤杂交而来, 白蛤和养殖菲律宾蛤仔来自莆田群体, 上述四种实验蛤仔均来自庄河养殖场2龄贝, 壳长22.2±1.02 mm, 湿重5.4±0.8 g。野生群体采自大连金石滩。实验开始前将实验样品置于20 L水槽中22℃暂养一周, 每天换水一次, 适量投喂螺旋藻粉。
1.2 LPS胁迫及组织获取将五个群体菲律宾蛤仔, 随机分为两组, 每个群体每个时间点各随机抽取三个个体进行实验。一组为LPS胁迫组, 注射50 μL(浓度为100 μg/mL)的LPS。另一组设为PBS对照组, 注射50 μL磷酸盐缓冲液(PBS)。每个群体进行生物学重复随机选取3个个体进行注射胁迫, 于0、3、6、12、24、48 h, 6个时间点解剖获得实验蛤仔的鳃和肝胰腺组织, 液氮冷冻后存于–80℃冰箱用于提取样品总RNA。
1.3 RNA提取及序列分析取30mg组织使用TRIzol法获得实验用蛤仔鳃组织及肝胰腺组织总RNA。用NanoDrop 2000c UV核酸定量仪进行RNA浓度检测。用TaKaRa Primer ScriptTM RT reage-nt Kit(TaKaRa, 大连)试剂盒进行反转录。从本实验室菲律宾蛤仔基因组中选取核心序列TYR6(>evm.model.xfSc0000366.24)、TYR10(>evm.model. xfSc0000339.13), 将蛋白序列上传到NCBI, 在NCBI中进行TYR蛋白序列比对分析, 将同源性高的物种的氨基酸序列下载下来, 使用Clustal X进一步对序列进行分析, 找到6个组氨酸残基[24]; 使用线上软件ExPASy(htps://www.expasy.org/)研究物种序列二级结构之间的关系[25]。通过MEGA X软件研究菲律宾蛤仔与不同物种间遗传进化关系, 并以发育树进行展示Bootstrap 1000次(Neighbor-Joining, NJ)[26-27]。
1.4 TYR基因荧光定量PCR分析根据荧光定量引物设计标准用Premier 5.0设计特异性荧光引物(表 1), 交由生工生物工程(上海)股份有限公司合成引物, 引物退火温度60℃, 以β-actin为内参基因。检测TYR基因在鳃和肝胰腺中不同时间的表达情况。使用SYBR® Premix Ex TaqTMⅡ(TliRNaseH Plus)试剂盒(TaKaRa, 大连)在LightCycler® 480定量PCR仪(Roche, 上海)进行序列扩增, 20 µL体系, 每组进行三次重复(表 2)。实验用两步法荧光定量PCR程序: 95 30 s, 95 5 s, ℃ ℃ 60 30 s, ℃循环40次。将所得结果用2–∆∆Ct法计算分析比较, 并进行单因素方差分析(One-way ANOVA), 用SPSS22.0进行数据处理。设置P < 0.05为表达量差异显著性水平。
| 基因 | 碱基序列 |
| β-actinF | CTCCCTTGAGAAGAGCTACGA |
| β-actinR | TAATGACAAGTGGTTTACGGG |
| TYR6F | ACCCAGATGAGCGTGGTAGAGG |
| TYR6R | TTAGTGTTTGGATACGGTGTTG |
| TYR10F | ACAGACCAATCACGCAGTTTC |
| TYR10R | TAGTCTTGCCAAAGCGTCATA |
| 反应体系 | 体积/µL |
| SYBR premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×) | 10 |
| PCR forward primer(10 µmol/L) | 0.8 |
| PCR reverse primer(10 µmol/L) | 0.8 |
| DNA模板 | 2 |
| dH2O(灭菌蒸馏水) | 6.4 |
| 合计 Total | 20 |
使用线上软件ExPASy对序列进行二级结构分析, 得到2个铜离子结合位点, 和6个组氨酸残基(图 1)。
 |
| 图 1 TYR氨基酸多序列比对 Fig. 1 Multiple alignment of TYR amino acid sequences. 注:大珠母贝(AHZ34287.1)、加勒比珠母贝(AGS47960.1)、美洲牡蛎(XP_022344539.1)、长牡蛎(EKC18551.1)、虾夷扇贝(XP_ 021374237.1)、栉孔扇贝(ASR73340.1)、三角帆蚌(APC92582.1)、金乌贼(CAC82191.1)。红色区域代表铜离子结合位点, 符号*代表保守的组氨酸残基位点。 |
五个群体菲律宾蛤仔的TYR6、TYR10基因的氨基酸序列与其他物种TYR基因在Clustal X上多序列比对, 其TYR6与长牡蛎(Crassostrea gigas)同源性最高为39.43%, 在进化树中最先聚为一支, 与虾夷扇贝(Mizuhopecten yessoensis)同源性为36.02%, 其次与三角帆蚌同源性为35%。TYR10与大珠母贝(Pinctada maxima)同源性最高为51.04%, 与加勒比珠母贝(Pinctada imbricata)同源性为49.31%, 因此TYR10和大珠母贝(Pinctada maxima)、加勒比珠母贝(Pinctada imbricata)最先聚为一支, 其次与金乌贼(Sepia officinalis)聚为一支, 再与其他贝类聚成一支, 最后才与脊椎动物聚为一大支(图 2)。
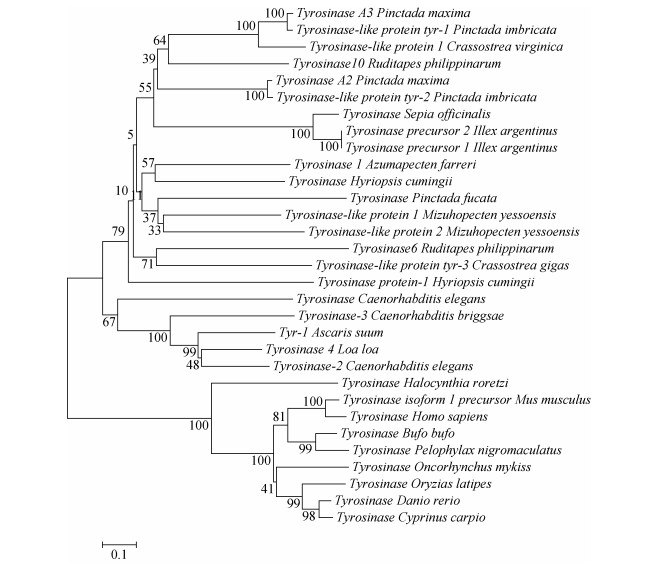 |
| 图 2 TYR基因系统进化树 Fig. 2 Phylogenetic tree of TYR genes Homo sapiens:人; Mus musculus:小鼠; Crassostrea gigas:长牡蛎; Pinctada maxima:大珠母贝; Pinctada imbricata:加勒比珠母贝; Crassostrea virginica:美洲牡蛎; Azumapecten farreri:栉孔扇贝; Hyriopsis cumingii:三角帆蚌; Sepia officinalis:金乌贼; Mizuhopecten yessoensis:虾夷扇贝; Loa loa:罗阿丝虫; Ruditapes philippmarum:菲律宾蛤仔; llex argentinus:阿根廷滑柔鱼; Pinctada fucata:合浦珠母贝; Caenorhabditis elegans:秀丽隐杆线虫; Ascaris suum:猪蛔虫; Halocynthia roretzi:真海鞘; Bufo bufo:蟾蜍; Pelophylax nigromaculatus:黑斑蛙; Oncorhynchus mykiss:虹鳟鱼; Oryzias latipes:青鳉; Danio rerio:斑马鱼; Cyprinus carpio:锦鲤 |
组织中的表达模式注射LPS后TYR6基因在养殖群体鳃组织中随时间增加表达量有显著变化(P < 0.05), 3h时表达量开始上调, 6 h、12 h与0 h相比差异显著, 分别是对照组的9.19和8.64倍(P < 0.05), 且6 h表达量达到最高, 随时间推移24 h表达量下调, 48 h表达量趋于初始水平(图 3); 在肝胰腺中6h表达量显著上调, 是对照组的21.88倍(P < 0.05), 随后表达量下调。TYR6基因在白蛤鳃组织中3 h、6 h、12 h表达量显著上调, 分别是对照组的3.22倍、5.16倍和3.51倍(P < 0.05), 且在6 h表达量达到峰值, 在24 h表达量下调趋近于初始水平(图 3); 在肝胰腺中, 6 h表达量显著上调是对照组的15.99倍(P < 0.05), 随后表达量下调。在24 h表达量达到另一峰值是对照组的7.24倍(P < 0.05)(图 4)。TYR6基因在白斑马蛤鳃组织中, 3 h、6 h、12 h均有显著上调, 在6 h表达量达到峰值是对照组的3.19倍(P < 0.05), 24 h表达量下调趋于初始水平(图 3); 在肝胰腺中6 h显著上调达到峰值是对照组的27.17倍(P < 0.05), 12 h下调至初始水平(图 4)。TYR6基因在野生群体鳃组织中, 3 h表达量显著上调达到峰值, 是对照组的6.46倍(P < 0.05), 之后下调至初始水平(图 3); 在肝胰腺中3 h表达量显著上调达到峰值, 是对照组的4.87倍(P < 0.05)(图 4)。TYR6基因在斑马蛤鳃组织中3 h、6h表达量显著上调, 分别是对照组的7.1倍和2.72倍(P < 0.05), 并于3 h达到峰值, 6 h表达量开始下调; 在肝胰腺中3 h表达量显著上调达到峰值, 是对照组的8.12倍(P < 0.05), 随后开始下调于48 h趋于初始水平。
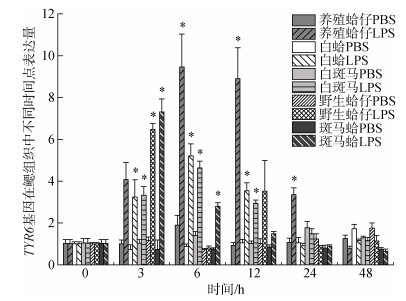 |
| 图 3 LPS胁迫下菲律宾蛤仔鳃组织TYR6基因在不同时间点的表达模式 Fig. 3 Expression patterns of TYR6 gene in the gill of Ruditapes philippinarum after LPS injection at different time points 注:同一群体不同时间点表达量与0h比, 用*表示差异显著(P < 0.05) |
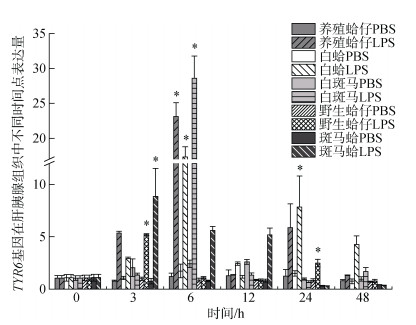 |
| 图 4 LPS胁迫下菲律宾蛤仔肝胰腺TYR6基因在不同时间点的表达模式 Fig. 4 Expression patterns of TYR6 gene in the hepatopancreas of Ruditapes philippinarum after LPS injection at different time points |
注射LPS后, TYR10基因在养殖群体鳃组织中3 h、6 h表达量显著上调, 分别是对照组的6.35倍和14.74倍(P < 0.05), 在6h表达量达到峰值, 随后表达量下调到初始水平(图 5); 在肝胰腺中, 6 h表达量显著上调达到峰值是对照组的7.55倍(P < 0.05)(图 6)。TYR10基因在白蛤鳃组织中3 h表达量显著上调达到峰值是对照组的4.23倍(P < 0.05), 随后下调至初始水平; 在肝胰腺中3 h显著上调并达到峰值, 是对照组的2.63倍(P < 0.05)。TYR10基因在白斑马群体鳃组织中3h表达量显著上调达到峰值, 是对照组的5.88倍(P < 0.05)(图 5); 在肝胰腺中6 h表达量显著上调达到峰值是对照组的19.85倍(P < 0.05), 随后下调至初始水平(图 6)。TYR10基因在野生群体鳃组织中3h表达量显著上调并达到峰值, 是对照组的6.7倍(P < 0.05) (图 5); 在肝胰腺中3 h、6 h、12 h表达量均有显著上调, 分别是对照组的9.22倍、20.32倍和10.51倍(P < 0.05), 在6 h表达量达到峰值(图 6)。TYR10基因在斑马蛤鳃组织中3 h、12 h表达量显著上调, 分别是对照组的6.89倍和4.74倍(P < 0.05), 3 h表达量达到峰值(图 5); 在肝胰腺中6 h显著上调达到峰值是对照组的21.08倍(图 6)。
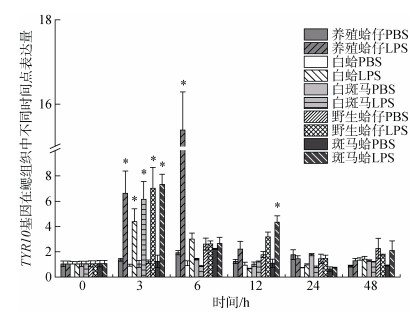 |
| 图 5 LPS胁迫下菲律宾蛤仔鳃TYR10基因在不同时间点的表达模式 Fig. 5 Expression patterns of TYR10 gene in the gill of Ruditapes philippinarum after LPS injection at different time points |
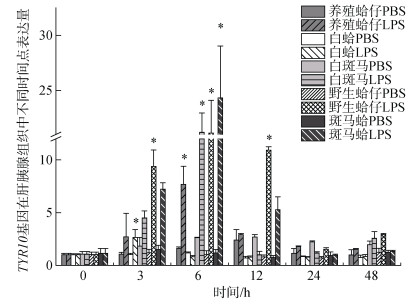 |
| 图 6 LPS胁迫下菲律宾蛤仔肝胰腺TYR10基因在不同时间点的表达模式 Fig. 6 Expression patterns of TYR10 gene in the hepatopancreas of Ruditapes philippinarum after LPS injection at different time points |
近年来的研究表明, 酪氨酸酶参与了软体动物的许多生物学功能, 包括免疫应答、卵囊形成、足丝、壳基质蛋白和角质层形成等[28-29, 12]。本实验中, 在LPS注射后TYR6、TYR10基因在五个蛤仔群体中鳃组织和肝胰腺组织中均有差异性表达, 从表达量结果来进行分析, TYR6白斑马鳃组织中的表达量在3h、6h、12h均有显著上调(P < 0.05)。TYR10在五个群体菲律宾蛤仔中斑马蛤肝胰腺中表达量最高(图 6), 可能跟斑马蛤本身的抗逆性强有关[30]。除TYR6在养殖群体鳃组织中未有显著上调, TYR基因在四个群体鳃组织中3h表达量均有显著上调(P < 0.05), 比在肝胰腺中显著上调时间出现要早, 推测菲律宾蛤仔在受到LPS注射后鳃组织较肝胰腺组织更为敏感。双壳类的鳃不仅是呼吸器官, 也是重要的免疫器官, 其与外界海水连续交换, 易被病原体感染[9]。推测TYR基因有可能在鳃组织中参与了免疫反应。TYR基因在蛤仔肝胰腺中的表达水平普遍要高于在鳃中的表达水平, LPS胁迫后TYR基因的高表达表明TYR基因可能在肝胰腺中参与了蛤仔的免疫应答反应, 在其他物种中也有类似的报道[22-24]。
Muñoz等[31]研究发现, 在双壳类血淋巴和血细胞中, 寄生虫侵染可以使酪氨酸酶活性显著上调。周智等[23]研究发现TYR基因在栉孔扇贝血淋巴中的表达水平决定血淋巴抗菌活性的强弱, 证明了酪氨酸酶参与了贝类天然免疫反应。Rishan[32]等研究表明, 在菲律宾蛤仔血淋巴中只含有一种酚氧化酶, 属于一种酪氨酸酶型酚氧化酶。酚氧化酶是无脊椎动物非特异性免疫系统的关键组成部分, 是丝氨酸蛋白酶复合酶级联的末端组成部分。
综上, 本实验通过荧光定量PCR分析了LPS胁迫下TYR基因在菲律宾蛤仔5种群体的鳃和肝胰腺中的表达水平。查明了TYR基因在LPS胁迫下的鳃组织和肝胰腺组织中的表达模式, 同时推测了TYR基因在蛤仔鳃和肝胰腺中表达与免疫的关系, 从TYR基因免疫应答水平上看, 不同群体TYR表达的高低与蛤仔免疫力表达有一定联系, TYR6、TYR10基因在斑马蛤鳃组织和肝胰腺组织中均有较高表达, 推测与斑马蛤是抗逆性强品系, 抗病能力要强于其他群体有关。为进一步对菲律宾蛤仔免疫学的研究提供基础。
| [1] |
农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017. Fisheries and Fishery Administration of the Ministry of Agriculture. China fisheries statistics yearbook[M]. Beijing: China Agriculture Press, 2017. |
| [2] |
吴后波, 潘金培. 弧菌属细菌及其所致海水养殖动物疾病[J]. 中国水产科学, 2001, 8(1): 89-93. Wu Houbo, Pan Jinpei. Progress in studies of vibriosis in aquaculture[J]. Journal of Fishery Sciences of China, 2001, 8(1): 89-93. DOI:10.3321/j.issn:1005-8737.2001.01.020 |
| [3] |
张新中, 张世秀, 李海平, 等. 海水养殖动物致病性(Pathogenicity)鳗弧菌(Vibrio anguillarum)的研究综述[J]. 渔业信息与战略, 2007, 22(1): 16-19. Zhang Xinzhong, Zhang Shixiu, Li Haiping, et al. Review on research of Vibrio anguillarum pathogenicity to aquatic animals in mariculture[J]. Fishery Information and Strategy, 2007, 22(1): 16-19. DOI:10.3969/j.issn.1004-8340.2007.01.005 |
| [4] |
李华, 王扬, 李强, 等. 灿烂弧菌的疏水性和生物被膜形成能力[J]. 中国水产科学, 2011, 18(5): 1084-1091. Li Hua, Wang Yang, Li Qiang, et al. Cell surface hydrophobicity and biofilm formation ability of Vibrio spleen-didus[J]. Journal of Fishery Sciences of China, 2011, 18(5): 1084-1091. |
| [5] |
Claus H, Decker H. Bacterial tyrosinases[J]. Systematic & Applied Micro-biology, 2006, 29(1): 3-14. |
| [6] |
García-Borrón J C, Solano F. Molecular anatomy of tyrosinase and its related proteins:beyond the histidine bound metal catalytic center[J]. Pigment Cell Research, 2010, 15(3): 162-173. |
| [7] |
Sugumaran M. Comparative Biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects[J]. Pigment Cell Research, 2002, 15(1): 2-9. DOI:10.1034/j.1600-0749.2002.00056.x |
| [8] |
Lerch K. Neurosporatyrosinase:structural, spectroscopic and catalytic properties[J]. Molecular & Cellular Bioche-mistry, 1983, 52(2): 125-138. |
| [9] |
Naraoka T, Uchisawa H, Mori H, et al. Purification, characterization and molecular cloning of tyrosinase from the cephalopod mollusk, Illex argenti-nus[J]. European Journal of Biochemistry, 2010, 270(19): 4026-4038. |
| [10] |
Palumbo A. A new dopachrome rear-anging enzyme from the ejected ink of the cuttlefish Sepia officinalis[J]. Biochemical Journal, 1994, 299(Pt3): 839-844. |
| [11] |
Palumbo A. SP-07 Melanogenesis in the Ink Gland of Sepia officinalis[J]. Pigment Cell Research, 2010, 16(5): 517-522. |
| [12] |
Huan P, Liu G, Wang H X, et al. Identification of a tyrosinase gene potentially involved in early larval shell biogenesis of the Pacific oyster Crassostrea gigas[J]. Development Genes & Evolution, 2013, 223(6): 389-394. |
| [13] |
Cerenius L, Kawabata S, Lee B L, et al. Proteolytic cascades and their involvement in invertebrate immunity[J]. Trends in Biochemical Sciences, 2010, 35(10): 575-583. DOI:10.1016/j.tibs.2010.04.006 |
| [14] |
Söderhäll K, Cerenius L. Role of theprophenoloxidase-activating system in invertebrate immunity[J]. Current Opinion in Immunology, 1998, 10(1): 23-28. DOI:10.1016/S0952-7915(98)80026-5 |
| [15] |
Zhou Z, Ni D, Wang M, et al. The phenoloxidase activity and antibacterial function of a tyrosinase from scallop Chlamys farreri[J]. Fish & Shellfi-sh Immunology, 2012, 33(2): 375-381. |
| [16] |
Xing J, Jiang J, Zhan W. Phenoloxidase in the scallop Chlamys farreri:purification and antibacterial activity of its reaction products generated in vitro[J]. Fish & Shellfish Immunology, 2012, 32(1): 89-93. |
| [17] |
Jiang J, Xing J, Sheng X, et al. Characterization of phenoloxidase from the Bay Scallop Argopecten irradians[J]. Journal of Shellfish Research, 2011, 30(2): 273-277. DOI:10.2983/035.030.0212 |
| [18] |
Aladaileh S, Rodney P, Nair S V, et al. Characterization of phenoloxidase activity in sydney rock oysters (Saccostrea glomerata)[J]. Comparative Biochemistry and Physiology, Part B, 2007, 148(4): 470-480. DOI:10.1016/j.cbpb.2007.07.089 |
| [19] |
Luna-González A, Maeda-MartíNez A N, Vargas-Albores F, et al. Phenoloxidase activity in larval and juvenile homogenates and adult plasma and haemocytes of bivalve molluscs[J]. Fish & Shellfish Immunol, 2003, 15(4): 275-282. |
| [20] |
Zhou Z, Ni D, Wang M, et al. The phenoloxidase activity and antibacterial function of a tyrosinase from scallop Chlamys farreri[J]. Fish & Shellfish Immunology, 2012, 33(2): 375-381. |
| [21] |
Asokan R, Arumugam M, Mullaina-dhan P. Activation of prophenoloxidase in the plasma and haemocytes of the marine mussel Perna viridis Linnaeus[J]. Developmental & Comparative Immunology, 1997, 21(1): 1. |
| [22] |
马菲菲.麻痹性贝毒在贝类中的生物转化及其对机体免疫系统的影响[D].山东青岛: 中国海洋大学, 2012. Ma Feifei. Biotransformation of paralytic shellfish toxins in shellfish and effect on its immune system[D]. Qingdao, Shandong Province: Ocean University of China, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2159826 |
| [23] |
张林宝, 孙伟, 蔡文贵, 等. 菲律宾蛤仔两种谷氧还蛋白基因对微生物侵染和重金属胁迫的应答[J]. 中国水产科学, 2014, 21(6): 1253-1259. Zhang Linbao, Sun Wei, Cai Wengui, et al. Responses of two glutaredoxin genes to bacterial and cadmium challenge in Venerupis philippinarum[J]. Journal of Fishery Sciences of China, 2014, 21(6): 1253-1259. |
| [24] |
Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23(21): 2947-2948. DOI:10.1093/bioinformatics/btm404 |
| [25] |
Wilkins M R, Gasteiger E, Bairoch A, et al. Protein Identification and Analysis Tools in the ExPASy Server[J]. Methods in Molecular Biology, 1999, 112(112): 531. |
| [26] |
Kumar S, Tamura K, Nei M. MEGA:Molecular Evolutionary Genetics Analysis software for microcomputers[J]. Computer Applications in the Biosciences:CABIOS, 1994, 10(2): 189-191. |
| [27] |
Felsenstein J. Confidence limits on phylogenies:an approach using the bootstrap[J]. Evolution, 1985, 39(4): 783-791. DOI:10.1111/j.1558-5646.1985.tb00420.x |
| [28] |
Bai G, Brown J F, Watson C, et al. Isolation and characterization of phenoloxidase from egg masses of the ga-stropod mollusc, Biomphalaria glabrata[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 1997, 118(2): 463. |
| [29] |
Waite J H, Tanzer M L. The bioadhe-sive of Mytilus byssus:a protein containing Ldopa[J]. Biochemical & Biophysical Research Communications, 1980, 96(4): 1554-1561. |
| [30] |
闫喜武, 霍忠明, 杨凤, 等. 菲律宾蛤仔"斑马蛤"[J]. 中国水产, 2015(9): 52-53. Yan Xiwu, Huo Zhongming, Yang Feng, et al. Ruditapes philippinarum 'ze-bra clam'[J]. China Fisheries, 2015(9): 52-53. DOI:10.3969/j.issn.1002-6681.2015.09.022 |
| [31] |
Muñoz P, Meseguer J, Esteban M A. Phenoloxidase activity in three comercial bivalve species. Changes due to natural infestation with Perkinsus atlanticus[J]. Fish & Shellfish Immunology, 2006, 20(1): 12-19. |
| [32] |
Cong R, Sun W, Liu G, et al. Purification and characterization of phenoloxidase from clam Ruditapes Philippinarum[J]. Fish Shellfish Immunol, 2005, 18(1): 0-70. |
 2020, Vol. 44
2020, Vol. 44


