
文章信息
- 宋宏策, 姜秋云, 李玲玲, 战蕊, 魏磊, 王晓通. 2020.
- SONG Hong-ce, JIANG Qiu-yun, LI Ling-ling, ZHAN Rui, WEI Lei, WANG Xiao-tong. 2020.
- 不同长牡蛎群体对海水酸化的生理响应差异分析
- Analysis of physiological responses in different populations of Crassostrea gigas to seawater acidification
- 海洋科学, 44(1): 132-141
- Marine Sciences, 44(1): 132-141.
- http://dx.doi.org/10.11759/hykx20190711002
-
文章历史
- 收稿日期:2019-07-11
- 修回日期:2019-08-08
海水酸化是指由于吸收大气中过量二氧化碳而导致海水逐渐变酸的现象, 随之所产生的海水pH值下降、碳酸盐体系失衡等海洋化学性质变化可能会对海洋动物的生存产生严重影响[1]。中国海域辽阔、海岸线漫长, 且在部分海区已经显现出海水酸化进程加快的趋势[2]。长牡蛎(Crassostrea gigas)是中国主要的水产养殖贝类, 具有生长速度快、适应性强等优点[3]。在自然的环境下, 野生长牡蛎多出现在潮间带海域, 附着在岸边的岩石上, 由于潮汐的影响, 潮间带生长的长牡蛎会时而暴露在空气中, 时而浸没在水下。相反, 在海湾的养殖场内, 长牡蛎在水泥池中育苗, 投放在以尼龙绳穿线扇贝壳或牡蛎壳而成的附着基上, 悬挂在筏架上, 在海水中进行垂下式养殖。因此, 养殖的长牡蛎均在潮下带生长, 其整个生活史都在水下完成。积年累月的生境差异, 可能对长牡蛎产生生态多样性的影响, 进而可能在一定程度上改变了潮间带野生与潮下带养殖长牡蛎的环境适应能力, 并且与野生群体相比, 养殖群体由于近亲繁殖或只在小范围内选择亲本, 可能会导致其遗传变异性的降低[4, 5]。
海洋酸化对海洋生物的主要生理过程均有可能产生负面影响, 且对于不同海洋生物类群的影响存在一定的种间差异, 即使同源性很高的物种, 或是同一物种的不同群体间也有可能表现出完全不同的响应情况[6, 7]。经海水酸化暴露后, 与野生悉尼岩牡蛎(Saccostrea glomerata)群体相比, 选育悉尼岩牡蛎群体的后代幼虫体型更大且具有较快的发育速度, 选育养殖品种具有更好的耐受酸化能力, 这一发现表明不同生境的同一物种对海水酸化的敏感性也存在显著差异[8]。进一步的蛋白质组学研究发现, 悉尼岩牡蛎成体对海水酸化的响应在野生和选育群体中有着明显的差异变化[9]。总的来说, 海洋酸化对海洋软体动物的整个生活周期都可产生一定影响作用, 进而严重影响海洋中的生物多样性, 打破原有的海洋生态平衡, 最终导致海洋生态系统发生不可逆转的改变[10]。
本研究以潮间带野生与潮下带养殖的两种长牡蛎作为实验对象, 在了解其对海水酸化响应的基本代谢特征的基础上, 整合两种长牡蛎的不同组织(鳃、外套膜及消化腺)在能量代谢及氧化应激等生理指标上的响应差异情况, 综合评价存在生境差异的两种长牡蛎对海水酸化的响应情况。
1 材料与方法 1.1 实验材料本实验所用长牡蛎均为壳长3 cm~5 cm左右的稚贝。潮间带野生长牡蛎采集于烟台市月亮湾海滩礁石, 潮下带养殖长牡蛎购置于烟台市芝罘岛牡蛎养殖场。在实验室内对实验长牡蛎进行3周驯养后, 筛选两种长牡蛎各150只, 随机分组进行海水酸化暴露实验。实验组分别设置为:潮间带野生与潮下带养殖对照组, 潮间带野生与潮下带养殖海水酸化处理组。向实验用海水中通气进行酸化条件的模拟暴露实验。海水酸化处理组通入CO2和空气的混合气体(pH约为7.6), 对照组通入周围空气(pH约为8.0)。暴露周期为21 d, 暴露处理过程中, 每天定时投喂微藻饵料, 并在进食结束后更换预先通气处理好的酸化海水, 在暴露过程中维持通气状态。在整个实验过程中, 每天1次利用pH计、盐度计等监测海水化学参数(温度、盐度、pH、pCO2和总碱度等)的变化情况(表 1)。
| 参数 | I-C | I-O | S-C | S-O |
| 温度(℃) | 14.00 ± 0.05 | 14.06 ± 0.05 | 14.10 ± 0.05 | 14.07 ± 0.05 |
| 盐度 | 34.20 ± 0.08 | 34.27 ± 0.05 | 34.12 ± 0.08 | 34.13 ± 0.05 |
| pH | 8.04 ± 0.02 | 7.62 ± 0.01 | 8.04 ± 0.01 | 7.64 ± 0.01 |
| 总碱度(µmol/kg) | 2 783.33 ± 24.95 | 2 776.67 ± 75.42 | 2 750.00 ± 58.88 | 2 836.67 ± 41.10 |
| 注: I-C为潮间带野生长牡蛎对照组; I-O为潮间带野生长牡蛎酸化组; S-C为潮下带养殖长牡蛎对照组; S-O为潮下带养殖长牡蛎酸化组 | ||||
在海水酸化暴露结束前, 各实验组随机取样两种长牡蛎, 分别开展标准代谢率(SMR)、耗氧率(OCR)及滤食率(IR)的测定, 每组3个重复。海水酸化暴露结束后, 解剖并切取长牡蛎的鳃、外套膜及消化腺组织, 每组6个重复用于生理指标的检测。
1.2 基础代谢指标的测定 1.2.1 标准代谢率(SMR)和耗氧率(OCR)本实验参考已有实验方法测定SMR和OCR指标[11, 12]。采用静水密闭式呼吸实验方法, 实验前需将贝壳表面的附着生物处理干净, 实验每组设置1个呼吸瓶作为空白对照, 同时设置3个呼吸瓶作为实验组, 每个呼吸瓶体积为5 L, 实验组中每个呼吸瓶放12只长牡蛎。测定之前, 为了避免摄食和环境变化对新陈代谢产生影响, 实验组长牡蛎在测定之前禁食24 h, 并置于流水条件下适应2 h。
实验中, 海水酸化处理组样本继续置于酸化海水中进行检测, 而对照组则采用正常海水。在适应及实验阶段保持海水的流速一致, 采用虹吸的方法使PE水槽内的使用水恒速, 实验时间为2 h, 实验期间保持呼吸瓶内水温恒定在15℃。
SMR计算如下:
其中, SMR为标准代谢率(µmolO2/(g·h)); ρ(DOt1)和ρ(DOt2)分别为放入实验组的呼吸瓶进水口、出水口的DO质量浓度(mg/L); ρ(DOc1)和ρ(DOc2)分别为空白瓶进水口、出水口的DO质量浓度(mg/L); ΔO2为呼吸瓶进水口与出水口的溶氧差值(µmol/L); v为呼吸瓶进水口流速(L/h);M为长牡蛎的软体部干质量(g); 0.8为长牡蛎的异速生长系数。
OCR计算如下:
其中, OCR为耗氧率(mg/(kg·h)); ρ(DOt1)和ρ(DOt2)分别为放入实验组的呼吸瓶进水口、出水口的DO质量浓度(mg/L); ρ(DOc1)和ρ(DOc2)分别为空白瓶进水口、出水口的DO质量浓度(mg/L); ΔO2为呼吸瓶进水口与出水口的溶氧差值(µmol/L); v为呼吸瓶进水口流速(L/h); M为长牡蛎的软体部干质量(g)。
1.2.2 滤食率(IR)的测定本实验参考已有实验方法测定IR指标[13]。实验采用静水法, 微充气, 实验每组设置1个烧杯作为空白对照, 同时设置3个烧杯作为实验组, 每个烧杯体积为1 L, 实验组每组放1只长牡蛎, 试验时间为2 h, 期间微量充气, 分别测定试验前后水中饵料浓度。试验结束后, 解剖分离贝壳与软体部, 将软体部置于烘箱(70℃)中烘干至恒质量, 用分析天平称质量。饵料浓度用血球计数板定量, 每个样本均定量4次, 取其平均值, 并根据下式计算试验幼贝的滤食率。
其中, IR为单位体质量的滤食率(cell/(g·h)); C0和Ct分别为试验开始和结束时水中的饵料浓度(104个/mL); V为试验水体体积(L); M为长牡蛎的软体部干质量(g); t为试验时间(h); Sd为空白组饵料变化系数。
1.3 能量代谢、氧化应激指标的测定各实验组称取0.1 g长牡蛎(鳃、外套膜及消化腺)组织样本, 加入4℃预冷的匀浆介质(pH=7.4, 0.01 mol/L TRIS, 0.0001 mol/L EDTA-2Na, 0.01 mol/L蔗糖, 0.8% NaCl), 制备成10 %的组织匀浆溶液。将组织匀浆溶液4 000 rpm, 4℃离心10 min, 取匀浆上清, 用于相关指标的测定。采用南京建成生物工程研究所商业化试剂盒测定能量代谢指标包括:谷丙转氨酶(ALT, C009-1-1)、琥珀酸脱氢酶(SDH, A022-1-1)、谷草转氨酶(AST, C010-1-1)、ATP酶(ATPase, A070-1-2)、乳酸脱氢酶(LDH, A020-2-2)、ATP含量(A095-1-1)。氧化应激指标包括:过氧化氢酶(CAT, A007-1-1)、谷胱甘肽巯基转移酶(GST, A004-1-1)、丙二醛(MDA, A003-1-1)、总超氧化物歧化酶(SOD, A001-1-2)。长牡蛎组织样本的总蛋白含量通过BCA法测定(A045-3-2)。
利用南京建成生物工程研究所商业化试剂盒检测与能量储存有关的糖原含量(A043-1-1), 称取50 mg的长牡蛎(鳃、外套膜及消化腺)组织样本, 浓硫酸脱水生成糖醛衍生物后, 通过蒽酮比色法, 检测各样本中的糖原含量。每个指标均重复测定6次。
1.4 数据分析测定指标数据以x±s表示, 通过T检验来分析酸化组和对照组之间的差异情况。对能量代谢、氧化应激等生理指标开展多元统计方法, 分别采用SPSS 22.0及SIMCA 14.1软件进行主成分分析(Principal Component Analysis, PCA)及偏最小二乘判别分析(Partial Least Square-Discriminant Analysis, PLS-DA)。对于长牡蛎群体的差异情况, PCA分析可通过减少变量的维度, 提供一个较为粗略的概述。对于不同组织间的区分, 则应用PLS-DA分析来预测变量的分区, 提高模型的解释性。
2 结果与分析 2.1 海水酸化对基础代谢指标的影响在21 d海水酸化暴露后, 相较于对照组, 潮间带野生长牡蛎的基础代谢指标极显著下调(P < 0.01), SMR下调62.44%, OCR下调68.97%, IR下调82.20%。相较于对照组, 潮下带养殖长牡蛎仅IR影响显著(P < 0.05), 下调58.82%。而SMR和OCR在海水酸化暴露后均未显著变化(P>0.05, 表 2)。上述结果显示, 海水酸化暴露对长牡蛎的基础代谢过程产生了一定影响, 且潮间带野生长牡蛎基础代谢活动的响应程度更加剧烈。
| 指标 | I-C | I-O | S-C | S-O |
| SMR (μmolO2/(g·h)) | 135.58 ± 8.48 | 50.92 ± 3.90** | 75.04 ± 9.18 | 69.91 ± 9.73 |
| OCR (mg/(kg·h)) | 3.90 ± 0.07 | 1.21 ± 0.10** | 2.19 ± 0.87 | 1.78 ± 0.20 |
| IR (cell/(g·h)) | 2.75×10–2 ± 9.39×10–4 | 7.36×10–3 ± 1.94×10–3** | 2.03×10–2 ± 3.65×10–3 | 8.36×10–3 ± 5.10×10–4* |
| 注: *. P < 0.05; **. P < 0.01; I-C.潮间带野生长牡蛎对照组; I-O.潮间带野生长牡蛎酸化组; S-C.潮下带养殖长牡蛎对照组; S-O.潮下带养殖长牡蛎酸化组 | ||||
如表 3所示, 在海水酸化暴露后, 与对照组相比, 潮间带野生长牡蛎鳃组织的ALT、AST、GST和SOD成显著上调(P < 0.05), 而总ATPase、ATP含量、糖原及CAT则出现显著下调(P < 0.05)。与潮间带野生长牡蛎鳃组织在海水酸化暴露后相比, 潮下带养殖长牡蛎鳃组织中总ATPase、糖原和CAT呈现相反的显著上调趋势(P < 0.05), 而MDA和SOD则出现显著下调(P < 0.05)。
| 指标 | I-C | I-O | S-C | S-O | |||||||||||
| G | M | D | G | M | D | G | M | D | G | M | D | ||||
| ALT (U/g蛋白) | 2.66±0.86 | 8.91±3.76 | 2.69±0.96 | 8.14 ± 1.64* | 8.53 ± 3.36 | 7.06±2.84* | 4.83 ± 1.88 | 6.21±1.07 | 17.13±4.29 | 5.78±1.88 | 5.41± 1.86 | 20.06±3.83 | |||
| SDH (U/mg蛋白) | 2.13±0.59 | 1.12±0.26 | 2.94±0.47 | 1.98 ± 0.43 | 1.24 ± 0.22 | 2.93 ± 0.31 | 1.9±0.57 | 0.62 ± 0.14 | 2.17±0.73 | 1.64 ± 0.71 | 1.15±0.43* | 2.24 ± 0.64 | |||
| AST (U/g蛋白) | 37.35 ± 4.60 | 32.32± 8.84 | 33.72±1.96 | 47.63±8.39 * | 33.15±8.65 | 34.31±2.30 | 58.25±7.29 | 30.89±4.45 | 35.84±2.90 | 50.68±1.43 | 29.08±13.83 | 35.25±3.38 | |||
| 总ATPasc (U/mg蛋白) | 1.57±0.51 | 2.25 ± 0.58 | 0.69 ± 0.22 | 0.94±0.24* | 4.18±1.48* | 1.69±0.35** | 1.27 ± 0.25 | 2.33 ± 1.05 | 0.64 ±0.18 | 2.17± 0.7 * | 2.70±1.11 | 0, 52 ± 0.23 | |||
| LDH (U/g蛋白) | 54.14 ± 11.12 | 54.62±21.67 | 58.35± 15.96 | 50.19± 12.69 | 187.75±76.06 * | 39.83± 17.90 | 140.42± 37.56 | 91.28±33.23 | 183.91 ± 89.15 | 111.77 ± 23.13 | 103.96±34.46 | 185.75±56.63 | |||
| ATP (μmol/g蛋白) | 2384.05±669.67 | 25.83 ± 12.51 | 1003.99 ±322.06 | 1567.16±497.18* | 142.41±36.37* | 1578.12±221.94** | 887.10±378.77 | 30.0 ± 8.81 | 406.91± 113.72 | 952.66±408.79 | 19.66±9.26 | 581.82 ± 219.58 | |||
| 糖原含量(mg/g) | 13.59±1.25 | 1.94 ± 0.27 | 16.38 ± 5.14 | 8.59±1.01** | 0.92±0.39** | 6.93±0.53 | 7.43 ± 1.05 | 4.88 ± 2.78 | 17.48±8.18 | 14.91±1.59** | 1.77±0.59* | 12.02 ± 3.78 | |||
| CAT (U/mg蛋白)u | 1.18±0.30 | 9.55±4.72 | 1.12±0.45 | 0.34±0.05** | 9.11±4.03 | 1.09±0.51 | 0.46±0.10 | 5.00±1.07 | 3.01 ±0.95 | 0.61±0.03* | 4.89±1.66 | 2.06+0.84 | |||
| GST (U/mg蛋白) | 6.54 ± 1.08 | 9.89±3.94 | 42.5U5.79 | 54.19± 12.65** | 3.13±1.26* | 54.09± 19.99 | 69.24±11.46 | 2.04±1.01 | 27.62±9.12 | 47.98± 16.97 | 7.28±3.22** | 31.87 ± 14.03 | |||
| MDA(U/mg蛋白) | 5.00±0.95 | 1.08 ± 0.43 | 3.06 ± 0.72 | 5.67 ± 0.57 | 4.36±0.93** | 3.33 ± 0.65 | 7.10±2.02 | 1.25±0.41 | 4.62 ± 2.04 | 4.18±0.22* | 6.55±2.79** | 1.23±0.60 | |||
| SOD (U/mg蛋白) | 197.97± 26.06 | 187.60± 53.86 | 121.46 ± 12.53 | 244.21 ±29.08* | 199.14± 67.57 | 141.49± 10.2* | 237.93± 49.90 | 140.29± 47.09 | 98.08 ± 9.48 | 177.25± 7.38* | 210.43 ±65.98 | 120.2±14.90* | |||
| 注:*.P < 0.05;**.P < 0.01;I-C.潮间带野生长牡蛎对照组;I-O.潮间带野生长牡蛎酸化组; S-C.潮下带养殖长牡蛎对照组; S-O.潮下带养殖长牡蛎酸化组; G.鳃组织; M.外套膜组织; D.消化腺组织 | |||||||||||||||
在海水酸化暴露后, 潮间带野生长牡蛎外套膜组织的总ATPase、LDH、ATP含量和MDA显著高于对照组(P < 0.05);而潮下带养殖长牡蛎外套膜中, SDH、GST、MDA显著高于对照组(P < 0.05), 糖原则显著低于对照组(P < 0.05)。
在海水酸化暴露后, 潮间带野生长牡蛎消化腺组织的ALT、总ATPase、ATP含量和SOD显著上调(P < 0.05), 而在潮下带养殖长牡蛎消化腺组织中, 仅SOD显著高于对照组(P < 0.05), MDA显著低于对照组(P < 0.05)。
上述结果显示, 在海水酸化暴露后, 长牡蛎不同组织中的能量代谢及氧化应激过程存在差异响应变化, 且相关生理指标的变化趋势在潮间带野生与潮下带养殖两种长牡蛎中亦存在差异性。
2.3 PCA分析潮间带野生与潮下带养殖长牡蛎对海水酸化的响应差异分别对海水酸化暴露条件下潮间带野生与潮下带养殖长牡蛎的指标响应变化进行PCA分析, 探究海水酸化对两种长牡蛎各指标的影响差异情况, 同时对所有长牡蛎(总体)进行PCA分析, 在长牡蛎总体范围内评价潮间带野生与潮下带养殖长牡蛎对海水酸化的综合响应差异。首先对各个指标的原始数据进行标准化处理。再提取主成分, 分别提取潮间带野生长牡蛎、潮下带养殖长牡蛎以及长牡蛎总体数据的前4、5及6个主成分, 其累积方差贡献率分别为85.397%、87.611%及87.379%, 说明在变量不丢失的前提下, 提取的主成分能够较为全面地概括数据信息。然后, 通过提取到的主成分计算潮间带野生与潮下带养殖长牡蛎及长牡蛎总体的各指标权重。通过单独群体下各指标的权重来分析潮间带野生与潮下带养殖长牡蛎各指标的影响程度。最后, 通过总体群体下的各指标的权重来计算此两种长牡蛎的综合得分, 综合得分可以反映出两种长牡蛎在海水酸化胁迫下的综合响应程度。
由表 4可知, 海水酸化对潮间带野生与潮下带养殖长牡蛎各个指标的影响程度不同。在潮间带野生长牡蛎中, 各指标的影响权重从大到小排序为:糖原、LDH、MDA、ATPase、GST、SOD、ALT、ATP、CAT、AST及SDH, 而潮下带养殖长牡蛎中各指标的影响权重从大到小排序为: ATP、SDH、ATPase、糖原、MDA、AST、CAT、GST、SOD、LDH及ALT。由上述影响权重可知, 潮间带野生长牡蛎的氧化应激相关指标权重相对较大, 潮下带养殖长牡蛎的能量代谢相关指标权重相对较大, 这表明, 海水酸化暴露条件下, 潮间带野生长牡蛎的氧化应激相关生理过程受影响程度大于潮下带养殖长牡蛎, 而潮下带养殖长牡蛎的能量代谢相关生理过程受影响程度则大于潮间带野生长牡蛎。
| 指标 | 潮间带 | 潮下带 | 总体 |
| ALT | 0.08 | 0.03 | 0.02 |
| SDH | 0.04 | 0.13 | 0.12 |
| AST | 0.05 | 0.10 | 0.14 |
| ATPase | 0.10 | 0.13 | 0.02 |
| LDH | 0.14 | 0.04 | 0.09 |
| ATP | 0.08 | 0.14 | 0.14 |
| 糖原 | 0.15 | 0.13 | 0.04 |
| CAT | 0.08 | 0.06 | 0.11 |
| GST | 0.09 | 0.06 | 0.09 |
| MDA | 0.11 | 0.13 | 0.12 |
| SOD | 0.09 | 0.05 | 0.12 |
利用长牡蛎总体各指标权重计算潮间带野生与潮下带养殖长牡蛎综合得分, 得分越高, 表明越容易受到海水酸化暴露的影响。潮间带野生与潮下带养殖长牡蛎得分分别为0.38和0.12。上述结果显示, 海水酸化暴露对这两种不同生境背景的长牡蛎造成了不同程度上的生理响应差异; 在海水酸化暴露条件下, 潮间带野生长牡蛎可能比潮下带养殖长牡蛎受到了更大的影响。
2.4 PLS-DA分析潮间带野生与潮下带养殖长牡蛎各组织对海水酸化的响应差异对所有海水酸化处理组及对照组构建模型分析, PLS-DA得分图参数显示R2X=0.593, R2Y=0.835和Q2 =0.804, 表明所建模型有效。如图 1所示, 潮间带野生与潮下带养殖长牡蛎不同的组织样本(鳃、外套膜及消化腺)在海水酸化暴露后可完全分开, 这说明长牡蛎能量代谢及氧化应激等生理指标变化可能存在组织间的差异。按照PLS-DA结果列出变量重要性值(VIP), VIP值越大, 说明对样本差异的贡献越大。本研究中, 差异较大(VIP值>1)的指标为: SDH、AST、ATPase、ATP含量、糖原、CAT、GST及SOD, 且上述指标在能量代谢、氧化应激过程中发挥重要作用, 说明潮间带野生与潮下带养殖长牡蛎的鳃、外套膜及消化腺组织可通过调节体内能量代谢、氧化应激过程抵抗海水酸化胁迫, 且潮间带野生与潮下带养殖长牡蛎不同组织应对海水酸化的调节机制可能存在差异。
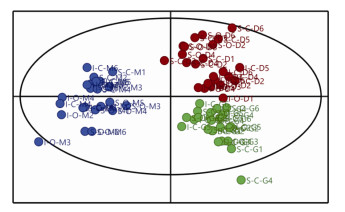 |
| 图 1 长牡蛎总体PLS-DA图 Fig. 1 PLS-DA diagram of all C. gigas 绿色圆点为鳃组织, 蓝色圆点为外套膜组织, 红色圆点为消化腺组织; I-C.潮间带野生长牡蛎对照组; I-O.潮间带野生长牡蛎酸化组; S-C.潮下带养殖长牡蛎对照组; S-O.潮下带养殖长牡蛎酸化组; G.鳃组织; M.外套膜组织; D.消化腺组织 The green dot is the gill tissue, the blue dot is the mantle tissue, and the red dot is the digestive gland tissue; I-C. the control group of intertidal wild-type C. gigas; I-O. the seawater acidification group of intertidal wild-type C. gigas; S-C. the control group of selectively bred C. gigas; S-O. the seawater acidification group of selectively bred C. gigas; G. the gill tissue; M. the mantle tissue; D. the digestive gland tissue |
对潮间带野生与潮下带养殖长牡蛎不同组织及其对照组进行PLS-DA分析, 如图 2所示, 在海水酸化后, 潮间带野生与潮下带养殖长牡蛎的鳃、外套膜及消化腺组织与对照组样本明显分离, 说明海水酸化对潮间带野生与潮下带养殖长牡蛎体内不同组织的能量代谢、氧化应激等相关生理过程造成影响。相较于鳃、消化腺组织, 海水酸化暴露后潮间带野生长牡蛎的外套膜组织样本与对照组样本分布相距更远, 说明海水酸化暴露对潮间带野生长牡蛎外套膜组织能量代谢及氧化应激生理过程影响更为明显。与潮下带养殖长牡蛎各个组织相比, 潮间带野生长牡蛎的鳃、外套膜及消化腺组织的酸化处理样本与对照样本分离更明显, 且分别位于图的不同象限。相较于潮下带养殖长牡蛎, 潮间带野生长牡蛎各个组织的样本分布更为分散。上述分析结果表明, 长牡蛎不同组织对海水酸化存在差异响应, 且相比于鳃及消化腺, 外套膜组织受影响最大。
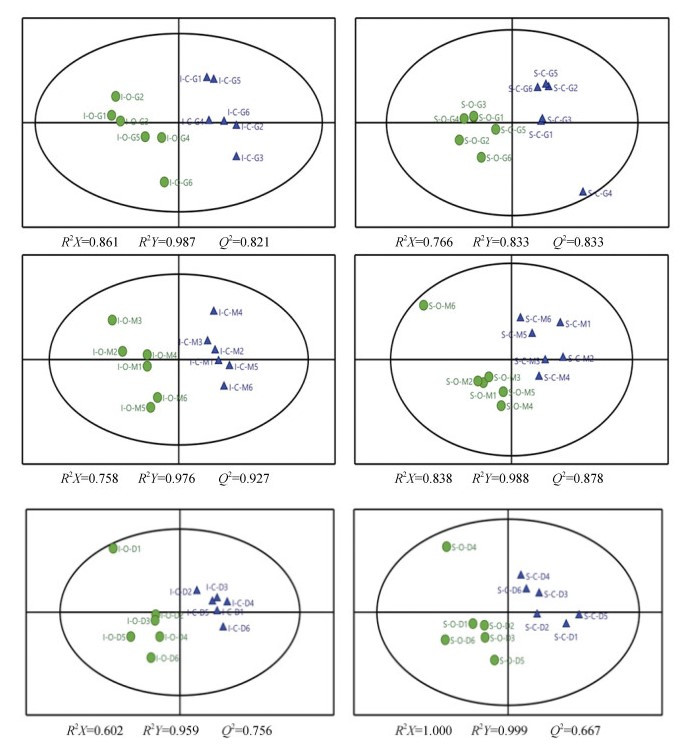 |
| 图 2 潮间带野生与潮下带养殖长牡蛎不同组织的PLS-DA图 Fig. 2 PLS-DA diagrams of different tissues in intertidal wild-type and subtidal selectively bred C. gigas 蓝色三角为对照组, 绿色圆点为海水酸化暴露组; I-C.潮间带野生长牡蛎对照组; I-O.潮间带野生长牡蛎酸化组; S-C.潮下带养殖长牡蛎对照组; S-O.潮下带养殖长牡蛎酸化组; G.鳃组织; M.外套膜组织; D.消化腺组织 The blue triangle is the control group, the green dot is the seawater acidification exposure group; I-C. the control group of intertidal wild-type C. gigas; I-O. the seawater acidification group of intertidal wild-type C. gigas; S-C. the control group of selectively bred C. gigas; S-O. the seawater acidification group of selectively bred C. gigas. G. the gill tissue; M. the mantle tissue; D. the digestive gland tissue |
已有研究显示, 软体动物可通过调控自身的基础代谢活动, 如降低摄食率等, 来应对外界的环境变化[14-16]。本研究中, 海水酸化暴露对潮间带野生与潮下带养殖长牡蛎基础代谢活动(SMR、OCR、IR)均产生了一定程度的影响。相较于潮下带养殖长牡蛎, 潮间带野生长牡蛎基础代谢活动的响应程度更加剧烈, 且多种生理指标出现了更为积极地应对调整, 可能表明其对海水酸化具有更强的适应性。
生理指标的检测显示, 仅ATPase及MDA在潮间带野生与潮下带养殖长牡蛎对照组的比较中均未出现显著差异, 而其他指标在两种长牡蛎间均有差异变化的表现。而海水酸化暴露后, 各种生理指标亦出现了不同的变化响应。说明相同物种的不同群体受不同生存环境影响出现不同的生理响应变化, 且在应对海水酸化暴露时, 亦可通过不同的方式调整体内生理过程, 以应对环境变化的威胁。本实验中的海水酸化暴露过程均是将长牡蛎浸没在水下开展的, 因此, 暴露方法本身可能对潮间带野生长牡蛎就是一种较大的干扰, 另外, 实验材料因为来自于不同长牡蛎群体, 存在其群体遗传背景不同产生系统误差而非生存环境造成差异的可能性, 从而导致两种长牡蛎对照组以及实验组在生理指标上出现了较大的差异变化。
生物机体生命活动的正常进行需要能量来维持, ATP是主要的供能物质, 糖原是能量储备物质[17, 18], 而ALT、SDH、AST、ATPase、LDH则是能量代谢过程中的关键酶类。在潮间带野生长牡蛎中, 海水酸化暴露对ATPase、LDH、糖原影响较大, 表明ATPase水解ATP释放能量、LDH参与的糖酵解和TCA循环及糖原分解供能等能量代谢过程受海水酸化的影响较大[19-21]。而潮下带养殖长牡蛎中, SDH、ATPase、ATP、糖原受影响较大, 这可能是在海水酸化暴露条件下, 潮下带养殖长牡蛎可通过调节机体ATP的浓度, 来保证自身能量供给以抵抗外界海水酸化, 同时SDH、ATPase参与TCA循环, 分解糖原, 调控能量代谢以应对海水酸化的胁迫作用[22-26]。
环境胁迫可使水生动物产生大量的氧自由基, 机体组织中活性氧的增多可诱导抗氧化剂和抗氧化酶体系的反应[27]。氧自由基攻击生物膜可产生脂质过氧化产物—MDA[28], 最终造成生物膜的损伤、渗漏, 甚至细胞的死亡。GST是体内清除自由基的重要酶, 具有清除过氧化物及解毒双重功能[29]。潮间带野生与潮下带养殖长牡蛎的MDA及GST均受到海水酸化暴露的较大影响, 表明海水酸化暴露可造成长牡蛎体内发生脂质过氧化, 同时长牡蛎利用GST清除体内过氧化物, 防止机体损伤。当生物受到外界胁迫后, SOD和CAT可被激活, 清除自由基, 保护细胞内稳态[30]。在海水酸化暴露后, 潮间带野生长牡蛎中SOD受影响程度较大, 而潮下带养殖长牡蛎CAT受影响较大, 表明长牡蛎抗氧化酶系统在应对海水酸化暴露的过程中扮演重要角色。
在海水酸化暴露后, 潮间带野生与潮下带养殖长牡蛎在基础代谢及关键生理过程(能量代谢及氧化应激)上存在差异响应情况。通过PCA分析两种不同生境背景的长牡蛎对海水酸化的响应差异, 表明相比于潮下带养殖长牡蛎, 潮间带野生长牡蛎可能对海水酸化暴露的生理响应更为剧烈。通过PLS-DA分析长牡蛎的不同组织对海水酸化的响应差异, 结果表明不同组织应对海水酸化的调节机制可能存在差异。相比于长牡蛎的鳃及消化腺组织, 外套膜组织受海水酸化的影响更大。
| [1] |
Guinotte J M, Fabry V J. Ocean acidification and its potential effects on marine ecosystems[J]. Ann N Y Acad Sci, 2010, 1134(1): 320-342. |
| [2] |
Liu Y, Peng Z, Zhou R, et al. Acceleration of modern acidification in the South China Sea driven by anthropogenic CO2[J]. Sci Rep, 2014, 4(6): 5148. |
| [3] |
廉伟, 毛玉泽. 长牡蛎养殖技术及常见问题[J]. 现代农业科技, 2010, 5: 302-303. Lian Wei, Mao Yuze. Aquaculture teachniques of Crassostrea gigas and common, problems[J]. Modern Agricultural Science and Technology, 2010, 5: 302-303. |
| [4] |
宋盛亮.长牡蛎不同选育群体间杂交效应及其与环境互作分析[D].青岛: 中国海洋大学, 2011. Song Shengliang. The analysis of effect of crossbreeding among different selected strains and genotype×environment interactions in the Pacific oyster Crassostrea gigas[D]. Qingdao: Ocean University of China, 2011. http://cdmd.cnki.com.cn/article/cdmd-10423-1011230034.htm |
| [5] |
王冬群, 李太武, 苏秀榕. 象山缢蛏养殖群体和野生群体遗传多样性的比较[J]. 中国水产科学, 2005, 2: 138-143. Wang Dongqun, Li Taiwu, Su Xiurong. Comparison of genetic diversity between hatchery stock and wild population of Sinonovacula constricta Lamarck in Xiangshan Bay[J]. Journal of Fishery Sciences of China, 2005, 2: 138-143. DOI:10.3321/j.issn:1005-8737.2005.02.005 |
| [6] |
Wood H L, Sundell K, Almroth B C, et al. Population-dependent effects of ocean acidification[J]. Proceedings of the Royal Society B:Biological Sciences, 2016, 283(1828): 1-7. |
| [7] |
Miller A W, Reynolds A C, Sobrino C, et al. Shellfish face uncertain future in high CO2 world:influence of acidification on oyster larvae calcification and growth in estuaries[J]. Plos One, 2009, 4(5): 1-8. |
| [8] |
Parker L M, Ross P M, Wayne A. O'Connor. Populations of the Sydney rock oyster, Saccostrea glomerata, vary in response to ocean acidification[J]. Marine Biology (Berlin), 2011, 158(3): 689-697. DOI:10.1007/s00227-010-1592-4 |
| [9] |
Thompson E L, O'Connor W, Parker L, et al. Differential proteomic responses of selectively bred and wildtype Sydney rock oyster populations exposed to elevated CO2[J]. Molecular Ecology, 2015, 24(6): 1248-1262. DOI:10.1111/mec.13111 |
| [10] |
Wittmann A C, Pörtner H O. Sensitivities of extant animal taxa to ocean acidification[J]. Nature Climate Change, 2013, 3(11): 995. DOI:10.1038/nclimate1982 |
| [11] |
Timmins-Schiffman E, Coffey W D, Hua W, et al. Shotgun proteomics reveals physiological response to ocean acidification in Crassostrea gigas[J]. BMC Genomics, 2014, 15(1): 951. DOI:10.1186/1471-2164-15-951 |
| [12] |
郑侠飞, 王岩倡. 三角帆蚌耗氧率测定方法的比较[J]. 浙江大学学报(农业与生命科学版), 2013, 39(4): 467-472. Zheng Xiafei, Wang Yanchang. Comparison of methods for measuring oxygen consumption rate of Hyriopsis cumingii[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2013, 39(4): 467-472. DOI:10.3785/j.issn.1008-9209.2013.04.016 |
| [13] |
曹善茂, 梁伟锋, 汪健, 等. 岩扇贝幼贝滤食率的基础研究[J]. 大连海洋大学学报, 2016, 6: 612-617. Cao Shanmao, Liang Weifeng, Wang Jian, et al. Basic study on filtration rate of Crassadoma gigantra larvae[J]. Journal of Dalian Fisheries University, 2016, 6: 612-617. |
| [14] |
Orr J C, Fabry V J, Aumont O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature (London), 2005, 437(7059): 681-686. DOI:10.1038/nature04095 |
| [15] |
Bamber R N. The effects of acidic seawater on three species of lamellibranch mollusc[J]. Journal of Experimental Marine Biology and Ecology, 1990, 143(3): 181-191. DOI:10.1016/0022-0981(90)90069-O |
| [16] |
Dove M C, Sammut J. Impacts of estuarine acidification on survival and growth of Sydney rock oysters Saccostrea glomerata (Gould 1850)[J]. Journal of Shellfish Research, 2007, 26(2): 519-528. DOI:10.2983/0730-8000(2007)26[519:IOEAOS]2.0.CO;2 |
| [17] |
贾秀琪, 张宏叶, 王丽. 低氧胁迫对河川沙塘鳢抗氧化酶及ATP酶活性的影响[J]. 海洋渔业, 2017, 39(3): 306. Jia Xiuqi, Zhang Hongye, Wang Li. Effect of hypoxia stress on the antioxidant enzyme and ATP enzyme activity in tissues of Odontobutis potamophila[J]. Marine Fisheries, 2017, 39(3): 306. DOI:10.3969/j.issn.1004-2490.2017.03.008 |
| [18] |
吕子豪, 王春燕, 林同. 黄野螟糖原磷酸化酶基因的时空表达动态及其对温度胁迫的响应[J]. 南京农业大学学报, 2019, 42(2): 276-283. Lv Zihao, Wang Chunyan, Lin Tong. Temporal and spatial expression dynamics of glycogen phosphorylase gene and its response to temperature stress in Heortia vitessoides[J]. Journal of Nanjing Agricultural University, 2019, 42(2): 276-283. |
| [19] |
Liquori G E, Zizza S, Mastrodonato M, et al. Pepsinogen and H, K-ATPase mediate acid secretion in gastric glands of Triturus carnifex (Amphibia, Caudata)[J]. Acta histochemica, 2005, 107(2): 133-141. DOI:10.1016/j.acthis.2005.03.002 |
| [20] |
Kaplan J H. Biochemistry of Na, K-ATPase[J]. Annual Review of Biochemistry, 2002, 71(1): 511-535. DOI:10.1146/annurev.biochem.71.102201.141218 |
| [21] |
侯若冰, 陈志达, 卞江, 等. L-乳酸脱氢酶催化反应机理的理论研究进展[J]. 化学通报, 2000, 63(1): 15-21. Hou Ruobing, Chen Zhida, Bian Jiang, et al. Research progress on the mechanism of L-lactate dehydrogenase catalysis[J]. Chemistry Bulletin, 2000, 63(1): 15-21. DOI:10.3969/j.issn.0441-3776.2000.01.004 |
| [22] |
Garg A D, Krysko D V, Verfaillie T, et al. A novel pathway combining calreticulin exposure and ATP secretion in immunogenic cancer cell death[J]. World J Gastroenterol, 2016, 22(11): 3186-3195. DOI:10.3748/wjg.v22.i11.3186 |
| [23] |
阮飞腾, 高森, 李莉, 等. 山东沿海魁蚶繁殖周期与生化成分的周年变化[J]. 水产学报, 2014, 38(1): 47-55. Ruan Feiteng, Gao Sen, Li Li, et al. Gonad development and biochemical composition in the ark shell Scapharca broughtonii from coast of Shandong Peninsula[J]. Journal of Fisheries of China, 2014, 38(1): 47-55. |
| [24] |
Ke Q Z, Li Q. Annual dynamics of glycogen, lipids, and proteins during the reproductive cycle of the surf clam Mactra veneriformis from the north coast of Shandong Peninsular, China[J]. Invert Reprod Develop, 2013, 57(1): 49-60. DOI:10.1080/07924259.2012.664174 |
| [25] |
Pogoda B, Buck B H, Saborowski R, et al. Biochemical and elemental composition of the offshore-cultivated oysters Ostrea edulis and Crassostrea gigas[J]. Aquaculture, 2013, 400-401(6): 53-60. |
| [26] |
Rutter J, Winge D R, Schiffman J D. Succinate dehydrogenase-assembly, regulation and role in human disease[J]. Mitochondrion, 2010, 10(4): 393-401. DOI:10.1016/j.mito.2010.03.001 |
| [27] |
Borgeraas J. UV-B induced mortality and antioxidant enzyme activities in Daphnia magna at different oxygen concentrations and temperatures[J]. Journal of Plankton Research, 2000, 22(6): 1167-1183. DOI:10.1093/plankt/22.6.1167 |
| [28] |
王妤, 庄平, 章龙珍, 等. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J]. 水产学报, 2011, 35(1): 66-73. Wang Yu, Zhuang Ping, Zhang Longzhen, et al. Effects of salinity on survival, growth and antioxidant defense system of Siganus guttatus[J]. Journal of Fisheries of China, 2011, 35(1): 66-73. |
| [29] |
郭飞, 刘军. Ebselen对耐力训练大鼠GST、CAT和LDH表达的影响[J]. 西安体育学院学报, 2009, 26(5): 585-588. Guo Fei, Liu Jun. Action of Ebselen on expression of GST、CAT、LDH induced by High-intensity andendurance-training rat[J]. Journal of Xi'an Institute of Physical Education, 2009, 26(5): 585-588. DOI:10.3969/j.issn.1001-747X.2009.05.019 |
| [30] |
Pipe R K, Porte C, Livingstone D R. Antioxidant enzymes associated with the blood cells and haemolymph of the mussel Mytilus edulis[J]. Fish & Shellfish Immunology, 1993, 3(3): 221-233. |
 2020, Vol. 44
2020, Vol. 44


