文章信息
- 王瑞旋, 王江勇, 李韵萍, 郭子晗, 李炳, 李云, 朱慧. 2020.
- WANG Rui-xuan, WANG Jiang-yong, LI Yun-ping, GUO Zi-han, LI Bing, LI Yun, ZHU Hui. 2020.
- 致病性海洋弧菌对氨基糖苷类药物的耐药传递机制初步研究
- Primary research on the transmission mechanism of resistance to aminoglycoside for pathogenic marine Vibrio strains
- 海洋科学, 44(10): 81-90
- Marine Sciences, 44(10): 81-90.
- http://dx.doi.org/10.11759/hykx20191221002
-
文章历史
- 收稿日期:2019-12-21
- 修回日期:2020-03-01
2. 中国水产科学研究院南海水产研究所, 广东 广州 510300;
3. 华南师范大学, 广东广州 510631;
4. 加尼福利亚浸会大学, 美国 加利福尼亚 92504
2. South China Sea Fisheries Research Institute, Guangzhou 510300, China;
3. South China Normal University, Guangzhou 510631, China;
4. California Baptist University, California 92504, USA
随着水产养殖业的不断发展, 病害问题愈演愈烈。其中, 弧菌病作为最早被发现且危害最严重的水生传染性疾病之一, 已日渐成为人们关注的焦点。迄今为止, 已发现的病原弧菌有哈维弧菌Vibrio harveyi、溶珊瑚弧菌V. alginolyticus、鳗弧菌V. anguillarum、副溶血弧菌V. parahaemolyticus、灿烂弧菌V. splendidus、杀鲑弧菌V. salmonicida、创伤弧菌V. vulnificus等。其中, 在海水养殖病害事件中, 哈维弧菌已成为出现频率最高的致病菌之一[1-2], 或以病原的身份存在, 或扮演“帮凶”角色引起海水动物包括鱼、虾、贝类的感染[3-9], 给养殖户带来了严重的经济损失, 同时也是人类的条件致病菌[10], 其中有大约5%的哈维弧菌可同时引起人类感染发病[11]。溶珊瑚弧菌是海水中的正常菌群之一, 其数量居于海洋弧菌之首, 它广泛分布于世界各地海水及河口处, 同时还大量分布于多种海洋动物中, 是多种海水养殖动物的条件致病菌。塔氏弧菌V. tubiashii也是典型的条件致病菌, 广泛分布于养殖环境中, 可引起牡蛎、象拔蚌、蛤蜊等软体动物甚至珊瑚等暴发疾病[12-14], 如Hasegawa等发现塔氏弧菌可使太平洋牡蛎Crassostrea gigas幼虫致死[15], 而Séré等则发现西印度洋中珊瑚所患的白斑综合征由塔氏弧菌所导致[16]。目前抗菌药物治疗仍是防治水产养殖动物细菌性病害的主要措施。而养殖生产实践中, 渔药的使用存在乱用、滥用等现象[17], 药物残留及药物的选择压力致使细菌基因突变或耐药基因转移从而产生耐药性, 最终导致抗菌药物的治疗效果减弱甚至无效[18], 抗生素的不科学使用正是导致耐药性的主要原因[19]。菌株的耐药性不仅能通过基因水平传播, 还能在相同或不同种属的细菌之间传播, 从而增加了水产养殖鱼类细菌性病害的防治难度, 并可能使得水产养殖鱼类细菌性病害面临药物治疗无效的结果。细菌的耐药性不仅对水产养殖户造成经济损失, 而且对人类健康造成严重的威胁。研究表明, 水产养殖动物细菌有将耐药性传递给人类细菌的可能性, 耐药质粒的传递作用使得水产养殖鱼类病原菌与大肠杆菌可相互传递耐药质粒, 威胁着人类健康[20]。此外, 食源性病原菌耐药同样威胁着人类健康, 且已有研究表明水产品中食源性致病菌广泛存在耐药现象[21]。
目前有28种以上抗菌药物被允许使用于水产养殖中, 几乎囊括了所有抗菌素类药物。作为广谱抗生素, 氨基糖苷类抗菌药物除了应用于人类疾病的治疗, 还常被应用于家畜和水产养殖业。随着应用的增多, 水生细菌对这类药物也产生了广泛的耐药性。有研究表明, 来源于河口水体、沉积物或养殖鱼类的水生弧菌对庆大霉素和链霉素等氨基糖苷类药物表现耐药性[22]。水生细菌耐药现象已不容忽视, 由于水环境中微生物的复杂性及水流的动力, 更利于细菌之间的接触从而使其更易于互相传递耐药性。耐药质粒的水平转移是自然界中细菌产生耐药性最主要、最常见的方式, 由耐药质粒介导的耐药性正朝着多重耐药方向发展。本文通过对致病弧菌的氨基糖苷类耐药基因进行检测和分析, 并将相关质粒转入大肠杆菌中使其对氨基糖苷类药物的敏感性大大降低, 本研究将为环境弧菌与临床细菌对氨基糖苷类药物的抗性传递研究提供数据基础和参考依据。
1 材料与方法 1.1 材料来源菌株来源: 7株受试菌由中国水产科学研究院南海水产研究所渔病室分离保存, 均为革兰氏阴性菌, 具体如下:编号BBX1:致使方斑东风螺Babylonia areolata患“肿吻症”而急性死亡的哈维弧菌[23-24], 编号BV2和9H7:均是引起鲍脓疱症的哈维弧菌[8]; 编号B2D:引起鲍肌肉萎缩症的哈维弧菌[25]; 编号BBXP1:使方斑东风螺死亡的塔氏弧菌; 编号NA0301:使杂色鲍鲍苗大规模脱落死亡的溶珊瑚弧菌[26]; 编号TO1:引起卵形鲳鲹Trachinotus ovatus结节病的美人鱼发光杆菌杀鱼亚种Photobacterium damselae subsp. piscicida[27]; 受体菌株:大肠杆菌Escherichia coli ATCC25922。同时以大肠杆菌ATCC25922、金黄色葡萄球菌Staphylococcus aureaus ATCC25923为质控菌株。
培养基:水解酪蛋白(Mueller-Hinton, 简称MH)琼脂培养基、MH液体培养基、营养琼脂培养基、营养肉汤培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖(Thiosulfate citrate bile salts sucrose, 简称TCBS)琼脂培养基、细菌基础培养基(Luria-Bertani, 简称LB)液体培养基(购自环凯生物科技有限公司)。
抗生素纸片:青霉素(10 U/片)、呋喃唑酮(300 μg/片)、庆大霉素(10 μg/片)、卡那霉素(30 μg/片)、新霉素(30 μg/片)、红霉素(15 μg/片)、四环素(30 μg/片)、多西环素(30 μg/片)、利福平(5 μg/片)、诺氟沙星(10 μg/片)、恩诺沙星(10 μg/片)、氧氟沙星(5 μg/片)、氯霉素(30 μg/片)、复方新诺明(10 μg/片)均购自北京天坛药物生物技术开发公司; 卡那霉素药粉、新霉素药粉均购自广州威佳科技有限公司。
试剂盒及PCR试剂及引物:高纯质粒DNA微量提取试剂盒(离心柱法)、细菌基因组DNA提取试剂盒(离心柱法)和DNA纯化试剂盒(离心柱法)(购自广州吉瑞基因科技有限公司), 6×buffer、PCRmix、ddH2O和Marker(购自宝生物工程有限公司)。
1.2 药敏测试以实验室保存的受试菌为研究对象, 采用纸片扩散法(Kirby-Bauer, 简称K-B法), 根据CLSI标准及相关文献进行操作[28-29]。用无菌生理盐水洗脱于斜面培养基上于28℃培养24 h的菌苔, 稀释至菌悬液浓度约为1×108 CFU/mL, 吸取100 μL菌悬液均匀涂布在MH琼脂培养基上(培养皿直径9 cm, 培养基厚度约4 mm), 涂布后在室温下放置15~30 min, 待菌液被吸收, 用无菌镊子夹取抗生素纸片贴在培养基表面, 每个平板放置5张药敏纸片, 纸片与培养皿边界距离>1.0 cm, 相邻纸片距离≥2.0 cm, 然后将平板在28℃生化培养箱中倒置培养24 h, 测量抑菌圈直径, 根据表 1和表 2判断不同菌株对不同抗菌药物的敏感程度:敏感(S)、中度耐药(I)、耐药(R)。
| 抗生素 | 纸片上药物含量/μg | 大肠杆菌/mm | 金黄色葡萄球菌/mm |
| 青霉素Penicillin | 10 | - | - |
| 呋喃唑酮Furazolidone | 300 | 20~25 | 18~22 |
| 庆大霉素Gentamicin | 10 | 19~26 | 19~27 |
| 卡那霉素Kanamycin | 30 | 17~25 | 19~26 |
| 新霉素Neomycin | 30 | - | - |
| 红霉素Erythromycin | 15 | - | 22~30 |
| 四环素Tetracycline | 30 | 18~25 | 24~30 |
| 多西环素Doxycycline | 30 | 18~24 | 23~29 |
| 利福平Rifampicin | 5 | 8~10 | 26~34 |
| 诺氟沙星Norfloxacin | 10 | 28~35 | 17~28 |
| 恩诺沙星Enrofloxacin | 10 | 28~36 | 22~28 |
| 氧氟沙星Ofloxacin | 5 | 29~33 | 24~28 |
| 氯霉素Chloramphenicol | 30 | 21~27 | 19~26 |
| 复方新诺明Sulfamethoxazole | 30 | 24~32 | 24~32 |
| 抗菌药物 | 判定标准-抑菌圈直径/mm | |||
| 耐药(R) | 中度耐药(I) | 敏感(S) | ||
| β-内酰胺类 | 青霉素 | - | - | - |
| 硝基呋喃类 | 呋喃唑酮 | ≤15 | 15~16 | ≥16 |
| 氨基糖苷类 | 庆大霉素 | ≤12 | 13~14 | ≥15 |
| 卡那霉素 | ≤13 | 14~17 | ≥18 | |
| 新霉素 | ≤12 | 13~16 | ≥17 | |
| 大环内酯类 | 红霉素 | ≤14 | 14~22 | ≥22 |
| 四环素类 | 四环素 | ≤15 | 15~18 | ≥18 |
| 多西环素 | ≤13 | 13~15 | ≥15 | |
| 利福霉素类 | 利福平 | ≤17 | 17~19 | ≥19 |
| 喹诺酮类 | 诺氟沙星 | ≤13 | 13~16 | ≥16 |
| 恩诺沙星 | ≤13 | 13~16 | ≥16 | |
| 氧氟沙星 | ≤13 | 13~15 | ≥15 | |
| 氯霉素类 | 氯霉素 | ≤13 | 13~17 | ≥17 |
| 磺胺类 | 复方新诺明 | ≤13 | 13~16 | ≥16 |
挑取活化的受试菌单菌落分别接种于含有2% NaCl的35 mL营养肉汤培养基中, 28℃摇床培养过夜, 分别按照高纯质粒DNA微量提取试剂盒和细菌基因组DNA提取试剂盒操作步骤进行操作, 分别获得质粒DNA和基因组DNA, 进一步回收DNA后用纯化试剂盒进行纯化。根据GENBANK中aph(3′)-IIa的碱基序列进行耐药基因扩增引物的设计, 并采用聚合酶链式反应法对耐药基因进行扩增。引物序列见表 3, PCR反应体系见表 4。PCR反应条件为: 94℃预变性2 min, 94℃变性50 s, 60℃退火45 s, 72℃延伸1 min, 35个循环, 72℃保持5 min, 4℃保存。
| 耐药基因 | 引物名称 | 引物序列(5′-3′) | Tm值/℃ | 目的片段/bp | GenBank登陆号 |
| aph(3′)-Ⅱa | aph(3′)-ⅡaF | TGACTGGGCACAACAGACAA | 57.5 | 677 | AY222814 |
| aph(3′)-ⅡaR | CGGCGATACCGTAAAGCAC | 59.2 |
| 组成 | 用量/μL |
| Mix | 12.5 |
| ddH2O | 9.5 |
| For Primer | 1 |
| Rev Primer | 1 |
| Template | 1 |
| Total | 25 |
将大肠杆菌标准株的新鲜菌落接种于10 mL的LB培养基中, 摇床200 r/min、37℃培养过夜。按照1︰20的比例, 将过夜培养菌液转接于100 mL的LB液体中, 摇床200 r/min、37℃培养3~5小时, 至OD600吸光值为0.5~0.8, 将菌液放置于冰上冷却10 min。将冷却后的菌液于4℃转速5 000×g离心10 min, 弃上清, 用35 mL预冷的ddH2O重悬细菌沉淀。将细菌悬液于4℃转速5 000×g离心10 min, 弃上清, 用35 mL预冷的甘油重悬细菌沉淀。将细菌悬液于4℃转速5 000×g离心10 min, 弃上清, 加入1 mL 10%甘油, 用1.5 mL离心管分装成100 μL/管, 由此获得大肠杆菌感受态细胞, 置于–80℃保存备用。将0.4 mL电击杯放于冰上预冷, 冻存的感受态细胞于冰上冻融。在冰上将5 μL质粒(4 ng/μL)加入到30 μL感受态细胞中, 并在冰上培育5 min。将质粒与感受态细胞的混合液加入到预冷的电击杯中, 去除电击杯中的气泡, 冰浴10 min。擦干电击杯外壁上的水, 电击。电击条件: 2.5 kV, 200Ω, 25 μF。听到蜂鸣声后迅速将1 mL 37℃保温的LB培养基加入到电击杯中(1 min之内), 并在无菌操作台中将混合液转移到1.5 mL EP管中(室温进行)。将混合液于220 r/min摇床37℃培养2 h, 吸取100 μL转化液均匀涂布在加入新霉素的营养琼脂平板上(新霉素浓度: 10 ng/mL, 室温放置待液体吸收后, 在37 ℃生化培养箱中倒置培养24 h后观察菌落生长状况。
重组质粒的鉴定:挑取转化平板上的单菌落接种到35 mL含有新霉素的营养肉汤培养基中, 37℃摇床培养过夜。取1~7 mL菌悬液于2 mL EP管中, 10 000×g离心1 min, 收集菌体沉淀。使用高纯质粒DNA微量提取试剂盒获得质粒DNA并保存于–20℃备用。利用聚合酶链式反应对重组质粒新霉素耐药基因aph(3′)-Ⅱa进行扩增以鉴定, 反应体系同表 5。
| 样品类型 | BBX1 | BBXP1 | TO1 | NA0301 | BV2 | B2D | 9H7 |
| 质粒DNA | + | + | – | + | – | + | + |
| 基因组DNA | - | - | - | - | + | + | - |
以新霉素对大肠杆菌的最小抑菌浓度(Minimum inhibitory concentration, 简称MIC)和最小杀菌浓度(Minimum bactericidal concentration, 简称MBC)为对照组, 分别测定新霉素对三株受试菌(BBX1、BBXP1、NA0301)的MIC值和MBC值, 设平行组。方法如下:取无菌2 mL EP管13支排成一排, 依次编号1、2、3、4、5、6、7、8、9、10、11、12、13。向每支EP管中加入1 mL MHA液体培养基, 在1号管中加入浓度为256 μg/mL新霉素1 mL混匀, 然后吸取1 mL匀液至2号管中, 混匀后再吸取1 mL匀液l至3号管中, 以此类推, 连续倍比稀释至11号管, 且从11号管吸取1 mL匀液弃去。12号管为不含新霉素的生长对照管, 13号管为阴性对照管。此时, 1—11号管的药物浓度依次为128、64、32、16、8、4、2、1、0.5、0.25、0.125 μg/mL。然后在1—12号管加入浓度约为107 CFU/mL的菌液10 μL, 使各管最终菌液浓度约105~106 CFU/mL。将各管放置在200 r/min摇床37 ℃培养24 h后观察结果。测定卡那霉素对受试菌的MIC的方法同上。然后, 取出肉眼观察到无细菌生长最低3个浓度(包括MIC)的EP管, 用移液枪吹打EP管中的培养液使其混匀, 并吸取100 μL培养液均匀涂布在MH琼脂平板上, 在常温下放置5~10 min待培养液被培养基完全吸收, 将平板在37 ℃下恒温倒置培养24 h, 对平板进行菌落计数, 并与对照组比较, 以与对照组平板菌落数差异显著的药物梯度浓度判定为受试药物对相应测试菌株的MIC值, 以无菌生长对应的药物梯度浓度判定为受试药物对相应测试菌株的MBC值。
2 结果分析 2.1 水产致病性弧菌的耐药率及质粒检测结果根据表 2的药敏实验判定标准, 对7株受试菌针对8类共14种抗菌药物的敏感性进行判断, 7株受试菌均表现耐药(如图 1), 其中编号B2D的菌株对受试的14种药物均表现为耐药(即对受试药物耐药比例为100%), 7株受试菌均对3类以上抗生素表现耐药, 多重耐药率为100%;且7个菌株均对受试的氨基糖苷类药物(包括庆大霉素、新霉素和卡那霉素)表现中度耐药和完全耐药。
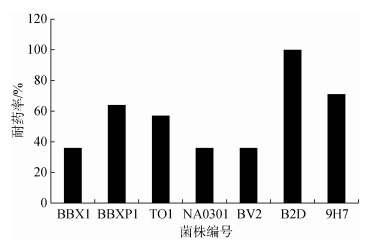 |
| 图 1 水产致病菌药物耐药率分析 Fig. 1 Antimicrobial susceptibility test for 7 bacteria from aquaculture |
将药敏实验所筛选得到的耐药菌通过质粒提取试剂盒的处理, 分析质粒携带情况(如图 2)结果发现, 7株受试菌均携带质粒, 质粒携带率为100%, 每株受试菌携带质粒大小约为1 kb, 均为小型质粒。
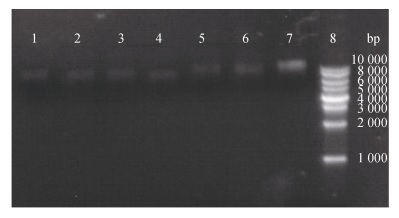 |
| 图 2 耐药菌质粒电泳图 Fig. 2 Electrophoresis of resistant bacteria plasmid 注: 1: TO1, 2: BBXP1, 3: BBX1, 4: NA0301, 5: BV2, 6: B2D, 7: 9H7, 8: DNA Marker(10 000 bp) |
用ddH2O代替质粒DNA作为阴性对照, 以质粒DNA和基因组DNA作为模板, 对氨基糖苷类耐药基因aph(3′)-Ⅱa进行PCR扩增。质粒DNA耐药基因扩增结果如图 3所示, 受试菌BBX1、BBXP1、NA0301、9H7均分别扩增出677 bp的特异性片段且无其他杂带出现。以相应菌株的基因组DNA为模板进行耐药基因的扩增, 如图 4所示, 上述4株菌中的BBX1、BBXP1和NA0301未扩增出耐药基因片段。677 bp的耐药基因在受试菌的质粒DNA及基因组DNA检出结果如表 5所示。
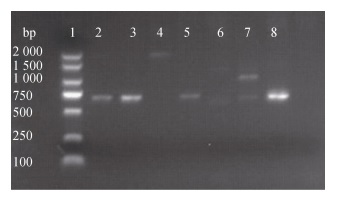 |
| 图 3 质粒DNA耐药基因aph(3′)-Ⅱa PCR产物电泳结果 Fig. 3 Electrophoresis of PCR-amplified resistant gene aph(3′)-Ⅱa in plasmid DNA 注: 1: DNA Marker (2 000 bp), 2: BBX1, 3: BBXP1, 4: TO1, 5: NA0301, 6: BV2, 7: B2D, 8: 9H7, 9:空白对照) |
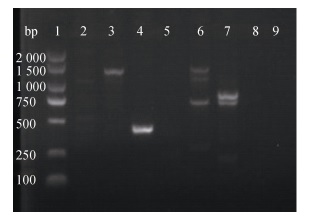 |
| 图 4 基因组DNA耐药基因aph(3′)-Ⅱa PCR产物电泳结果 Fig. 4 Electrophoresis of PCR-amplified resistant gene aph(3′)-Ⅱa in genome DNA 1: DNA Marker (2 000 bp), 2: BBX1, 3: BBXP1, 4: TO1, 5: NA0301, 6: BV2, 7: B2D, 8: 9H7, 9:空白对照 |
对在质粒DNA上检测出特异片段同时在相应基因组DNA上未检出特异片段的3株受试菌(BBX1、BBXP1和NA0301)进行耐药基因测序, 用DNAstar MegAlign软件对耐药基因测序结果进行分析, 结果表明BBX1、BBXP1、NA0301中的aph(3′)-Ⅱa耐药基因与GenBank中的序列(登录号: AY222814)同源性分别为99.1%、99.5%、99.5%, 表明引物特异性较高, 所扩增到的片段为aph(3′)-Ⅱa基因(图 4), 提示受试菌aph(3′)-Ⅱa耐药基因位于质粒DNA上, 参与介导受试菌对新霉素的抗性。
2.2 重组质粒的鉴定将3株受试菌的耐药质粒用电转化法分别转移进受体菌大肠杆菌中, 形成转化子。以弧菌质粒DNA为模板作为阳性对照, 以大肠杆菌质粒DNA为模板作为阴性对照, 以ddH2O代替质粒DNA作为空白对照, 以转化子(分别命名为BBX1-大肠、BBXP1-大肠、NA0301-大肠)的质粒DNA作为模板, 对氨基糖苷类耐药基因aph(3′)-Ⅱa进行PCR扩增。扩增结果如图 5所示, 3株转化子均扩增出677 bp的特异性片段。通过DNAstar MegAlign软件对耐药基因测序结果进行分析, 结果表明转化子BBX1-大肠、BBXP1-大肠、NA0301-大肠中的aph(3′)-Ⅱa耐药基因与GenBank中的序列(登录号: AY222814)同源性分别为95.5%、99.2%、99.2%, 可表明扩增到的片段为aph(3′)-Ⅱa基因。而以大肠杆菌标准株质粒DNA为模板的阴性对照未扩增出特异性片段(如图 5), 说明受体菌大肠杆菌标准株不含有耐药基因aph(3′)-Ⅱa, 即3株受试菌中的耐药质粒成功转移到受体菌大肠杆菌标准株中。
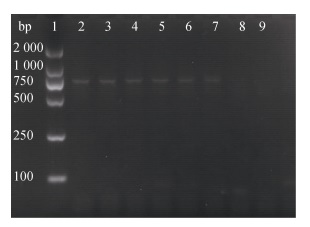 |
| 图 5 耐药质粒电转产物电泳结果 Fig. 5 Electrophoresis of PCR-amplified resistant gene after electroporation 注: 1: DNA Marker(2 000 bp), 2: BBX1, 3: BBXP1, 4: NA0301, 5: BBX1-大肠, 6: BBXP1-大肠, 7: NA0301-大肠, 8:大肠杆菌标准株, 9:空白对照 |
用肉汤稀释法测定MIC及MBC, 结果如图 6所示, 新霉素对大肠杆菌标准株及转化子(BBX1-大肠, BBXP1-大肠, NA0301-大肠)的MIC分别为2 ng/μL、4 ng/μL、4 ng/μL、4 ng/μL, 新霉素对大肠杆菌标准株及转化子(BBX1-大肠, BBXP1-大肠, NA0301-大肠)的MBC分别为4 ng/μL、16 ng/μL、6±2 ng/μL、8 ng/μL; 卡那霉素对大肠杆菌标准株及其转化子(BBX1-大肠, BBXP1-大肠, NA0301-大肠)的MIC分别为8 ng/μL、16 ng/μL和32 ng/μL、16 ng/μL, 卡那霉素对大肠杆菌标准株及转化子(BBX1-大肠, BBXP1-大肠, NA0301-大肠)的MBC分别为16 ng/μL、32 ng/μL、32 ng/μL、32 ng/μL。结果显示, 新霉素和卡那霉素对大肠杆菌标准株的MIC及MBC均低于3株转化子对相应抗菌药物的MIC及MBC。大肠杆菌标准株和3株转化子对新霉素抗性的差异表明3株受试菌中的耐药质粒成功转移到大肠杆菌标准株中, 且介导大肠杆菌标准株对新霉素及卡那霉素的耐药机制, 使大肠杆菌标准株对新霉素及卡那霉素的敏感性降低。
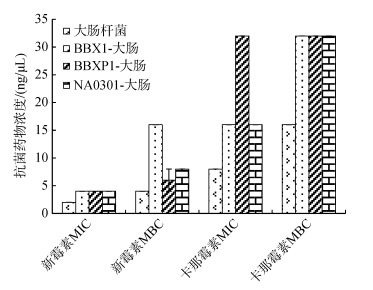 |
| 图 6 大肠杆菌电转前后对新霉素和卡那霉素抗性的对比 Fig. 6 Comparison of neomycin and kanamycin resistance between E.coli and the transformants |
海水养殖环境源的弧菌群的耐药状况不容忽视, 部分地区海水弧菌对单种药物的耐药率最高达到90%以上[30], 部分养殖贝类中弧菌的多重耐药率高达70%以上[29]。众所周知, 海洋弧菌属于条件致病菌, 广泛存在于水环境中及养殖动物体内。有研究表明弧菌基因组上隐藏着随时可被插入耐药基因片段的整合子[31], 加上水体环境非常利于微生物之间的接触, 更利于菌群间互相交换传递耐药因子[32], 从而使弧菌更易表现多重耐药性。而致病菌的耐药性传播和扩散不仅严重影响多种药物在兽医临床的治疗效果, 且耐药菌群很可能借助动物宿主通过食物链、环境或直接接触等与人类临床病原菌进行传递, 特别是人畜/人鱼共患致病菌的耐药性, 更给人类医疗带来压力[33]。本研究中来源于重要养殖贝类的7株弧菌均表现多重耐药, 4株弧菌对6类及以上抗菌药物耐药, 1株弧菌对8类共14种抗菌药物耐药, 多重耐药率为100%。
耐药质粒的转移不仅使得耐药菌的数量在世界范围急剧增加, 更介导着耐药菌往多重耐药方面发展。已有研究表明仅通过混合培养即可将耐药质粒从大肠杆菌向水生病原弧菌转移, 且可使四环素对受体弧菌的MIC值大大提高[34]。本研究中仍以大肠杆菌标准株为受体菌, 以质粒上携带氨基糖苷类耐药基因aph(3′)-Ⅱa的哈维弧菌、溶珊瑚弧菌和塔氏弧菌为供体菌, 采用电击转化的方法实现耐药质粒的转移, 所测得转化子的MIC值和MBC值均提高了2~4倍, 显示3株转化子对新霉素及卡那霉素敏感性均低于大肠杆菌对相应抗菌药物的敏感性, 且在转化子质粒上检测到了目的片段, 表明3株供体菌的耐药质粒成功转移到受体菌中, 且质粒参与介导受体菌对新霉素和卡那霉素的抗性。然而, 转化子并未到达完全耐药的表型。可能由于受试菌对氨基糖苷类抗菌药物耐药性除了耐药质粒介导之外, 还存在其他耐药机制的共同作用。另一方面, 也可能是对受体菌做电转化后, 未进行持续的诱导实验, 使得耐药质粒上的耐药基因未能对作用底物(抗菌药物)产生修饰作用, 抗菌药物仍能与细菌细胞中16S rRNA上的A位点相结合, 从而抑制细菌蛋白的合成, 使细菌对抗菌药物仍存在一定敏感性, 可通过基因敲除、耐药质粒消除等手段进行进一步的验证。本研究中虽以电击转化方式进行实验以缩短反应时间, 而笔者也曾通过混合培养方法(接合反应)将鲍病原哈维弧菌的耐质粒转入大肠杆菌中, 使受体菌由初始对磺胺类药物高度敏感转变为完全耐药, 并获得对应耐药质粒的全序列(全长10 940 bp)[35], 提示水产养殖病原菌耐药株携带的耐药基因向大肠杆菌传递的过程中, 转化方式不受限制。而已有报道在对志贺菌属细菌质粒的研究中发现了多重耐药的广宿主接合质粒, 该质粒可介导大肠杆菌与志贺菌属细菌之间耐药性的水平传递, 且具有头孢类及单环内酰类的耐药基因[36]。相关研究表明能传递耐药基因的质粒中, 存在能够在不同种类的细菌之间传递的广宿主接合质粒[37-38]。值得关注的是, 大肠杆菌常被作为模式菌株, 与弧菌的生长条件差异较大, 但二者之间可通过质粒传递耐药性, 该结果提示环境菌群很可能在特定条件下将自身的耐药性传递至临床菌种, 甚至包括部分人类病原菌。近年来, 氨基糖苷类药物尤其是新霉素和卡那霉素被世界卫生组织认为是临床极其重要的药物[39]。笔者在前期的耐药分析中发现了水产养殖病原菌对新霉素和卡那霉素存在较强的耐药性(7个受试株均存在不同程度的耐药性), 而氨基糖苷磷酸酶基因aph(3′)-IIa主要抑制卡那霉素和新霉素的活性, 虽然APH (3′)-IIa的主要氨基糖苷底物是卡那霉素和新霉素, 但这种磷酸转移酶在体外也能灭活阿米卡星, 即使其转化速度较慢[40], 依然存在耐药传播风险。以往的研究表明, aph(3′)-IIa最初被认为是转座子Tn5的组成部分[41], 由于Tn5不携带传递功能信息, 因此通常遵循垂直遗传模式[40], 后期的研究认为氨基糖苷类修饰基因具有通过水平转移进行传播的潜力[43]。然而, 国内外对这种磷酸转移酶相关重要基因aph(3′)-IIa的研究很不足, 国内相关报道甚少, 仍有很多问题未明晰。本研究不仅明确了aph(3′)-Ⅱa基因存在于受试水生病原弧菌的质粒上并参与介导菌株对新霉素和卡那霉素的耐药性, 且首次确认了特定条件下(如通过电击转化)该基因可由水产病原菌传递至大肠杆菌, 因此, 本研究结果可为耐药菌中耐药质粒的消除提供依据, 为预防水生环境病原菌与临床病原菌株之间耐药性的传递机制研究提供参考。
4 结论本研究通过对多个水产致病弧菌(包括引起方斑东风螺、鲍发病的哈维弧菌、塔氏弧菌、溶珊瑚弧菌及卵形鲳鲹结节病病原美人鱼发光杆菌杀鱼亚种)质粒上新霉素和卡那霉素对应耐药基因aph(3′)-IIa进行检测分析, 并利用电穿孔法将筛选得到的哈维弧菌、塔氏弧菌和溶珊瑚弧菌3个受试病原菌株上的质粒分别转入大肠杆菌标准株中, 进一步的药敏测试结果显示, 3株转化子对新霉素及卡那霉素敏感性均明显低于受试大肠杆菌标准株对相应抗菌药物的敏感性(转化子的MIC值和MBC值均提高了2~4倍), 且在转化子质粒上检测到了目的片段。本研究明确了aph(3′)-Ⅱa基因存在于受试水生病原弧菌的质粒上并参与介导菌株对新霉素和卡那霉素的耐药性, 且首次确认了特定条件下该基因可由水产病原菌传递至大肠杆菌。
| [1] |
Cano-gomeza A, H jb L, Owensa L. A multiplex PCR-based protocol for identification and quantification of Vibrio harveyi-related species[J]. Aquaculture, 2015, 437: 195-200. DOI:10.1016/j.aquaculture.2014.10.050 |
| [2] |
Cardinaud M, Dheilly N M, Huchette S. The early stages of the immune response of the European abalone Haliotis tuberculata to a Vibrio harveyi infection[J]. Developmental & Comparative Immunology, 2015, 51: 287-297. |
| [3] |
Travers M A, Lego'icn, Huchette S. Summer immune depression associated with increased susceptibility of the European abalone, Haliotis tiiberciilata to Vibrio harveyi infection[J]. Fish & Shellfish Immunology, 2008, 25(6): 800-808. |
| [4] |
Haldar S, Maharajan A, Chatterjee S. Identificationof Vibrio harveyi as acausative bacterium for a tail rot disease of sea bream Sparus aurata from research hatchery in Malta[J]. Microbiology Research, 2010, 165: 639-648. DOI:10.1016/j.micres.2009.12.001 |
| [5] |
Hashem M, El-barbary M. Vibrio harveyi infection in Arabian Surgeon fish (Acanthurus sohal) of Red Sea at Hurghada, Egypt[J]. Egyptian Journal of Aquatic Research, 2013, 39(3): 199-203. DOI:10.1016/j.ejar.2013.10.006 |
| [6] |
Li Y Z, Wang L, Yang Y M. Genetic analysis of disease resistance to Vibrio harveyi by challenge test in Chinese tongue sole (Cynoglossus semilaevis)[J]. Aquaculture, 2019, 503: 430-435. DOI:10.1016/j.aquaculture.2019.01.011 |
| [7] |
Li M F, Wang C L, Sun L. A pathogenic Vibrio harveyi lineage causes recurrent disease outbreaks in cultured Japanese flounder (Paralichthys olivaceus) and induces apoptosis in host cells[J]. Aquaculture, 2011, 319: 30-36. DOI:10.1016/j.aquaculture.2011.06.034 |
| [8] |
Wang R X, Yao T, Liu X J. Isolation and characterisation of Vibrio harveyi as etiological agent of foot pustule disease in the abalone Haliotis discus hannai Ino 1953[J]. Indian Journal of Fisheries, 2018, 65(1): 79-85. |
| [9] |
Zhou J, Fang W, Yang X. Anonluminescent and highly virulent Vibrio harveyi strain is associated with "bacterial white tail disease" of Litopenaeus vannamei shrimp[J]. PloS One, 2012, 7(2): 1-6. |
| [10] |
Singer A C, Shaw H, Rhodes V. Review of antimicrobial resistance in the environment and its relevance to environmental regulators[J]. Frontiers in Microbiology, 2016, 7: 1-22. |
| [11] |
Kang C H, Kim Y G, Oh S G. Antibiotic resistance of Vibrio harveyi isolated from seawater in Korea[J]. Marine Pollution Bulletin, 2014, 86(1-2): 261-265. DOI:10.1016/j.marpolbul.2014.07.008 |
| [12] |
杨求华, 葛辉, 方旅平. 池塘养殖刺参病原菌塔氏弧菌的分离与鉴定[J]. 南方水产科学, 2014(4): 45-51. Yang Qiuhua, Ge Hui, Fang Lvping. Identification of Vibrio tubiashii isolated from diseased pond cultured sea cucumbers (Apostichopus japonicus)[J]. South China Fisheries Science, 2014(4): 45-51. |
| [13] |
Haskell S, Tubiash, Paul E. Chanley, Einar Leifson[J]. Journal of Bacteriology, 1965, 90(4): 1036-1044. DOI:10.1128/JB.90.4.1036-1044.1965 |
| [14] |
Biel F M, Allen F A, H se C C. Autolysis in Vibrio tubiashii and Vibrio coralliilyticus[J]. Canadian Journal of Microbiology, 2014, 60(2): 57-63. DOI:10.1139/cjm-2013-0654 |
| [15] |
Hasegawa H, Gharaibeh D N, Lind E J. Virulence of metalloproteases produced by Vibrio species on Pacific oyster Crassostrea gigas larvae[J]. Diseases of Aquatic Organisms, 2009, 85(2): 123-131. |
| [16] |
Séré M G, Tortosa P, Chabanet P. Identification of a bacterial pathogen associated with Porites white patch syndrome in the Western Indian Ocean[J]. Molecular Ecology, 2015, 24(17): 4570-4581. DOI:10.1111/mec.13326 |
| [17] |
杨先乐, 郭微微, 孙琪. 水产品质量安全与渔药的规范使用[J]. 中国渔业质量与标准, 2013, 3(4): 1-6. Yang Xianle, Guo Weiwei, Sun Qi. The quality and safety of aquatic products and the standard use of fishery drugs[J]. Fishery Quality and Standards in China, 2013, 3(4): 1-6. |
| [18] |
Lu J, Jin M, Nguyen S H, Mao L K. Non-antibiotic antimicrobial triclosan induces multiple antibiotic resistance through genetic mutation[J]. Environment International, 2018, 118: 257-265. DOI:10.1016/j.envint.2018.06.004 |
| [19] |
Voigt A M, Zacharias Timm C, Wasser F. Association between antibiotic residues, antibiotic resistant bacteria and antibiotic resistance genes in anthropogenic wastewater-An evaluation of clinical influences[J]. Che mosphere, 2020, 241: 125032. |
| [20] |
Clark C G, Kravetz A N, Alekseenko V V. Micro biological and epidemiological investigation of cholera epidemic in Ukraine during 1994 and 1995[J]. Epidemiology & Infection, 1998, 121(1): 1-13. |
| [21] |
杨娟, 马智龙, 蔡震. 泰州市112份水产品中副溶血性弧菌检出状况及耐药性分析[J]. 现代预防医学, 2016, 43(20): 3699-3702. Yang Juan, Ma Zhilong, Cai Zhen. Analysis on the contamination and drug resistance of Vibrio parahaemolyticus in 112 aquatic products in Taizhou[J]. Modern Preventive Medicine, 2016, 43(20): 3699-3702. |
| [22] |
Rocha R D S, Sousa O V D. Multidrug-resistant Vibrio, associated with an estuary affected by shrimp farming in Northeastern Brazil[J]. Marine Pollution Bulletin, 2016, 105(1): 337-340. DOI:10.1016/j.marpolbul.2016.02.001 |
| [23] |
王江勇, 王瑞旋, 苏友禄. 方斑东风螺"急性死亡症"的病原病理研究[J]. 南方水产科学, 2013, 9(5): 93-99. Wang Jiangyong, Wang Ruixuan, Su Youlu. Pathogen and pathology of "acute death syndrome" of Babylonia areolata[J]. South China Fisheries Science, 2013, 9(5): 93-99. |
| [24] |
刘晓靖, 王瑞旋, 凌慧. 方斑东风螺"急性死亡症"病原及其毒力基因研究[J]. 海洋环境科学, 2019(1): 7-15. Liu Xiaojing, Wang Ruixuan, Ling Hui. Studies on the pathogenic bacteria and their virulence factors of "acute death syndrome"in Babylonia Areolata[J]. Marine Environment Science, 2019(1): 7-15. |
| [25] |
王江勇, 孙秀秀, 王瑞旋. 杂色鲍肌肉萎缩症病原菌的分离鉴定及系统发育分析[J]. 南方水产科学, 2010, 6(5): 21-26. Wang Jiangyong, Sun Xiuxiu, Wang Ruixuan. Isolation, identification and phylogenetic analysis of pathogen from Haliotis diversicolor Reeve with withering syndrome[J]. South China Fisheries Science, 2010, 6(5): 21-26. |
| [26] |
王瑞旋, 刘广锋, 徐力文. 杂色鲍苗大规模脱落死亡的初步研究[J]. 海洋科学, 2007, 31(4): 53-57. Wang Ruixuan, Liu Guangfeng, Xu Liwen. Studies on the stripping off and death of larvaes of Haliotis diversicolor Reeve[J]. Marine Sciences, 2007, 31(4): 53-57. |
| [27] |
Wang R X, Feng J, Su Y L. Studies on the isolation of Photobacterium damselae subsp[J]. Veterinary Microbiology, 2013, 162: 957-963. DOI:10.1016/j.vetmic.2012.09.020 |
| [28] |
Clinical Laboratory Standards Institute (CLSI). Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria: approved guideline, second edition (M45-A2)[S]. Wayne, PA: Clinical Laboratory Standards Institute, 2010: 7.
|
| [29] |
Wang R X, Wang J Y, Sun Y C. Antibiotic resistance monitoring in Vibrio spp[J]. Marine Pollution Bulletin, 2015, 101: 701-706. DOI:10.1016/j.marpolbul.2015.10.027 |
| [30] |
姚小娟.海水养殖源弧菌耐药性检测与整合子分析[D].上海: 上海海洋大学, 2014. Yao Xiaojuan. Drug resistance detection and integrons analysis of Vibrios from mariculture source[D]. Shanghai: Shanghai Ocean University, 2014. http://d.wanfangdata.com.cn/thesis/D599671 |
| [31] |
Kang C H, Kim Y G, Oh S G. Antibiotic resistance of vibrio harveyi isolated from seawater in Korea[J]. Marine Pollution Bulletin, 2014, 86(1-2): 261-265. DOI:10.1016/j.marpolbul.2014.07.008 |
| [32] |
Chen H Y, Chen R H, Jing L J. A metagenomic analysis framework for characterization of antibiotic resistomes in river environment:Application to an urban river in Beijing[J]. Environmental Pollution, 2019, 245: 398-407. DOI:10.1016/j.envpol.2018.11.024 |
| [33] |
Danner M C, Robertson A, Behrends V. Antibiotic pollution in surface fresh waters:Occurrence and effects[J]. Science of the Total Environment, 2019, 664: 793-804. DOI:10.1016/j.scitotenv.2019.01.406 |
| [34] |
鄢庆枇, 方恩华, 苏永全. 大黄鱼病原弧菌耐药质粒转移研究[J]. 海洋科学, 2004, 28(3): 44-49. Yan Qingpi, Fang Enhua, Su Yongquan. Transfer of drug resistance plasmids from Escherichia coli to pathogenic vibrio[J]. Marine Sciences, 2004, 28(3): 44-49. |
| [35] |
王瑞旋, 耿玉静, 冯娟. 杂色鲍哈维弧菌耐药质粒的鉴定和分析[J]. 南方水产科学, 2012, 8(2): 1-6. Wang Ruixuan, Geng Yujing, Feng Juan. Identification and analysis of resistant plasmid of pathogenic bacteria Vibrio harveyi isolated from Haliotis diversicolor[J]. South China Fisheries Science, 2012, 8(2): 1-6. |
| [36] |
侯瑞娟.志贺菌属细菌耐药相关质粒的耐药性研究[D].郑州: 郑州大学, 2012. Hou Ruijuan. Reasearch on the resistance of plasmid mediated Shigella spp. Resistance[D]. Zhengzhou: Zhengzhou University, 2012. http://d.wanfangdata.com.cn/thesis/Y2102749 |
| [37] |
高丽丽.猪源产ESBL大肠杆菌的扩散及膨润土促其耐药基因转移机制的研究[D].泰安: 山东农业大学, 2015. Gao Lili. Spread of animal original ESBL-producing Escherichia coli and the promotion effect and mechanism of bentonite on ESBL gene transfer[D]. Taian: Shandong Agricultural University, 2015. https://www.zhangqiaokeyan.com/academic-degree-domestic_mphd_thesis/020313679110.html |
| [38] |
Yu Z, Gunn L, Wall P. Antimicrobial resistance and its association with tolerance heavy metals in agricu lture production[J]. Food Microbiology, 2017, 64: 23-32. DOI:10.1016/j.fm.2016.12.009 |
| [39] |
World Health Organization (WHO). Critically important antimicrobials for human medicine, 3rd revision 2011[R]. Geneva: WHO, 2012.
|
| [40] |
Woegerbauer M, Zeinzinger J, Springer B. Prevalence of the aminoglycoside phosphotransferase genes aph(3')-IIIa and aph(3')-IIa in Escherichia coli, Enterococcus faecalis, Enterococcus faecium, Pseudomonas aeruginosa, Salmonella enterica subsp[J]. Journal of Medical Microbiology, 2014, 63: 210-217. DOI:10.1099/jmm.0.065789-0 |
| [41] |
Beck E, Ludwig G, Auerswald E. Nucleotide sequence and exact localization of the neomycin phosphotransferase gene from transposon Tn5[J]. Gene, 1982, 19: 327-336. DOI:10.1016/0378-1119(82)90023-3 |
| [42] |
Thomas C M, Nielsen K M. Mechanisms of, and barriers to, horizontal gene transfer between bacteria[J]. Nature Reviews Microbiology, 2005, 3: 711-721. DOI:10.1038/nrmicro1234 |
 2020, Vol. 44
2020, Vol. 44


