文章信息
- 张玉, 赵鹏, 张晓梅, 周毅. 2020.
- ZHANG Yu, ZHAO Peng, ZHANG Xiao-mei, ZHOU Yi. 2020.
- 硫化物胁迫对海草影响的研究进展
- A review of the effects of sulfide stress on seagrass
- 海洋科学, 44(11): 123-131
- Marine Sciences, 44(11): 123-131.
- http://dx.doi.org/10.11759/hykx20200224001
-
文章历史
- 收稿日期:2020-02-24
- 修回日期:2020-03-29
2. 自然资源部第四海洋研究所, 广西 北海 536000;
3. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266237;
4. 中国科学院大学, 北京 100049
2. Fourth Institute of Oceanography, Ministry of Natural Resources, Beihai 536000, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
海草是唯一一类沉水性的且具地下根和根状茎的海洋高等植物, 全球共分布有72种海草, 生长在除南极洲以外的所有大洲的海洋浅海、沿岸水域和河口中[1-2]。大面积的连片海草被称为海草床, 海草床是三大典型沿海生态系统之一, 对浅海海岸和河口生态系统具有重要意义, 能够净化水质[3]、防风固堤[4], 是海洋生物重要的栖息地和育幼场[5], 为许多生物提供食物来源[6], 是沿海地区牧食食物链和碎屑食物链的重要组成部分[7], 并且在碳、氮、磷的生物地球化学循环中具有重要作用[8]。
硫酸盐的还原作用是沿海海洋沉积物中有机质厌氧矿化的主要终点过程, 该过程会生产有毒的硫化物[9-11]。研究表明, 当硫化物浓度低至10~1 000 μmol/L时, 对植物仍具有很强的毒性[12]。硫化物会抑制植物中与ATP有效性或营养状态有关的酶活性(如乙醇脱氢酶ADH), 降低植物蛋白含量、腺苷酸能荷比(AEC)以及氮素的吸收等[10, 13-15]。同时, 硫化物会抑制真核细胞线粒体中细胞色素氧化酶的活性, 对植物的分生组织产生毒害作用[12]。此外, 有研究观察到在沉积物硫化物的影响下植物从沉积物中吸收养分的含量有所减少[16-17], 且呼吸作用也受到抑制[10, 18]。由此可见, 硫化物对植物的光合作用、好氧代谢、生长发育和养分吸收等方面都有负面影响。
海草通常生长在高度还原性的沉积物中, 其中会含有潜在的有毒硫化物[19]。迄今为止, 在所研究的大多数海草中都发现了硫化物侵入植株组织内部的现象, 而且在温带和热带区域已经发生过多起因为草床沉积物中硫化物浓度过高而导致海草大面积死亡事件[11, 20-23]。佛罗里达湾, 是加勒比海和大西洋地区形成热带海草的主要栖息地, 其热带海草物种Thalassia testudinum分别在1987年和2015年的夏末秋初发生过两次大规模死亡事件, 海草床的损失面积达95平方公里和88平方公里, 而根据调查显示当时沉积物有机质含量非常高, 孔隙水中硫化氢的含量更是超过了2 000 μmol/L[20, 24]。
鉴于海草床在生态系统中的重要性, 以及硫化物对海草的危害性, 本文综述了近三十年来硫化物对海草胁迫的相关研究工作, 主要内容包括硫化物对海草产生胁迫的环境条件, 硫化物侵入海草组织的途径、时空变化, 硫化物对海草产生的主要危害, 以及不同海草物种受硫化物的侵入情况。基于对上述内容的总结归纳, 最后提出了未来研究工作的重点。本文有助于全面了解海草与硫化物胁迫之间的关系, 并为将来开展更深入的研究提供参考。
1 硫化物对海草产生胁迫的环境条件 1.1 缺氧硫化物对海草产生胁迫仅发生在低氧环境下, 其侵入海草组织速率与根和根状茎的供氧密切相关, 氧气浓度降低会减弱海草组织对硫化物侵入的防御能力[19, 25]。海草的根状茎和根部的氧气供应在很大程度上取决于叶片的光合作用以及来自上层水体的氧气供给[26]。氧气可以通过根系释放到沉积物中[26-27], 它可以在根部周围形成薄的氧化带, 并在硫化物到达根表面之前将其再氧化成无害的硫酸盐[28]。然而, 当水体中氧浓度较低或植物组织和沉积物对氧的需求量较高时, 沉积物就会形成缺氧条件[29], 在这种情况下, 硫化物可侵入海草组织[23, 30]。
Pedersen等人的研究表明, 硫化物侵入与植物的氧平衡密切相关, 只有在分生组织或根状茎中氧分压相对较低时才会发生[30]。Terrados等人发现海草床内添加蔗糖的样方沉积物的氧化还原电位较低, 缺氧情况明显, 沉积物中硫酸盐的还原速率升高, 孔隙水中溶解的硫化物含量升高[19]。Holmer和Laursen发现遮阴条件下, 海草的光合作用受到影响, 导致海草根系释放的氧气量减少, 硫化物产量随之增加[31]。Borum利用微电极技术, 对佛罗里达湾三个不同地点的海草分生组织和根茎中的氧气和硫化物动力学进行研究, 结果发现水柱缺氧以及其他因素造成的植物光合作用减少导致了硫化物侵入海草植株组织[23]。Holmer和Nielsen研究了海草床内的丝状藻类的爆发现象[32], 结果表明大量海藻在夜间的呼吸作用及其夏末秋初的降解过程会消耗大量的氧气, 从而造成沉积物缺氧现象, 沉积物的缺氧加上有机质的富集, 二者共同刺激了沉积物微生物的活动, 增加了硫酸盐还原速率, 使沉积物中硫化物的浓度增加[33], 导致硫化物对海草产生胁迫。
1.2 缺铁铁含量对沉积物中硫化物动力学起着重要作用, 这是因为铁能与硫化物反应生成硫化亚铁沉淀(FeS)和黄铁矿(FeS2)[34], 从而减少沉积物中硫化物的浓度[35]。而沉积物中铁含量的减少限制了硫化物的埋藏和再氧化, 沉积物对硫化物的缓冲能力下降, 从而增加了海草在硫化物中的暴露程度[36-37]。Robertson等人观察到沉积物中硫化物浓度高的区域其铁的浓度较低[38]。因此沉积物中铁含量较低可能是高硫化物侵入海草组织的重要原因[37]。一些现场实验表明, 在沉积物中添加铁元素可以直接降低海草床的硫化物水平, 从而降低硫化物对海草床的毒性, 增加植物密度和生产力, 甚至可以扭转草床暴露在高浓度硫化物下的退化趋势, 促进海草床的恢复[36, 39-41]。例如, Marbà的现场实验表明, 在西班牙地中海南部Posidonia australis海草床中添加铁元素可使沉积物硫酸盐还原率降低2倍, 植株补充量增加2.5倍[39]。
1.3 有机质富集有机质的沉积及其对沉积物生物地球化学条件的影响是控制硫化物侵入海草组织的重要因素[42]。Frederiksen等人研究了渔业活动对Posidonia oceanica受硫化物侵入的影响, 结果表明渔场废水的沉积增加了沉积物有机质含量, 从而刺激了底栖生物的矿化过程, 导致了硫化物浓度的增加[42]。Simpson通过实验发现硫化物的浓度随碎屑添加量的增加而增加, 这与Boschker等人前期研究结果一致[43-44]。O. Mascaró向沉积物中加入5 g/L的鱼食, 通过有机质富集来促进硫酸盐还原细菌的活动, 发现硫化物的产量明显增加[25]。Holmer在研究五种生长在不同沉积物条件下的温带海草的高硫化物侵入情况时发现, 有两个地点观察到高硫化物侵入海草组织的现象, 而这两个地点均伴随着有机质富集的情况, 因此也表明有机质富集是造成硫化物压力升高的因素[37]。
1.4 高盐Johnson研究发现, 当盐度为65时, 海草根际氧化能力受到损害, T. testudinum草床沉积物中硫化物的浓度要比盐度 < 55时高; 且与对照组(盐度为35)相比, 硫化物积累浓度是其4倍, 分生组织中硫化物浓度达到最高536±330 μmol/L[45]。造成该现象的原因是T. testudinum的夜间耗氧量在一定范围内随盐度(35、45、55和65)的增加而增加[46], 这意味着高盐度暴露会导致呼吸系统耗氧量增加, 呼吸速率的增加提高了硫化物侵入海草组织的速率, 从而使海草的分生组织受到更长时间、更高浓度的硫化物的影响[45]。
2 硫化物侵入海草组织的途径、时空变化 2.1 硫化物侵入海草组织的途径利用海草中稳定的硫同位素信号, 可以跟踪海草中硫化物的侵入情况[29, 47]。该技术利用了两种硫源不同的硫同位素, 即来自海水或沉积物孔隙水中的硫酸盐以及沉积物孔隙水中的硫化物[12]。由于硫酸盐还原细菌的分馏作用, 其产生的硫化物最终由重的34S和轻的32S组成。海水中硫酸盐的δ34S值通常是恒定的, 大约是+21‰左右[48], 沉积物孔隙水δ34S值变化很大, 其数值可达+ 60‰[49-50]。沉积物中硫化物的δ34S的值与之相差很大, 范围通常在–10‰~ 20‰, 个别沉积物中硫化物δ34S的值能低至–50‰。因此受硫化物侵入的海草的δ34S信号值要低于未受硫化物侵入的海草[51]。
为了适应厌氧沉积物环境, 海草体内生有发达的腔隙系统, 该系统连接了叶片、根状茎和根, 并允许氧气在植物内运输[52-53], 然而硫化物气体也会通过该腔隙系统在海草植株体内由地下组织转移到叶片中[23, 30]。Holmer的两项研究发现当Zostera marina受到硫化物侵入时, 不同组织δ34S信号不同, 叶片相对于根和根状茎δ34S信号来说是正的, 表明硫化物先侵入到根部, 然后通过组织中的腔隙系统转移到其他组织中[29, 32]。Holmer还发现Zostera nigricaulis受到硫化物侵入时, 硫化物的侵入途径和前者一样, 也是从根部进入到植株内, 进而转移到根状茎和叶片中[37]。
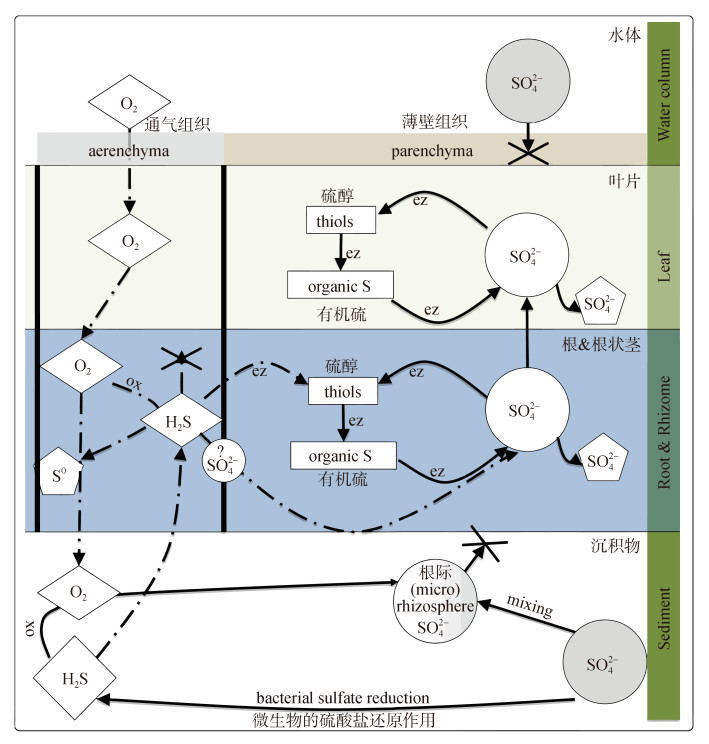
2.2 硫化物在海草组织中的时空变化在植物组织中, 硫化物可能的氧化产物包括单质硫(S0)、硫酸盐(SO42–), 硫代硫酸盐(S2O32–)以及其他含硫有机化合物, 如含硫氨基酸和辅酶[54-55]。然而硫化物在海草体内发生再氧化的具体机制目前仍然不清楚, 但是不少研究表明单质硫是硫化物的主要再氧化产物, 且在海草组织中积累较多[29, 33, 42, 56]。Hasler-Sheetal通过扫描电子显微镜、能量色散x射线光谱学、色谱和分光光度法以及稳定的同位素示踪等方法发现硫化物侵入海草组织后, 有一部分硫化物在海草腔隙组织中被氧化沉淀为单质硫, 有一部分硫化物进一步转化为硫醇和硫酸盐, 还有一部分通过酶促代谢反应转化为有机硫。不同形态的硫主要在地下组织(根和根茎)中积累, 积累量超过80%, 在地下组织中, 67%的沉淀为单质硫, 17%为有机硫, 12%为硫酸盐, 4%为硫醇。此外, 单质硫和硫醇主要储存在根状茎和根中, 而硫酸盐则从地下组织运输到地上组织[56-57]。Hasler-Sheetal根据其硫化合物定量结果和稳定同位素示踪的结果将硫化物的变化过程总结在图 1的概念模型中[57]。
硫化物对海草的危害主要是通过直接破坏海草的分生组织并进一步抑制海草的光合作用发生的。Garcias-Bonet发现P. oceanica分生组织中分裂细胞的百分比与沉积物中硫化物的浓度呈密切的负相关关系, 该结果表明硫化物会在海草叶片的形成过程中抑制分生组织的分裂活动, 从而对海草的生长带来严重的负面影响[58]。硫化物还可以通过海草的根和根状茎扩散到光合作用组织中[25, 57], 通过影响光系统Ⅱ[59]或线粒体中细胞色素c氧化酶[10]等酶的活性抑制光合作用, 导致能量生产下降, 并对其他含金属酶产生负面影响[60]。
迄今为止, 已经有多项研究证明硫化物会抑制海草的生长, 降低其生物量, 并对海草床造成许多其他的负面影响[23, 25, 30, 61-62]。例如, Mascaró通过添加有机质来控制硫化物对海草的胁迫程度, 实验结果发现高含量有机质添加处理组, 植株受到严重的硫化物胁迫, 与对照组相比, 其生长率在2周和4周后分别下降了79%和91%, 而且植株开始变软, 出现明显的降解现象[25]。此外, 全球已经发生多起因为沉积物中硫化物浓度过高而导致海草大面积死亡事件[11, 20, 23-24]。
4 不同海草物种受硫化物侵入的情况虽然与其他植物家族相比, 海草物种的数量相对较少(72种), 但是各物种间海草的形态大小差异较大, 从小型(叶长度 < 2 cm)到大型物种(叶长度 > 2 m)均有, 其地上、地下组织的分化程度差异也较大[63], 而这些特征在海草响应硫化物胁迫中具有重要作用[19, 33, 37, 64]。从海草物种的大小方面来说, 植株越小受硫化物侵入程度越高[65], 而且较小的海草物种如Halophila ovalis和Zostera nigricaulis, 其各个组织(根、茎、叶)之间硫化物的侵入是相互关联的; 植株越大受硫化物侵入程度相对较低, 较大的海草物种如Amphibolis antartica, 其更长的茎以及叶鞘更是将沉积物中硫化物与叶片隔离开, 因此其根状茎和根中硫化物侵入程度很高, 而叶片中硫化物侵入程度很低[37]。地下生物量在海草响应硫化物的过程中起到的作用因物种而异。Posidonia sp.和Cymodocea sp.根的生物量与硫化物侵入程度呈负相关, 这可能是因为植株较大, 光合作用产氧量较多, 通过根释放了更多氧气, 促进了周围环境中硫化物的氧化过程, 使硫化物侵入减少[65]。而Halophila sp.情况正好相反, 该物种植株较小, 光合作用产氧量有限, 浓密的根毛增加了根吸收的有效面积, 促进了植株从环境中吸收硫化物[66-67]。
Frederiksen等人的研究表明P. oceanica和Z. marina叶片受硫化物侵入程度不同, P. oceanica叶片受硫化物影响较低; 而Z. marina的叶片则受硫化物侵入程度较高, 该现象可由以下两点原因解释: (1)与物种间的形态差异有关, P. oceanica的根状茎与Z. marina不同, 既有垂直的, 也有水平的, 这增加了根到根状茎的扩散距离; (2)物种间腔隙组织发育的变异可能影响植物器官间硫化物的扩散, Frederiksen对两物种根状茎横断面的显微镜检查显示, 与Z. marina相比, P. ocenica的腔隙组织较少, 硫化物在体内转移速度较慢[42]。
5 存在的问题与展望当前海草所面临的硫化物胁迫是全球性的问题, 更是不容忽视的重要问题。但是从研究的内容和层面来看, 大量的研究主要集中在海草个体、种群层面, 而细胞、组织层面的研究较少, 对硫化物胁迫的分子应答机制研究更是几乎没有; 另外, 硫化物胁迫下海草床的修复研究也相对较少, 因此未来应该加强以上三方面的研究。
5.1 硫化物胁迫下海草组织、细胞层面的研究叶片是植物的同化器官, 生理功能较为活跃, 能直接影响植物的光合、呼吸、养分运输等主要生理活动[68], 胁迫条件下叶片细胞的多种结构和功能会受到破坏, 从而导致植物不能进行正常的生理代谢活动, 并最终导致死亡, 例如叶绿体和类囊体出现明显破坏时, 意味着叶绿体的光合功能将受到严重影响[69]; 细胞核的变形则会严重影响基因的表达、蛋白质的合成等[70], 而膜系统则是胁迫条件下受破坏的主要部位, 前人的研究表明, 逆境胁迫对植物叶绿体、线粒体和细胞核等细胞器的伤害首先是对膜结构的伤害[68]。此外, 还有研究表明, 植物叶片组织的叶片厚度、栅栏组织、海绵组织等与植物的抗逆性密切相关[71]。因此硫化物胁迫下, 海草叶片组织中主要细胞器、膜系统以及各种组织的变化情况也是反映海草响应硫化物胁迫的重要方面, 应进行深入研究。
5.2 硫化物胁迫下海草分子应答机制的研究硫化物对海草光合作用影响的研究目前局限在间接研究方面, 即测定光合作用相关的参数或者测定硫化物胁迫后海草的生物量是如何变化的。而硫化物胁迫对海草光合系统的直接影响还没有相关研究, 例如光系统Ⅰ和Ⅱ是受到了哪些影响, 过程中相关酶的活性又是如何变化的, 这些更深一层次的原因也是值得探究的。当植物受到环境胁迫时, 体内会产生大量的活性氧, 如果活性氧不能及时被清除, 就会引发一系列生理生化代谢紊乱, 最终造成植物的死亡, 因此硫化物对海草产生胁迫时, 海草细胞内的抗氧化酶系统是如何变化以应对胁迫的, 也应该进行深入研究。
此外, 海草对硫化物胁迫响应的内在机制目前还不清楚, 随着基因组学、转录组学、蛋白质组学以及代谢组学等组学技术的兴起, 应该从分子各个层面深入地解析海草对硫化物胁迫的响应, 并最终从整体水平上把握其应答机制。此外, 传统的指标如生物量、生长速率、光合作用、叶片表型等对环境胁迫响应的时间相对较长, 一旦从传统指标发现海草生长不良说明海草床早已受到环境的胁迫, 已经发生了退化。而通过转录组、蛋白质组、代谢组等组学方面的测定可以找到成熟可靠的硫化物胁迫“预响应”的分子标志物, 如转录组层面的响应基因、蛋白质组层面的蛋白产物、代谢组层面的代谢产物等, 用以提前判断海草床是否受到硫化物胁迫, 避免出现因为硫化物浓度升高造成海草大面积死亡事件, 从而起到海洋生态环境工程监测预警作用。
5.3 硫化物环境下现场修复技术的探索因为铁元素能结合海草生长环境中的硫化物,产生硫化亚铁沉淀(FeS)和黄铁矿(FeS2)[34], 从而减少沉积物中硫化物的浓度[35], 所以目前有多项研究通过向海草床中添加铁元素来减轻硫化物对海草床的胁迫, 并取得了一定的成果[36, 39-41]。张倩研究发现, 高硫化物胁迫下添加铁元素, 可显著提高Z. marina植株密度和生长速度, 较低硫化物水平时添加铁元素虽也能提高各指标值, 但效果不明显[40]。因此不同的草床, 沉积物硫化物环境不同, 具体的修复技术需要根据草床的实际情况进行。
此外, 可以将海草对硫化物胁迫的分子应答机制与基因工程手段相结合运用于生态修复中。在分子应答机制的基础上, 通过基因工程改进海草抗性基因的表达, 提高植株对硫化物胁迫的耐受性。例如陆地植物在研究抗除草剂胁迫时, 通过基因工程修饰除草剂作用的靶蛋白使植株对其不敏感(EPSPS抑制剂基因)[72-73], 或者分离出能解除除草剂毒性的酶基因(bar基因), 使其过量表达以解除除草剂对植物的毒性作用[74-75]。因此, 未来可以借助基因工程的手段培育耐硫化物胁迫的植株用于海草床的恢复。
| [1] |
Short F, Carruthers T, Dennison W, et al. Global seagrass distribution and diversity:A bioregional model[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1-2): 3-20. DOI:10.1016/j.jembe.2007.06.012 |
| [2] |
Short F T, Polidoro B, Livingstone S R, et al. Extinction risk assessment of the world's seagrass species[J]. Biological Conservation, 2011, 144(7): 1961-1971. DOI:10.1016/j.biocon.2011.04.010 |
| [3] |
Moore K A. Influence of seagrasses on water quality in shallow regions of the lower Chesapeake Bay[J]. Journal of Coastal Research, 2004, 162-178. |
| [4] |
Fonseca M S, Cahalan J A. A preliminary evaluation of wave attenuation by four species of seagrass[J]. Estuarine Coastal & Shelf Science, 1992, 35(6): 565-576. |
| [5] |
Unsworth R K F, Nordlund L M, Cullen-Unsworth L C. Seagrass meadows support global fisheries production[J]. Conservation Letters, 2019, 12(1): e12566. DOI:10.1111/conl.12566 |
| [6] |
Edgar G J, Shaw C, Watson G F, et al. Comparisons of species richness, size-structure and production of benthos in vegetated and unvegetated habitats in Western Port, Victoria[J]. Journal of Experimental Marine Biology and Ecology, 1994, 176(2): 201-226. DOI:10.1016/0022-0981(94)90185-6 |
| [7] |
Short F T, Wyllie-Echeverria S. Natural and human-induced disturbance of seagrasses[J]. Environmental Conservation, 1996, 23(1): 17-27. DOI:10.1017/S0376892900038212 |
| [8] |
Fortes M D. Mangrove and seagrass beds of East Asia:Habitats under stress[J]. Ambio, 1988, 17(3): 207-213. |
| [9] |
Thode-Andersen S, Jørgensen B B. Sulfate reduction and the formation of 35S-labeled FeS, FeS2, and S0 in coastal marine sediments[J]. Limnology and Oceanography, 1989, 34(5): 793-806. DOI:10.4319/lo.1989.34.5.0793 |
| [10] |
Koch M S, Mendelssohn I A, Mckee K L. Mechanism for the hydrogen sulfide-induced growth limitation in wetland macrophytes[J]. Limnology and Oceanography, 1990, 35(2): 399-408. DOI:10.4319/lo.1990.35.2.0399 |
| [11] |
Goodman J L, Moore K A, Dennison W C. Photosynthetic responses of eelgrass (Zostera marina L.) to light and sediment sulfide in a shallow barrier island lagoon[J]. Aquatic Botany, 1995, 50(1): 37-47. DOI:10.1016/0304-3770(94)00444-Q |
| [12] |
Raven J A, Scrimgeour C M. The influence of anoxia on plants of saline habitats with special reference to the sulphur cycle[J]. Annals of Botany, 1997, 79: 79-86. DOI:10.1093/oxfordjournals.aob.a010309 |
| [13] |
Trought M C T, Drew M C. The development of waterlogging damage in wheat seedlings (Triticum aestivum L.)[J]. Plant and Soil, 1980, 54(1): 77-94. DOI:10.1007/BF02182001 |
| [14] |
Saglio P H, Raymond P, Pradet A. Oxygen transport and root respiration of maize seedlings:A quantitative approach using the correlation between ATP/ADP and the respiration rate controlled by oxygen tension[J]. Plant Physiology, 1983, 72(4): 1035-1039. DOI:10.1104/pp.72.4.1035 |
| [15] |
Mendelssohn I A, Burdick D M. The relationship of soil parameters and root metabolism to primary production in periodically inundated soils[M]. The Ecology and Management of Wetlands, 1988, Chapter 34:398-428.
|
| [16] |
Howes B L, Dacey J W H, Goehringer D D. Factors controlling the growth form of spartina alterniflora:feedbacks between above-ground production, sediment oxidation, nitrogen and salinity[J]. Journal of Ecology, 1986, 74(3): 881-898. DOI:10.2307/2260404 |
| [17] |
Bradley P M, Morris J T. Physical characteristics of salt marsh sediments:Ecological implications[J]. Marine Ecology Progress Series, 1990, 61(3): 245-252. |
| [18] |
Pearson J, Havill D C. The effect of hypoxia and sulphide on culture-grown wetland and non-wetland plants:Ⅱ.Metabolic and physiological changes[J]. Journal of Experimental Botany, 1988, 39: 431-439. DOI:10.1093/jxb/39.4.431 |
| [19] |
Terrados J, Duarte C M, Kamp-Nielsen L, et al. Are seagrass growth and survival constrained by the reducing conditions of the sediment?[J]. Aquatic Botany, 1999, 65(1-4): 175-197. DOI:10.1016/S0304-3770(99)00039-X |
| [20] |
Robblee M B, Barber T R, Carlson P R, et al. Mass mortality of the tropical seagrass Thalassia Testudinum in Florida Bay (USA)[J]. Marine Ecology Progress Series, 1991, 71(3): 297-299. |
| [21] |
Zieman J C, Fourqurean J W, Frankovich T A. Seagrass die-off in Florida Bay:Long-term trends in abundance and growth of turtle grass, Thalassia testudinum[J]. Estuaries, 1999, 22(2B): 460-470. |
| [22] |
Seddon S, Connolly R M, Edyvane K S. Large-scale seagrass dieback in northern Spencer Gulf, South Australia[J]. Aquatic Botany, 2000, 66(4): 297-310. DOI:10.1016/S0304-3770(99)00080-7 |
| [23] |
Borum J, Pedersen O, Greve T M, et al. The potential role of plant oxygen and sulphide dynamics in die-off events of the tropical seagrass, Thalassia testudinum[J]. Journal of Ecology, 2005, 93(1): 148-158. DOI:10.1111/j.1365-2745.2004.00943.x |
| [24] |
Hall M O, Furman B T, Merello M, et al. Recurrence of Thalassia testudinum seagrass die-off in Florida Bay, USA:initial observations[J]. Marine Ecology Progress Series, 2016, 560: 243-249. DOI:10.3354/meps11923 |
| [25] |
Mascaro O, Valdemarsen T, Holmer M, et al. Experimental manipulation of sediment organic content and water column aeration reduces Zostera marina (eelgrass) growth and survival[J]. Journal of Experimental Marine Biology and Ecology, 2009, 373(1): 26-34. DOI:10.1016/j.jembe.2009.03.001 |
| [26] |
Pedersen O, Borum J, Duarte C M, et al. Oxygen dynamics in the rhizosphere of Cymodocea rotundata[J]. Marine Ecology Progress Series, 1998, 169: 283-288. DOI:10.3354/meps169283 |
| [27] |
Caffrey J M, Kemp W M. Seasonal and spatial patterns of oxygen production, respiration and root-rhizome release in Potamogeton perfoliatus L. and Zostera marina L[J]. Aquatic Botany, 1991, 40(2): 109-128. DOI:10.1016/0304-3770(91)90090-R |
| [28] |
Schaub B E M, Vangemerden H. Sulfur bacteria in sediments of two coastal ecosystems:The Bassin d'Arcachon and the Etang du Prevost, France[J]. Hydrobiologia, 1996, 329(1-3): 199-210. DOI:10.1007/BF00034558 |
| [29] |
Frederiksen M S, Glud R N. Oxygen dynamics in the rhizosphere of Zostera marina:A two-dimensional planar optode study[J]. Limnology and Oceanography, 2006, 51(2): 1072-1083. DOI:10.4319/lo.2006.51.2.1072 |
| [30] |
Pedersen O, Binzer T, Borum J. Sulphide intrusion in eelgrass (Zostera marina L.)[J]. Plant Cell and Environment, 2004, 27(5): 595-602. DOI:10.1111/j.1365-3040.2004.01173.x |
| [31] |
Holmer M, Laursen L. Effect of shading of Zostera marina (eelgrass) on sulfur cycling in sediments with contrasting organic matter and sulfide pools[J]. Journal of Experimental Marine Biology and Ecology, 2002, 270(1): 25-37. DOI:10.1016/S0022-0981(02)00015-1 |
| [32] |
Holmer M, Nielsen R M. Effects of filamentous algal mats on sulfide invasion in eelgrass (Zostera marina)[J]. Journal of Experimental Marine Biology and Ecology, 2007, 353(2): 245-252. DOI:10.1016/j.jembe.2007.09.010 |
| [33] |
Holmer M, Pedersen O, Ikejima K. Sulfur cycling and sulfide intrusion in mixed Southeast Asian tropical seagrass meadows[J]. Botanica Marina, 2006, 49(2): 91-102. |
| [34] |
Brüchert V, Pratt L M. Contemporaneous early diagenetic formation of organic and inorganic sulfur in estuarine sediments from St. Andrew Bay, Florida, USA[J]. Geochimica Et Cosmochimica Acta, 1996, 60(13): 2325-2332. DOI:10.1016/0016-7037(96)00087-7 |
| [35] |
Jügensen, Barker B. The sulfur cycle of a coastal marine sediment (Limfjorden, Denmark)[J]. Limnology & Oceanography, 1977, 22(5): 814-832. |
| [36] |
Holmer M, Duarte C M, Marbá N. Iron additions reduce sulfate reduction rates and improve seagrass growth on organic-enriched carbonate sediments[J]. Ecosystems, 2005, 8(6): 721-730. DOI:10.1007/s10021-003-0180-6 |
| [37] |
Holmer M, Kendrick G A. High sulfide intrusion in five temperate seagrasses growing under contrasting sediment conditions[J]. Estuaries and Coasts, 2013, 36(1): 116-126. DOI:10.1007/s12237-012-9550-7 |
| [38] |
Robertson D, Teasdale P R, Welsh D T. A novel gel-based technique for the high resolution, two-dimensional determination of iron (Ⅱ) and sulfide in sediment[J]. Limnology and Oceanography-Methods, 2008, 6: 502-512. DOI:10.4319/lom.2008.6.502 |
| [39] |
Marbà N, Calleja M, Duarte C, et al. Iron additions reduce sulfide intrusion and reverse seagrass (Posidonia oceanica) decline in carbonate sediments[J]. Ecosystems, 2007, 10(5): 745-756. DOI:10.1007/s10021-007-9053-8 |
| [40] |
张倩.大叶藻对矿质元素Fe和Cu的吸收规律及铁元素对海草床硫化物压力的缓解效应研究[D].山东青岛: 中国海洋大学, 2015. Zhang Qian. Studies on the iron and coper absorption patterns of mineral elements of eelgrass (Zostera marina L.) and alleviating effects of iron addition on the sulfide stress towards eelgrass bed[D]. Qingdao, Shandong Province: Ocean University of China, 2015. |
| [41] |
Wang X T, Zhang Q, Liu Y S, et al. The influence of increased iron concentration on survival and growth of seedlings and young plants of eelgrass Zostera marina[J]. Marine Ecology, 2017, 38(3): e12425. DOI:10.1111/maec.12425 |
| [42] |
Frederiksen M S, Holmer M, Diaz-Almela E, et al. Sulfide invasion in the seagrass Posidonia oceanica at Mediterranean fish farms:assessment using stable sulfur isotopes[J]. Marine Ecology Progress Series, 2007, 345: 93-104. DOI:10.3354/meps06990 |
| [43] |
Boschker H T S, Wielemaker A, Schaub B E M, et al. Limited coupling of macrophyte production and bacterial carbon cycling in the sediments of Zostera spp. meadows[J]. Marine Ecology Progress Series, 2000, 203: 181-189. DOI:10.3354/meps203181 |
| [44] |
Simpson A G, Tripp L, Shull D H, et al. Effects of Zostera marina rhizosphere and leaf detritus on the concentration and distribution of pore-water sulfide in marine sediments[J]. Estuarine Coastal and Shelf Science, 2018, 209: 160-168. DOI:10.1016/j.ecss.2018.05.024 |
| [45] |
Johnson C R, Koch M S, Pedersen O, et al. Hypersalinity as a trigger of seagrass (Thalassia testudinum) die-off events in Florida Bay:Evidence based on shoot meristem O2 and H2S dynamics[J]. Journal of Experimental Marine Biology and Ecology, 2018, 504: 47-52. DOI:10.1016/j.jembe.2018.03.007 |
| [46] |
Koch M S, Schopmeyer S A, Nielsen O I, et al. Conceptual model of seagrass die-off in Florida Bay:Links to biogeochemical processes[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1-2): 73-88. DOI:10.1016/j.jembe.2007.05.031 |
| [47] |
Oakes J M, Connolly R M. Causes of sulfur isotope variability in the seagrass, Zostera capricorni[J]. Journal of Experimental Marine Biology and Ecology, 2004, 302(2): 153-164. DOI:10.1016/j.jembe.2003.10.011 |
| [48] |
Rees C E, Jenkins W J, Monster J. Sulfur isotopic composition of ocean water sulfate[J]. Geochim Cosmochim Acta, 1978, 42: 377-381. DOI:10.1016/0016-7037(78)90268-5 |
| [49] |
Kaplan I R, Emery K O, Rittenberg S C. The distribution and isotopic abundance of sulphur in recent marine sediments off southern California[J]. Geochimica Et Cosmochimica Acta, 1963, 27(APR): 297-331. |
| [50] |
Jørgensen B B. A theoretical model of the stable sulfur isotope distribution in marine sediments[J]. Geochimica Et Cosmochimica Acta, 1979, 43: 363-374. DOI:10.1016/0016-7037(79)90201-1 |
| [51] |
Frederiksen M. Seagrass response to organic loading of meadows caused by fish farming or eutrophication[D]. Odense, Denmark: University of Southern Denmark, 2005.
|
| [52] |
Roberts D G, Mccomb A J, Kuo J. The structure and continuity of the lacunar system of the seagrass Halophila ovalis (R. Br.) Hook f. (Hydrocharitaceae)[J]. Aquatic Botany, 1984, 18(4): 377-388. DOI:10.1016/0304-3770(84)90058-5 |
| [53] |
Greve T M, Borum J, Pedersen O. Meristematic oxygen variability in eelgrass (Zostera marina)[J]. Limnology and Oceanography, 2003, 48(1): 210-216. DOI:10.4319/lo.2003.48.1.0210 |
| [54] |
Jorgensen B B, Bak F. Pathways and Microbiology of Thiosulfate Transformations and Sulfate Reduction in a Marine Sediment (Kattegat, Denmark)[J]. Applied and Environmental Microbiology, 1991, 57(3): 847-856. DOI:10.1128/AEM.57.3.847-856.1991 |
| [55] |
Rennenberg H. The fate of excess sulfur in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1984, 35: 121-153. DOI:10.1146/annurev.pp.35.060184.001005 |
| [56] |
Hasler-Sheetal, H. Fate and effect of sulfate on seagrasses: from molecule to ecosystem[D]. Odense, Denmark: University of Southern Denmark, 2014.
|
| [57] |
Hasler-Sheetal H, Holmer M. Sulfide intrusion and detoxification in the seagrass Zostera marina[J]. PLoS One, 2015, 10(6): e0129136. DOI:10.1371/journal.pone.0129136 |
| [58] |
Garcias-Bonet N, Marba N, Holmer M, et al. Effects of sediment sulfides on seagrass Posidonia oceanica meristematic activity[J]. Marine Ecology Progress Series, 2008, 372: 1-6. DOI:10.3354/meps07714 |
| [59] |
Dooley F D, Wyllie-Echeverria S, Gupta E, et al. Tolerance of Phyllospadix scouleri seedlings to hydrogen sulfide[J]. Aquatic Botany, 2015, 123: 72-75. DOI:10.1016/j.aquabot.2015.02.004 |
| [60] |
Hasler-Sheetal H, Castorani M C N, Glud R N, et al. Metabolomics reveals cryptic interactive effects of species interactions and environmental stress on nitrogen and sulfur metabolism in seagrass[J]. Environmental Science & Technology, 2016, 50(21): 11602-11609. |
| [61] |
Borum J, Raun A L, Hasler-Sheetal H, et al. Eelgrass fairy rings:sulfide as inhibiting agent[J]. Marine Biology, 2014, 161(2): 351-358. DOI:10.1007/s00227-013-2340-3 |
| [62] |
Li S-Q, Zhang H-Y, Kang B, et al. Assessment of the ameliorating effect of sedimentary iron inputs on sulfide stress in eelgrass beds[J]. Marine Pollution Bulletin, 2020, 150: 110730. DOI:10.1016/j.marpolbul.2019.110730 |
| [63] |
Duarte C M, Merino M, Agawin N S R, et al. Root production and belowground seagrass biomass[J]. Marine Ecology Progress Series, 1998, 171: 97-108. DOI:10.3354/meps171097 |
| [64] |
Holmer M, Hasler-Sheetal H. Sulfide intrusion in seagrasses assessed by stable sulfur isotopes-a synthesis of current results[J]. Frontiers in Marine Science, 2014, 1: Article 64. |
| [65] |
Apostolaki E T, Holmer M, Santinelli V, et al. Species-specific response to sulfide intrusion in native and exotic Mediterranean seagrasses under stress[J]. Marine Environmental Research, 2018, 134: 85-95. DOI:10.1016/j.marenvres.2017.12.006 |
| [66] |
Roberts D G. Root-hair structure and development in the seagrass Halophila ovalis (R.Br.) Hook[J]. Australian Journal of Marine and Freshwater Research, 1993, 44(1): 85-100. DOI:10.1071/MF9930085 |
| [67] |
Kuo J, Hartog C D. Seagrass morphology, anatomy, and ultrastructure[M]. Springer Netherlands, 2006.
|
| [68] |
姚瑞玲.不同种源青钱柳幼苗对渗透胁迫适应机理的研究[D].江苏南京: 南京林业大学, 2007. Yao Ruiling. Response mechanisms of Cyelocarya Paliurus seedlings for different provenances under osmotic stress[D]. Nanjing, Jiangsu Province: Nanjing Forestry University, 2007. |
| [69] |
王波, 宋凤斌, 任长忠, 等. 盐碱胁迫对燕麦叶绿体超微结构及一些生理指标的影响[J]. 吉林农业大学学报, 2005, 27(5): 473-477, 485. Wang Bo, Song Feng-bin, Ren Chang-zhong, et al. Effects of saline-alkali stress on ultrastructure in chloroplast and some physiological indexes of oats[J]. Journal of Jilin Agricultural University, 2005, 27(5): 473-477, 485. |
| [70] |
王凤茹, 张红, 商振清, 等. 干旱逆境下小麦幼苗叶片细胞核超微结构与钙离子的关系[J]. 华北农学报, 2000, 15(S1): 4-7. Wang Fengru, Zhang Hong, Shang Zhenqing, et al. The relationship between the nucleus of the wheat seedling and Ca2+ under water stress[J]. Acta Agriculturae Boreali-Sinica, 2000, 15(S1): 4-7. |
| [71] |
冉卓.低温胁迫紫花苜蓿生理生化特性和解剖结构的研究[D].辽宁沈阳: 沈阳农业大学, 2017. Ran Zhuo. Effect on physiological and biochemical characteristics and anatomical structure of alfalfa under low temperature stress[D]. Shenyang, Liaoning Province: Shenyang Agricultural University, 2007. |
| [72] |
燕树锋, 祝水金, 铁双贵. 转EPSPS-G6基因抗草甘膦棉花的获得及抗性鉴定[J]. 基因组学与应用生物学, 2018, 37(9): 3944-3949. Yan Shufeng, Zhu Shuijin, Tie Shuanggui. Acquirement and glyphosate resistance identification of transgenic cotton with EPSPS-G6 Gene[J]. Genomics and Applied Biology, 2018, 37(9): 3944-3949. |
| [73] |
翁嘉慧, 楼亿圆, 徐京, 等. 转AM79-EPSPS基因抗草甘膦大豆遗传稳定性分析[J]. 农业生物技术学报, 2019, 27(9): 1550-1559. Weng Jiahui, Lou Yiyuan, Xu Jing, et al. Genetic stability analysis of transgenic AM79-EPSPS glyphosate-resistant soybean (Glycine max)[J]. Journal of Agricultural Biotechnology, 2019, 27(9): 1550-1559. |
| [74] |
邓力华, 邓晓湘, 魏岁军, 等. 抗虫抗除草剂转基因水稻B1C893的获得与鉴定[J]. 杂交水稻, 2014, 29(1): 67-71, 75. Deng Lihua, Deng Xiaoxiang, Wei Suijun, et al. Development and identification of herbicide and insect resistant transgenic plant B1C893 in rice[J]. Hybrid Rice, 2014, 29(1): 67-71, 75. |
| [75] |
胡毅, 付超, 王雪婷, 等. 抗除草剂转基因普通白菜的获得和检测[J]. 山西农业科学, 2019, 47(5): 734-737. Hu Yi, Fu Chao, Wang Xueting, et al. Detection and obtainment of transgenic herbicide resistant plant in Pak choi[J]. Journal of Shanxi Agricultural Sciences, 2019, 47(5): 734-737. |
 2020, Vol. 44
2020, Vol. 44