文章信息
- 徐利婷, 马岩, 张一梦, 管方, 翟晓凡, 董续成, 段继周, 侯保荣. 2020.
- XU Li-ting, MA Yan, ZHANG Yi-meng, GUAN Fang, ZHAI Xiao-fan, DONG Xu-cheng, DUAN Ji-zhou, HOU Bao-rong. 2020.
- Pseudomonas sp.在杀菌剂耐受条件下对X70管线钢的腐蚀行为研究
- Effect of Pseudomonas sp. on the corrosive behavior of metal materials under biocide resistance
- 海洋科学, 44(12): 14-22
- Marine Sciences, 44(12): 14-22.
- http://dx.doi.org/10.11759/hykx20200313001
-
文章历史
- 收稿日期:2020-03-13
- 修回日期:2020-05-24
2. 中国科学院大学, 北京 100049;
3. 青岛海洋科学与技术国家试点实验室, 山东 青岛 266237;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
假单胞菌广泛存在于土壤、淡水和海洋环境中, 是海洋中最丰富、分布最广的好氧菌之一。研究表明, 假单胞菌在南海海域的碳钢腐蚀初期锈层微生物群落中一直占据着主导地位[1-4]。假单胞菌作为锈层微生物群落中主要的微生物之一, 对金属材料的微生物腐蚀具有直接或间接的贡献。因此, 研究假单胞菌对金属材料腐蚀的影响具有重要意义。目前, 关于假单胞菌对金属材料的腐蚀研究国内外已有报道[5-14], 但其对腐蚀的影响还存在一些争议, 有的学者认为假单胞菌能通过代谢活动而造成碳钢[15]、不锈钢[11, 16]和铝合金[17]等各种金属材料的严重腐蚀, 有的学者则认为假单胞菌会对金属材料起到缓蚀作用。
微生物常通过在金属表面形成生物膜来加速金属材料的腐蚀。在生物膜中, 假单胞菌可以通过电子传递、胞外多聚物、代谢产物等直接影响金属的腐蚀行为[18-23]。同时作为好氧菌, 假单胞菌会消耗生物膜内的氧气, 为硫酸盐还原菌等腐蚀性厌氧微生物的生长提供了良好的厌氧环境, 间接影响金属的腐蚀行为。
投加杀菌剂是目前石油开采、油气管道输运、电厂冷却水等许多工业中用来防控微生物腐蚀的主要手段之一。常用的杀菌剂主要为氧化型杀菌剂和非氧化型杀菌剂。氧化型杀菌剂主要包括:氯系杀菌剂、溴系杀菌剂、二氧化氯、过氧化氢等。非氧化性杀菌剂主要包括:季铵盐类杀菌剂、有机硫化物、醛类化合物、有机溴化合物、季磷盐类杀菌剂等。四羟甲基硫酸磷(THPS)属于季磷盐类杀菌剂, 其分子式为[CH2(OH)4P]2SO4, 其结构式如图 1所示, 由于其高效、环保、低腐蚀性的优点被广泛用于微生物腐蚀防控领域, 尤其是在石油化工和天然气行业[24]。
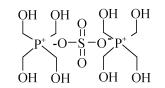 |
| 图 1 THPS结构式 Fig. 1 Structural formula of THPS |
长期投加大量化学杀菌剂不仅会造成环境污染[25-27], 还会增强微生物对杀菌剂的耐药性, 降低防护效果。一般而言, 微生物的生物膜状态比浮游状态具有更强的耐药性, 生物膜中的微生物对各种抗菌剂的敏感性比浮游状态中生长的同一细菌低10~1 000倍[28]。假单胞菌作为好氧菌, 往往定殖于金属锈层生物膜外层中, 是最先响应杀菌剂的微生物之一。如果投加杀菌剂时药量不足, 或者金属表面细菌生物膜耐药性的增强而导致无法将细菌完全杀灭, 那么在这样的杀菌剂耐受条件下, 假单胞菌是否会改变其腐蚀行为呢?目前关于这方面的研究几乎完全空白。
为了初步验证这一猜测, 我们选择本课题组从碳钢腐蚀锈层中分离出来的一株野生型Pseudomonas sp.作为此次研究实验菌株, 选择常用的非氧化型杀菌剂四羟甲基硫酸磷(THPS)作为试验杀菌剂, 展开了实验室条件下杀菌剂THPS耐受条件下Pseudomonas sp.对X70管线钢腐蚀行为的影响研究。
1 实验材料与方法 1.1 材料实验用钢为X70管线钢, 大小为10 mm×10 mm× 5 mm, 其化学成分(质量分数)为: C 0.130%, Si 0.290%, Mn 1.650%, P 0.020%, S 0.010%, V 0.034%, Nb 0.010%, Ti 0.023%。实验前用400#、800#、1500#、2000#的水砂纸逐级打磨, 然后用二次水清洗, 无水乙醇超声清洗, 冷风吹干。无水乙醇超声10 min脱水处理, 真空干燥, 称重, 备用。
1.2 细菌的培养实验用菌株为Pseudomonas sp., 是本课题组从海水全浸碳钢锈层中分离纯化的菌种, 使用前–80℃保藏。实验前将Pseudomonas sp.活化, 接种到无菌培养基中, 在摇床中180 r/min培养进行过夜培养, 培养温度为37℃。培养基成分为: MHB培养基(青岛高科园海博生物科技有限公司)10.5 g/L溶于二次水中, 在121℃下高温蒸汽灭菌20 min。
1.3 细菌耐药性定性实验配置MHB固体培养基, 121℃, 20 min湿热灭菌后置于超净台通风冷却10 min左右, 用0.22 μm口径的无菌滤膜加入相应浓度的THPS水溶液, 摇晃均匀后迅速倒平板备用。将Pseudomonas sp.活化, 在37℃, 180 r/min培养摇床过夜培养, 无菌环境中稀释1000倍, 取20 μL到每个平板进行涂布, 将平板放置在37℃恒温培养箱过夜培养后进行观察。
1.4 实验设计与试验体系本研究共设置4组研究对照体系: M, 无杀菌剂无菌培养体系; MT, 含杀菌剂无菌培养体系; MP, 无杀菌剂接种细菌培养体系; MTP, 含杀菌剂接种细菌培养体系。各体系装置为500 mL体积的广口瓶, 溶液介质为二次水溶解的MHB培养基400 mL, 瓶口用透气的封口膜封闭, 保持空气流畅同时阻隔细菌。在挂片前各体系都经过湿热灭菌处理。
将X70试片分别在上述腐蚀介质中浸泡一定周期后, 进行腐蚀失重测试、腐蚀形貌及腐蚀产物等的测试和表征, 获得相关研究结果。其中含菌体系中, 细菌的接种量为1%的体积比, 初始接种浓度约在106个/mL。经打磨后的X70试片, 每组3个平行样, 紫外光照30 min灭菌处理后, 在超净台悬挂到溶液中, 在30℃恒温培养箱进行静态挂片实验, 实验周期为7 d。对照组在同样的条件下开展有关实验。
1.5 浮游和附着细菌的计数用Auvon细菌计数板在光学显微镜(OLYMPUS DP80)下对浮游和附着细菌进行计数。在无杀菌剂接种细菌MP体系和含杀菌剂接种细菌MTP体系的7 d挂片腐蚀过程中, 分别在第24 h、72 h、120 h、168 h进行浮游和附着细菌计数。
对于浮游细菌计数, 取100 μL培养基, 转移到1 mL灭菌离心管中, 逐级稀释到合适倍数, 进行显微计数。对于试片表面的附着细菌生物膜计数, 首先用灭菌刀片刮取表面的生物膜, 然后将试片和刀片同时放入PBS缓冲液中, 53 Hz超声10 min, 制成菌悬液后, 稀释到合适倍数, 进行观察计数, 每组三个平行样品。
1.6 腐蚀速率测定采用静态腐蚀挂片失重法进行腐蚀速率测定。挂片实验前, 将逐级打磨过的X70试片在无水乙醇中超声除污, 再用二次水清洗, 干燥处理后称重、测量并计算表面积。将X70试片置于上述4种实验体系中, 于30℃恒温培养箱中培养7 d后, 按照《金属和合金的腐蚀-腐蚀试样上腐蚀产物的清除》(GB/T16545-2015)中方法[29], 在酸洗液(500 mL浓盐酸, 3.5 g六次甲基四胺, 加蒸馏水至1 000 mL)中浸泡, 清洗去除腐蚀产物, 然后用灭菌二次水冲洗, 无水乙醇脱水, 真空干燥, 称重。实验设置三个平行组, 最终取平均值为最终结果。腐蚀速率按照如下公式进行计算:
V:腐蚀速率(g·m–2·h–1);
W0:样品的初始质量(g);
W1:去除腐蚀产物后重量(g);
S:试样的表面积(m2);
T:失重腐蚀试验时间(h)。
1.7 材料表面活/死细菌荧光观察实验荧光显微镜观察的样品处理方法:挂片取出后用灭菌PBS缓冲液轻轻冲洗, 用活死细胞染色试剂盒(BioVision)染色(活菌为绿色, 死菌为红色), 37℃暗处理15 min后在荧光显微镜下, 用蓝色荧光观察。
1.8 腐蚀产物形貌观察及成分分析用扫描电子显微镜(SEM)、荧光显微镜、3D-测量激光共聚焦显微镜、XRD和显微红外对各个体系中浸泡后的X70试片进行形貌观察和腐蚀产物测定。观察和测量前的样品处理方法为:将各体系中浸泡的X70试片取出后经氮气吹干, 常温真空干燥处理后进行观察和测试。其中用SEM对含菌体系(MP和MTP体系)中的X70试片观察时, 样品的前期处理方式有所不同:首先用体积分数为5%的戊二醛PBS缓冲液固定生物膜样品2 h, 然后依次用体积分数为25%、50%、75%、100%的乙醇溶液浸泡15 min, 最后对试片进行超临界点CO2干燥、喷金处理。
2 结果与讨论 2.1 THPS对Pseudomonas sp.浮游和吸附性的影响首先用不同浓度梯度(0 μL/L, 75 μL/L, 150 μL/L, 300 μL/L)的THPS对Pseudomonas sp.生长进行耐药性浓度定性筛选试验(图 2), 发现75 μL/L浓度的THPS对Pseudomonas sp.的生长产生较强的抑制作用, 但同时不会杀灭或强烈抑制细菌的生长, 进而导致实验周期的大量延长, 因此下一步实验THPS的浓度统一选择75 μL/L, 该浓度在Pseudomonas sp.耐受范围内。
 |
| 图 2 假单胞菌在含不同浓度THPS的平板上生长情况. Fig. 2 Pseudomonas sp. on the plates with different concentrations of THPS 注: a: 0 μL/L; b: 75 μL/L; c: 150 μL/L; d: 300 μL/L |
在MTP体系中, THPS在前12 h抑制了浮游细菌的生长, 培养基几乎没有变浑浊, 24 h时MTP体系的浑浊度已经与MP体系相似, Pseudomonas sp.浮游细胞的密度与MP体系中已无明显差距, 分别为: 2.29×108个/mL和1.71×108个/mL, 并且都已经进入了稳定期(图 3a)。
 |
| 图 3 MP体系和MTP体系中浮游细菌密度和吸附细菌密度. a: MP体系和MTP体系中浮游细菌的密度; b: MP体系和MTP体系中X70试片表面吸附细菌的密度 Fig. 3 Density of planktonic and sessile bacteria in the MP and MTP systems. a: Density of planktonic bacteria in the MP and MTP systems; b: Density of sessile bacteria on the surface of X70 in the MP and MTP systems |
THPS在30℃, pH 7时的半衰期大概为21.2 d[30], 所以在MTP体系中, 浮游细菌在12 h以后的快速增长不可能是由THPS的降解导致的。分析原因可能是细菌在杀菌剂THPS刺激下快速建立起防御机制来抵抗杀菌剂。
对于附着细菌, 结果则有明显不同。虽然MTP体系与MP体系具有相似的变化趋势, 在整个培养过程中两个体系中X70试片表面吸附细菌数量都呈现增长趋势, 但MTP体系附着细菌数量显著高于MP体系(图 3b)。在第7 d时, 两个体系中吸附细菌的密度分别为: 9.80×107个/cm2和4.32×108个/cm2。添加杀菌剂THPS后, X70表面细菌的吸附数量是没有添加THPS的4~5倍, 说明杀菌剂THPS刺激了Pseudomonas sp.生物膜在X70试片表面的附着增长。Yu Yang等也报道过亚致死浓度的纳米银能增强铜绿假单胞菌PAO1的生物膜形成能力[31]。
通过活死菌染色荧光显微镜观察发现, 第7 d时MP体系中X70试片表面细菌大量死亡或濒临死亡, 而MTP(有杀菌剂)体系中X70试片表面细菌数量明显多于MP(无杀菌剂)体系, 细菌只有少量死亡且细菌呈现出更明显的膜形状(图 4a, 4b)。可能原因是在杀菌剂THPS的长时间刺激下, 细菌代谢适应导致其更强的耐受性[32], 同时, Pseudomonas sp.在杀菌剂刺激下更倾向于吸附到X70表面且分泌出更多的胞外多聚物将细胞紧密交联在一起, 在胞外多聚物的保护下, 细菌具有更强的抗性。而没有添加杀菌剂THPS时, 细菌附着在X70表面形成的胞外多聚物相对较少, 成膜相对稀疏, 在培养体系中营养物质消耗殆尽的情况下细菌代谢活性可能较低。
 |
| 图 4 MP体系和MTP体系中X70试片浸泡7 d后表面吸附细菌荧光染色图 Fig. 4 Fluorescence staining of sessile bacteria on the surface of X70 test coupons seven days after immersion in the MP and MTP systems 注: a: M体系; b: MTP体系 |
无菌条件下(M和MT体系), 75 μL/L的THPS促进了X70试片表面的腐蚀。M体系中X70试片表面的腐蚀速率为0.064 5 g·m–2·h–1; MT体系中X70试片表面的腐蚀速率为0.128 5 g·m–2·h–1(P < 0.05), 明显高于M体系。因此, 75 μL/L的THPS能促进X70试片表面的腐蚀。可能原因是THPS溶液呈酸性, 在一定程度上增加了体系中质子浓度, 导致腐蚀增加。
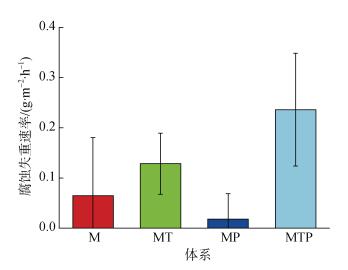 |
| 图 5 X70管线钢在不同体系中浸泡7天后的腐蚀失重速率 Fig. 5 Corrosion weight loss rate of X70 pipeline steel after immersion for 7 days under different systems |
无杀菌剂THPS条件下(M和MP体系), Pseudomonas sp.抑制了X70试片表面的腐蚀。MP体系中X70试片表面的腐蚀速率为0.017 9 g·m–2·h–1(P < 0.05), 明显低于M体系中的, 说明在该培养条件下Pseudomonas sp.对X70试片产生明显的抑制作用。可能原因是Pseudomonas sp.的大量生长繁殖消耗了体系中的氧气, 使得MP体系处于一个相对缺氧的状态, 阻碍了电子到氧气的传输过程, 从而抑制了试片表面的腐蚀。
MTP体系中, 试样的腐蚀速率是最高的, 其腐蚀速率达到了0.236 1 g·m–2·h–1(P≤0.05), 是MT的1.84倍, M的3.66倍。其原因可能有以下几种: (1) Pseudomonas sp.在杀菌剂THPS的刺激下改变了其代谢途径或产生了新的具有腐蚀性的代谢产物; (2)吸附在X70试片表面的Pseudomonas sp.分泌的胞外多聚物(EPS)具有腐蚀性; 在杀菌剂的刺激下, 由于细菌的趋利避害性Pseudomonas sp.更倾向于吸附到X70试片表面, 即其成膜性增强(图 3b, 图 4b), 因此腐蚀性增强。(3) Pseudomonas sp.可与X70试片进行直接电子传递, 杀菌剂的刺激增强了Pseudomonas sp.直接获取电子来维持生命的能力, 同时由于吸附数量增多导致腐蚀加速。顾等也曾提出SRB的腐蚀与H2S关系不大而与附着细菌数量呈正相关, SRB主要通过电子传递造成金属腐蚀[33]。
2.3 腐蚀形貌表征通过扫描电镜和3D-测量激光共聚焦显微镜来观察各体系中X70试片表面的腐蚀形貌。通过扫描电镜可以观察到在M体系中, X70试片表面的腐蚀产物呈比较平整的片状(图 6a, 图 7a), 大量裂痕将腐蚀产物分裂成小片状, 该腐蚀形貌与Ashassi-Sorkhabi H等发现的一株铁氧化菌对金属的腐蚀形貌类似[34]。而事实上该假单胞菌也能在铁氧化菌筛选培养基中生长, 因此也具备铁氧化能力。从宏观来看, 该腐蚀产物偏黄色, 轻薄的一层附着在X70表面, 疏松易脱落。
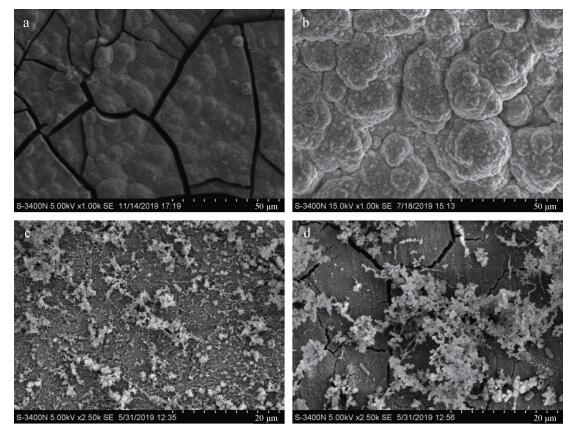 |
| 图 6 X70试片在不同体系中浸泡7天扫描电镜图 Fig. 6 SEM image of X70 coupons immersed in the different systems for seven days 注: a: M体系; b: MT体系; c: MP体系; d: MTP体系 |
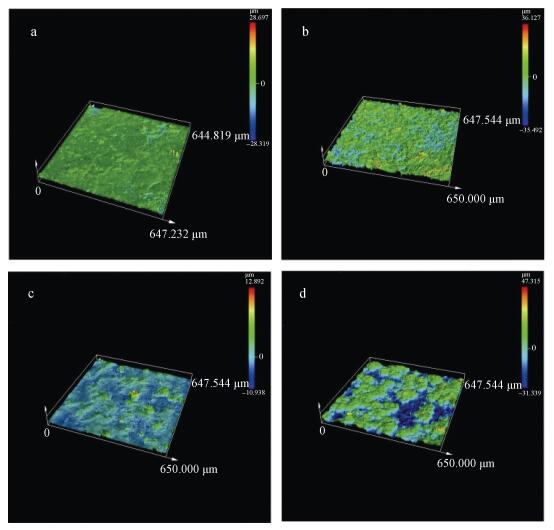 |
| 图 7 X70试片在不同体系中浸泡7天后3D-测量激光共聚焦显微镜观察形貌图 Fig. 7 Topographic height map observed by the 3D measurement of laser confocal microscope on the surface of X70 coupons immersed for seven days via the laser confocal microscope 注: a: M体系中X70试片表面的腐蚀产物; b: MT体系中X70试片表面的腐蚀产物; c: MP体系中X70试片表面的腐蚀产物; d: MTP体系中X70试片表面的腐蚀产物 |
MT体系中的X70试片表面腐蚀产物比M体系中更厚且更加粗糙(图 7b), 显微镜下局部呈现半球形(图 6b), 但也疏松易脱落。MP体系中X70试片表面覆盖一层薄的生物膜和疏松的腐蚀产物(图 6c, 图 7c), 宏观上可直观的看到基体几乎没有被腐蚀, 说明Pseudomonas sp.抑制了金属的腐蚀, 这和腐蚀失重速率结果一致。在MTP体系中X70试片表面覆盖一层生物膜和较疏松的腐蚀产物, 同时也有大量规则晶体状致密结实的腐蚀产物(图 6d), 从宏观上看腐蚀产物比MP体系厚实致密且不易脱落(图 7d), 同时在腐蚀产物或基体上可看到有多处裂痕(图 6d)。
2.4 腐蚀产物分析不同体系中X70试片表面腐蚀产物有明显差异(图 8)。MP体系中因为X70试片表面腐蚀程度很轻, 所以XRD只能检测到基体Fe的峰; MTP体系中X70试片表面的腐蚀产物种类最丰富, 主要有Fe2O3、Fe3(PO4)2·8H2O和α-FeOOH; M体系和MP体系中X70试片表面能检测到的XRD峰非常微弱(图 8), 可能原因是腐蚀产物质量较小且易脱落。M体系中X70试片表面可能有Fe2O3的存在, 在MT体系中X70试片表面可能有FeCO3的存在。
 |
| 图 8 不同体系中X70试片浸泡7天后腐蚀产物XRD图 Fig. 8 XRD patterns of corrosion products for X70 coupons immersed in the different systems for seven days |
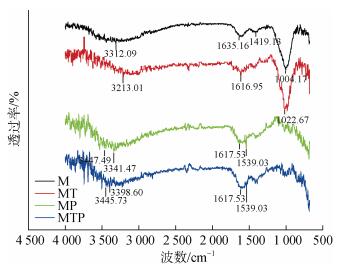 |
| 图 9 在不同体系中浸泡7天后X70试片表面的红外图谱 Fig. 9 Infrared spectrum of the X70 surface after soaking in the different systems for seven days |
含菌和无菌体系中, X70试片表面的有机腐蚀产物类型差异较大。无菌的M体系和MT体系中X70试片表面的腐蚀产物具有相似的红外图谱, 其细微的差异由THPS的添加引起。无菌的两个体系中X70试片表面的腐蚀产物红外图谱的最强峰都是在1 000 cm–1附近, 在1 635 cm–1和1 419 cm–1附近有较强吸收峰, 根据图谱份分析, 两个体系中的腐蚀产物可能会有酰胺类物质的存在, 也可能是体系中的一些蛋白质等成分与金属螯合形成的一些腐蚀产物成分。MT体系中吸收峰强度大于M体系, 说明其有机腐蚀产物含量大于M体系。
含菌的MP和MTP体系中X70试片表面的腐蚀产物具有相似的红外图谱, 其最强峰在3 400 cm–1附近和1 617 cm–1附近分别对应于O-H的伸缩运动和C=C伸缩运动。3 500~3 100cm–1之间的峰、1 422 cm–1附近的峰、1 000 cm–1附近的吸收峰、1 120~1 130 cm–1之间的吸收峰以及1 400~1 450 cm–1处的吸收峰分别对应于N-H伸缩振动、C-C伸缩运动、C-O伸缩振动、O-C-O的特征吸收峰和羧酸官能团[35]。而这些官能团结构是多糖、脂蛋白、细胞表面蛋白等细胞外多聚物的组成结构, 证实了试片表面胞外聚合物的存在, 其可能参与了腐蚀过程。MTP体系中X70表面腐蚀产物红外吸收峰大于MP体系, 说明其胞外多聚物多于MP体系中, 这与荧光显微镜观察结果和腐蚀失重结果相一致。这两个体系中红外图谱的细微差异可能是由于在杀菌剂THPS的刺激下杀菌剂代谢产物有所差异导致的。而含菌体系与无菌体系中有机腐蚀产物的巨大差异说明了细菌及其分泌的胞外聚合物对有机腐蚀产物有显著影响。
3 结论在添加了75μL/L杀菌剂THPS的含菌体系中, Pseudomonas sp.改变了其对X70试片表面的腐蚀行为(与没有添加杀菌剂THPS的含菌体系相比), 从抑制腐蚀转变成了促进腐蚀。原因可能是Pseudomonas sp.改变了代谢途径, 产生了具有腐蚀性的代谢产物; 或者其电子传递方式发生了改变导致其腐蚀行为的逆转, 但具体机理需进一步实验验证。本次研究说明在添加杀菌剂的实际环境中, 微生物的腐蚀行为和机理可能与传统意义的腐蚀行为和机理不同, 这是本次研究最大的创新性。
同时, 研究结果说明结合生产实践进一步深入研究在杀菌剂存在条件下细菌的腐蚀行为和腐蚀机理是十分必要的。另外, 在微生物腐蚀防护研究过程中充分考虑实际环境, 结合环境中不同理化因素如杀菌剂种类、油水混合物种类、水的流速等条件进行研究, 也许会为腐蚀防护研究提供新的视角, 同时也更具有实际意义。
| [1] |
Zhang Y, Ma Y, Duan J, et al. Analysis of marine microbial communities colonizing various metallic materials and rust layers[J]. Biofouling, 2019, 35(4): 429-442. DOI:10.1080/08927014.2019.1610881 |
| [2] |
吴进怡, 肖伟龙, 柴柯, 等. 热带海洋环境下海水中微生物对45钢腐蚀行为的单因素影响[J]. 金属学报, 2010, 46(1): 118-122. Wu Jinyi, Xiao Weilong, Chai Ke, et al. Single factor effect of microorganisms in seawater on corrosion behavior of 45 steel in tropical marine environment[J]. Acta Metallurgica Sinica, 2010, 46(1): 118-122. |
| [3] |
吴进怡, 柴柯, 肖伟龙, 等. 25钢在海水中的微生物单因素腐蚀[J]. 金属学报, 2010, 6(6): 755-760. Wu Jinyi, Chai Ke, Xiao Weilong, et al. Microbial single-factor corrosion of 25 steel in seawater[J]. Journal of Metals, 2010, 6(6): 755-760. |
| [4] |
肖伟龙, 柴柯, 杨雨辉, 等. 25钢在热带海洋环境下海水中的微生物腐蚀及其对力学性能的影响[J]. 中国腐蚀与防护学报, 2010, 30(5): 359-362. Xiao Weilong, Chai Ke, Yang Yuhui, et al. Microbial corrosion of 25 steel in seawater in tropical marine environment and its effect on mechanical properties[J]. Journal of Chinese Society for Corrosion and protection, 2010, 30(5): 359-362. |
| [5] |
Rajasekar A, Ting Y P. Role of Inorganic and organic medium in the corrosion behavior of Bacillus megaterium and Pseudomonas sp. in stainless steel SS 304[J]. Industrial & Engineering Chemistry Research, 2011, 50(22): 12534-12541. |
| [6] |
Obuekwe C O, Westlake D W S, Plambeck J A. Evidence that available energy is a limiting factor in the bacterial corrosion of mild-steel by a Pseudomonas sp.[J]. Canadian Journal of Microbiology, 1987, 33(3): 272-275. DOI:10.1139/m87-046 |
| [7] |
Nandakumar K, Sreekumari K R, Kikuchi Y. Antibacterial properties of magnesium alloy AZ31B:in-vitro studies using the biofilm-forming bacterium Pseudomonas sp.[J]. Biofouling, 2002, 18(2): 129-135. DOI:10.1080/08927010290032386 |
| [8] |
Lan G, Chen C, Liu Y, et al. Corrosion of carbon steel induced by a microbial-enhanced oil recovery bacterium Pseudomonas sp. SWP-4[J]. Rsc Advances, 2017, 7(10): 5583-5594. DOI:10.1039/C6RA25154D |
| [9] |
Li Q, Dong L, Yang Y, et al. Corrosion behavior of AISI 1045 carbon steel in metalworking fluids containing Pseudomonas xiamenensis[J]. International Journal of Electrochemical Science, 2020, 15(1): 470-483. |
| [10] |
Feng H, Li H, Lu P, et al. Investigation on microbiologically influenced corrosion behavior of CrCoNi medium-entropy alloy by Pseudomonas aeruginosa[J]. Acta Metallurgica Sinica, 2019, 55(11): 1457-1468. |
| [11] |
Zhou E, Li H, Yang C, et al. Accelerated corrosion of 2304 duplex stainless steel by marine Pseudomonas aeruginosa biofilm[J]. International Biodeterioration & Biodegradation, 2018, 127: 1-9. |
| [12] |
Xu D, Xia J, Zhou E, et al. Accelerated corrosion of 2205 duplex stainless steel caused by marine aerobic Pseudomonas aeruginosa biofilm[J]. Bioelectrochemistry, 2017, 113: 1-8. DOI:10.1016/j.bioelechem.2016.08.001 |
| [13] |
Saleem Khan M, Li Z, Yang K, et al. Microbiologically influenced corrosion of titanium caused by aerobic marine bacterium Pseudomonas aeruginosa[J]. Journal of Materials Science & Technology, 2019, 35(1): 216-222. |
| [14] |
Li H, Yang C, Zhou E, et al. Microbiologically influenced corrosion behavior of S32654 super austenitic stainless steel in the presence of marine Pseudomonas aeruginosa biofilm[J]. Journal of Materials Science & Technology, 2017, 33(12): 1596-1603. |
| [15] |
Liu H, Fu C, Gu T, et al. Corrosion behavior of carbon steel in the presence of sulfate reducing bacteria and iron oxidizing bacteria cultured in oilfield produced water[J]. Corrosion Science, 2015, 100: 484-495. DOI:10.1016/j.corsci.2015.08.023 |
| [16] |
Gubner R, Beech I B. The effect of extracellular polymeric substances on the attachment of Pseudomonas NCIMB 2021 to AISI 304 and 316 stainless steel[J]. Biofouling, 2000, 15(1-3): 25-36. DOI:10.1080/08927010009386295 |
| [17] |
Guan F, Zhai X F, Duan J Z, et al. Influence of sulfate-reducing bacteria on the corrosion behavior of 5052 aluminum alloy[J]. Surface & Coatings Technology, 2017, 316: 171-179. |
| [18] |
Guan F, Yuan X, Duan J, et al. Phenazine enables the anaerobic respiration of Pseudomonas aeruginosa via electron transfer with a polarised graphite electrode[J]. International Biodeterioration & Biodegradation, 2019, 137: 8-13. |
| [19] |
Huang L, Huang Y, Lou Y, et al. Pyocyanin-modifying genes phzM and phzS regulated the extracellular electron transfer in microbiologically-influenced corrosion of X80 carbon steel by Pseudomonas aeruginosa[J]. Corrosion Science, 2020, 164: 108355. DOI:10.1016/j.corsci.2019.108355 |
| [20] |
Torres Bautista B E, Wikiel A J, Datsenko I, et al. Influence of extracellular polymeric substances (EPS) from Pseudomonas NCIMB 2021 on the corrosion behaviour of 70Cu-30Ni alloy in seawater[J]. Journal of Electroanalytical Chemistry, 2015, 737: 184-197. DOI:10.1016/j.jelechem.2014.09.024 |
| [21] |
Scheerder J, Breur R, Slaghek T, et al. Exopolysaccharides (EPS) as anti-corrosive additives for coatings[J]. Progress in Organic Coatings, 2012, 75(3): 224-230. DOI:10.1016/j.porgcoat.2012.05.003 |
| [22] |
Li S, Qu Q, Li L, et al. Bacillus cereus s-EPS as a dual bio-functional corrosion and scale inhibitor in artificial seawater[J]. Water Research, 2019, 166: 115094. DOI:10.1016/j.watres.2019.115094 |
| [23] |
Bao Q, Zhang D, Lv D, et al. Effects of two main metabolites of sulphate-reducing bacteria on the corrosion of Q235 steels in 3.5wt.% NaCl media[J]. Corrosion Science, 2012, 65: 405-413. DOI:10.1016/j.corsci.2012.08.044 |
| [24] |
Jia R, Unsal T, Xu D, et al. Microbiologically influenced corrosion and current mitigation strategies:A state of the art review[J]. International Biodeterioration & Biodegradation, 2019, 137: 42-58. |
| [25] |
刘宏芳, 黄玲, 刘涛, 等. 硫酸盐还原菌杀菌剂应用现状及研究进展[J]. 中国腐蚀与防护学报, 2009, 29(2): 154-160. Liu Hongfang, Huang Ling, Liu Tao, et al. Application status and research progress of sulfate reducing bactericides[J]. Journal of Chinese Society for Corrosion and protection, 2009, 29(2): 154-160. |
| [26] |
刘宏芳, 杨华啸, 黄玲, 等. 环境友好型溴类杀菌剂的合成及其抗菌防腐蚀性能研究[J]. 材料保护, 2008, 41(7): 18-20. Liu Hongfang, Yang Huaxiao, Huang Ling, et al. Synthesis of environmentally friendly bromine fungicides and their antibacterial and anticorrosive properties[J]. Materials Protection, 2008, 41(7): 18-20. |
| [27] |
Xu D, Wen J, Gu T, et al. Biocide cocktail consisting of glutaraldehyde, ethylene diamine disuccinate (EDDS), and methanol for the mitigation of souring and biocorrosion[J]. Corrosion, 2012, 68(11): 994-1002. DOI:10.5006/0605 |
| [28] |
Davies, D. Understanding biofilm resistance to antibacterial agents[J]. Nature Review Drug Discovery, 2003, 2(2): 114-122. DOI:10.1038/nrd1008 |
| [29] |
孙艳, 吴佳佳, 张盾, 等. 不同海域、不同腐蚀区带Q235碳钢实海挂片腐蚀产物层内微生物调查[J]. 中国腐蚀与防护学报, 2018, 38(4): 333-342. Sun Yan, Wu Jiajia, Zhang Dun, et al. Microbial investigation in the corrosion product layer of Q235 carbon steel solid sheet in different sea areas and different corrosion zones[J]. Journal of Chinese Society for Corrosion and protection, 2018, 38(4): 333-342. |
| [30] |
Sharma M, Menon P, Voordouw J, et al. Effect of long term application of tetrakis (hydroxymethyl)-phosphonium sulfate (THPS) in a light oil-producing oilfield[J]. Biofouling, 2018, 34(6): 605-617. DOI:10.1080/08927014.2018.1476500 |
| [31] |
Gilbert P, Allison D G, McBain A J. Biofilms in vitro and in vivo:do singular mechanisms imply cross-resistance[J]. Applied Microbiology, 2002, 92: 98S-110S. DOI:10.1046/j.1365-2672.92.5s1.5.x |
| [32] |
Crabbé A, Jensen P Ø, Bjarnsholt T, et al. Antimicrobial tolerance and metabolic adaptations in microbial biofilms[J]. Trends in Microbiology, 2019, 27(10): 850-863. DOI:10.1016/j.tim.2019.05.003 |
| [33] |
Gu T Y, Jia R, Unsal T, et al. Toward a better understanding of microbiologically influenced corrosion caused by sulfate reducing bacteria[J]. Journal of Materials Science & Technology, 2019, 35(4): 631-636. |
| [34] |
Ashassi-Sorkhabi H, Moradi-Haghighi M, Zarrini G, et al. Corrosion behavior of carbon steel in the presence of two novel iron-oxidizing bacteria isolated from sewage treatment plants[J]. Biodegradation, 2012, 23(1): 69-79. DOI:10.1007/s10532-011-9487-8 |
| [35] |
李梓番.环境优势微生物对高放废物处置材料钢和水泥砂浆腐蚀影响基础研究[D].绵阳: 西南科技大学, 2015. Li Zifan. Basic research on the impact of environmentally superior microorganisms on the corrosion of high-level radioactive waste disposal materials steel and cement mortar[D]. Mianyang: Southwest University of Science and Technology, 2015. |
 2020, Vol. 44
2020, Vol. 44


