文章信息
- 梁英, 纪维玮, 石伟杰, 田传远, 胡乃霞, 闫译允. 2020.
- LIANG Ying, JI Wei-wei, SHI Wei-jie, TIAN Chuan-yuan, HU Nai-xia, YAN Yi-yun. 2020.
- 氮限制时间对海绿球藻和微绿球藻生长、总脂含量及脂肪酸组成的影响
- Effects of nitrogen limitation time on growth, total lipid content, and fatty acid composition of Halochlorococcum sarcotum and Nannochloris oculata
- 海洋科学, 44(2): 45-55
- Marine Sciences, 44(2): 45-55.
- http://dx.doi.org/10.11759/hykx20190831002
-
文章历史
- 收稿日期:2019-08-31
- 修回日期:2019-11-21
2. 国家海洋局秦皇岛海洋环境监测中心站, 河北 秦皇岛 066002
2. Marine Environment Monitoring Central Station of Qinhuangdao, State Oceanic Administration, Qinhuangdao 066002, China
近年来, 由于各种环境问题, 可持续生物燃料替代物一直是研究的重点。目前, 将可再生的生物柴油用作燃料则是一种备受关注的发展方向。微藻因含有较多脂类而成为生物柴油原料的良好选材之一[1]。微藻的细胞组分(如蛋白质、脂类、色素等)会随着培养条件的改变而改变[2]。许多研究表明, 环境因子(如温度、光照、pH、盐度等)能够对微藻生长产生影响, 其中光照是重要影响因子, 通过影响叶绿素a的合成从而影响微藻的光合作用及其生长, 同时对细胞内油脂等生化成分产生影响[3-6]。另外, 养分限制尤其是氮限制, 通常是增加微藻细胞中特定目标成分的有效途径。国内外学者通过对藻类生物量和脂类积累的研究, 为生物柴油生产技术发展提供了参考[7]。在氮限制条件下, 大部分微藻有可能积累大量的脂类或碳水化合物[8]。
氮元素在所有生物的生长发育过程中都是必不可少的营养元素, 并且它还参与多数生物大分子的合成。研究发现, 氮限制条件可促进某些藻细胞的分裂, 并且使蛋白质合成受抑制, 从而抑制细胞内色素合成, 大幅降低了光合作用效率, 而三酰甘油(TG)及活性氧(ROS)的含量显著提高[9]。Han等[10]在半连续培养条件下进行了蛋白核小球藻(Chlorella pyrenoidosa)的培养, 研究表明, 氮限制可以使细胞的脂质含量增加。Bona等[11]研究发现, 氮限制是富油新绿藻(Neochloris oleoabundans)生产脂肪酸的一种简便操作策略。吴琼芳等[12]在不同初始NaNO3浓度条件下培养普通小球藻(Chlorella vulgaris Beijierineck), 结果表明适当氮限制可以促进普通小球藻细胞内脂质的积累。近年来, 很多学者对多种微藻进行了氮限制条件下的研究[13-16], 发现不同微藻种类、氮限制程度及时间等因素都会对微藻生物量、总脂含量和脂肪酸组成造成不同程度的影响。目前看来, 影响微藻生长及总脂含量的具体氮限制时间的相关研究较少, 需要对此开展进一步的研究。
海绿球藻(Halochlorococcum sarcotum)生长速度较快, 有潜力作为优良的生物柴油原料。微绿球藻(Nannochloris oculata)富含多种营养, 具有较高的油脂含量, 且较易于培养, 也可作为产油微藻[17]。目前, 石伟杰[18]及梁英[19]的相关报道显示, 海绿球藻和微绿球藻总脂含量能分别达到干重的35.80%和40.42%。本实验以海绿球藻及微绿球藻作为实验材料, 研究不同氮限制时间对二者的生长及总脂含量影响, 为提高藻细胞的生物量、积累更多的生物活性物质及大规模培养提供理论依据。
1 材料与方法 1.1 藻种来源及实验设计用于本研究的海绿球藻(Halochlorococcum sarcotum)和微绿球藻(Nannochloris oculata)藻种, 均来源于中国海洋大学水产学院微藻实验室, 代号分别为MACC/C11和MACC/C14。
实验所用培养基为f培养基, 即f/2培养基[20]营养盐浓度的两倍, 将40 mL处于指数生长期的两种藻分别接种到2000 mL的f培养基中, 均以5×105个/mL作为初始接种密度, 设置3个重复。藻种在温度(25±1)℃, 盐度31, 光照强度100 μmol·m–2∙s–1的条件下连续充空气培养。到指数生长末期, 将每瓶2 000 mL藻液平均分为5份, 每份400 mL, 将每份藻液离心收获后, 分别接种到400 mL不含氮的f培养基中进行氮限制实验, 氮限制时间设定为0、1、2、4和6 d, 每份对应一个氮限制时间, 每个处理组3个重复, 培养时间共为6 d, 培养条件同上。每天于固定时间取藻液适量, 进行细胞密度及叶绿素荧光参数测定。在氮限制0、1、2、4、6 d后分别离心收获这两种藻, 进行单位体积干重及叶绿素含量、总脂及脂肪酸含量的测定。
1.2 各项参数测定细胞密度用血球计数板测定4次, 并取其平均值。叶绿素荧光参数的测定按梁英等[21]的方法进行, 用Platt等[22]的方程快速拟合光曲线, 得到以下参数:最大相对电子传递速率rETRmax, 快速光曲线的初始斜率α和最小饱和光照强度Ik。光系统Ⅱ最大光能转化效率Fv/Fm及非光化学淬灭NPQ可直接读取。叶绿素含量测定使用戴荣继等[23]的方法进行。
生物量使用电子分析天平测定, 用单位体积干重表示, 单位为g·L–1。总脂含量(用占干重百分比表示)用改进的Bligh-Dyer法[24]进行测定。总脂产量g·L–1的计算公式为:总脂产量=总脂含量×干重。总脂产率g·(L·d)–1计算公式为:总脂产率=总脂含量×干重/培养天数。
脂肪酸含量测定参照梁英等[25]的方法, 首先对离心收获后的样品进行冷冻干燥处理, 然后用改进的乙酰氯甲醇方法[26]将样品甲酯化, 最后萃取脂肪酸甲酯, 待分层后, 取上清液进行脂肪酸分析。
1.3 数据处理数据使用SPSS24软件处理, 以P < 0.05为差异显著标准, 进行单因子方差分析及多重比较。作图使用Sigmaplot12.5软件。
2 结果与分析 2.1 氮限制时间对海绿球藻和微绿球藻叶绿素荧光特性的影响图 1为海绿球藻和微绿球藻在氮限制0~6 d时的快速光响应曲线, 根据快速光响应曲线拟合得到参数如表 1所示。由单因子方差分析结果可以看出, 氮限制时间对海绿球藻和微绿球藻的rETRmax、α和Ik的影响具有显著性差异(P < 0.05)。由表可知, 海绿球藻的rETRmax从第1 d开始随氮限制时间的增加逐渐降低, 在氮限制6 d时达到最小值。α在氮限制0~2 d逐渐降低, 氮限制2 d后变化不显著。Ik在氮限制0~ 1 d时增加, 第1 d达到最大值, 而后随氮限制时间的增加逐渐降低, 在氮限制的第5 d达到最小值。由图 2可知氮限制时间对海绿球藻光系统Ⅱ最大光能转化效率Fv/Fm、非光化学淬灭NPQ产生的影响, 经分析也具有显著性差异(P < 0.05)。海绿球藻在氮限制0~1 d时Fv/Fm值从0.69增加到0.72, 1~5 d随氮限制时间的增加而逐渐下降, 到氮限制第6 d时下降至0.68。在氮限制1~3 d时, NPQ值逐渐增加, 在第3 d达到最大值后, 随氮限制时间的增加, 该值整体趋势为逐渐减小。
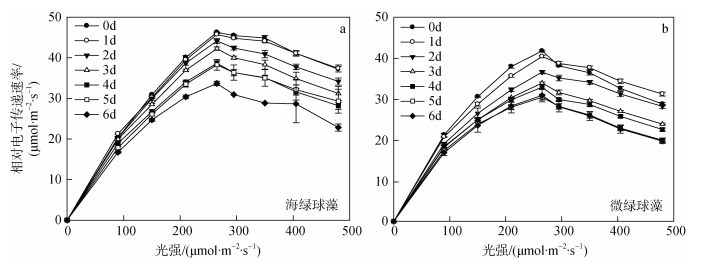 |
| 图 1 不同氮限制时间下海绿球藻和微绿球藻的快速光响应曲线 Fig. 1 Fast photoresponse curves of Halochlorococcum sarcotum and Nannochloris oculata under different nitrogen limitation times |
| 微藻 种类 |
测定指标 | 氮限制时间/d | ||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | ||
| 海绿 球藻 |
rETRmax/ (μmol·m–2·s–1) |
37.67±0.21d | 37.52±0.43d | 33.39±0.79c | 30.93±0.26b | 30.03±0.35b | 28.00±0.55a | 27.91±1.41a |
| α | 0.38±0.01c | 0.34±0.01b | 0.31±0.00a | 0.31±0.00a | 0.31±0.01a | 0.31±0.00a | 0.31±0.02a | |
| Ik/ (μmol·m–2·s–1) |
99.14±0.22c | 110.27±1.21d | 109.23±2.18d | 99.343±0.18c | 95.92±2.71b | 90.91±1.11a | 91.09±1.63a | |
| 微绿 球藻 |
rETRmax/ (μmol·m–2·s–1) |
43.38±0.23e | 42.98±0.36e | 40.51±0.67d | 38.19±0.73c | 35.00±0.44b | 34.98±1.64b | 30.40±0.72a |
| α | 0.35±0.00c | 0.35±0.01c | 0.35±0.00c | 0.34±0.01c | 0.32±0.01b | 0.31±0.01a | 0.30±0.00a | |
| Ik/ (μmol·m–2·s–1) |
123.24±1.21c | 123.78±2.85c | 115.85±1.39bc | 111.00±4.87b | 107.83±3.27ab | 113.95±9.48b | 101.68±2.82a | |
| 注:多重比较分析结果按升序排列, 即a < b < c < d < e, 同行上标不同字母表明组间差异显著(P < 0.05)。下同。 | ||||||||
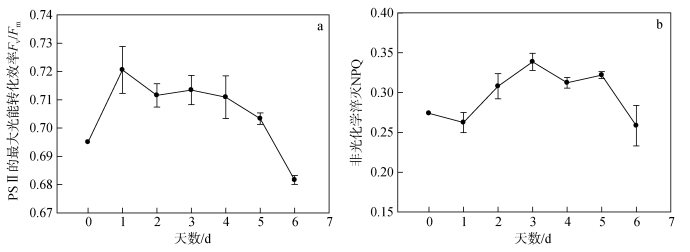 |
| 图 2 不同氮限制时间下海绿球藻光系统Ⅱ最大光能转化效率及非光化学淬灭的变化 Fig. 2 Changes in the value of Fv/Fm and NPQ of Halochlorococcum sarcotum under different nitrogen limitation times |
由表 1可以看出, 随氮限制时间延长, 微绿球藻的rETRmax随之明显降低。α变化趋势为随氮限制时间的增加持续降低。图 3表明, 微绿球藻的Fv/Fm值在氮限制0~1 d时稍有增加, 从0.70增至0.72, 1 d后逐渐降低, 到氮限制第6 d时降低至最小值0.64。NPQ值随氮限制时间的增加先降低, 在氮限制4 d时达到最小值, 然后逐渐升高。
 |
| 图 3 不同氮限制时间下微绿球藻光系统Ⅱ最大光能转化效率及非光化学淬灭的变化 Fig. 3 Changes in the value of Fv/Fm and NPQ of Nannochloris oculata under different nitrogen limitation times |
图 4所示为不同氮限制时间下海绿球藻和微绿球藻细胞密度的变化。随着氮限制时间增加, 海绿球藻细胞密度有较小幅度的增加, 氮限制6 d时细胞密度是0 d时的1.08倍; 微绿球藻的细胞密度逐渐增加, 且总体变化幅度较小, 在氮限制的第5 d达到最大值, 此时细胞密度是0 d时的1.08倍。
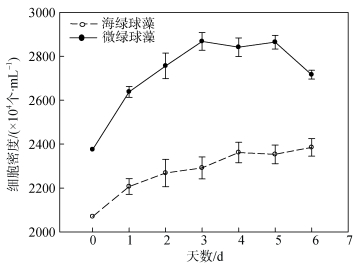 |
| 图 4 不同氮限制时间下海绿球藻和微绿球藻细胞密度的变化 Fig. 4 Changes in the cell densities of Halochlorococcum sarcotum and Nannochloris oculata under different nitrogen limitation times |
不同氮限制时间下海绿球藻和微绿球藻生物量及叶绿素含量的变化如表 2所示。海绿球藻在氮限制0 d时生物量最低, 随氮限制时间增加其生物量增加, 且氮限制1~6 d之间生物量没有显著性差异。微绿球藻生物量的变化趋势与海绿球藻相一致。由表可知, 两种藻的叶绿素含量均随氮限制时间的增加而逐渐降低。氮限制0~1 d时海绿球藻的叶绿素含量显著高于2~6 d时海绿球藻的叶绿素含量, 微绿球藻在氮限制0 d时叶绿素含量最高, 6 d时叶绿素含量达到最小值。
| 微藻种类 | 测定指标 | 氮限制时间/d | ||||
| 0 | 1 | 2 | 4 | 6 | ||
| 海绿球藻 | 生物量/(g∙L–1) | 0.47±0.02a | 0.52±0.01b | 0.52±0.03b | 0.54±0.02b | 0.54±0.02b |
| 叶绿素含量/(μg∙mL–1) | 3.05±0.23b | 3.54±0.29b | 2.48±0.33a | 2.47±0.25a | 2.00±0.30a | |
| 微绿球藻 | 生物量/(g·L–1) | 0.41±0.02a | 0.46±0.01b | 0.47±0.02b | 0.48±0.02b | 0.49±0.02b |
| 叶绿素含量/(μg∙mL–1) | 11.31±0.24c | 10.59±0.51c | 9.53±0.16b | 9.19±0.09b | 7.96±0.72a | |
表 3所示的是不同氮限制时间下海绿球藻和微绿球藻的总脂含量、总脂产量和总脂产率。由表可以看出, 海绿球藻的总脂含量和总脂产量均随氮限制时间的增加而逐渐增加。海绿球藻在氮限制0 d时的总脂含量(34.93%)和总脂产量(0.16 g∙L–1)处于最小值, 氮限制4 d时, 该藻的总脂含量和总脂产量均达到最大值, 分别为47.34%和0.25 g∙L–1, 比0 d时增加了35.53%和56.25%。氮限制2 d时海绿球藻总脂产率达到最大值0.021 g∙(L∙d)–1, 显著高于其他氮限制时间的总脂产率, 总体呈现先增加后减少的趋势。总脂产率这一指标通过反映油脂积累速率, 可以完善产油藻株的评价标准, 因此, 2 d是海绿球藻的最佳氮限制时间。
| 微藻种类 | 测定指标 | 氮限制时间/d | ||||
| 0 | 1 | 2 | 4 | 6 | ||
| 海绿球藻 | 总脂含量/% | 34.93±1.12a | 36.20±1.44a | 47.32±1.42b | 47.34±0.66b | 46.09±1.44b |
| 总脂产量/(g·L–1) | 0.16±0.01a | 0.19±0.01b | 0.25±0.01c | 0.25±0.01c | 0.25±0.01c | |
| 总脂产率/[g·(L·d)–1] | 0.016±0.001ab | 0.017±0.001ab | 0.021±0.001c | 0.018±0.001b | 0.016±0.001a | |
| 微绿球藻 | 总脂含量/% | 33.36±0.49a | 36.24±1.40b | 43.81±1.32c | 46.39±0.26d | 47.46±1.11d |
| 总脂产量/(g·L–1) | 0.14±0.01a | 0.17±0.01b | 0.20±0.00c | 0.22±0.01d | 0.23±0.01d | |
| 总脂产率/[g·(L·d)–1] | 0.014±0.001a | 0.015±0.001bc | 0.017±0.000d | 0.016±0.001c | 0.015±0.001ab | |
随着氮限制时间的增加, 微绿球藻的总脂含量及总脂产量逐渐增加。氮限制0 d时, 微绿球藻的总脂含量(33.36%)和总脂产量(0.14 g∙L–1)处于最小值。氮限制6 d时, 该藻的总脂含量和总脂产量均达到最大值, 分别为47.46%和0.23 g∙L–1, 比0 d时增加42.23%和64.29%。随氮限制时间的延长, 微绿球藻总脂产率先增加后减少, 在氮限制2 d时达到最大值0.017 g∙(L∙d)–1, 显著高于其他氮限制时间的总脂产率。因此, 2 d是微绿球藻的最佳氮限制时间。
2.4 氮限制时间对海绿球藻和微绿球藻脂肪酸组成的影响不同氮限制时间下海绿球藻脂肪酸的组成如图 5所示。由图可知, 海绿球藻的主要脂肪酸是16:0(18.04%~20.40%)、18:0(3.87%~6.09%)、20:0 (1.72%~2.41%)、18:1n-9(40.96%~52.62%)、16:3n-3 (4.05%~7.11%)和18:2n-6(13.96%~17.81%)。单因子方差分析结果显示, 氮限制对海绿球藻的18:0、20:0及SFA(饱和脂肪酸总和)的影响差异不显著(P > 0.05), 而对18:1n-9、MUFA(单不饱和脂肪酸总和)以及PUFA(多不饱和脂肪酸总和)的影响具有显著性差异(P < 0.05)。随着氮限制时间增加, 海绿球藻的18:1n-9和MUFA逐渐增加, 其含量在0 d时最低, 6 d时最高, 比0 d时增加了28.47%。海绿球藻的PUFA含量随氮限制时间增加而降低, 在氮限制0 d和1 d时含量较高, 氮限制2、4、6 d时含量降低且3个处理组之间没有显著性差异。
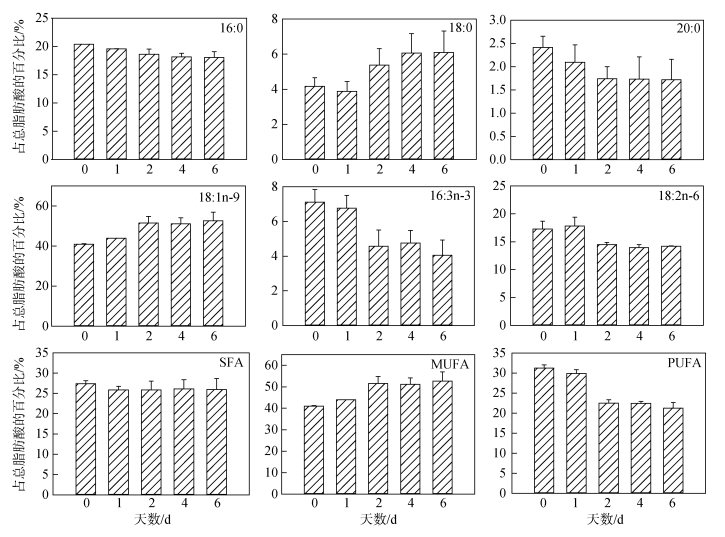 |
| 图 5 不同氮限制时间下海绿球藻的脂肪酸组成(占总脂肪酸的百分比) Fig. 5 Fatty acid compositions (% of total fatty acid) of Halochlorococcum sarcotum under different nitrogen limitation times |
图 6所示为不同氮限制时间下微绿球藻脂肪酸的组成。由图可知, 微绿球藻的主要脂肪酸是16:0 (24.48%~26.69%)、18:0(5.08%~5.71%)、20:0(1.61%~ 2.76%)、18:1n-9(39.23%~47.18%)、16:3n-3(3.94%~ 6.85%)和18:2n-6(11.27%~13.63%)。单因子方差分析结果表明, 氮限制对微绿球藻的18:0、18:2n-6及SFA的影响差异不显著, 而对该藻的16:0、18:1n-9、16:3n-3、MUFA和PUFA的影响具有显著性差异, 微绿球藻的16:0、18:1n-9及MUFA含量都在氮限制0 d时较低, 随着氮限制时间增加含量逐渐增加, 其中, 16:0含量在氮限制6 d时比0 d时增加了9.03%, 但与氮限制1、2、4 d的含量差异不显著。18:1n-9和MUFA含量在氮限制2 d时最高, 比0 d时增加了20.27%。而随氮限制时间增加, 16:3n-3和PUFA含量逐渐降低, 两者均在氮限制0 d时含量最高, 6 d时含量最低, 分别比0 d时降低了42.48%和28.07%。
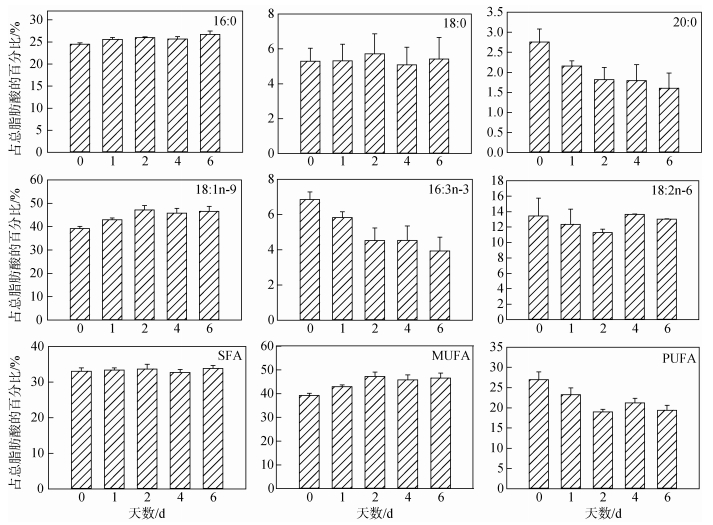 |
| 图 6 不同氮限制时间下微绿球藻的脂肪酸组成(占总脂肪酸的百分比) Fig. 6 Fatty acid compositions (% of total fatty acid) of Nannochloris oculata under different nitrogen limitation times |
叶绿素荧光技术常用于光合作用研究之中。rETRmax表示最大相对电子传递速率, α是光响应曲线的初始斜率[27]。本实验结果显示, 海绿球藻和微绿球藻rETRmax和α值的变化趋势均为随氮限制时间的增加而逐渐降低, 表明氮限制不利于海绿球藻和微绿球藻的光合作用, 微藻细胞在氮限制条件下, 同化作用受阻, 光合电子传递被抑制, 光能利用效率下降, 增加了热能等形式的耗散。这与王璐瑶等[28]对金色奥杜藻(Odontella aurita)研究结果相一致, 金色奥杜藻的Pm(Pm即代表最大相对电子传递速率rETRmax)随氮浓度下降而降低, 说明氮素的营养水平直接影响了微藻细胞的表观光合生理状况。最小饱和光照强度Ik值在实验期间总体呈下降趋势, 表明氮限制导致光合反应中心被破坏, 从而使微藻的强光耐受力降低, 影响其光合作用, 导致微藻生长受阻。Fv/Fm表示光系统Ⅱ最大光能转化效率, 反映微藻在遭受环境胁迫时光合作用所受到的影响, 当处于不良环境中时该值会明显下降[29]。在实验过程中, 海绿球藻和微绿球藻的叶绿素荧光参数Fv/Fm均随氮限制时间的增加而降低, 且最小值均出现在实验结束即氮限制6 d时。该值呈下降趋势反映出海绿球藻和微绿球藻的光化学能量转换受到影响, 光系统Ⅱ的氧化端被破坏, 且由于氮限制使藻细胞合成蛋白质受阻, 无法及时修复受损部位, 原初反应受到抑制。徐兴莲[30]对威氏海链藻(Thalassiosira weiss flogii)等硅藻进行研究, 发现Fv/Fm值在氮限制条件下显著降低, 光系统II的光化学活性随氮限制时间延长而逐渐降低, 与本实验得到的结果一致。NPQ的变化反映热耗散变化, 在本实验中, NPQ随氮限制时间的增加而逐渐上升, 说明藻细胞利用提高NPQ的方式来散失过多光能[31], 通过保证光合系统稳态来减少细胞损伤。综合以上结果可以看出, 氮限制破坏海绿球藻和微绿球藻细胞光系统Ⅱ反应中心, 从而阻碍电子传递, 进一步降低光合作用效率。
氮是组成微藻细胞内生物大分子的基本元素之一, 氮的缺乏或限制会使微藻的生长和胞内的营养代谢受到影响[32]。许海等[33]研究表明, 斜生栅藻(Scenedesmus obliquus)和铜绿微囊藻(Microcystis aeruginosa)在无氮的BG11培养基中长速较慢, 10 d时细胞密度较0 d时基本不变, 说明两种藻在氮限制条件下生长受到抑制。本研究结果表明, 随着氮限制时间逐渐增加, 海绿球藻和微绿球藻的细胞密度有小幅度的增加, 与许海等的研究结果有所不同。其原因可能是由于本研究中使用的是天然海水配置的f培养基, 天然海水本身含有少量的氮, 实验所用藻种是海水藻, 而许海等是用纯水配置BG11培养基, 实验所用藻种是淡水藻。一些学者的研究结果与本实验结果一致。夏荣霜等[34]对东海原甲藻(Proro cen trum donghaiense)进行氮限制培养10 d发现, 在实验早期(氮限制0~4 d)藻细胞密度逐渐升高, 认为此时藻细胞生长、分裂所受抑制较弱, 氮限制4~6 d时细胞密度基本保持不变, 6~10 d时逐渐下降。梁英等[16]对筒柱藻(Cylindrotheca sp.)的研究表明, 随氮限制时间增加, 其细胞密度先升高而后又小幅降低, 氮限制8 d时为0 d时的1.35倍。Li等[35]研究发现, 随着氮限制时间增加, 富油新绿藻的细胞密度在一定时间内增加, 而单个细胞中的叶绿素含量逐渐下降。Li等认为叶绿素含量下降的原因是细胞中的叶绿素在缺氮条件下分解, 将分解所得到的氮用于合成更重要的物质(如蛋白质、核酸)来供应细胞生长。若缺氮条件持续下去, 叶绿素含量低至一定临界值时, 细胞生长就会受阻, 细胞密度将停止增加。在本实验过程中得到了相似的结果, 海绿球藻和微绿球藻的叶绿素含量均随氮限制时间增加而逐渐下降。其原因可能是当缺乏氮元素时, 胞内的氮不足以进行叶绿素的合成。
氮缺乏引起的应激反应是微藻改变脂质代谢的一种自然机制[36]。虽然缺氮条件对细胞内多种成分的产生有所抑制, 但仍能保持较高的脂质合成速率, 使藻细胞中油脂增多[37]。本实验中, 海绿球藻在氮限制4 d时总脂含量达到最高值, 比0 d时增加了35.53%。微绿球藻在实验结束即氮限制6 d时总脂含量达到最高值, 比0 d时增加了42.23%。胡章喜等[32]认为, 细胞内的蛋白质、糖类等含氮较多的物质在氮限制条件下无法合成, 而脂类含氮较少, 所以此时光合作用所获得的能量用于合成脂类化合物, 导致胞内总脂含量增加。Xin等[38]则认为, 细胞内类囊体膜含量在氮限制条件下会减少, 从而使乙酰水解酶(PAF- AH)被激活, 磷脂被水解。细胞内乙酰辅酶A(CoA)可能因此增多, 且氮限制可使甘油二脂酰转移酶活化, 此酶使CoA转化为甘油三脂(TG), 因此氮限制可增加细胞内总脂含量。周芷薇等[39]在低氮胁迫(硝酸钠浓度为3.6 mmol∙L–1)的条件下培养两种高产油微藻发现, 斧形魏氏藻(Vischeria helvetica)在3~9 d时总脂含量增加, 此后逐渐平稳; 点状魏氏藻(Vischeria punctata)在0~12 d时总脂含量逐渐增加, 而后趋于平稳。由此可以看出, 氮限制对微藻总脂含量的影响与微藻种类、限制程度及限制天数等因素相关。李涛等[40]研究结果表明, 仅以总脂含量及生物量为标准不足以评价产油藻株, 可以利用总脂产率反映油脂积累速率来弥补, 因此本实验将总脂含量和总脂产率两个参数相结合, 综合评价氮限制时间对海绿球藻和微绿球藻油脂积累的影响。在实验过程中, 随氮限制时间增加, 海绿球藻和微绿球藻总脂含量显著升高, 总脂产率先增加后减少, 两种藻的总脂产率均在氮限制2 d时达到最高值, 由此可以得出, 2 d是海绿球藻和微绿球藻的最佳氮限制时间。
氮限制也影响微藻的脂肪酸组成。梁英等[16]采用“两步法”对筒柱藻进行研究的结果表明, 筒柱藻的SFA含量随氮限制时间增加先升高后降低, MUFA含量随氮限制时间的增加而上升, PUFA含量随氮限制时间的增加而减少。本实验得出的氮限制时间对海绿球藻和微绿球藻MUFA和PUFA含量影响的结果与上述研究结果一致, 而与之不同的是, 本实验中SFA含量随氮限制时间增加变化不显著。两个实验都是采用“两步法”进行氮限制试验, 氮限制时间对SFA含量影响的差异可能是由于微藻种类不同造成的。在周芷薇等[39]的研究中, 两种魏氏藻饱和脂肪酸和单不饱和脂肪酸的相对含量随着低氮胁迫时间增加而逐渐上升, 多不饱和脂肪酸的相对含量则随之下降。焦媛媛[41]对小球藻的研究发现, 氮限制条件更有利于饱和脂肪酸和单不饱和脂肪酸的合成, 而抑制多不饱和脂肪酸的合成。从上述两个研究得到的结果来看, 氮限制对微藻单不饱和脂肪酸和多不饱和脂肪酸的影响与本研究基本一致, 而对饱和脂肪酸的影响因藻种不同而有所差异。生物柴油的主要成分为十六烷酸、十八烷酸、十八烯酸、十八碳二烯酸等长链饱和与不饱和脂肪酸同甲醇或乙醇所形成的酯类化合物[42], 相关研究显示, 脂肪酸链长为C15~C22、不饱和程度较低的原料更适合用于生物柴油的生产[43], 因为不饱和程度高的脂肪酸会降低氧化稳定性、影响燃烧热以及十六烷值[44]。本实验脂肪酸分析结果显示, 海绿球藻和微绿球藻含有的脂肪酸主要为C16及C18系脂肪酸, 随着氮限制时间的增加, 海绿球藻的18:1n-9含量以及微绿球藻的16:0、18:1n-9含量逐渐增加, 两种藻的PUFA含量降低, 总体不饱和程度降低, 因此两种藻的脂肪酸组成比较适于生产生物柴油。
4 结论有研究表明, 利用氮限制的方法虽可以有效提高微藻的总脂含量, 但会降低其生物量。本实验针对此问题采用了“两步法”, 先将海绿球藻和微绿球藻在最适条件下培养到指数生长末期, 离心后转接到相同体积的不含氮的培养基中培养。实验结果表明, 海绿球藻和微绿球藻的总脂含量分别在氮限制第4 d和第6 d达到最高值。二者在氮限制2 d时总脂产率都达到最高, 因此二者产脂的最佳氮限制时间均为2 d, 且此时两种藻的叶绿素荧光参数及生长状况也都处于较为理想的状态。此外, 海绿球藻的18:1n-9和MUFA含量随氮限制时间增加而逐渐升高, 在6 d时达最高值, PUFA含量在氮限制1 d时含量最高, 而后降低; 微绿球藻的18:1n-9和MUFA含量在2 d时最高, 而PUFA含量随氮限制时间增加而逐渐降低, 在0 d时最高。氮限制对两种微藻SFA含量的影响差异不显著。本实验结果可为海绿球藻和微绿球藻的大规模生产、培养和利用提供理论依据。
| [1] |
Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294-306. DOI:10.1016/j.biotechadv.2007.02.001 |
| [2] |
Vassilev S V, Vassileva C G. Composition, properties and challenges of algae biomass for biofuel application:an overview[J]. Fuel, 2016(181): 1-33. |
| [3] |
Emdadi D, Berland B. Variation in lipid class composition during batch growth of Nannochloropsis salina and Pavlova lutheri[J]. Marine Chemistry, 1989, 26(3): 215-225. DOI:10.1016/0304-4203(89)90004-2 |
| [4] |
陈书秀, 梁英. 光照强度对雨生红球藻叶绿素荧光特性及虾青素含量的影响[J]. 南方水产, 2009, 5(1): 1-8. Chen Shuxiu, Liang Ying. Effects of illumination on the chlorophyll fluorescence parameters and astaxanthin content of Haematococcus pluvialis[J]. South China Fisheries Science, 2009, 5(1): 1-8. DOI:10.3969/j.issn.1673-2227.2009.01.001 |
| [5] |
曹春晖, 孙世春, 麦康森, 等. 光照强度对四株海洋绿藻总脂含量和脂肪酸组成的影响[J]. 生态学报, 2010, 30(9): 2347-2353. Cao Chunhui, Sun Shichun, Mai Kangsen, et al. Effect of light intensity on the total lipid contents and fatty acid composition in 4 strains of marine green algae[J]. Acta Ecologica Sinica, 2010, 30(9): 2347-2353. |
| [6] |
黄永胜, 李长玲, 黄翔鹄, 等. 温度、盐度和照度对北方娄氏藻生长和叶绿素a含量的影响[J]. 广东海洋大学学报, 2017, 37(4): 28-33. Huang Yongsheng, Li Changling, Huang Xianghu, et al. Effects of temperature, salinity and illuminance on growth and chlorophyll-a content of Lauderia borealis[J]. Journal of Guangdong Ocean University, 2017, 37(4): 28-33. DOI:10.3969/j.issn.1673-9159.2017.04.005 |
| [7] |
Z. Ikaran, S. Suárez-Alvarez, I. Urreta, et al. The effect of nitrogen limitation on the physiology and metabolism of Chlorella vulgaris var L3[J]. Algal Research, 2015(10): 134-144. |
| [8] |
Rastogi R P, Pandey A, Larroche C, et al. Algal Green Energy-R & D and technological perspectives for biodiesel production[J]. Renewable and Sustainable Energy Reviews, 2018, 82: 2946-2969. DOI:10.1016/j.rser.2017.10.038 |
| [9] |
Yang H L, Lu C K, Chen S F, et al. Isolation and characterization of Taiwanese heterotrophic microalgae:screening of strains for docosahexaenoic acid (DHA) production[J]. Marine Biotechnology, 2010, 12(2): 173-185. DOI:10.1007/s10126-009-9207-0 |
| [10] |
Han F, Huang J, Li Y, et al. Enhanced lipid productivity of Chlorella pyrenoidosa through the culture strategy of semi-continuous cultivation with nitrogen limitation and pH control by CO2[J]. Bioresource Technology, 2013, 136: 418-424. DOI:10.1016/j.biortech.2013.03.017 |
| [11] |
Bona F, Capuzzo A, Franchino M, et al. Semicontinuous nitrogen limitation as convenient operation strategy to maximize fatty acid production in Neochloris oleoabundans[J]. Algal Research, 2014, 5: 1-6. DOI:10.1016/j.algal.2014.03.007 |
| [12] |
吴琼芳, 张莹, 罗舒怀, 等. 氮限制对普通小球藻积累油脂过程中生化组成与光合生理的影响[J]. 植物科学学报, 2016, 34(2): 280-288. Wu Qiongfang, Zhang Ying, Luo Shuhuai, et al. Effects of nitrogen limitation on biochemical composition and photosynthetic physiology during lipid accumulation in Chlorella vulgaris Beijierineck[J]. Plant Science Journal, 2016, 34(2): 280-288. |
| [13] |
Courchesne N M D, Parisien A, Wang B, et al. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches[J]. Journal of Biotechnology, 2009, 141(1): 31-41. |
| [14] |
Devi M P, Subhash G V, Mohan S V. Heterotrophic cultivation of mixed microalgae for lipid accumulation and wastewater treatment during sequential growth and starvation phases:effect of nutrient supplementation[J]. Renewable Energy, 2012, 43: 276-283. DOI:10.1016/j.renene.2011.11.021 |
| [15] |
Dhup S, Dhawan V. Effect of nitrogen concentration on lipid productivity and fatty acid composition of Monoraphidium sp[J]. Bioresource Technology, 2014, 152: 572-575. DOI:10.1016/j.biortech.2013.11.068 |
| [16] |
梁英, 孟祥荣, 孙明辉, 等. 氮磷饥饿时间对筒柱藻生长及总脂含量的影响[J]. 水产科学, 2017, 36(3): 249-258. Liang Ying, Meng Xiangrong, Sun Minghui, et al. Effects of nitrogen and phosphorus starvation time on the growth and the total lipid content of Cylindrotheca sp[J]. Fisheries Science, 2017, 36(3): 249-258. |
| [17] |
孟迎迎, 陆洪斌, 刘娇, 等. 石墨化碳对微藻油脂及微藻生物柴油的脱色研究[J]. 中国油脂, 2016, 41(10): 53-57. Meng Yingying, Lu Hongbin, Liu Jiao, et al. Bleaching of microalgal oil and microalgal biodiesel by graphitic carbon[J]. China Oils and Fats, 2016, 41(10): 53-57. DOI:10.3969/j.issn.1003-7969.2016.10.012 |
| [18] |
石伟杰.高脂绿藻的选育以及油脂积累条件的初步研究[D].山东青岛: 中国海洋大学, 2012. Shi Weijie. Preliminary study on breeding of high-lipid marine green algae and condition for lipid accumulation[D]. Qingdao, Shandong Province: Ocean University of China, 2012. |
| [19] |
梁英, 王玥, 石伟杰, 等. 不同浓度柠檬酸对2株绿藻生长及总脂含量影响[J]. 中国海洋大学学报(自然科学版), 2018, 48(10): 1-10. Liang Ying, Wang Yue, Shi Weijie, et al. Effect of citric acid at different concentrations on the growth and total lipid content of two green algae[J]. Periodical of Ocean University of China, 2018, 48(10): 1-10. |
| [20] |
Guillard R R L, Ryther J H. Studies of marine planktonic diatoms:I. Cyclotella nana (Hustedt) and Detonula confervacea (Cleve) Gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. DOI:10.1139/m62-029 |
| [21] |
Liang Y, Sun M H, Tian C Y, et al. Effects of salinity stress on the growth and chlorophyll fluorescence of Phaeodactylum tricornutum and Chaetoceros gracilis (Bacillariophyceae)[J]. Botanica Marina, 2014, 57(6): 469-476. |
| [22] |
Platt T, Gallegos C L, Harrison W G. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J]. Journal of Marine Research, 1980, 38(4): 687-701. |
| [23] |
戴荣继, 黄春, 佟斌, 等. 藻类叶绿素及其降解产物的测定方法[J]. 中央民族大学学报(自然科学版), 2004, 13(1): 75-80. Dai Rongji, Huang Chun, Tong Bin, et al. Determination of algal chlorophyll and their degradation products[J]. Journal of the Central University for Nationalities, 2004, 13(1): 75-80. DOI:10.3969/j.issn.1005-8036.2004.01.013 |
| [24] |
Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian journal of biochemistry, 1959, 37(8): 911-917. |
| [25] |
梁英, 刁永芳, 田传远, 等. 硅浓度对筒柱藻B169生长、叶绿素荧光参数、总脂含量及脂肪酸组成的影响[J]. 海洋湖沼通报, 2014(1): 18-25. Liang Ying, Diao Yongfang, Tian Chuanyuan, et al. Effects of silicon concentrations on the growth, chlorophyll fluorescence parameters, total lipid content and fatty acid compositions of Cylindrotheca sp. B169[J]. Transactions of Oceanology & Limnology, 2014(1): 18-25. |
| [26] |
Lepage G, Roy C C. Improved recovery of fatty acid through direct transesterification without prior extraction or purification[J]. Journal of lipid research, 1984, 25(12): 1391-1397. |
| [27] |
叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740. Ye Zipiao. A review on modeling of responses of photosynthesis to light and CO2[J]. Chinese Journal of Plant Ecology, 2010, 34(6): 727-740. DOI:10.3773/j.issn.1005-264x.2010.06.012 |
| [28] |
王璐瑶, 桑敏, 李爱芬, 等. 不同缺氮营养水平对金色奥杜藻生长及光合生理的影响[J]. 中国生物工程杂志, 2012, 32(6): 48-56. Wang Luyao, Sang Min, Li Aifen, et al. Effects of different nitrogen nutrition level on the growth and photosynthetic physiology of Odontella aurita[J]. China Biotechnology, 2012, 32(6): 48-56. |
| [29] |
Parkhill J, Maillet G, Cullen J J. Fluorescence-based maximal quantum yield for PSⅡ as a diagnostic of nutrient stress[J]. Journal of Phycology, 2001, 37(4): 517-529. DOI:10.1046/j.1529-8817.2001.037004517.x |
| [30] |
徐兴莲.阳光紫外辐射和氮营养盐对硅藻光合作用影响的研究[D].湖北武汉: 湖北工业大学, 2016. Xu Xinglian. Photosynthetic performance in response to solar ultraviolet radiation and nitrogen limitation in diatoms[D]. Wuhan, Hubei Province: Hubei University of Technology, 2016. |
| [31] |
莫亿伟, 郭振飞, 谢江辉. 温度胁迫对柱花草叶绿素荧光参数和光合速率的影响[J]. 草业学报, 2011, 20(1): 96-101. Mo Yiwei, Guo Zhenfei, Xie Jianghui. Effects of temperature stress on chlorophyll fluorescence parameter and photosynthetic rates of Stylosanthes guianensis[J]. Acta Prataculture Sinica, 2011, 20(1): 96-101. |
| [32] |
胡章喜, 安时, 段舜山, 等. 不同氮源对布朗葡萄藻生长, 总脂和总烃含量的影响[J]. 生态学报, 2009, 29(6): 3290-3294. Hu Zhangxi, An Shi, Duan Shunshan, et al. Effects of nitrogen sources on the growth, contents of total lipids and total hydrocarbons of Botryococcus braunii[J]. Acta Ecologica Sinica, 2009, 29(6): 3290-3294. |
| [33] |
许海, 吴雅丽, 杨桂军, 等. 铜绿微囊藻, 斜生栅藻对氮磷饥饿的耐受能力研究[J]. 生态科学, 2014, 33(5): 879-884. Xu Hai, Wu Yali, Yang Guijun, et al. Tolerance of Microcystis aeruginosa and Scendesmus obliquus to nitrogen and phosphorus deficiency[J]. Ecological Science, 2014, 33(5): 879-884. |
| [34] |
夏荣霜, 徐兆礼, 高倩. 东海原甲藻在氮、磷限制胁迫下的补偿生长[J]. 中国水产科学, 2014, 21(6): 1200-1210. Xia Rongshuang, Xu Zhaoli, Gao Qian. Compensatory growth of Prorocentrum donghaiense Lu under nitrogen and phosphorus deficiency stress[J]. Journal of Fishery Sciences of China, 2014, 21(6): 1200-1210. |
| [35] |
Li Y, Horsman M, Wang B, et al. Effects of nitrogen sources on cell growth and lipid accumulation of green alga Neochloris oleoabundans[J]. Applied Microbiology and Biotechnology, 2008, 81(4): 629-636. DOI:10.1007/s00253-008-1681-1 |
| [36] |
Tornabene T G, Holzer G, Lien S, et al. Lipid composition of the nitrogen starved green alga Neochloris oleoabundans[J]. Enzyme and Microbial Technology, 1983, 5(6): 435-440. DOI:10.1016/0141-0229(83)90026-1 |
| [37] |
Sheehan J, Dunahay T, Benemann J, et al. A look back at the US Department of Energy's aquatic species program: biodiesel from algae[R]. National Renewable Energy Laboratory, 1998.
|
| [38] |
Li X, Hu H Y, Gan K, et al. Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake and lipid accumulation of a freshwater microalga Scenedesmus sp[J]. Bioresource Technology, 2010, 101(14): 5494-5500. DOI:10.1016/j.biortech.2010.02.016 |
| [39] |
周芷薇, 高保燕, 雷学青, 等. 低氮胁迫对两种魏氏藻生长和油脂积累的影响[J]. 可再生能源, 2015, 33(5): 777-783. Zhou Zhiwei, Gao Baoyan, Lei Xueqing, et al. The effects of low-nitrogen stress on the growth and lipid accumulation of Vischeria helvetica and Vischeria punctata[J]. Renewable Energy Resources, 2015, 33(5): 777-783. |
| [40] |
李涛, 李爱芬, 桑敏, 等. 富油能源微藻的筛选及产油性能评价[J]. 中国生物工程杂志, 2011, 31(4): 98-105. Li Tao, Li Aifen, Sang Min, et al. Screening oleaginous microalgae and evaluation of the oil-producing characteristic[J]. China Biotechnology, 2011, 31(4): 98-105. |
| [41] |
焦媛媛.海洋微藻快速生长及油脂富集技术的初步研究[D].山东青岛: 中国海洋大学, 2010. Jiao Yuanyuan. Priliminary study on the rapid growth and oil accumulation of marine microalgae[D]. Qingdao, Shandong Province: Ocean University of China, 2010. |
| [42] |
方正, 吕德义. 微藻制备生物柴油的研究进展[J]. 现代化工, 2017, 37(9): 57-61. Fang Zheng, Lv Deyi. Research progress on biodiesel production by microalgae[J]. Modern Chemical Industry, 2017, 37(9): 57-61. |
| [43] |
朱顺妮, 刘芬, 樊均辉, 等. 微藻生物能源研究现状及展望[J]. 新能源进展, 2018, 6(6): 467-474. Zhu Shunni, Liu Fen, Fan Junhui, et al. Research progress and prospect of microalgae bioenergy[J]. Advances in New and Renewable Energy, 2018, 6(6): 467-474. DOI:10.3969/j.issn.2095-560X.2018.06.002 |
| [44] |
Williams P J L B, Laurens L M L. Microalgae as biodiesel & biomass feedstocks:Review & analysis of th the biochemistry, energetics & economics[J]. Energy & environmental science, 2010, 3(5): 554-590. |
 2020, Vol. 44
2020, Vol. 44

