文章信息
- 臧瑜, 孙燕, 杨丽莉, 李亚男, 骆添, 慕芳红. 2020.
- ZANG Yu, SUN Yan, YANG Li-li, LI Ya-nan, LUO Tian, MU Fang-hong. 2020.
- 大连金沙滩小型底栖生物时空分布特征及影响因素
- Spatiotemporal distribution pattern of meiofauna and its influencing factors in the Jinshatan Beach, Dalian
- 海洋科学, 44(2): 76-89
- Marine Sciences, 44(2): 76-89.
- http://dx.doi.org/10.11759/hykx20190115002
-
文章历史
- 收稿日期:2019-01-15
- 修回日期:2019-03-04
潮间带(intertidal zone)是海洋和陆地之间的过渡地带, 其环境(温度、盐度、暴露时间、沉积物粒度分布等)梯度变化明显, 生境高度多样化, 与人类活动休戚相关。潮间带生态系统的保护和监测, 以及潮间带生物资源的利用, 一直是海洋生态研究和海岸带管理的主要课题。砂质潮间带是典型的由砂和波浪能等物理因素驱动的生态系统[1]。栖息于沙滩的生物大多营隐蔽的挖掘或者间隙生活, 不为人所见, 砂质滩一度被认为是“生态沙漠”, 但实际上它拥有丰富多彩的生物群落, 栖息着极为多样的底栖动物[2]。小型底栖生物(meiofauna)定义为能够通过500 µm孔径网筛, 而被40~64 µm(近年来多用31 µm)孔径网筛截留的后生动物[3], 包括线虫类、介形类、涡虫类、腹毛类、桡足类和端足类等多个类群, 也包括大型底栖生物(如多毛类、双壳类)的幼体。小型底栖生物既是沉积物中有机碎屑的摄食者, 又是底栖细菌、微藻的主要消耗者, 本身还是更高层营养级生物的重要食物, 是底栖食物网中重要的一环, 其群落结构、多样性格局和生物量变动直接控制着大型经济无脊椎动物幼体的补充[4], 是潮间带生态系统的一个重要生物类群。
我国潮间带小型底栖生物的研究工作始于20世纪80年代中期, 张志南等[5-9]、蔡立哲等[10-12]在秦皇岛、大连、青岛、厦门、香港等地的潮间带开展了小型底栖生物调查研究。进入21世纪, 有关砂质潮间带的小型底栖生物研究逐渐增多, 研究内容也在丰度、生物量时空分布研究[13-24]的基础上, 逐步开展了海洋酸化[25-29]、缺氧[30]和人为扰动[31-32]对小型底栖生物影响的实验生态研究, 但总体上, 我国砂质潮间带小型底栖生物的本底资料仍较匮乏。大连位于北半球的暖温带地区, 具有明显的四季更替。张志南等[33]于春季对石槽岩滩的附植小型底栖动物进行了调查, Hua等[24]对大连夏家河子砂质潮间带春季小型底栖生物进行了调查和气候带间的比较研究, 目前仍缺乏对该地砂质潮间带小型底栖生物季节动态的研究。
本研究选取大连金沙滩海水浴场砂质潮间带为野外采样地点, 对小型底栖生物与其所处的沉积环境进行了季节性的调查, 研究小型底栖生物丰度、生物量和群落的时空变化及其与环境变量的关系, 研究结果可为砂质潮间带小型底栖生物的研究提供基础数据, 也可为全球气候变化背景下砂质潮间带的保护、开发和利用提供科学依据。
1 采样地点、材料与方法 1.1 采样点大连位于中国辽东半岛最南端, 东临黄海, 西临渤海, 具有海洋性特点的暖温带大陆性季风气候。本研究在黄海沿岸选取了金沙滩海水浴场潮间带(121°35′58″E, 38°52′20″N, 平均坡度9.0°)作为采样点进行野外采样, 具体采样点如图 1所示。
 |
| 图 1 大连金沙滩砂质潮间带小型底栖生物采样点 Fig. 1 Sampling site in the sandy intertidal zone of the Jinshatan Beach, Dalian |
先后于2015年12月、2016年3、7、10月大潮时分别进行了冬、春、夏、秋4个季节月的小型底栖生物调查采样。在所研究的沙滩选取了两个断面, 间隔约100 m, 其中断面1靠近雨水管道出口; 在每个断面的高、中、低潮区各设1个采样点, 进行小型底栖生物和环境因子样品的采集, 并在每个采样点使用多参数水质仪(In-Situ Inc, Smartroll MP)进行间隙水的水温、pH值、盐度和溶解氧质量浓度的原位测定。用字母H、M、L分别代表高、中、低潮区, 如“H1”表示断面1高潮带, “H-3”表示3月份高潮带, 此缩写规律在正文以及所有图表中都适用。
2015年12月进行的野外采样使用的为内径4.4 cm的PVC采样管, 因大连金沙滩潮间带表层具坚硬砾石, 易造成采样管的损坏, 因此2016年3、7、10月进行的野外采样均采用内径4.8 cm的不锈钢管。用取样管在每个采样点随机取3个重复芯样用于小型底栖生物的分选, 沉积物芯样长20 cm, 芯样采出后立即装入500 mL样品瓶中, 用5%的甲醛溶液固定, 虎红染色。样品分选采用倾上浮液淘洗法, 即将上浮液分别过孔径为500 µm和31 µm的两层网筛, 共淘洗6次, 将31 µm网筛中的生物转移到划线培养皿中, 在解剖镜下分类计数。每个采样点另采两管20 cm沉积物芯样装入塑料封口袋中, 用于含水量、粒度、有机碳质量分数、叶绿素a(Chl-a)质量比等环境因子的测定, –20℃冷冻保存, 其测定按照《海洋调查规范》[34]规定方法进行。
1.3 数据处理与分析本研究中的生物量为干质量生物量, 其估算采用各类群丰度值乘以相应类群的平均个体干质量经验值的方法, 小型底栖生物各类群的平均个体干质量参照Jario[35]、Widbom[36]和张志南[37]的研究结果, 其中桡足类的平均个体干质量按McIntyre[38]的研究结果, 具体见表 1。
| 类群 | 个体干 质量/µg |
| 线虫类Nematoda | 0.4 |
| 桡足类Copepoda | 1.86 |
| 涡虫类Tubellaria | 3.5 |
| 多毛类Polychaeta | 14 |
| 海螨类Halacaroidea | 1.5 |
| 双壳类Bivalvia | 4.2 |
| 介形类Ostracoda | 26 |
| 昆虫类Insecta | 3.5 |
| 腹足类Gastropoda | 4.2 |
| 腹毛类Gastrotricha | 3.5 |
| 端足类Amphipoda | 15 |
| 动吻类Kinarhyncha | 2 |
| 等足类Isopoda | 15 |
| 其他类Others | 3.5 |
应用SPSS17.0软件对所得生物数据和环境因子数据进行方差分析:在分析前对数据进行Levene方差齐性检验, 若方差不齐, 则对其进行对数转换至方差齐, 之后进行One-way ANOVA检验及多重比较分析(Tukey), 如果数据转换后方差仍然不齐, 则进行非参数检验(Kruskal-Wallis); 对生物数据与各环境因子进行变量相关分析(Pearson)。应用PRIMER 6软件对数据进行多元统计分析:以百分比表示的环境因子数据经对数转换, 对环境因子数据建立Euclidean distance矩阵进行PCA分析(principal components analysis); 对小型底栖生物类群分选数据进行生物多样性分析(DIVERSE); 丰度数据经标准化和平方根转换, 建立Bray-Curtis相似性矩阵进行Cluster (hierar chical agglomerative clustering)聚类分析及MDS (non-metric multidimensional scaling)标序分析; 采用ANOSIM(analysis of similarities)检验群落组间差异的显著性并通过SIMPER(similarities percentages procedure)分析组间类群的差异; 环境与生物群落之间的关系采用生物-环境分析(BIOENV)。
2 结果与分析 2.1 环境因子对本研究所调查的大连金沙滩潮间带环境因子进行测量和分析, 结果详见表 2。金沙滩间隙水平均温度14.90℃±7.26℃, 沉积物的平均含水量33.50%± 10.55%, 均表现为7月、10月高, 12月、3月低; 间隙水的盐度为28.8~35, 12月最高7月最低; 年平均有机碳质量分数为0.38%±0.56%, 其中10月最高, 3月最低, 但均低于国家沉积物质量一类标准(2%)[39], 断面1有机碳质量分数显著高于断面2。金沙滩年平均Chl-a质量比为0.99 µg/g±1.44 µg/g, 其中7月最高, 12月最低; 平均溶氧质量浓度为5.38 mg/L± 2.69 mg/L, 12月高7月低, 高潮带显著高于低潮带; pH值平均为7.90±0.23, 季节间差异不显著, 高潮带显著高于低潮带。
| 采样时间 | 潮区 | 温度 /℃ |
pH 值 |
溶氧 /(mg/L) |
盐度 | 含水量 /% |
Chl-a质量比 /(μg/g) |
有机碳 质量分数/% |
中值 粒径 |
分选 系数 |
偏态 系数 |
沉积物质量分数/% | |||||
| 极粗砂 | 粗砂 | 中砂 | 细砂 | 极细砂 | 粉砂及黏土 | ||||||||||||
| H | 7.00 | 8.12 | 9.21 | 34.00 | 22.14 | 0.09 | 0.11 | 0.40 | 0.72 | 0.15 | 26.97 | 41.79 | 22.47 | 7.78 | 0.93 | 0.07 | |
| 2015年12月 | M | 8.10 | 7.82 | 7.07 | 33.95 | 23.44 | 0.19 | 0.11 | —0.34 | 0.53 | 0.16 | 72.25 | 9.07 | 2.24 | 11.45 | 4.69 | 0.30 |
| L | 7.79 | 7.91 | 5.22 | 35.00 | 23.84 | 0.44 | 0.48 | 1.36 | 1.59 | -0.24 | 41.06 | 7.01 | 5.22 | 28.22 | 17.94 | 0.55 | |
| H | 9.20 | 8.04 | 7.60 | 31.70 | 23.38 | 1.66 | 0.11 | —0.10 | 0.76 | 0.24 | 54.49 | 22.00 | 5.74 | 15.07 | 2.48 | 0.22 | |
| 2016年3月 | M | 8.39 | 8.10 | 5.94 | 31.10 | 23.81 | 1.32 | 0.23 | -0.21 | 1.46 | 1.01 | 59.47 | 5.60 | 3.63 | 19.77 | 10.85 | 0.68 |
| L | 9.77 | 7.67 | 2.62 | 30.25 | 22.70 | 2.23 | 0.15 | -0.15 | 1.50 | 1.02 | 56.28 | 7.11 | 4.90 | 15.92 | 14.33 | 1.45 | |
| H | 25.88 | 8.01 | 3.55 | 29.70 | 44.67 | 0.58 | 0.56 | —0.36 | 0.48 | 0.12 | 69.81 | 17.17 | 2.60 | 7.61 | 2.39 | 0.42 | |
| 2016年7月 | M | 25.76 | 7.91 | 2.53 | 29.70 | 43.54 | 0.74 | 0.18 | —0.46 | 0.33 | 0.04 | 80.21 | 11.41 | 1.49 | 4.11 | 2.31 | 0.46 |
| L | 23.66 | 7.48 | 1.20 | 29.15 | 43.23 | 3.99 | 0.58 | —0.34 | 0.89 | 0.52 | 72.66 | 6.81 | 3.05 | 6.48 | 8.93 | 2.08 | |
| H | 17.07 | 8.02 | 7.65 | 31.45 | 42.09 | 0.08 | 0.22 | 0.31 | 0.77 | 0.11 | 35.45 | 37.96 | 10.64 | 14.33 | 1.44 | 0.18 | |
| 2016年10月 | M | 17.65 | 8.01 | 6.94 | 32.00 | 44.49 | 0.09 | 0.33 | 0.08 | 0.74 | 0.18 | 45.98 | 31.53 | 5.83 | 12.38 | 3.83 | 0.44 |
| L | 18.59 | 7.80 | 5.05 | 29.85 | 44.70 | 0.56 | 1.53 | -0.12 | 0.71 | 0.20 | 54.82 | 23.99 | 4.50 | 9.13 | 6.97 | 0.57 |
金沙滩潮间带以极粗砂和粗砂为主, 粉砂及黏土质量比不足1%。中值粒径波动范围为–0.52~1.82, 大多为负值; 分选系数平均值为0.87±0.45, 波动范围为0.29~1.61, 分选程度一般, 其中7月的分选程度最好(0.57±0.46);偏态系数平均值为0.29±0.42, 多数为正偏态。
对金沙滩潮间带四季的环境因子进行Pearson相关分析可知:有机碳质量分数与其他环境因子变量间无显著相关关系; 温度与含水量、极粗砂质量比呈正相关关系, 与溶氧质量浓度、盐度、中砂质量比呈负相关; Chl-a质量比与pH值、溶氧质量浓度、盐度呈负相关关系, 溶氧质量浓度与pH值、盐度呈正相关关系, 盐度与含水量呈负相关关系。此外, 沉积物粒度特征与除有机碳质量分数外的各项环境因子变量间存在显著相关关系, 是影响其他理化性质的重要因素:中值粒径与间隙水溶氧质量浓度及盐度正相关, 与间隙水温度负相关; 极粗砂质量比与间隙水温度正相关, 与间隙水溶氧质量浓度及盐度负相关; 中砂质量比与溶氧质量浓度正相关, 与间隙水温度负相关; 粉砂及黏土质量比与沉积物Chl-a质量比正相关, 与间隙水溶氧质量浓度、盐度及pH值负相关。
对金沙滩潮间带四季的环境因子进行PCA分析, 结果如图 2所示。分析结果显示, 横纵两个排序轴保留的信息量占总信息量的54.9%;对第一主分量贡献较大的变量依次是间隙水溶氧、盐度、温度、沉积物极粗砂质量比等; 对第二主分量贡献较大的变量依次是沉积物极细砂质量比、粗砂质量比、含水量、粉砂及黏土质量比、细砂质量比等。
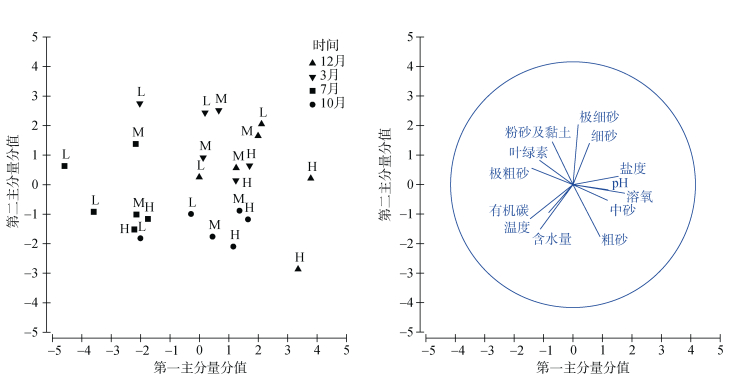 |
| 图 2 环境因子PCA分析结果 Fig. 2 PCA results of environmental factors |
金沙滩潮间带共鉴定出15个小型底栖生物类群, 包括底栖桡足类(以下简称桡足类)、自由生活海洋线虫类(以下简称线虫类)、涡虫类、多毛类、腹毛类、寡毛类、缓步类、双壳类、介形类、端足类、腔肠类、海螨类、昆虫类、无节幼体、动吻类等。图 3为小型底栖生物主要类群丰度和生物量的百分比组成:丰度组成中, 线虫类最高, 占总丰度的47.55%, 桡足类次之, 占总丰度的25.27%, 其余占比较大的类群包括涡虫类(12.40%)、寡毛类(6.87%)、无节幼体(3.62%)、多毛类(3.53%)和介形类(0.33%), 其他类群占比之和不超过0.5%;生物量组成中, 多毛类最高, 占总生物量的24.14%, 其次是桡足类占总丰度的22.97%, 再次为涡虫类占总丰度的21.21%, 其余占比较大的类群包括寡毛类(11.75%)、线虫类(9.29%)无节幼体(5.85%)、和介形类(4.21%), 其他类群占比之和约为0.56%。小型底栖生物主要类群的平均丰度及生物量见表 3。
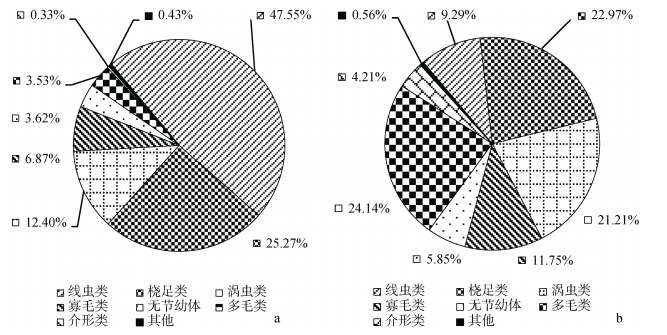 |
| 图 3 小型底栖生物主要类群丰度和生物量的百分比组成 Fig. 3 Percentage composition of the abundance and biomass of the major meiofaunal groups a:丰度; b:生物量 |
| 类群 | 丰度/(个/cm2) | 生物量/(µg/cm2) |
| 桡足类Copepoda | 10.75±17.59 | 19.99±32.72 |
| 线虫类Nematoda | 20.22±32.77 | 8.09±13.11 |
| 涡虫类Tubellaria | 5.27±12.52 | 18.45±43.81 |
| 多毛类Polychaeta | 1.5±4.8 | 21.01±67.25 |
| 腹毛类Gastrotricha | 0.005±0.039 | 0.02±0.14 |
| 寡毛类Oligochaeta | 2.92±6.36 | 10.23±22.26 |
| 缓步类Tardigrade | 0.001±0.008 | 0.003±0.027 |
| 双壳类Bivalvia | 0.004±0.014 | 0.02±0.06 |
| 介形类Ostracoda | 0.14±0.28 | 3.66±7.34 |
| 端足类Amphipoda | 0.002±0.009 | 0.02±0.14 |
| 腔肠类Coelenterate | 0.001±0.007 | 0.003±0.023 |
| 海螨类Halacaroidea | 0.08±0.12 | 0.12±0.18 |
| 昆虫类Insecta | 0.07±0.11 | 0.23±0.37 |
| 无节幼体Nauplius | 1.54±2.85 | 5.09±9.81 |
| 动吻类Kinarhyncha | 0.002±0.011 | 0.004±0.022 |
| 未鉴定 | 0.02±0.08 | 0.07±0.29 |
| 合计 | 42.52±42.91 | 87.00±85.32 |
金沙滩潮间带小型底栖生物年平均丰度为42.52个/cm2±42.91个/cm2。One-way ANOVA分析表明, 小型底栖生物丰度在两断面间差异不显著, 在不同季节、潮区间存在极显著差异(p < 0.01), 变化趋势为3月> 10月> 7月> 12月, 高潮带 > 中潮带 > 低潮带; 多重比较分析显示, 除7月与3月、10月间差异不显著外, 其他各月间均存在显著差异, 高、低潮带之间差异显著。分别对不同季节数据进行One-way ANOVA分析可知, 7月、12月丰度在潮区间无显著差异; 3月份高潮带显著高于中、低潮带(p < 0.01), 10月份高、中潮带显著高于低潮带(p < 0.01)。
金沙滩潮间带小型底栖生物年平均生物量为87.00 µg/cm2±85.32µg/cm2, One-way ANOVA分析表明季节间存在极显著差异(p < 0.01), 变化趋势为10月> 7月> 3月> 12月, 多重比较分析显示, 12月小型底栖生物生物量显著低于其他月份(p < 0.05), 非参数检验显示不同潮区间差异显著(p < 0.05), 高潮带 > 低潮带 > 中潮带。小型底栖生物丰度、生物量方差分析结果见表 4, 各潮区小型底栖生物丰度和生物量的季节变化情况如图 4。
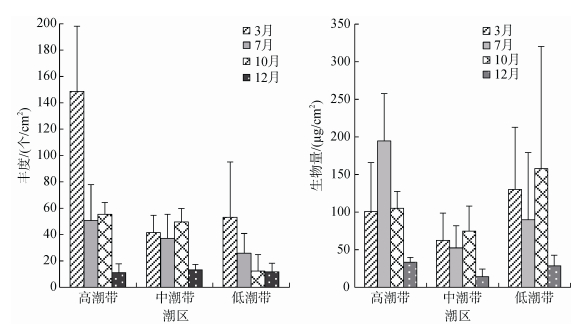 |
| 图 4 不同潮区小型底栖生物丰度和生物量的时空变化 Fig. 4 Seasonal and spatial variations of meiofaunal abundance and biomass |
| 变量 | 统计方法 | 分组 | 自由度 | 统计量 | p |
| 丰度 | One-way ANOVA | 季节 | 3 | 15.320 | 0.000** |
| 断面 | 1 | 0.142 | 0.708 | ||
| 潮区 | 2 | 5.702 | 0.005** | ||
| 生物量 | One-way ANOVA | 季节 | 3 | 14.156 | 0.000** |
| 断面 | 1 | 0.193 | 0.662 | ||
| Kruskal–Wallis检验 | 潮区 | 2 | 7.942 | 0.019* | |
| *. p < 0.05, 差异显著; **. p < 0.01, 差异极显著。 | |||||
对金沙滩小型底栖生物类群丰度数据进行聚类分析, 结果如图 5所示:在62%相似性水平可分为4组, a组为10月份低潮带, b组为12月份3个潮区, c组为7月份3个潮区, d组包括为3月份3个潮区和10月份高、中潮带; ANOSIM分析显示, 4组间差异显著(R=0.79, p < 0.01)。
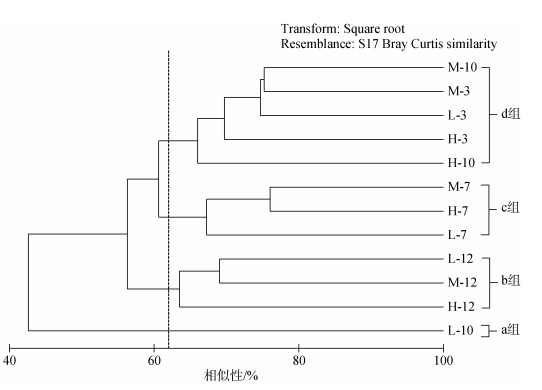 |
| 图 5 小型底栖生物丰度聚类分析结果 Fig. 5 Cluster ordination on the abundance data of meiofaunal groups |
对分组结果进行SIMPER分析, 结合不同季节小型底栖生物各类群丰度及相对丰度图 6可知: b(12月冬季组)、c(7月夏季组)两组类群组成差异主要表现为c组涡虫类、桡足类、多毛类的增多及线虫类相对丰度的降低; b、d(春秋季组)两组类群组成差异主要表现为b组线虫类、桡足类、寡毛类等丰度的减少; c、d两组类群组成差异主要表现为c组线虫类、寡毛类等丰度的减少和涡虫类丰度的增多; a(秋季低潮带)、d两组类群组成差异主要表现为a组线虫类、桡足类、寡毛类等丰度的减少和多毛类丰度的增多, 从环境因子看, 这可能是由于10月份低潮带有机碳质量分数达1.53%, 远远高于其他时间和地点造成的。
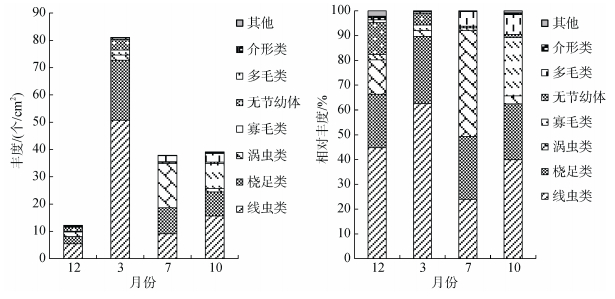 |
| 图 6 不同月份小型底栖生物各类群丰度及相对丰度 Fig. 6 Mean abundance and relative abundance of the major meiofaunal groups in different seasons |
对小型底栖生物群落进行多样性分析, 结果见表 5。One-way ANOVA分析表明, 不同季节间J′存在极显著差异(p < 0.01), 3月显著低于12月, 其他多样性指数无显著差异; 不同潮区间d存在显著差异(p < 0.05), 高潮带显著高于低潮带; 非参数检验显示, H′、J′及Simpson指数1-λ′在不同潮区间存在极显著差异(p < 0.01), 均表现为中潮带 > 高潮带 > 低潮带。
| 时间 | 潮区 | S | N | d | J′ | H′ | 1–λ′ |
| 2015年12月 | H | 13 | 74 | 2.789 | 0.4754 | 1.219 | 0.5565 |
| M | 10 | 87 | 2.016 | 0.6299 | 1.45 | 0.7363 | |
| L | 7 | 77 | 1.381 | 0.5555 | 1.081 | 0.5615 | |
| 2016年3月 | H | 10 | 821 | 1.341 | 0.31 | 0.7137 | 0.3391 |
| M | 10 | 229 | 1.656 | 0.5418 | 1.248 | 0.6278 | |
| L | 9 | 293 | 1.408 | 0.4189 | 0.9203 | 0.464 | |
| 2016年7月 | H | 9 | 280 | 1.42 | 0.5117 | 1.124 | 0.5638 |
| M | 9 | 205 | 1.503 | 0.497 | 1.092 | 0.6096 | |
| L | 10 | 143 | 1.814 | 0.4988 | 1.148 | 0.6044 | |
| 2016年10月 | H | 10 | 306 | 1.572 | 0.4808 | 1.107 | 0.5995 |
| M | 10 | 274 | 1.603 | 0.5711 | 1.315 | 0.6754 | |
| L | 7 | 68 | 1.424 | 0.4318 | 0.8402 | 0.4263 | |
| 注: S:样品中小型底栖生物类群数; N:样品中小型底栖生物个体总数; d:丰富度指数(Margalef’s species richness); J′:均匀度指数(Pielou’s evenness); H′: Shannon–Wiener指数, 取log以e为底; 1–λ′: Simpson指数 | |||||||
金沙滩小型底栖生物丰度与环境因子数据的Pearson相关分析结果见表 6, 可知:涡虫类丰度与盐度呈正相关关系, 与Chl-a质量比呈负相关; 多毛类丰度与极粗砂质量比呈负相关关系; 寡毛类丰度与有机碳质量分数及粗砂质量比呈正相关关系, 无节幼虫丰度与温度及含水量呈正相关关系; 小型底栖生物其他类群及总丰度与环境因子变量间无显著相关关系。BIOENV分析表明, 间隙水盐度、沉积物极粗砂质量比和有机碳质量分数的组合能最好的解释金沙滩小型底栖生物群落结构, 其相关系数为0.413。
| 环境因子 | Pearson相关系数 | |||||||
| 桡足类 | 线虫类 | 涡虫类 | 多毛类 | 寡毛类 | 介形类 | 无节幼虫 | 总丰度 | |
| 温度 | –0.059 | –0.236 | –0.248 | –0.059 | 0.01 | –0.09 | 0.534** | –0.058 |
| pH值 | 0.117 | 0.199 | 0.115 | 0.218 | –0.006 | 0.21 | –0.285 | 0.272 |
| 溶氧质量浓度 | –0.12 | 0.263 | 0.404 | 0.335 | 0.28 | –0.134 | –0.183 | 0.13 |
| 盐度 | –0.164 | –0.008 | 0.466* | 0.216 | –0.042 | 0.069 | –0.252 | –0.138 |
| 含水量 | –0.114 | –0.258 | –0.107 | 0.121 | 0.193 | –0.18 | 0.602** | –0.109 |
| Chl-a质量比 | 0.105 | 0.205 | –0.495* | –0.375 | –0.241 | –0.118 | 0.058 | 0.142 |
| 有机碳质量分数 | –0.181 | –0.225 | –0.086 | –0.03 | 0.508* | –0.102 | 0.201 | –0.194 |
| 极粗砂质量比 | 0.193 | –0.05 | –0.332 | –0.444* | –0.211 | 0.157 | 0.092 | 0.081 |
| 粗砂质量比 | –0.156 | 0.193 | 0.24 | 0.366 | 0.430* | –0.383 | 0.106 | 0.166 |
| 中砂质量比 | –0.165 | 0.171 | 0.238 | 0.269 | 0.38 | –0.111 | –0.117 | 0.016 |
| 细砂质量比 | 0.113 | 0.193 | 0.076 | 0.263 | –0.39 | 0.193 | –0.067 | 0.167 |
| 极细砂质量比 | 0.148 | –0.204 | –0.155 | –0.031 | –0.273 | 0.155 | 0.049 | –0.206 |
| 粉砂及黏土质量比 | 0.103 | –0.211 | –0.3 | –0.214 | –0.223 | –0.267 | 0.32 | –0.18 |
| 注: *在0.05水平(双侧)上显著相关; **在0.01水平(双侧)上显著相关。 | ||||||||
本研究选取大连金沙滩海水浴场砂质潮间带为采样地点, 研究了小型底栖生物丰度、生物量和群落的时空变化及其与环境变量的关系, 研究结果表明小型底栖生物的丰度和生物量都存在显著或极显著的潮区差异和季节波动; 类群组成存在显著的季节变化, 但生物多样性指数在潮区间存在显著差异, 除J′值外, 季节变化不明显; 高潮带丰度、生物量和多样性都高于低潮带, 中潮带生物多样性较高, 但丰度及生物量低于高潮带。
3.1 小型底栖生物分布的影响因素本研究结果表明季节对大连金沙滩的沉积环境理化因子影响显著。金沙滩潮间带间隙水温度与沉积物含水量均表现为夏、秋季(7、10月)高而春、冬季(3、12月)低, 季节性差异显著, 符合大连水热同期的气候变化特点; 间隙水的盐度与含水量呈极显著的负相关, 表现为7月低12月高, 断面、潮区之间无显著差异, 也与当地降雨量的季节分布相吻合; 溶氧质量浓度12月最高7月最低, 可能是由于夏季温度高, 且微生物分解加速, 需要消耗大量氧气所致, 也可能与夏季是金沙滩的旅游旺季, 游客的踩踏压缩有关[40]; Chl-a质量比可代表沉积物中微藻的丰度, 3、7月高10、12月低, 这表明春夏季潮间带都具有较高的初级生产力。
除了上述季节性的影响, 影响沉积物气水透性等条件的粉砂及黏土质量比、极粗砂质量比、中值粒径等粒度特征, 与其他理化性质均存在显著相关关系; 此外, 金沙滩间隙水pH值、溶氧质量浓度均为高潮带显著高于低潮带, 可能与金沙滩潮间带坡度较大有关, 低潮带沉积物暴露时间较短, 暴露程度较低, 水分含量较高, 温度变化小, 因此导致了低的氧含量及pH值[3], 高潮带则相反。尽管断面1高潮带采样点上缘存在一个雨水管道出口, 使断面1的有机碳质量分数略高于断面2, 但除10月份低潮带采样点有机碳质量分数由于不明原因高达1.53%外, 其余各采样点有机碳质量分数都不足0.6%, 处于相对较低水平。
小型底栖生物的分布可受物理、化学和生物因素的影响, 如沉积物粒度特征、叶绿素质量比、水温、盐度、季节以及自身繁殖特点等[41]。本研究小型底栖生物的丰度、生物量和类群组成都存在显著的季节变化。3月份有适宜的光照和温度, 有利于底栖微藻生长繁殖[42], 可为小型底栖生物提供丰富的食物来源[43], 而春季又逢小型底栖生物的主要繁殖季节, 因而3月出现较高的丰度值, 反之12月的小型底栖生物丰度最低; 随着温度的升高, 且微生物分解过程旺盛, 耗氧增多, 造成7月溶氧质量浓度最低, 低潮带甚至呈现缺氧状态, 反而不利于一些底栖生物的生存, 因而7月的丰度值低于3月。此外有研究显示[31], 季节影响之外, 海水浴场沙滩上的散步、奔跑、嬉戏及浅海区的游泳等旅游活动引起的沉积物改变可能是导致小型底栖动物的丰度、类群和种类组成及分布变化的重要原因之一, 旅游旺季(7月)小型底栖动物丰度及其优势类群海洋线虫丰度明显低于淡季, 并在中潮带表现突出。因此季节因素引起的沉积物理化因子的变化以及人为扰动的差异是导致大连金沙滩小型底栖生物季节动态变化的关键影响因素。
本研究小型底栖生物的丰度、生物量和生物多样性还存在显著的潮区差异。高潮带的丰度、生物量和生物多样性都较高, 这可能是因为该海滩高潮带沉积物被淹没时间短, 含氧量较高, 特别在3月温度开始上升, Chl-a质量比增高的情况下, 可为小型底栖生物提供较好的生存条件, 得以大量繁殖, 因此在3月出现丰度高峰, 7月出现生物量高峰。根据Huston动态平衡假说(Huston’s dynamic equilibrium hypothesis), 小型底栖生物的最佳生存条件是在中潮带, 因而具有较高的生物多样性[44], 而金沙滩中潮带虽然生物多样性较高潮带高, 但小型底栖生物丰度与生物量都低于高潮带, 这可能是由于金沙滩作为旅游沙滩, 中潮带受人为扰动过大造成的。此外, 本研究生物多样性的分析仅建立在类群数据的基础上, 未来工作应进一步对其主要类群进行种、属水平的鉴定, 以便更好的进行生物多样性的分析。本研究中间隙水盐度、沉积物极粗砂质量比和有机碳质量分数的环境因子的组合能最好地解释金沙滩小型底栖生物群落结构, 反映了季节、沉积物粒度和理化环境对小型底栖生物群落的综合影响。10月份低潮带采样点有机碳异常增高可能是造成该采样点小型底栖生物群落迥异于其他采样点的主要原因。
将本研究与近年来我国海域不同砂质潮间带的小型底栖生物研究[17, 19-23]进行比较可知, 大连潮间带小型底栖生物季节分布规律与青岛潮间带基本一致, 普遍表现为春季丰度最高, 夏秋丰度明显降低, 这可能是因为大连与青岛同处温带沿海, 气候条件相近, 且同为旅游景点, 受人为扰动影响情况相似; 舟山、厦门潮间带丰度则较大连更低, 与Hua等研究[24]得出的亚热带潮间带小型底栖生物丰度通常低于温带的规律一致。此外, 本研究中高潮带的小型底栖生物丰度、生物量和生物多样性都较高, 不符合Huston动态平衡假说, 这与青岛薛家岛砂质潮间带[45]和舟山朱家尖东沙砂质潮间带[23]的研究结果相似, 可能是受人为扰动和沉积物初级生产力水平的影响和制约, 具体作用机制尚需通过更多采样调查进行深入研究。
3.2 平均个体干质量参考值的选取本研究通过小型底栖生物各生物类群丰度值乘相应平均个体干质量的方法估算生物量, 所采用的平均个体干质量与国内现有的小型底栖生物调查工作一致, 但不同沉积物类型中各类群的物种组成有所差异, 与其他生境相比, 砂质潮间带间隙生活的小型底栖生物个体较小, 使用相同的参考值来计算可能存在较大误差。若想取得更为准确的生物量数据, 根据海洋调查规范, 可以采用直接称重法或体积换算法[34]:直接称重法即取一定数量某一类群的样品冲洗干净后置于标准水分测定仪中加热至恒重, 再使用微量天平称重; 体积换算法则需通过显微镜描图仪测量生物个体体长与最大体宽, 适用于小型底栖生物各主要类群, 同时不同类群对应不同换算系数(如等足类换算系数为230, 而线虫类为530), 其中桡足类的换算系数又依形状而不同(如盾形桡足类对应换算系数为230, 圆柱形则为750)。此处以小型底栖生物常见优势类群桡足类与线虫类为例, 对小型底栖生物平均个体干质量参考值的选取进行简单讨论。
以桡足类为例, 采用丰度值乘平均个体干质量的方法估算生物量, 常见引用的平均个体干质量参考值有两个, 分别是McIntyre[38]提出的1.86 µg与Wieser[46]提出的1.70 µg; 另有一些研究通过对样品中个体干质量和体长数据进行回归分析得到线性关系公式来计算其生物量。Goodman[47]采集不同沉积物类型的样品, 采用45 µm网筛分选, 实际称量并计算了样品中桡足类的生物量, 比较了样品中桡足类实际生物量和根据其他作者发表的平均个体干质量计算而得到的生物量, 将其与上述两个参考值进行比较, 发现在砂质的沉积物(sand)中, 根据Wiesre的平均个体干质量1.70 µg计算的生物量比参考值1.86 µg更接近称量值, 在泥沙质的沉积物(sand-mud)或砂石质的沉积物(sand-gravel)中则相反; 在不同类型沉积物中, 根据个体干质量-体长线性回归关系计算的生物量都比两种参考值估算的结果更准确, 但显然不如使用统一的个体干质量参考值进行计算更简便。
以线虫类为例, 我国小型底栖生物研究中对海洋线虫生物量的估算, 普遍采用0.4 µg这一经验值; 在进行线虫干质量测定时, 由于直接称量法处理后的样品无法用于后续制片分析, 大多数学者采用体积换算法。近年来, 多位学者对北黄海、南黄海、长江口附近等不同海域沉积物样品中的线虫个体干质量进行了实测, 所得结果自0.104~0.365 µg不等[48-51], 但都明显小于0.40 µg; 对海南省东寨港[52]、福建九龙江口和洛阳江口[53]红树林湿地沉积物中的线虫干质量测定结果分别为0.6、0.826 µg, 明显大于0.40 µg, 对砂质潮间带沉积物中的线虫个体干质量的研究则少有报道。
综上所述, 使用平均个体干质量与丰度乘积的方法来估算小型底栖生物各类群生物量, 需要考虑到不同沉积物类型中小型底栖生物的差异性, 而不同沉积类型中各类群平均个体干质量的参考量值的确定和使用, 需要通过对不同沉积环境针对性的采样研究来进行进一步探索。为保证数据资料的可比性, 现阶段对小型底栖生物生物量的研究, 应尽可能同时报道相应丰度数据。
4 结论本研究对大连金沙滩砂质潮间带小型底栖生物及其所处的沉积环境进行了季节性的采样调查, 主要结果如下: (1)金沙滩砂质潮间带共鉴定出15个小型底栖生物类群, 优势类群为海洋线虫类与桡足类。(2)小型底栖生物的丰度和生物量都存在显著的潮区差异和季节波动。小型底栖生物年平均丰度为42.52个/cm2±42.91个/cm2, 其中线虫类丰度最高, 桡足类次之, 涡虫类第三, 丰度在季节、潮区间变化趋势为3月> 10月> 7月> 12月, 高潮带 > 中潮带 > 低潮带; 年平均生物量为87.00 µg/cm2±85.32µg/cm2, 其中多毛类生物量最高, 桡足类次之, 涡虫类第三, 生物量在季节、潮区间变化趋势为10月> 7月> 3月> 12月, 高潮带 > 低潮带 > 中潮带。(3)金沙滩小型底栖生物群落在不同季节间有显著差异, 间隙水盐度、极粗砂质量比和有机碳质量分数的组合能最好地解释金沙滩小型底栖生物群落结构。
| [1] |
McLachlan A, Turner I. The interstitial environment of sandy beaches[J]. Marine Ecology, 1994, 15(3/4): 177-211. |
| [2] |
McLachlan A, Dorvlo A. Global patterns in sandy beach macrobenthic communities[J]. Journal of Coastal Research, 2005, 21(4): 674-687. |
| [3] |
Higgins R P, Thiel H. Introduction to the Study of Meiofauna[M]. Washington, D.C.: Smithsonian Institution Press, 1988.
|
| [4] |
Heip C, Vincx M, Vranken G. The Ecology of Marine Nematodes[J]. Oceanography and Marine Biology:An Annual Review, 1985, 23: 399-489. |
| [5] |
张志南, 钱国珍. 小型底栖生物取样方法的研究[J]. 海洋湖沼通报, 1990(4): 37-42. Zhang Zhinan, Qian Guozhen. A study on sampling methods for meiofauna[J]. Transactions of Oceanology and Limnology, 1990(4): 37-42. |
| [6] |
张志南. 秦皇岛砂滩海洋线虫的数量研究[J]. 青岛海洋大学学报, 1991, 21(1): 63-75. Zhang Zhinan. A study on the abundance of free-living marine nematodes on four intertidal sandy beaches at the Qinhuangdao Bay, north China[J]. Journal of Ocean University of Qingdao, 1991, 21(1): 63-75. |
| [7] |
张志南, 党宏月, 于子山. 青岛湾有机质污染带小型底栖生物群落的研究[J]. 青岛海洋大学学报, 1993, 23(1): 83-91. Zhang Zhinan, Dang Hongyue, Yu Zishan. A study on the meiobenthic community in an organically polluted beach of Qingdao Bay[J]. Journal of Ocean University of Qingdao, 1993, 23(1): 83-91. |
| [8] |
张志南, 林霞, 于子山. 大连石槽岩滩附植小型动物的初步研究[J]. 青岛海洋大学学报, 1994, 24(3): 373-383. Zhang Zhinan, Lin Xia, Yu Zishan. Preliminary study on the phytal meiofauna from the rocky beach[J]. Journal of Ocean University of Qingdao, 1994, 24(3): 373-383. |
| [9] |
Zhang Zhinan. Phytal meiofauna of a rocky shore at the cape of Aguilar marine reserve, Hong Kong[J]. The Marine Flora and Fauna of Hong Kong and Southern China, 1997, 4: 204-217. |
| [10] |
蔡立哲, 李复雪. 厦门潮间带泥滩和虾池小型底栖动物类群的丰度[J]. 台湾海峡, 1998, 17(1): 91-95. Cai Lizhe, Li Fuxue. Abundance of meiofauna on intertidal mudflat and shrimp ponds in Xiamen[J]. Journal of Oceanography in Taiwan Strait, 1998, 17(1): 91-95. |
| [11] |
蔡立哲, 厉红梅, 邹朝中. 厦门钟宅泥滩海洋线虫群落的种类组成及其多样性[J]. 厦门大学学报(自然科学版), 2000, 39(5): 669-675. Cai Lizhe, Li Hongmei, Zou Chaozhong. Species composition and diversity of marine nematode community on intertidal mudflat in Zhongzhai, Xiamen[J]. Journal of Xiamen University (Natural Science), 2000, 39(5): 669-675. DOI:10.3321/j.issn:0438-0479.2000.05.016 |
| [12] |
蔡立哲, 厉红梅, 邹朝中. 深圳河口福田泥滩海洋线虫的种类组成及季节变化[J]. 生物多样性, 2000, 8(4): 385-390. Cai Lizhe, Li Hongmei, Zou Chaozhong. Species composition and seasonal variation of marine nematodes on Futian mudflat in Shenzhen estuary[J]. Chinese Biodiversity, 2000, 8(4): 385-390. DOI:10.3321/j.issn:1005-0094.2000.04.005 |
| [13] |
林岿璇, 张志南, 韩洁. 南麂列岛海洋自然保护区潮间带小型生物初步研究[J]. 青岛海洋大学学报, 2003, 33(2): 219-225. Lin Kuixuan, Zhang Zhinan, Han Jie. A preliminary study on the meiofauna in the intertidal zone in Nanji islands marine reserve[J]. Journal of Ocean University of Qingdao, 2003, 33(2): 219-225. DOI:10.3969/j.issn.1672-5174.2003.02.008 |
| [14] |
范士亮, 刘海滨, 张志南, 等. 青岛太平湾砂质潮间带小型底栖生物丰度和生物量的研究[J]. 中国海洋大学学报, 2006, 36(Sup.): 98-104. Fan Shiliang, Liu Haibin, Zhang Zhinan, et al. Study on the abundance and biomass of meiofauna in the sandy beach of Taiping Bay, Qingdao[J]. Periodical of Ocean University of China, 2006, 36(Sup.): 98-104. |
| [15] |
林秀春, 蔡立哲, 金亮. 湄洲湾灵川贝类养殖滩涂小型底栖动物数量研究[J]. 台湾海峡, 2007, 26(2): 289-294. Lin Xiuchun, Cai Lizhe, Jin Liang. Studies on the meiofauna number at the shell fish farming mudflat of Lingchuan in Meizhou Bay[J]. Journal of Oceanography in Taiwan Strait, 2007, 26(2): 289-294. DOI:10.3969/j.issn.1000-8160.2007.02.020 |
| [16] |
张艳. 附植小型底栖动物生物量测定方法的初步研究[J]. 中国农学通报, 2009, 25(18): 452-456. Zhang Yan. A preliminary study on determination of biomass of the phytal meiofauna[J]. Chinese Agricultural Science Bulletin, 2009, 25(18): 452-456. |
| [17] |
杨世超, 慕芳红, 周红, 等. 2006年冬季胶州湾及邻近山东半岛南岸海域小型底栖动物丰度和生物量[J]. 中国海洋大学学报, 2009, 39(Sup.): 78-82. Yang Shichao, Mu Fanghong, Zhou Hong, et al. Abundance and biomass of the meiofauna in Jiaozhou Bay and southern coastal waters of Shandong Peninsula in winter, 2006[J]. Periodical of Ocean University of China, 2009, 39(Sup.): 78-82. |
| [18] |
杜永芬, 徐奎栋, 类彦立, 等. 青岛湾小型底栖生物周年数量分布与沉积环境[J]. 生态学报, 2011, 31(2): 431-440. Du Yongfen, Xu Kuidong, Lei Yanli, et al. Annual quantitative distribution of meiofauna in relation to sediment environment in Qingdao Bay[J]. Acta Ecologica Sinica, 2011, 31(2): 431-440. |
| [19] |
丛冰清.舟山砂质潮间带小型底栖生物空间分布及季节动态[D].青岛: 中国海洋大学, 2011. Cong Bingqing. Spatial distribution and seasonal dynamics of meiofauna in a sandy beach of Zhoushan[D]. Qingdao: Ocean University of China, 2011. |
| [20] |
张婷.厦门典型沙滩小型底栖动物生态学的研究[D].青岛: 中国海洋大学, 2011. Zhang Ting. Ecological study of meiofauna in the typical sandy beaches of Xiamen[D]. Qingdao: Ocean University of China, 2011. |
| [21] |
付姗姗, 慕芳红, 杨世超, 等. 青岛沧口潮间带小型底栖生物的时空分布研究[J]. 中国海洋大学学报, 2012, 42(Sup.): 124-130. Fu Shanshan, Mu Fanghong, Yang Shichao, et al. Study on the spatial-temporal distribution of meiofauna in the intertidal zone of Cangkou, Qingdao[J]. Periodical of Ocean University of China, 2012, 42(Sup.): 124-130. |
| [22] |
李佳, 华尔, 张志南. 青岛砂质潮间带小型底栖动物分布及季节动态[J]. 应用生态学报, 2012, 23(12): 3458-3466. Li Jia, Hua Er, Zhang Zhinan. Distribution and seasonal dynamics of meiofauna in intertidal zone of Qingdao sandy beaches, Shandong Province of East China[J]. Chinese Journal of Applied Ecology, 2012, 23(12): 3458-3466. |
| [23] |
许书会, 周红, 华尔, 等. 夏冬两季舟山砂质潮间带小型底栖生物的分布特征及影响因素[J]. 中国海洋大学学报, 2013, 43(8): 60-68. Xu Shuhui, Zhou Hong, Hua Er, et al. Distribution pattern of intertidal meiofauna in a sandy beach of Zhoushan in summer and winter and its influencing factors[J]. Periodical of Ocean University of China, 2013, 43(8): 60-68. |
| [24] |
Hua Er, Zhang Zhinan, Zhou Hong, et al. Meiofauna distribution in intertidal sandy beaches along China shoreline (18°-40°N)[J]. Journal of Ocean University of China (Oceanic and Coastal Sea Research), 2016, 15(1): 19-27. DOI:10.1007/s11802-016-2740-3 |
| [25] |
杨世超.重金属铜、镉及海水酸化对底栖猛水蚤的毒性研究[D].青岛: 中国海洋大学, 2010. Yang Shichao. Toxicity of copper, cadimium and seawater acidification to the benthic harpacticoid[D]. Qingdao: Ocean University of China, 2010. |
| [26] |
韦晓慧.海洋酸化条件下铜、镉对日本虎斑猛水蚤(Tigriopus japonicus)发育、繁殖和超氧化物歧化酶活性的影响[D].青岛: 中国海洋大学, 2013. Wei Xiaohui. Effect of simulated ocean acidification condition and heavy metals of Cu and Cd on the development, reproduction and SOD activity of Tigriopus japonicus[D]. Qingdao: Ocean University of China, 2013. |
| [27] |
曹志泉.海水酸化和温度对日本虎斑猛水蚤(Tigriopus japonicus)繁殖和发育的影响[D].青岛: 中国海洋大学, 2013. Cao Zhiquan. Effect of simulated ocean acidification and temperature on the development and reproduction of Tigriopus japonicus[D]. Qingdao: Ocean University of China, 2013. |
| [28] |
孙艳桃, 慕芳红, 韦晓慧, 等. 海水酸化对日角猛水蚤和日本虎斑猛水蚤摄食率的影响[J]. 海洋湖沼通报, 2014(3): 105-111. Sun Yantao, Mu Fanghong, Wen Xiaohui, et al. Effect of seawater acidification on ingestion rates of Tisbe sp. and Tigriopus japonicus[J]. Transactions of Oceanology and Limnology, 2014(3): 105-111. |
| [29] |
陈瑶, 董炜峰, 戴红, 等. 海洋酸化对日本虎斑猛水蚤抗氧化性指标和繁殖发育的影响[J]. 生态学杂志, 2017, 36(1): 144-149. Chen Yao, Dong Weifeng, Dai Hong, et al. Influence of CO2-induced seawater acidification on the antioxidant parameters, development and reproduction in Tigriopus japonicus[J]. Chinese Journal of Ecology, 2017, 36(1): 144-149. |
| [30] |
华尔, 李佳, 董洁, 等. 砂质潮间带自由生活海洋线虫对缺氧的响应:微型受控生态系研究[J]. 生态学报, 2012, 32(13): 3975-3986. Hua Er, Li Jia, Dong Jie, et al. Responses of sandy beach nematodes to oxygen deficiency:Microcosm experiments[J]. Acta Ecologica Sinica, 2012, 32(13): 3975-3986. |
| [31] |
华尔, 林佳宁, 冯颂, 等. 踩踏对砂质滩小型底栖动物的影响:现场扰动实验初步结果[J]. 中国海洋大学学报, 2010, 40(10): 63-68. Hua Er, Lin Jianing, Feng Song, et al. Trampling effects on sandy beach meiofauna:Preliminary results of field experiments[J]. Periodical of Ocean University of China, 2010, 40(10): 63-68. |
| [32] |
许书会.人为干扰对砂质潮间带小型底栖生物的影响[D].青岛: 中国海洋大学, 2013. Xu Shuhui. Effect of human-disturbance to marine meiofauna in the sandy intertidal shores of Qingdao[D]. Qingdao: Ocean University of China, 2013. |
| [33] |
张志南, 林霞, 于子山. 大连石槽岩滩附植小型动物的初步研究[J]. 青岛海洋大学学报, 1994, 24(3): 373-383. Zhang Zhinan, Lin Xia, Yu Zishan. Preliminary study on the phytal meiofauna from the rocky beach at Shicao, Dalian[J]. Journal of Ocean University of Qingdao, 1994, 24(3): 373-383. |
| [34] |
GB/T12763.3-2007, 海洋调查规范[S]. GB/T12763.3-2007, Specifications for Oceanographic Survey[S]. |
| [35] |
Juario J V. Nematode species composition and seasonal fluctuation of a sublittoral meiofauna community in the German Bight[J]. Ver ff Inst Meeresforsch Bremerh, 1975, 15: 283-337. |
| [36] |
Widbom B. Determination of average individual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna[J]. Marine Biology, 1984, 84(1): 101-108. DOI:10.1007/BF00394532 |
| [37] |
张志南, 周红, 于子山, 等. 胶州湾小型底栖生物的丰度和生物量[J]. 海洋与湖沼, 2001, 32(3): 139-147. Zhang Zhinan, Zhou Hong, Yu Zishan, et al. Abundance and biomass of the benthic meiofauna in the northern soft-bottom of the Jiaozhou Bay[J]. Oceanologia and Limnologia Sinica, 2001, 32(3): 139-147. |
| [38] |
McIntyre A D. Meiobenthos of sub-littoral muds[J]. Journal of the Marine Biological Association of the United Kingdom, 1964, 44(3): 665-674. DOI:10.1017/S0025315400027843 |
| [39] |
GB18668-2002, 海洋沉积物质量[S]. GB18668-2002, Marine sediment quality[S]. |
| [40] |
Wynberg R P, Branch G M. Disturbance associated with bait-collection for sandprawns (Callianassa kraussi) and mudprawns (Upogebia africana):Long-term effects on the biota of intertidal sandflats[J]. Journal of Marine Research, 1994, 52(3): 523-558. DOI:10.1357/0022240943077019 |
| [41] |
慕芳红, 张志南, 郭玉清. 渤海小型底栖生物的丰度和生物量[J]. 青岛海洋大学学报, 2001, 31(6): 897-905. Mu Fanghong, Zhang Zhinan, Guo Yuqing. Abundance and biomass of the benthic meiofauna in the Bohai Sea[J]. Journal of Ocean University of Qingdao, 2001, 31(6): 897-905. DOI:10.3969/j.issn.1672-5174.2001.06.012 |
| [42] |
姜祖辉, 陈瑞盛, 王俊. 胶州湾红岛潮间带底栖微藻种类组成及其生物量变化[J]. 海洋水产研究, 2007, 28(5): 74-81. Jiang Zuhui, Chen Ruisheng, Wang Jun. Species composition and biomass of microphytobenthos in intertidal zone of Hongdao Island, Jiaozhou Bay[J]. Marine Fisheries Research, 2007, 28(5): 74-81. |
| [43] |
Armonies W, Reise K. Faunal diversity across a sandy shore[J]. Marine Ecology Progress Series, 2000, 196: 49-57. DOI:10.3354/meps196049 |
| [44] |
Huston M. A general hypothesis of species diversity[J]. The American Naturalist, 1979, 113(1): 81-101. DOI:10.1086/283366 |
| [45] |
韦晓慧, 慕芳红, 杨世超, 等. 青岛薛家岛砂质潮间带小型底栖生物丰度和生物量[J]. 中国海洋大学学报, 2013, 43(10): 60-66. Wei Xiaohui, Mu Fanghong, Yang Shichao, et al. Study on the abundance and biomass of meiofauna in the intertidal sands of Xuejiadao in Qingdao[J]. Periodical of Ocean University of China, 2013, 43(10): 60-66. |
| [46] |
Wieser W. Benthic studies in Buzzards Bay Ⅱ. The meiofauna[J]. Limnology and Oceanography, 1960, 5(2): 121-137. DOI:10.4319/lo.1960.5.2.0121 |
| [47] |
Goodman K S. The estimation of individual dry weight and standing crop of harpacticoid copepods[J]. Hydrobiologia, 1980, 72(3): 253-259. DOI:10.1007/BF00005629 |
| [48] |
黄勇.南黄海小型底栖生物生态学和海洋线虫分类学研究[D].青岛: 中国海洋大学, 2005. Huang Yong. Studies on ecology of meiofauna and systematics of free-living marine nematodes in the Southern Yellow Sea[D]. Qingdao: Ocean University of China, 2005. |
| [49] |
于婷婷, 徐奎栋. 长江口及邻近海域秋冬季小型底栖动物类群组成与分布[J]. 生态学报, 2013, 33(15): 4556-4566. Yu Tingting, Xu Kuidong. Assemblage composition and distribution of meiobenthos in the Yangtze Estuary and its adjacent waters in autumn-winter season[J]. Acta Ecologica Sinica, 2013, 33(15): 4556-4566. |
| [50] |
于婷婷, 徐奎栋. 北黄海冬季沉积物中线虫个体干质量初探[J]. 海洋科学, 2015, 39(6): 8-14. Yu Tingting, Xu Kuidong. Investigation on the individual dry weight of nematodes in sediments of the northern Yellow Sea in winter[J]. Marine Sciences, 2015, 39(6): 8-14. |
| [51] |
史本泽, 于婷婷, 徐奎栋. 长江口及东海夏季小型底栖动物丰度和生物量变化[J]. 生态学报, 2015, 35(9): 3093-3103. Shi Benze, Yu Tingting, Xu Kuidong. Abundance and biomass of meiofauna in the Yangtze Estuary and East China Sea in summer, with special reference to changes over the past ten years[J]. Acta Ecologica Sinica, 2015, 35(9): 3093-3103. |
| [52] |
刘均玲, 黄勃, 梁志伟. 东寨港红树林小型底栖动物的密度和生物量研究[J]. 海洋学报, 2013, 35(2): 187-192. Liu Junling, Huang Bo, Liang Zhiwei. Study on abundance and biomass of benthic meiofauna in mangrove of Dongzhai Bay[J]. Acta Oceanologica Sinica, 2013, 35(2): 187-192. DOI:10.3969/j.issn.0253-4193.2013.02.020 |
| [53] |
刘梦迪, 陈建春, 郭玉清, 等. 红树林湿地沉积物中海洋线虫个体干质量的研究[J]. 海洋学报, 2018, 40(8): 89-96. Liu Mengdi, Chen Jianchun, Guo Yuqing, et al. Study on the individual dry weight of marine nematodes in mangrove sediments[J]. Haiyang Xuebao, 2018, 40(8): 89-96. DOI:10.3969/j.issn.0253-4193.2018.08.009 |
 2020, Vol. 44
2020, Vol. 44


