文章信息
- 李俭平, 周忻宇, 代婧炜, 沈庆洲. 2020.
- LI Jian-ping, ZHOU Xin-yu, DAI Jing-wei, SHEN Qing-zhou. 2020.
- 羧乙基壳聚糖蒙脱石吸附养殖水体中Cu2+的应用
- Adsorption of Cu2+ in aquaculture water using carboxyethyl chitosan (CEC)/montmorillonite adsorbent
- 海洋科学, 44(2): 120-130
- Marine Sciences, 44(2): 120-130.
- http://dx.doi.org/10.11759/hykx20190901001
-
文章历史
- 收稿日期:2019-09-01
- 修回日期:2019-10-21
由于硫酸铜作为药物使用不当等原因, 水生动物铜中毒屡见发生[1]。重金属铜也会在鱼体中进行富集, 通过生物链进入高级生物体, 从而对人类健康及其他生物种类产生危害[2]。根据《渔业水质标准》规定, 养殖水体中铜的含量应控制在0.01 mg/L以内[3]。吸附法是一种既简便又适用的治理和回收废水中的重金属离子方法。
蒙脱石储量大、价格低廉、制备简单、稳定性好、天然无害, 壳聚糖无毒害、可自然降解、具有良好的环境兼容性[4], 但蒙脱石在水中固-液分离速度慢、絮凝物脱水效果差, 并且壳聚糖的密度小、造粒难、不易与溶液中金属离子接触以及酸性条件下壳聚糖分子中的-NH2易质子化而使壳聚糖溶于水等问题也限制了它们的使用[5]。
现将制得的羧乙基壳聚糖与蒙脱石进行负载, 使二者相互结合, 不但很大程度上使体积变得更大, 更扩大了层间距和比表面积, 从而达到吸附能力增大的目的[6]。
作者拟以蒙脱石负载羧乙基壳聚糖, 制备成复合吸附剂, 通过红外光谱分析(IR)、扫描电子显微镜分析(SEM)、X-射线粉末衍射分析(XRD)等手段分析其表面性能和复合机理, 通过改变两者的配比、投加量、时间、Cu2+浓度、pH值等探讨影响其吸附性能的条件, 并从吸附动力学和吸附热力学角度分析吸附剂对Cu2+的吸附机理, 最后考察其再生利用效果。
1 实验材料与方法 1.1 试剂和仪器分析使用的是符合国家标准的分析纯试剂, 实验用水为新鲜3次蒸馏水。
实验中的玻璃器皿均用盐酸溶液或硫酸溶液浸泡, 用自来水冲洗后再用蒸馏水冲洗数次。
水浴恒温振荡器(SHZ), 双光束红外分光光度计(WGH-30A型), 扫描电镜(Hitachi-S4800, 日立), X-射线衍射仪(D8advance, 德国Buker公司), 原子吸收分光光度计(4510F)。
1.2 羧乙基壳聚糖的制备准确称取8 g丙烯酸溶于30 mL蒸馏水。在磁力搅拌器搅拌下用胶头滴管滴加溶于20 mL蒸馏水的10 g固体氢氧化钠水溶液到丙烯酸水溶液中, 调至pH=6[7]。将2.0 g壳聚糖溶于已调节pH=6的丙烯酸水溶液中, 搅拌使其混合均匀后, 将溶液转移到3口烧瓶中, 用恒温加热磁力搅拌器水浴恒温90℃下反应, 持续加热回流5 h。冷却, 调至pH=10后再4 000 r/min离心10 min, 向上清液中倒入2倍体积的无水乙醇沉淀, 洗涤后, 真空烘干24 h, 研磨成粉末, 储存备用[8]。
1.3 复合吸附剂的制备称取定量蒙脱石及羧乙基壳聚糖, 用适量水使其充分浸润, 搅拌直至成为糊状, 真空干燥箱中充分干燥48 h后, 将其研磨成粉末, 过直径0.125 mm筛, 即得到不同配比的复合吸附剂, 放置阴凉干燥处储存备用[9]。
1.4 实验方法移取一定量的Cu2+溶液放入锥形瓶中, 向其中投加适量羧乙基壳聚糖蒙脱石复合吸附剂, 水浴恒温振荡器震荡一定时间后, 离心取上清液, 用火焰原子吸收分光光度法测其吸光度, 计算其吸附率和吸附容量。
吸附率为:
| $ v = \frac{{{C_0} - {C_{\rm{e}}}}}{{{C_0}}} \times 100\% $ | (1) |
吸附容量为:
| $ q = \frac{{\left( {{C_0} - {C_\mathit{e}}} \right)V}}{M} $ | (2) |
v代表去除率, C0代表最初Cu2+浓度(mg/L); Ce代表最终Cu2+浓度(mg/L); q代表整体反应结束后的吸附容量(mg/g); V代表锥形瓶中溶液体积(L); M代表加入的吸附剂的总质量(g)。
2 结果分析与讨论 2.1 复合吸附剂的表征 2.1.1 傅里叶红外光谱分析从图 1中可以看出壳聚糖中3 350 cm–1是N-H伸缩振动和O-H伸缩振动的特征吸收峰部分重叠的结果, 1 636 cm–1为-NH2的变角振动峰, 1 085 cm–1是C-O-C的伸缩振动吸收峰, 通过羧乙基化改性后谱图中3 500 cm–1~3 400 cm–1处的吸收峰宽度变小, 说明-NH和-OH间氢键遭到破坏, 而1 697 cm–1为-C=O伸缩振动吸收峰, 1 602 cm–1为COO–的反对称伸缩振动峰。这些结果证明, 羧乙基被成功引入壳聚糖的胺基之上。
 |
| 图 1 壳聚糖(chitosan)和羧乙基壳聚糖(CEC)的红外光谱图 Fig. 1 Infrared spectra of chitosan and CEC |
由于制备蒙脱石负载羧乙基壳聚糖时, 羧乙基壳聚糖的加入量很小, 其对红外的吸收信号较弱, 负载羧乙基壳聚糖前后出峰位置基本没有太大的变化, 只能从峰强弱分析, 图 2-b中1 570 cm–1是羧乙基壳聚糖的特征吸收峰, 为C=O的不对称伸缩振动峰, 在3 618 cm–1和3 400 cm–1处吸收峰明显变强, 峰面积变大, 说明羧乙基壳聚糖插入蒙脱石层间, 使其结构中-OH基团增多[10, 11]; 另外783 cm–1和990 cm–1处, 峰面积明显变大, 说明蒙脱石晶格间Al-O八面体与羧乙基壳聚糖有明显的化学吸附作用[11]。
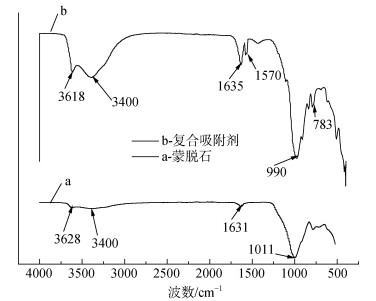 |
| 图 2 蒙脱石和蒙脱石-羧乙基壳聚糖复合吸附剂的红外波谱图 Fig. 2 Infrared spectra of montmorillonite and composite adsorbent |
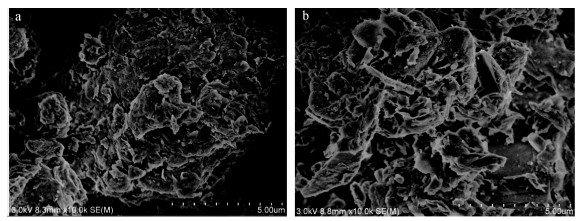
通过图 3发现壳聚糖形貌是片状形, 表面致密均匀, 无孔洞出现, 而产物羧乙基壳聚糖形貌是颗粒小不规整, 表面疏松多孔, 这说明羧乙基化后的壳聚糖, 更有利于吸附[10]。
 |
| 图 3 壳聚糖和羧乙基壳聚糖的SEM图 Fig. 3 SEM spectra of chitosan and CEC a.壳聚糖, b.羧乙基壳聚糖 a. chitosan, b. CEC |
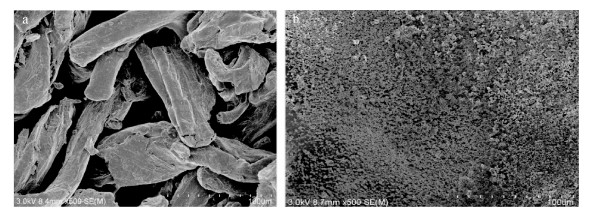
从图 4可以看出蒙脱石颗粒分布紧密, 有团聚现象, 而复合吸附剂, 呈不规则的片状结构, 层间状态更为分散, 表面积增大, 有利于吸附, 说明羧乙基壳聚糖成功进入到蒙脱石层间。
 |
| 图 4 蒙脱石(a)和蒙脱石-羧乙基壳聚糖复合吸附剂(b)的SEM图 Fig. 4 SEM spectra of montmorillonite (a) and composite adsorbent (b) |
从图 5中可以看出复合吸附剂d(001)面衍射特征峰的2θ角位置由蒙脱石的6.07°变为5.81°。根据布拉格方程2dsinθ=nλ, 可以计算得复合吸附剂对应的晶体层间距比蒙脱石有所增加[12], 但增长幅较小, 这可能是羧乙基壳聚糖插层进入蒙脱石层间后导致层间距增大。
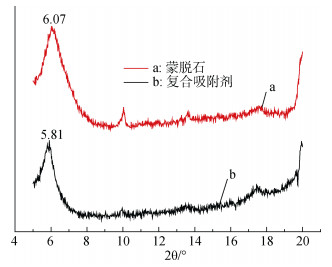 |
| 图 5 蒙脱石和蒙脱石羧乙基壳聚糖复合吸附剂的XRD图 Fig. 5 XRD spectra of montmorillonite and composite adsorbent |
用火焰原子吸收分光光度法测Cu2+的吸光度值, 绘制标准曲线。
实验结果如图 6。
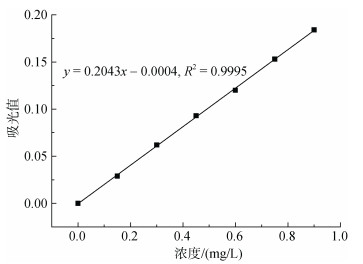 |
| 图 6 Cu2+标准曲线 Fig. 6 The standard curve of Cu2+ |
移取多个50 mL、30 mg/L、pH=6.0的Cu2+溶液放入锥形瓶中, 向其中投加3.0 g/L不同配比的羧乙基壳聚糖-蒙脱石复合吸附剂, 单独蒙脱石、壳聚糖、羧乙基壳聚糖作对比, 恒温35℃水浴40 min后取上清液, 测其吸光度。
由图 7实验结果可知, 壳聚糖单独使用时对Cu2+的去除率最低, 其次是蒙脱石和羧乙基壳聚糖, 不同配比复合吸附剂中, 当羧乙基壳聚糖与蒙脱石的比例是0.04时Cu2+的去除率最显著, 计算得90.81%。
 |
| 图 7 不同配比吸附剂对Cu2+吸附效果的影响 Fig. 7 Effect of different proportions of adsorbents on the adsorption of Cu2+ 横坐标1-3表示蒙脱石、壳聚糖、羧乙基壳聚糖; 4-10表示羧乙基壳聚糖与蒙脱石配比为0.02、0.04、0.06、0.08、0.10、0.50、1.00复合吸附剂 The abscissas 1-3 represent montmorillonite, chitosan and carboxyethyl chitosan; 4-10 represent the composite adsorbent under the conditions of the carboxyethyl chitosan and montmorillonite mass ratio of 0.02、0.04、0.06、0.08、0.10、0.50、1.00 respectively |
配比增加后Cu2+去除率出现先增大后减小的现象可能是因为蒙脱石层间的阳离子交换容量≥羧乙基壳聚糖数量时, 去除率随配比的增加而升高; 但是当蒙脱石的阳离子交换容量小于羧乙基壳聚糖数量之后去除率开始下降[13]。
2.4 吸附剂投加量对Cu2+吸附效果的影响移取多个50 mL、30 mg/L、pH=6.0的Cu2+溶液放入锥形瓶中, 向其中投加1.0、1.6、2.2、3.0、4.0、5.0、6.0 g/L的配比0.04的复合吸附剂, 置于35℃水浴, 吸附40 min后取上清液, 测其吸光度。
根据图 8看出随着投加量的增加, Cu2+去除率增加, 吸附剂在投加1.0 g/L~4.0 g/L范围内, Cu2+去除率增长较为快速, 几乎呈直线增长, 从63.13%增长到93.05%;随着吸附剂投加量越来越多, 溶液中Cu2+去除率基本维持稳定; 然而吸附容量当投加量越来越多它却全程呈现降低的状态。
 |
| 图 8 不同吸附剂投加量对Cu2+吸附效果的影响 Fig. 8 Effect of different dosage of adsorbents on the adsorption of Cu2+ |
随着投加量的增加, 吸附剂可以供应的吸附点位也增加, 更有利于Cu2+的吸附, 去除率会有所提升。而当复合吸附剂的量达到某个限度之后, 即使投加量越来越多, 去除率却基本不再改变, 而吸附容量却一直下降, 这是因为溶液中大部分Cu2+被去除后, 复合吸附剂表明的吸附点位数不断下降, 相关孔道也不断被堵塞[12], 再加复合吸附剂时, 平均吸附Cu2+量降低。此外, 过量的复合吸附剂在溶液中也增加了分离出溶液中吸附剂的难度[14]。基于节省原料以及保持高去除率的观念, 后续实验中将羧乙基壳聚糖与蒙脱石复合吸附剂定为4.0 g/L。
2.5 温度对Cu2+吸附效果的影响移取多个50 mL、30 mg/L、pH=6.0的Cu2+溶液放入可加热玻璃容器中, 向其中投加4.0 g/L配比为0.04的复合吸附剂, 分别置于25、30、35、40、45、50℃水浴, 吸附40 min后取上清液, 测其吸光度。
由图 9可知, 羧乙基壳聚糖与蒙脱石复合吸附剂当温度在25℃~40℃时, Cu2+去除率增长较为明显, 从91.71%增长到94.10%;在此之后, 虽然温度继续越来越高, 但是Cu2+去除率增长缓慢, 为了节省资源, 蒙脱石负载羧乙基壳聚糖复合吸附剂的反应液控制在40℃。
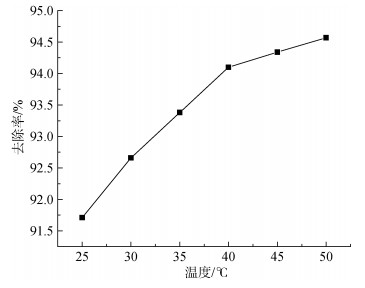 |
| 图 9 不同温度对Cu2+吸附效果的影响 Fig. 9 Effect of different temperature on the adsorption of Cu2+ |
移取多个50 mL、30 mg/L、pH=6.0的Cu2+溶液放入锥形瓶中, 向其中投加4.0 g/L配比为0.04的复合吸附剂置于40℃水浴, 在0、10、20、30、40、60、80、120 min后取上清液, 测其吸光度。
从图 10中可以看出在0~10 min范围内, 随着吸附时间的增长, 溶液中Cu2+的去除率增长速度很快, 在60 min以后, 随着吸附时间的增长, Cu2+去除率基本不再变化, 后续实验吸附时间选择60 min。原因可能在于Cu2+只能在复合吸附剂的有限空间内被吸附, 主要与吸附点位数量及Cu2+质量浓度有关[15]。在初期, 吸附剂表面具有大量的吸附点位, 而且溶液中Cu2+的质量浓度较高, 吸附剂表面具有较高的推动力, 从而对Cu2+具有较高去除率; 在60 min以后溶液中的Cu2+质量浓度变为很小而且吸附剂表面已经吸附了大量的Cu2+, 导致Cu2+吸附速率下降[16]。
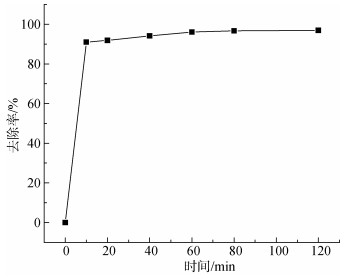 |
| 图 10 不同时间对Cu2+吸附效果的影响 Fig. 10 Effect of different time on the adsorption of Cu2+ |
移取多个50 mL、30 mg/L的Cu2+溶液放入锥形瓶中, 调节pH在3.0、4.0、5.0、6.0、7.0、8.0、9.0, 向其中投加4.0 g/L配比为0.04的复合吸附剂置于40℃水浴加热60 min后取上清液, 测其吸光度, 另设一组不添加吸附剂作为空白对照。
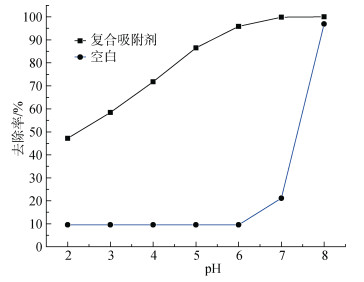 |
| 图 11 不同pH对Cu2+吸附效果的影响 Fig. 11 Effect of different pH on the adsorption of Cu2+ |
由实验结果可知, pH越来越高, 则Cu2+的去除率与之相应会越来越高, 最终接近100%。但从空白对照中可看出pH=7时, 开始生成沉淀, 当pH=8时去除率逼近100%, 说明溶液的OH–对Cu2+作用形成沉淀[17], 所以pH=6时比较适宜。
2.8 Cu2+浓度对Cu2+吸附效果的影响移取多个50 mL、pH=6.0的Cu2+溶液(控制质量浓度在1、5、15、30、50、70、90、120、150 mg/L)放入可加热玻璃容器中, 向其中投加4.0 g/L配比为0.04的复合吸附剂置于40℃水浴加热60 min后取上清液, 测其吸光度。
由图 12中看出, 整体上随着Cu2+浓度越来越大, Cu2+的去除率与其成反比例即明显的越来越低, 在Cu2+质量浓度为1 mg/L~120 mg/L范围内, 由100.00%降到50.28%;与之相反的是吸附容量与Cu2+质量浓度成正比, 由0.25 mg/g增大到15.08 mg/g。
 |
| 图 12 不同Cu2+浓度对Cu2+吸附效果的影响 Fig. 12 Effect of different Cu2+ concentration on the adsorption of Cu2+ |
在投加量一定的情况下, 当Cu2+质量浓度较低时, 吸附剂表面有足够的吸附点位和离子交换容量使绝大部分Cu2+被吸附。在Cu2+质量浓度越来越高的同时, 溶液中Cu2+会逐渐增加直至过量, 但是已经饱和的吸附剂表面的吸附点位以及有限的离子交换容量已然无法接纳过多的Cu2+[12]。越来越高的Cu2+质量浓度使得Cu2+与复合吸附剂表面碰撞的概率越来越大, 达到了使吸附容量增大的目的[18]。
根据采集黄骅和天津淡水养殖鱼塘水体养殖一段时间后水体中实验结果(表 1), 处理后的水体中Cu2+质量浓度接均近于0, 符合《渔业水质标准》[19]规定, Cu≤0.01 mg/L的要求。
| 样品 | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 原有质量浓度(mg/L) | 0.013 | 0.032 | 0.051 | 0.068 | 0.021 | 0.052 |
| 吸附后质量浓度(mg/L) | 0 | 0.0001 | 0.0003 | 0.0005 | 0.0001 | 0.0004 |
| 去除率(%) | 100 | 99.7 | 99.4 | 99.3 | 99.5 | 99.2 |
移取多个50 mL、pH=6.0的30 mg/L Cu2+溶液(NaCl质量浓度分别控制在0%、1%、2%、2.5%、3%、3.5%)放入可加热玻璃容器中, 向其中投加4.0 g/L配比为0.04的复合吸附剂置于40℃水浴加热60 min后取上清液, 测其吸光度。从图 13中可以看出, 吸附剂对Cu2+的去除率随NaCl初始质量浓度的增加而逐渐降低, Na+离子的存在与Cu2+形成竞争吸附的关系, 所以本类复合吸附剂在海水养殖中使用效果比在淡水养殖中差。
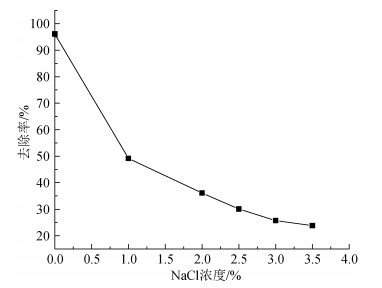 |
| 图 13 不同NaCl浓度对Cu2+吸附效果的影响 Fig. 13 Effect of different NaCl concentration on the adsorption of Cu2+ |
移取多个50 mL、pH=6.0的Cu2+溶液(控制质量浓度在15、30、50、70、90、120 mg/L)放入锥形瓶中, 在30、40、50℃下向其中投加4.0 g/L配比为0.04的复合吸附剂水浴加热60 min后, 测上清液吸光度。以平衡吸附量qe为纵坐标、平衡浓度Ce为横坐标, 得到不同温度下复合吸附剂对Cu2+的吸附等温线[12]。
目前常采用Langmiur和Freundlich两种吸附等温模型来描述固—液体系中的等温吸附行为[12]。
Langmuir方程由于它描述了吸附的基础过程而被广泛应用。表达式如下[20]:
| $ \frac{{{C_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{1}{{{q_{\max }}K}} + \frac{{{C_{\rm{e}}}}}{{{q_{\max }}}} $ | (3) |
Freundlich方程适用于大多数多层非均相吸附。表达式如下[21]:
| $ \ln {q_{\rm{e}}} = \ln {K_{\rm{f}}} + \frac{1}{{\rm{n}}}\ln {C_{\rm{e}}} $ | (4) |
Ce代表反应结束时的Cu2+质量浓度(mg/L); qe代表反应结束时的吸附容量(mg/g); qmax代表单位吸附剂能吸附Cu2+的最多量(mg/g); K、Kf和n为吸附常数。
图 14是各个温度下Cu2+吸附等温线, 当温度越来越高, 吸附容量变大, 符合吸热过程的特征。Langmuir、Freundlich方程的拟合曲线和相关数据见表 2和表 3。根据图表得出结论: Langmuir方程更适合描述蒙脱石负载羧乙基壳聚糖对Cu2+的吸附过程, 且拟合得出的最大吸附容量与实验实测的平衡容量更相接近, 其表现为单层吸附。
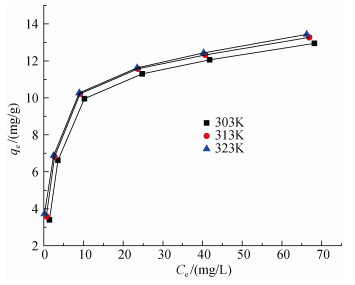 |
| 图 14 不同温度下Cu2+吸附等温线 Fig. 14 Adsorption isotherms of Cu2+ at different Temperatures |
| 温度(K) | Langmuir 吸附等温方程 |
Freundlich 吸附等温方程 |
| 303 | y=0.07357x+0.3112 | y=0.3226x+1.3366 |
| 313 | y=0.07355x+0.2130 | y=0.2707x+1.5573 |
| 323 | y=0.07345x+0.1772 | y=0.2134x+1.7574 |
| 温度(K) | qe, exp(mg/g) | Langmuir吸附等温方程 | Freundlich吸附等温方程 | |||||
| qmax(mg/g) | K(L/mg) | R2 | Kf | 1/n | R2 | |||
| 303 | 12.59 | 13.59 | 0.2364 | 0.9989 | 3.8061 | 0.3226 | 0.8669 | |
| 313 | 13.27 | 13.60 | 0.3452 | 0.9976 | 4.7460 | 0.2704 | 0.9275 | |
| 323 | 13.43 | 13.61 | 0.4146 | 0.9957 | 5.7973 | 0.2134 | 0.9831 | |
由于本实验的吸附等温线更加符合Langmiur吸附等温模型, 故热力学参数ΔG、ΔH和ΔS采用以下公式进行计算[12, 22]:
| $ \Delta G = - RT\ln {K_{\rm{d}}} $ | (5) |
| $ \Delta G = \Delta H - T\Delta S $ | (6) |
| $ \ln {K_{\rm{d}}}{\rm{ = }}\Delta S/R - \Delta H/RT $ | (7) |
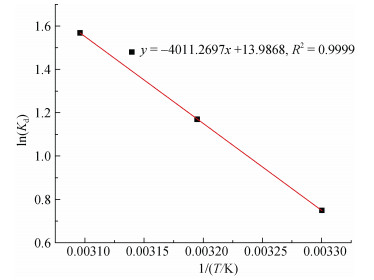
通过以ln(qe/Ce)对qe作图, 由此拟合得到直线及直线方程(图 14), 将qe延长至零, 可求得Kd, 从而根据式(5)可求得各温度下对应的ΔG值。再根据式(7), 通过以lnKd对1/T作图(图 15), 由拟合得到的直线斜率和截距即可算出对应的ΔH值和ΔS值[12], 具体的计算结果如表 3所示。
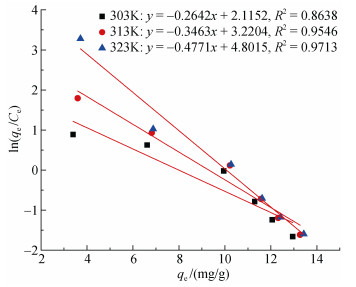 |
| 图 15 Kd求解直线图 Fig. 15 Straight line graph of Kd solution |
 |
| 图 16 ΔH与ΔS求解拟合直线图 Fig. 16 Fitting straight line graph of ΔH and ΔS solution |
复合吸附剂对Cu2+的吸附过程反应焓变ΔH = 33.35.61 kJ/mol > 0, 说明该吸附反应过程为吸热反应, ΔS = 116.29 J/(mol·K) > 0, 说明该吸附过程为熵增过程, 即吸附体系朝着混乱度增加的方向进行。吉布斯自由能ΔG = –2.12 kJ/mol ~ –4.80 kJ/mol < 0, 说明所制备的复合吸附剂对Cu2+的吸附过程是自发进行的, 且随着温度的升高, ΔG的绝对值增大, 表明吸附过程中的推动力增大, 即升高温度对吸附进行是有利的[12]。
2.11 吸附剂吸附Cu2+动力学实验移取多个50 mL、30 mg/L、pH=6.0的Cu2+溶液放入锥形瓶中, 在30、40、50℃下向其中投加4.0 g/L配比为0.04的复合吸附剂, 水浴加热0、10、20、40、60、120 min后, 测上清液吸光度。
在各温度下, 复合吸附剂对Cu2+的吸附速率在吸附初期都十分迅速, 此外, 通过对比不同温度下的吸附动力学曲线可知, 升高温度有利于吸附过程的进行。采用准一级动力学模型、准二级动力学模型来对图 17中的实验数据进行线性拟合, 结果见表 5和表 6。
| 温度(K) | ΔH(kJ/mol) | ΔS(J/mol·K) | ΔG(kJ/mol) |
| 303 | 33.35 | 116.29 | –2.12 |
| 313 | –3.22 | ||
| 323 | –4.80 |
 |
| 图 17 不同温度下Cu2+吸附动力学曲线 Fig. 17 Cu2+ adsorption kinetics curves at different temperatures |
| 温度(K) | 一级动力学方程 | 二级动力学方程 |
| 303 | y =– 0.03039x – 0.4649 | y= 0.1455x + 0.1126 |
| 313 | y= –0.02989x – 0.6485 | y= 0.1448x + 0.09351 |
| 323 | y= –0.02797x – 0.9348 | y= 0.1442x + 0.07186 |
| 温度(K) | qe, exp(mg/g) | 一级动力学方程 | 二级动力学方程 | |||||
| k1 | qep(mg/g) | R2 | k2 | qep(mg/g) | R2 | |||
| 303k | 7.86 | 0.03039 | 0.628 | 0.9564 | 0.1880 | 6.87 | 0.9998 | |
| 313K | 8.13 | 0.02928 | 0.523 | 0.9631 | 0.2242 | 6.90 | 0.9998 | |
| 323K | 8.25 | 0.02797 | 0.393 | 0.9602 | 0.2893 | 6.93 | 0.9999 | |
一级动力学表达式[23]:
| $ \ln \left( {{q_{\rm{e}}} - {q_t}} \right) = \ln {q_{\rm{e}}} - {{\rm{k}}_1}t $ | (8) |
二级动力学表达式[24]:
| $ \frac{t}{{{q_t}}} = \frac{1}{{{k_2}q_{\rm{e}}^{\rm{2}}}} + \frac{t}{{{q_{\rm{e}}}}} $ | (9) |
qt代表t时间内的总的吸附容量(mg/g); qe代表反应结束时的总的吸附容量(mg/g); k1、k2为吸附速率常数。
根据表 5和表 6看出, 准二级动力学模型能更好地拟合复合吸附剂吸附Cu2+的动力学过程, 各温度下的相关系数R2更接近1, 且拟合得到的平衡吸附量qe与实验实测得到的平衡吸附量qe, ex更接近, 由此可知, 复合吸附剂对Cu2+的吸附更加符合准二级动力学模型, 即该吸附过程为化学吸附过程[12, 25]。根据阿伦尼乌斯方程:
| $ k = A{{\rm{e}}^{ - E}}{a^{\mathit{/RT}}} $ | (10) |
变形得到:
| $ \ln k = - \frac{{{E_{\rm{a}}}}}{{RT}} + {\mathop{\rm lnA}\nolimits} $ | (11) |
采用对吸附动力学过程拟合效果最好的准二级动力学模型反应速率常数k2, 对Ea进行计算。具体计算过程为:以lnk2对1/T作图并进行拟合, 结果如图 17所示。
根据所拟合的直线斜率可求得反应活化能Ea = 16.75 kJ/mol, 一般情况下, 对于物理吸附反应, 其反应活化能一般小于4.2 kJ/mol; 对于化学吸附反应, 其反应活化能约为8.4 kJ/mol ~83.7 kJ/mol, 因此可据此来判断吸附反应的类型[26]。这说明该吸附过程属于化学吸附。
 |
| 图 18 活化能(Ea)求解拟合直线图 Fig. 18 Fitting straight line graph of activation energy (Ea) solution |
移取多个50 mL、30 mg/L、pH=6的Cu2+溶液放入锥形瓶中, 向其中投加4.0 g/L配比为0.04的复合吸附剂置于40℃水浴60 min后取上清液, 测其吸光度后, 向沉淀中分别加入0.10 mol/L的HCl或0.10 mol/L的NaOH溶液50 mL充分解吸后取沉淀, 烘干作为新的复合吸附剂重复以上步骤3次。测得复合吸附剂用HCl或NaOH洗涤后对Cu2+的吸附效果如图 19。
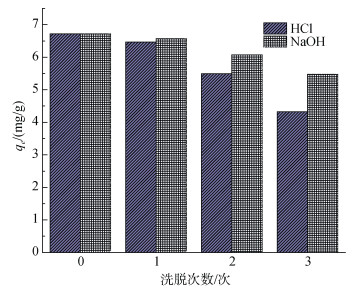 |
| 图 19 再生实验结果 Fig. 19 Results of regeneration experiment |
初次没有经过解吸的吸附容量为6.72 mg/g, 经过0.10 mol/L的HCl解吸3次后的复合吸附剂再次进行吸附实验时, 吸附容量只有4.3 mg/g, 而经过0.10 mol/L的NaOH溶液解吸3次后的复合吸附剂再次进行吸附实验时, 吸附容量为5.48 mg/g, 高于经过HCl解吸后的吸附容量, 这就说明NaOH的再生能力优于HCl。
2.13 成本计算通过计算得知, 复合吸附剂成本略高于蒙脱石而低于壳聚糖和羧乙基壳聚糖, 但吸附去除率远高于其他三类单独使用, 而且固-液分离速度快、脱水效果好。
| 吸附剂种类 | 用量 (g/L) |
效果 (吸附率(%)) |
成本(元) |
| 蒙脱石 | 3.0 | 56 | 0.30 |
| 壳聚糖 | 3.0 | 24 | 1.26 |
| 羧乙基壳聚糖 | 3.0 | 68 | 13.71 |
| 复合吸附剂(羧乙基壳聚糖:蒙脱石为0.04:1) | 3.0 | 90.81 | 1.14 |
| 注:羧乙基壳聚糖按合成原料(丙烯酸、壳聚糖、氢氧化钠)价格计算成本 | |||
蒙脱石负载羧乙基壳聚糖复合吸附剂在对淡水养殖鱼塘水体中Cu2+去除后可达到《渔业水质标准》规定, 并具有良好的再生能力; 复合吸附剂对Cu2+吸附过程为吸热反应和单层化学吸附, 主要依靠离子交换反应去除溶液的Cu2+, 成本略高于蒙脱石而低于壳聚糖和羧乙基壳聚糖, 但吸附去除率远高于其他3类单独使用, 而且固-液分离速度快、脱水效果好。
| [1] |
李振, 陈玉林. 养殖水体自身污染的控制措施[J]. 中国水产, 2004, 7: 68-69. Li Zhen, Chen Yulin. Control measures for aquaculture water pollution[J]. China Fisheries, 2004, 7: 68-69. |
| [2] |
宋力, 蒋桂芳, 蒋山泉, 等. 一种新型絮凝剂对养殖水体中铜的去除作用[J]. 山西农业科学, 2012, 40(7): 756-758. Song Li, Jiang Guifang, Jiang Shanquan, et al. Elimination effect of a new flocculant on copper in aquaculture water[J]. Journal of Shanxi Agricultural Sciences, 2012, 40(7): 756-758. DOI:10.3969/j.issn.1002-2481.2012.07.15 |
| [3] |
谢炎福, 祖恩普. 硫酸铜引起鱼类中毒原因的分析及对策[J]. 水利渔业, 2005, 25(6): 98-99. Xie Yanfu, Zu Enpu. Analysis and countermeasure of causes of fish poisoning caused by copper sulfate[J]. Water fishery, 2005, 25(6): 98-99. DOI:10.3969/j.issn.1003-1278.2005.06.044 |
| [4] |
曾德芳, 程杰. 改性蒙脱石-壳聚糖絮凝剂处理造纸废水[J]. 化工环保, 2009, 29(2): 144-146. Zeng Defang, Cheng Jie. Treatment of paper making waste water using m odified montmorillonite-chitosan flocculant[J]. Environmental Protection of Chemical Industry, 2009, 29(2): 144-146. DOI:10.3969/j.issn.1006-1878.2009.02.011 |
| [5] |
郑慧. 重金属废水的处理技术现状和发展趋势[J]. 广州化工, 2009, 36(10): 134-135. Zheng Hui. The actuality and trend of heavy metals wastewater treatment technology[J]. Guangzhou Chemical Industry, 2009, 36(10): 134-135. |
| [6] |
Nalini Sankaranamakrishnan, Ajit Kumar Sharma, Rashmi Sanghi. Novel chitosan derivative for the removal of cadmium in the presence of cyanide from electroplating waste water[J]. Journal of Hazardous Materials, 2007, 148: 353-359. DOI:10.1016/j.jhazmat.2007.02.043 |
| [7] |
赵春禄, 刘辉, 刘振儒. 壳聚糖的化学改性及吸附性能的研究[J]. 环境化学, 2005, 24(2): 209-212. Zhao Chunlu, Liu Hui, Liu Zhenru. A study on chemical modify of chitosan and its adsorbability[J]. Environmental Chemistry, 2005, 24(2): 209-212. DOI:10.3321/j.issn:0254-6108.2005.02.023 |
| [8] |
李利明.聚羟基铁-壳聚糖改性膨润土的制备及其吸附性能研究[D].南宁: 广西大学, 2012. Li Liming. Study on preparation and adsorption properties of polyhydroxyl iron-chitosan modified bentonite[D]. Nanning: Guangxi University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10593-1012496791.htm |
| [9] |
Mara L P D, Ana F V M, Cybelle M F. Adsorptive removal of Cu (Ⅱ) from aqueous solution using non-crosslinked and crosslinked chitosan-coated bentonite beads[J]. Desalination, 2011, 275(1-3): 154-159. DOI:10.1016/j.desal.2011.02.051 |
| [10] |
杨蕊.壳聚糖衍生物的制备及其在水处理中的应用[D].沈阳: 沈阳理工大学, 2013. Yang Rui. Preparation and application of chitosan derivatives in water treatment[D]. Shenyang: Shenyang Ligong University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10144-1015510267.htm |
| [11] |
赵蓉.膨润土负载壳聚糖的制备及其对染料的吸附研究[D].南京: 南京林业大学, 2013. Zhao Rong. Preparation and characterisation of bentonite compound chitosan and its adsorption behaviour of organic dyes[D]. Nanjing: Nanjing Forestry University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10298-1011401713.htm |
| [12] |
刘立山.磁性壳聚糖/膨润土复合吸附剂的制备及其吸附Cu2+的研究[D].长沙: 湖南大学, 2015. Liu Lishan. Study on synthesis of magnetic chitosan/bentonite composite adsorbent and its application for Cu2+ adsorption[D]. Changsha: Hunan University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10532-1015731418.htm |
| [13] |
郑重, 唐星华, 柯城, 等. 交联壳聚糖的合成及其对重金属离子吸附的研究进展[J]. 江西科学, 2008, 26(3): 421-425. Zheng Zhong, Tang Xinghua, Ke Cheng, et al. Cross-linked chitosan synthesis and heavy metal ion adsorption on progress[J]. Jiangxi Science, 2008, 26(3): 421-425. DOI:10.3969/j.issn.1001-3679.2008.03.020 |
| [14] |
韩红青, 朱岳. 膨润土改性及其应用研究[J]. 无机盐工业, 2011, 43(10): 5-8. Han Hongqing, Zhu Yue. Study on modification and application of bentonite[J]. Inorganic Chemicals Industry, 2011, 43(10): 5-8. DOI:10.3969/j.issn.1006-4990.2011.10.002 |
| [15] |
肖娟, 郭会明. 膨润土改性及其应用进展[J]. 当代化工, 2009, 38(6): 626-628. Xiao Juan, Guo Huiming. Modification and application of bentonite[J]. Contemporary Chemical Industry, 2009, 38(6): 626-628. DOI:10.3969/j.issn.1671-0460.2009.06.022 |
| [16] |
施周, 刘立山, 杨秀贞, 等. 磁性壳聚糖/膨润土复合吸附剂吸附Cu2+[J]. 环境工程学报, 2015, 9(12): 5677-5682. Shi Zhou, Liu Lishan, Yang Xiuzhen, et al. Adsorption of Cu2+ using magnetic chitosan/bentonite composite[J]. Chinese Journal of Environmental Engineering, 2015, 9(12): 5677-5682. DOI:10.12030/j.cjee.20151205 |
| [17] |
Slaney A J, Bhamirdmarri R. Adsorption of pentachlorophenol (PCP) by activated carbon in fixed beds application of homogeneous surface diffusion model[J]. Water Science Technology, 1998, 38(7): 227-235. DOI:10.2166/wst.1998.0296 |
| [18] |
张廷安, 豆志河. 用壳聚糖脱除废水中的铜离子[J]. 东北大学学报(自然科学版), 2006, 27(2): 203-205. Zhang Tingan, Dou Zhihe. Removal of Cu2+ in wastewater with chitosan[J]. Journal of Northeastern University (Natural Science), 2006, 27(2): 203-205. DOI:10.3321/j.issn:1005-3026.2006.02.023 |
| [19] |
GB11607-89, 渔业水质标准[S]. GB11607-89, Fishery Water Quality Standards[S]. |
| [20] |
Langmuir I. The adsorption of gases on plane surface of glass, mica and platinum[J]. Journal of the American Chemical Society, 1918, 40(9): 1361-1403. DOI:10.1021/ja02242a004 |
| [21] |
Freundlich H M F. Uber die adsorption in lusungen[J]. Journal of physical chemistry, 1906, 57: 385-470. |
| [22] |
Huang W Y, Chen J, He F, et al. Effective phosphate adsorption by Zr/Al-pillared montmorillonite:insight into equilibrium, kinetics and thermodynamics[J]. Applied Clay Science, 2014, 104: 252-260. |
| [23] |
Wu F C, Tseng R L, Juang R S. Kinetic modeling of liquid-phase adsorption of reactive dyes and metal ions on chitosan[J]. Water Research, 2001, 35(3): 613-618. DOI:10.1016/S0043-1354(00)00307-9 |
| [24] |
Ho Y S. Review of second-order models for adsorption systems[J]. Hazard. Mater, 2006, 136: 681-689. DOI:10.1016/j.jhazmat.2005.12.043 |
| [25] |
郭学益, 肖彩梅, 梁莎, 等. 改性柿子粉吸附剂对Cd2+的吸附性能[J]. 中南大学学报(自然科学版), 2012, 43(2): 412-417. Guo Xueyi, Xiao Caimei, Liang Sha, et al. Adsorption of Cd2+ by chemically modified persimmon powder[J]. Journal of Central South University (Science and Technology), 2012, 43(2): 412-417. |
| [26] |
Smith J M. Chemical engineering kinetics[M]. NewYork: Mc Graw Hill, 1981: 225-263.
|
 2020, Vol. 44
2020, Vol. 44

