文章信息
- 张雪, 王俊, 高燕, 王宏, 马武, 刘克奉, 陈卫. 2020.
- ZHANG Xue, WANG Jun, GAO Yan, WANG Hong, MA Wu, LIU Ke-feng, CHEN Wei. 2020.
- 2014年春季渤海浮游植物群落结构
- Phytoplankton community structure in the Bohai Sea in the spring of 2014
- 海洋科学, 44(6): 45-55
- Marine Sciences, 44(6): 45-55.
- http://dx.doi.org/10.11759/hykx20190729001
-
文章历史
- 收稿日期:2019-07-29
- 修回日期:2019-11-07
2. 天津市海洋牧场技术工程中心, 天津 300457;
3. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
4. 南京农业大学, 江苏 南京 210095
2. Tianjin Marine Ranching Technical Engineering Center, Tianjin 300457, China;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
4. Nanjing Agriculture University, Nanjing 210095, China
海洋浮游植物是海洋中最重要的初级生产者, 在海洋生态系统中位于食物链的最低层次, 是食物网中物质和能量的重要转化者和传递者之一。浮游植物是多种浮游动物和鱼、虾、贝及其幼体的直接和间接的生物饵料[1], 其种类组成和丰度变化对维持整个海洋生态系统乃至地球生态系统的平衡起到至关重要的作用。浮游植物的生长受多种环境因素的影响。由于其没有自主活动能力, 基本上随波逐流, 气象、物理、水文环境会在一定程度上影响其栖息密度的变化。浮游植物因其个体小, 对环境变化十分敏感, 所以环境的改变可从浮游植物的群落结构特征指标上反映出来, 可以作为生态环境的指示[2-3]。随着人类活动的日益加剧, 大量废水排放入海, 给沿海环境造成巨大压力, 海水富营养化严重[4], 一定程度上改变了海洋环境中生源要素(C、N、P)的结构组成[5], N/P值的升高和Si/N值的下降, 可能是造成浮游植物群落结构出现一些演变趋势的原因[6]。同时, 全球气候的变化(海洋酸化, 全球变暖等)对海洋浮游植物群落的变动[7-9]也产生一定的影响。
渤海是我国半封闭的内海, 地处中国大陆东部的最北端, 三面环陆。渤海由北面的辽东湾、西面的渤海湾、南面的莱州湾、中央浅海盆地和渤海海峡五部分组成。渤海与黄海以渤海海峡为分界线, 即山东半岛的蓬莱角至辽东半岛的老铁山连线。沿岸有许多河流入海, 包括海河、黄河和辽河等, 是黄渤海区经济鱼虾的产卵场、孵化、索饵育肥场。随着环渤海经济圈的迅猛发展, 渤海近岸环境问题日益突出, 通过对环渤海沿海地区陆源污染调查及定点监测站位分析发现, 渤海72%的沿海城市近岸海域为三类和超三类海水, 87%的超标海水来源于陆源污染, 如生活污水、工业废水和海水养殖废水等, 13%来自于海上污染物, 如石油等[10]。造成渤海局部海域富营养化严重, 营养盐含量及结构发生显著变化[11], 赤潮发生频率增高、规模增大、种类增多和持续时间延长, 给我国海洋生态环境、渔业生产和滨海旅游等产生严重影响[12]。
浮游植物群落结构的变动是对外界环境变化做出的响应, 本研究通过2014年度对渤海海域进行大面综合调查, 并与历史同期资料对比, 分析渤海浮游植物的种类组成、数量与空间分布, 综合评价浮游植物群落的现状及变化, 为今后渤海环境生态系统的研究和渔业资源变动提供重要基础资料和参考依据。
1 材料和方法 1.1 调查海区2014年5月17日—26日对渤海进行水文、化学和生物的大面航次综合调查, 调查站位基本涵盖整个渤海海域, 包括渤海湾、辽东湾、莱州湾、渤海中部及渤海海峡邻近海域。共设置52个采样站位(图 1)。
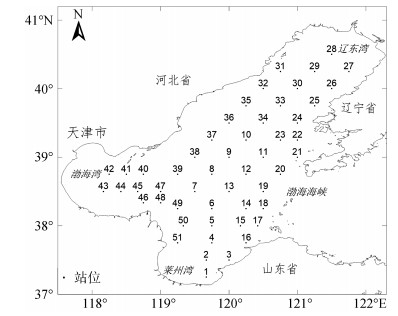 |
| 图 1 2014年春季渤海浮游植物采样站位 Fig. 1 Surveyed area and sampling stations of the Bohai Sea in the spring of 2014 |
按照国家《海洋调查规范-海洋生物调查》(GB/T12763.6-2007)[13]中的方法, 采用浅水III型浮游生物网(网口内径37 cm, 网长140 cm, 筛绢JP80, 网目孔径77 μm)自底层至表层垂直拖网采样, 垂直拖网速度为0.5 m/s, 样品用甲醛溶液固定和保存(终浓度为5%)。在实验室对样品浓缩, 至一定体积后取0.5 mL亚样品置于计数框中, 用倒置显微镜(OLYMPUS IX71)于100×、200×和400×下进行物种鉴定和计数。计数结果根据浓缩体积和垂直拖网的滤水量换算成104个/m3为单位代表网采浮游植物的细胞丰度。
1.3 数据处理与分析物种多样性采用香农威纳指数(H′)[14]表示, 物种丰富度和物种均匀度分别用Margalef指数(D)[15]和Pielou指数(J)[16]表示; 浮游植物物种优势度指数(Y)参考Dufrene等[17]的方法。其计算公式分别为:
| $H' = - \sum\limits_{i = 1}^s {{P_i}} {\log _2}{P_i}\;{\rm{, }}{P_i} = {{{n_i}} / N}, $ | (1) |
| $J = {{H'} /{{\rm{log}}{}_2}}S, $ | (2) |
| $D = (S - 1)/\ln N, $ | (3) |
| $Y = {f_i}{p_i}, $ | (4) |
式中, N为总丰度(个/m3), S为样品中的物种总数; Pi为第i种的个体数与样品中总个体数的比值, fi为第i物种数量占总个体数量的比例; ni为第i物种的丰度(个/m3)。
另外, 运用IBM SPSS Statistics 20软件对数据进行单因素方差分析, 以P < 0.05作为差异显著性判断标准。
2 结果与讨论 2.1 浮游植物物种组成2014年春季渤海海域共鉴定浮游植物3个门29属50种(表 1), 其中以硅藻为主, 为23属43种, 占总物种的86%;甲藻门5属6种, 占总物种的12%;金藻门1属1种。其中, 圆筛藻属(Coscinodiscus)的种类最多, 共12种, 优势物种为星脐圆筛藻(Coscinodiscus asteromphalus), 虹彩圆筛藻(Coscinodiscus oculus-iridis)和辐射圆筛藻(Coscinodiscus radiatus); 其次为角毛藻属(Chaetoceros), 共5种, 主要为密联角毛藻(Chaetoceros densus)和卡氏角毛藻(Chaetoceros castracanei)。根管藻属(Rhizosolenia)也占一定数量, 主要为翼根管藻印度变型(Rhizosolenia alata), 根管藻在莱州湾的数量显著高于其他海区(P < 0.05)。渤海是典型的半封闭性内海, 沿岸入海河流众多, 且地处北温带, 春季受外海水影响较小。浮游植物的生态类型多为广温广盐种和温带近岸性种, 少数为暖温性种。有研究显示, 渤海湾的圆筛藻属和角毛藻属的优势地位在下降, 但还能保持一定的优势[19], 本次调查在渤海湾海域并未发现角毛藻, 并且圆筛藻属的数量仅为总丰度的6%, 取而代之的是硅藻门的斯氏几内亚藻和具槽帕拉藻, 后续需要加强监测。莱州湾的硅藻主要由斯氏几内亚藻组成, 占该海域总丰度的66.84%, 甲藻主要由夜光藻组成, 占整个渤海夜光藻丰度的59.95%。辽东湾浮游植物细胞总丰度仅次于莱州湾, 该海区角毛藻的数量尤其多, 显著性高于其他海区(P < 0.01), 占所属海区总物种的50%左右, 以密联角毛藻为主。
| 门类 | 物种 |
| 硅藻门 Bacillariophyta |
短柄曲壳藻Achnanthes brevipes |
| 八幅辐环藻*Actinocyclus octonarius | |
| 六幅辐裥藻*Actinoptychus senarius | |
| 透明辐杆藻Bacteriastrum hyalium | |
| 卡氏角毛藻Chaetoceros castracanei | |
| 旋链角毛藻Chaetoceros curvisetus | |
| 密联角毛藻Chaetoceros densus | |
| 爱氏角毛藻Chaetoceros eibenii | |
| 角毛藻Chaetoceros sp. | |
| 豪猪棘冠藻Corethrom hystrix | |
| 蛇目圆筛藻Coscinodiscus argus | |
| 星脐圆筛藻Coscinodiscus asteromphalus | |
| 中心圆筛藻Coscinodiscus centralis | |
| 弓束圆筛藻Coscinodiscus curvatulus | |
| 巨圆筛藻Coscinodiscus gigas | |
| 格氏圆筛藻Coscinodiscus granii | |
| 琼氏圆筛藻Coscinodiscus jonesianus | |
| 虹彩圆筛藻Coscinodiscus oculus-iridis | |
| 辐射圆筛藻Coscinodiscus radiatus | |
| 圆筛藻Coscinodiscus sp. | |
| 细弱圆筛藻Coscinodiscus subtilis | |
| 威氏圆筛藻Coscinodiscus wailesii | |
| 新月柱鞘藻*Cylindrotheca closterium | |
| 布氏双尾藻Ditylum brightwellii | |
| 脆杆藻Fragilaria sp. | |
| 柔弱几内亚藻*Guinardia delicatula | |
| 斯氏几内亚藻*Guinardia striata | |
| 短纹楔形藻Licmophora abbreviata | |
| 膜状缪氏藻*Meuniera membranacea | |
| 长菱形藻Nitzschia longissima | |
| 洛氏菱形藻Nitzschia lorenziana | |
| 菱形藻Nitzschia sp. | |
| 具槽帕拉藻*Paralia sulcata | |
| 羽纹藻Pinnularia sp. | |
| 曲舟藻Pleurosigma sp. | |
| 翼鼻状藻*Proboscia alata | |
| 柔弱伪菱形藻*Pseudo-nitzschia delicatissima | |
| 尖刺伪菱形藻*Pseudo-nitzschia pungens | |
| 翼根管藻印度变型Rhizosolenia alata | |
| 刚毛根管藻Rhizosolenia setigera | |
| 优美旭氏藻矮小变型Schroederella delicatula f. schroederi | |
| 伏氏海线藻*Thalassionema frauenfeldii | |
| 离心列海链藻Thalassiosira eccentrica | |
| 甲藻门 Pyrrophyta |
梭角藻Ceratium fusus |
| 三角角藻Ceratium tripos | |
| 春膝沟藻Gonyaulax verior | |
| 夜光藻Noctiluca scintillans | |
| 海洋原多甲藻*Protoperidinium oceanicum | |
| 粗梨甲藻Pyrocystis robusta | |
| 金藻门 Chrysophyta |
小等刺硅鞭藻Dictyocha fibula |
| *种名更改请参考文献[18] | |
2014年春季渤海浮游植物总细胞丰度分布介于1.08×104~181.09×104个/m3, 平均为25.47×104个/m3。浮游植物总细胞丰度分布呈现西部少东部多的特征, 由北至南, 高值主要集中在辽东半岛西部附近海域, 渤海湾及其邻近海域和辽东湾底部海域浮游植物细胞丰度相对较低(图 2)。硅藻细胞丰度介于0.83×104~ 180.06×104个/m3, 平均为23.45×104个/m3, 占细胞总丰度的92.2%。硅藻细胞分布与总细胞丰度基本一致, 高值分布区长兴岛附近主要由硅藻门的具槽帕拉藻和密连角毛藻组成, 莱州湾的黄河口附近以硅藻门的角毛藻和斯氏几内亚藻为主, 4个物种都是该季节的主要优势种。甲藻细胞丰度介于0.02×104~ 13.36×104个/m3, 平均为2.01×104个/m3, 占细胞总丰度的1.8%。细胞分布较为均匀, 仅有零星几处站位细胞丰度较为集中, 高值区主要分布在莱州湾湾底以及辽东湾口和秦皇岛邻近海域, 硅藻与甲藻细胞丰度比值为12︰1。
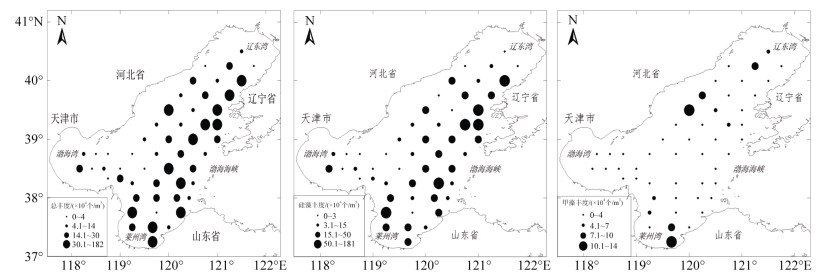 |
| 图 2 2014年春季渤海浮游植物细胞丰度平面分布 Fig. 2 Horizontal distribution of phytoplankton cell abundance in the spring of 2014 |
将渤海及其四个海区(莱州湾、辽东湾、渤海湾和渤海中部)的浮游植物进行对比分析发现, 莱州湾由于其有陆源径流量较大的河流-黄河的汇入, 营养盐比其他海域相对丰富, 浮游植物繁殖旺盛, 细胞丰度最高。渤海湾位于渤海最靠西部的湾底, 距离黄海较远, 接受外海水营养成分的交换补给较少。另外渤海湾的调查站位离近岸稍远, 陆源径流营养盐不充分也可能是导致细胞丰度最低的原因之一。本文中的水文及化学环境因子, 主要参考同时期的调查资料[20]和历史同期调查资料[21]。
2.3 浮游植物优势种组成及分布特征2014年春季渤海浮游植物优势种为密联角毛藻、斯氏几内亚藻、具槽帕拉藻和夜光藻(表 2、表 3)。
| 海区 | 平均细胞丰度/(×104个/m3) | ||||||||||
| 总数 | 硅藻 | 甲藻 | 角毛藻 | 圆筛藻 | 根管藻 | 角藻 | 密联角毛藻 | 斯氏几内亚藻 | 具槽帕拉藻 | 夜光藻 | |
| 莱州湾 | 43.04 | 37.72 | 5.30 | 2.07 | 4.25 | 1.36 | 0.14 | 2.07 | 28.77 | 0.63 | 5.15 |
| 辽东湾 | 34.43 | 31.54 | 2.90 | 14.30 | 0.50 | 0.19 | 0.06 | 11.50 | 0.04 | 13.12 | 2.79 |
| 渤海湾 | 4.98 | 4.54 | 0.44 | 0.00 | 0.34 | 0.006 | 0.09 | 0.00 | 1.87 | 2.24 | 0.34 |
| 渤海中部 | 16.64 | 16.27 | 0.42 | 0.29 | 0.48 | 0.06 | 0.03 | 0.19 | 1.28 | 12.18 | 0.31 |
| 渤海 | 25.47 | 23.45 | 2.01 | 5.88 | 0.98 | 0.28 | 0.06 | 4.76 | 4.58 | 9.65 | 1.92 |
| 物种 | 占总细胞丰度的比例/% | 出现频率/% | 优势度 |
| 密联角毛藻 | 19 | 33 | 0.064 |
| 斯氏几内亚藻 | 18 | 29 | 0.053 |
| 具槽帕拉藻 | 39 | 90 | 0.349 |
| 夜光藻 | 7.7 | 76 | 0.059 |
春季具槽帕拉藻细胞丰度介于0.14×104~ 48.99×104个/m3, 平均值为9.65×104个/m3, 细胞丰度占总细胞丰度的39%。优势度最大, 为0.35, 在该海域出现频率达90%, 分布面积较广, 基本涵盖整个海域。已有研究表明, 具槽帕拉藻2—4月份达到繁殖高峰, 主要分布在渤海中部, 5月份分布范围逐渐向近岸延伸, 数量减少[22]。渤海存在明显的环流特征[23], 潮汐、潮流和风生环流是该区域最主要的动力过程, 渤海存在3个强潮流区, 分别位于渤海海峡, 黄河口至渤海湾中部和辽东湾的中部[24]。对渤海中部潮流及余流的调查发现[25], 2014年5月大部分海域潮流属于不正规半日潮, 潮流运动形式以逆时针旋转为主, 流速一般小于75 cm/s。春季以西南风为主, 某些海域余流受风的影响较大。具槽帕拉藻属于底栖浮游植物, 本文中具槽帕拉藻高值区主要分布在辽东湾口附近及渤海海峡附近(图 3), 渤海强潮流区基本覆盖其高值分布区。因此, 其分布基本由渤海潮流及风生环流等物理因素所控制。
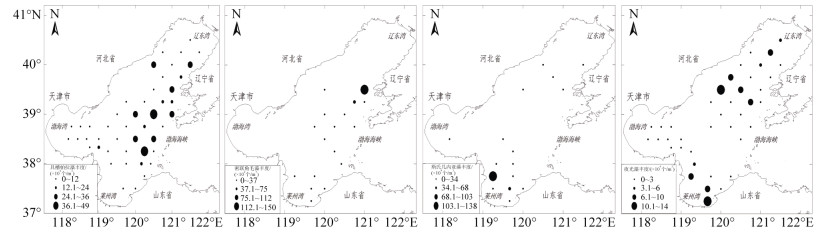 |
| 图 3 2014年春季渤海浮游植物优势种细胞丰度平面分布 Fig. 3 Cell abundance of phytoplankton dominant species in the spring of 2014 |
密联角毛藻细胞丰度介于0.07×104~149.76× 104个/m3, 平均值为4.76×104个/m3, 细胞丰度占总细胞丰度的19%。优势度为0.064, 出现频率较低为33%, 密联角毛藻仅分布于渤海的东部, 主要位于辽东半岛东南部沿线和渤海中东部至莱州湾东部海域, 高值区集中分布在长兴岛附近(图 3), 该物种属于远洋性种类, 其分布与黄海和渤海之间的海水交换具有密切关系。
斯氏几内亚藻细胞丰度介于0.02×104~137.50× 104个/m3, 平均值为4.58×104个/m3, 细胞丰度占总细胞丰度的18%。优势度为0.053, 出现频率为29%, 斯氏几内亚藻集中分布在莱州湾及其邻近海域和辽东湾中部海域, 高值区位于黄河口附近(图 3), 查阅历史资料发现, 斯氏几内亚藻仅在本次调查中成为渤海主要优势种[26], 局部海域调查中有成为优势种的记录[27], 以往大面调查未曾有优势种的记录。对北黄海的调查中, 斯氏几内亚藻往往只是成为站位优势种[28-29], 但是近几年对北黄海秋季的调查中, 发现其常成为优势种存在[30]。程玲等[31]对2012—2014年莱州湾海域的浮游植物结构调查中也发现, 2014年5月斯氏几内亚藻的优势度尤其高, 达0.75。同时, 夜光藻丰度也较高, 与本文调查结果一致。斯氏几内亚藻属于广温广盐的广布种, 其在黄河口附近51号站位达到最高值, 与该区域高含量营养盐具有一定关系。至于斯氏几内亚藻的分布特征受渤海自身的潮流和余流及黄、渤海之间海流交换的直接影响较大。
夜光藻细胞丰度介于0.03×104~13.30×104个/m3, 平均值为1.92×104个/m3, 细胞丰度占总细胞丰度的7.7%。优势度为0.059, 在该海域出现频率相对较高, 为76%, 在渤海中部较少分布, 高值区主要分布在黄河口和莱州湾底附近以及辽东湾口和秦皇岛邻近海域(图 3)。夜光藻属于异养生物, 其生长离不开饵料生物。研究表明, 外界饵料密度决定着夜光藻的生长率, 外界营养条件可以通过使饵料增加而促进夜光藻的生长[32]。夜光藻属于常见赤潮原因种, 适宜温度较广, 春季, 夏季和秋季都有在沿岸爆发的记录[33], 影响赤潮原因种暴发的因素复杂多样[34], 找出控制其暴发的机制, 不仅需要海上连续调查监测, 还要结合室内对其摄食习性、生长和繁殖机制的研究等。
2.4 浮游植物多样性分布香农-威纳多样性指数、均匀度指数和丰富度指数是表征群落稳定性的指标, 通常多样性水平越高, 群落生态系统稳定性越强[35]。结果显示, 2014年春季渤海浮游植物群落多样性水平整体偏低(图 4)。其中, 渤海丰富度指数介于0.22~1.81, 平均为0.77, 丰富度较高的海域主要为辽东湾中部海域和莱州湾湾口邻近海域, 渤海中部海域丰富度稍低; 香农-威纳多样性指数和均匀度指数的大小变化情况基本一致, 香农-威纳多样性指数介于0.11~3.32, 平均为1.26;均匀度指数介于0.04~0.9, 平均为0.39, 高值区主要分布在渤海的沿岸附近海域, 渤海中部海域的香农-威纳多样性指数和均匀度指数极显著低于其他海区(P < 0.01)(表 4), 香农-威纳多样性指数和均匀度指数分别为0.8和0.25, 极显著低于其他海区(P < 0.01), 该海区具槽帕拉藻丰度较高, 为该海区细胞总丰度的73.19%, 是导致局部海区群落稳定性较低的主要原因。
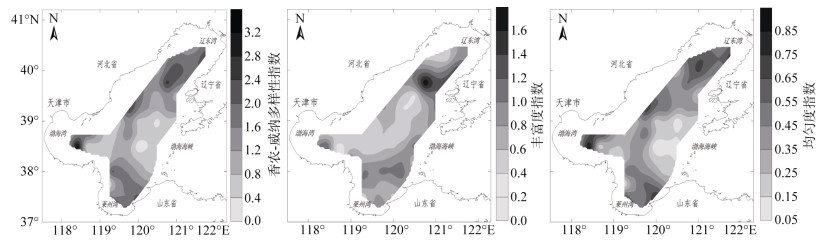 |
| 图 4 2014年春季渤海浮游植物多样性指数平面示意图 Fig. 4 Phytoplankton diversity index in the spring of 2014 |
| 海区 | 丰富度 | 香农-威纳多样性指数 | 均匀度 |
| 莱州湾 | 0.78 | 1.69 | 0.52 |
| 辽东湾 | 0.86 | 1.46 | 0.44 |
| 渤海湾 | 0.63 | 1.46 | 0.51 |
| 渤海中部 | 0.72 | 0.80 | 0.25 |
| 渤海 | 0.77 | 1.26 | 0.39 |
渤海作为我国主要渔业资源的重要产卵场和索饵场育肥场, 对其研究可以追溯到20世纪50年代, 之后陆续开展诸多调查, 本文通过与1950s、1980s、1990s、2000s和2010s不同年代, 跨越近60年的渤海大面调查的历史资料进行对比(图 5, 表 5)发现, 渤海春季浮游植物群落出现一些演替现象, 主要表现在, 角毛藻属的优势地位和细胞丰度与20世纪60年代相比, 都有大幅降低, 但是与21世纪初相比有所回升。
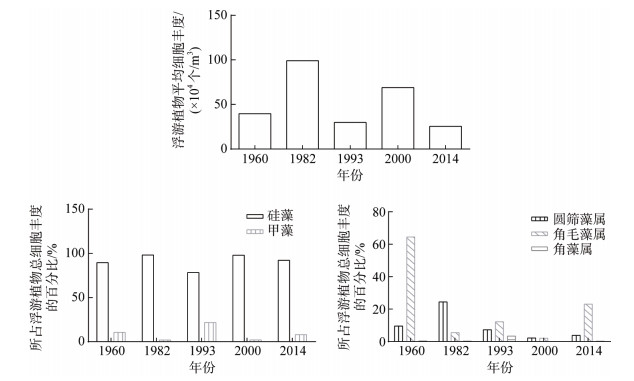 |
| 图 5 不同年份渤海浮游植物细胞丰度的长期变化 Fig. 5 Long-term changes in phytoplankton cell abundances in the Bohai Sea in different years |
| 调查时间 | 采样方法 | 调查海域 | 细胞高值区分布 | 主要优势种 | 细胞丰度(×104个/m3) | 参考文献 |
| 1959年春季 | 网采 | 渤海 | 渤海湾、莱州湾、辽东湾、黄河口和滦河口 | 劳氏角毛藻、卡氏角毛藻、密联角毛藻和中肋骨条藻 | — | [38, 26] |
| 1983年5月 | 网采 | 渤海 | 黄河口, 海河口及渤海中部部分海区 | 圆筛藻、卡氏角毛藻、密联角毛藻、尖刺伪菱形藻和具槽帕拉藻 | 大部分低于50, 密集区100~300 | [39] |
| 1984年5月 | 网采 | 渤海 | 辽东湾南部, 渤海中部及莱州湾 | 骨条藻、菱形海线藻、具槽帕拉藻、日本星杆藻、爱氏辐环藻、窄隙角毛藻和奇异菱形藻 | 405, 次高峰 | [40] |
| 1993年5月 | 网采 | 渤海 | 黄河口, 渤海中部和秦皇岛个别站位 | 圆筛藻、角毛藻、具槽帕拉藻、诺氏海链藻和夜光藻 | 28 | [22] |
| 1999年4—5月 | 网采 | 渤海中部及渤海海峡(2遍调查) | 渤海中部靠近渤海海峡 | 冰河拟星杆藻、虹彩圆筛藻、太阳双尾藻、刚毛根管藻、布氏双尾藻、圆海链藻。卡氏角毛藻、浮动弯角藻和尖刺伪菱形藻的优势度稍弱 | 0.18~391, 平均33.08; 0.17 ~1068, 平均73.57 | [41] |
| 2014年5月 | 网采 | 渤海 | 莱州湾, 上延渤海中部东侧至辽东湾南部海域 | 密联角毛藻、斯氏几内亚藻、具槽帕拉藻和夜光藻 | 1.08~181.09, 平均25.47 | 本文 |
| 注: “—”表示无具体数值。 | ||||||
从渤海浮游植物生态类型上看变化不大, 浮游植物多数属于温带近岸性种类。从浮游植物物种组成上看, 依然保持硅藻为主, 甲藻次之的格局。但是, 硅藻的属种组成却发生较大变化。20世纪60年代, 角毛藻属和圆筛藻属是硅藻门两个重要的属, 到20世纪80年代, 圆筛藻属和角毛藻属所占浮游植物细胞丰度显著降低, 尤其是角毛藻属。从浮游植物细胞丰度上看, 浮游植物总细胞丰度一直处于波动状态, 20世纪80年代和21世纪初丰度相比其他年份较高。而硅藻和甲藻的细胞丰度也处于波动状态, 并且两者细胞丰度变化呈现一种此消彼长的趋势。从优势种组成上看, 角毛藻和圆筛藻常成为主要优势种, 20世纪80年代之后, 硅藻门优势种不断变换, 角毛藻属和圆筛藻属在物种数量和细胞丰度上都有所降低, 虽然每个年代的大面调查都会有圆筛藻属和角毛藻属的优势种出现, 但是每个年代的具体物种却会发生变化, 尤其是曾是主要优势种的扁面角毛藻, 近些年数量骤减。具槽帕拉藻仍然保持较高的优势地位。20世纪90年代之后, 夜光藻的优势地位也逐渐显现, 本次调查还发现, 斯氏几内亚藻第一次在渤海大面调查中成为主要优势种。已有研究同样发现[36], 近年来渤海浮游植物群落出现明显的物种演替现象, 角毛藻的优势地位在下降, 具槽帕拉藻、夜光藻逐渐兴起。从细胞丰度及生物量上看, 渤海水域浮游植物现存量(叶绿素a)及其初级生产力20世纪90年代与20世纪80年代相比都大幅下降[37]。
渤海是一近乎封闭的内海, 仅东部海域通过渤海海峡与黄海相通, 因此山东半岛北部和辽东半岛西部海域受外海的影响较大, 渤海湾及辽东湾湾内海域受沿岸入海河流的影响大。整个渤海入海河流众多, 海水交换力弱, 营养盐较为丰富, 再加上水浅, 表底层营养盐交换好, 有利于浮游植物的繁殖生长。20世纪80年代以来, 随着渤海沿岸经济的快速发展, 大量工业污水, 海水养殖废水和城市生活污水排放入海, 围填海、港口码头等工程的建设与开发, 给沿岸的生态环境造成极大地破坏, 富营养化严重, 赤潮频发。对比近20年渤海中部环境参数变化发现, 该区域氮磷比大幅上升, 主要原因为无机氮含量的增高[42]。海水无机氮浓度增加, 氮磷比呈上升趋势, 营养盐含量的分布状况, 很大程度上决定了渤海浮游植物群落的分布状态, 导致近岸海域浮游植物生物量增加, 使营养盐向外海输入的部分减少, 外海浮游植物生物量相对较低[43]。浮游植物正常元素吸收的氮磷比为16, 研究表明, 水温和营养元素之间的比例对角毛藻细胞数量变动具有较明显的影响[44], 氮磷比的升高还会引起浮游植物演替向甲藻和非硅藻主导的群落结构[45], 高的Redfield值不利于硅藻生长。同时, 由于浮游植物自主活动能力弱, 受海流影响较大, 渤海环流的输运会对浮游植物群落中的广布种重新分配, 对近岸暴发的赤潮种进行疏散、分流, 对海洋生态平衡起到一定的积极效应。另外, 随着全球变暖, 海水温度也有一定程度地升高, 温度的升高有利于适温高的种类形成优势, 如甲藻、夜光藻等[40]。
2.6 浮游植物群落结构的变化对渔业资源结构的潜在影响浮游植物是海洋食物链最基础的生物饵料, 其种群结构的变化, 会通过影响高生态位生物的食物组成, 改变渔业资源种群的结构。研究表明, 多数鱼类摄食的食物种类会随着生长发育的不同阶段有很大的变化, 仔稚鱼及幼鱼期其摄食习性一般属于狭食性, 此时饵料生物组成的多样性程度和稳定性越高, 其对饵料环境的适应性越强, 存活率越高[46]。浮游动物是多数鱼、虾、贝等的主要饵料生物, 对渤海重要渔业资源结构演变分析发现[47], 渤海次级生产力(浮游动物和底栖生物)结构的变化是导致渤海主要渔业资源结构变化的重要因素之一。而浮游动物中的大部分种类营浮游植物食性, 以摄食硅藻类为主[48], 主要是圆筛藻和底栖硅藻。对虾、滤食性贝类等幼体的开口饵料也多为浮游植物硅藻, 梭鱼和斑鰶等腐屑食性鱼类摄食的硅藻主要为圆筛藻, 其次是底栖硅藻[49]。浮游植物作为初级生产者, 处于食物链的最底端, 其群落结构的变化势必会对食物链的上层消费者的摄食结构、饵料补给和海洋渔业资源变动产生影响, 需要做好预测和防范, 浮游植物群落结构的变化对于海洋生态系统动力学的研究也具有重要参考价值。
3 结论1) 2014年春季渤海共鉴定浮游植物3个门28属50种, 以硅藻为主, 还有少数甲藻和金藻。其中, 硅藻门中圆筛藻属的种类最多, 共12种, 其次为角毛藻属, 共5种。
2) 浮游植物优势种为密联角毛藻、斯氏几内亚藻、具槽帕拉藻和夜光藻。与历史同期资料对比, 优势种发生明显演替, 角毛藻属的降低, 取而代之的是硅藻门的其他物种和夜光藻, 具槽帕拉藻的优势地位未改变。
3) 2014年春季渤海浮游植物群落多样性水平较低, 且分布不均, 渤海中部群落稳定性较差, 莱州湾稍好。
致谢: 感谢中国水产科学院黄海水产研究所资源室参与采样的出海人员, 感谢“黄海星”科研调查船的全体船员以及原天津渤海水产研究所出海人员的支持与辛苦付出, 谨致谢忱!
| [1] |
康元德. 黄海浮游植物的生态特点及其与渔业的关系[J]. 海洋水产究, 1986, 7(1): 102-107. Kang Yuande. The Ecological characteristics of phytoplankton and the relationship between phytoplankton and fisheries in the Yellow Sea[J]. Marine Fisheries Research, 1986, 7(1): 102-107. |
| [2] |
Shubert L E. Algae as Ecological Indicators[M]. London: Academic Press, 1984: 434.
|
| [3] |
Villegas I, Giner J D. Phytoplankton as a biological indicator of water quality[J]. Water Research, 1973, 7(3): 479-487. DOI:10.1016/0043-1354(73)90028-6 |
| [4] |
邹景忠, 董丽萍, 秦保平. 渤海湾富营养化和赤潮问题的初步探讨[J]. 海洋环境科学, 1983, 2(2): 41-54. Zou Jingzhong, Dong Liping, Qin Baoping. Preliminary discussion on eutrophication and red tide in Bohai Bay[J]. Marine Environmental Science, 1983, 2(2): 41-54. |
| [5] |
崔毅, 宋云利. 渤海海域营养现状研究[J]. 海洋水产研究, 1996, 17(1): 57-62. Cui Yi, Song Yunli. Study on evaluation of nutrition status in the Bohai sea[J]. Marine Fisheries Research, 1996, 17(1): 57-62. |
| [6] |
郭术津, 孙军, 张辉, 等. 2011年秋季北黄海浮游植物群落[J]. 天津科技大学学报, 2013, 28(1): 22-29. Guo Shujin, Sun Jun, Zhang Hui, et al. Phytoplankton community in the North Yellow Sea in autumn of 2011[J]. Journal of Tianjin University of Science & Technology, 2013, 28(1): 22-29. DOI:10.3969/j.issn.1672-6510.2013.01.008 |
| [7] |
王宪, 李文权. 闽南-台湾浅滩近岸上升流区浮游植物碳同化速率的研究[J]. 生态学报, 1992, 12(3): 219-224. Wang Xian, Li Wenquan. Study on the carbon assimilation rate of phytoplankton in the upwelling region in Minnan-Taiwan bank of fishing ground[J]. Acta Ecological Sinica, 1992, 12(3): 219-224. |
| [8] |
矫晓阳, 朱明远, 吴宝铃. 一些海洋浮游植物量子产值的研究[J]. 生态学报, 1993, 13(1): 17-24. Jiao Xiaoyang, Zhu Mingyuan, Wu Baoling. Studies on the quantum yield of somemarine phytoplankton[J]. Acta Ecological Sinica, 1993, 13(1): 17-24. DOI:10.3321/j.issn:1000-0933.1993.01.011 |
| [9] |
孙军, 刘冬艳, 柴心玉, 等. 1998~1999年春秋季渤海中部及其邻近海域叶绿素a浓度及初级生产力估算[J]. 生态学报, 2003, 23(3): 517-526. Sun Jun, Liu Dongyan, Chai Xinyu, et al. The chlorophyll a concentration and estimating of primary productivity in the Bohai Sea in 1998~1999[J]. Acta Ecological Sinica, 2003, 23(3): 517-526. DOI:10.3321/j.issn:1000-0933.2003.03.016 |
| [10] |
赵章元, 孔令辉. 渤海海域环境现状及保护对策[J]. 环境科学研究, 2000, 13(2): 23-27. Zhao Zhangyuan, Kong Linghui. Environmental status quo and protection countermeasures in Bohai marine areas[J]. Research of Environmental Sciences, 2000, 13(2): 23-27. DOI:10.3321/j.issn:1001-6929.2000.02.008 |
| [11] |
蒋红, 崔毅, 陈碧鹃, 等. 渤海近20年来营养盐变化趋势研究[J]. 海洋水产研究, 2005, 26(6): 61-67. Jiang Hong, Cui Yi, Chen Bijuan, et al. The variation trend of nutrient salts in the Bohai Sea[J]. Marine Fisheries Research, 2005, 26(6): 61-67. |
| [12] |
林凤翱, 卢兴旺, 洛昊, 等. 渤海赤潮的历史、现状及其特点[J]. 海洋环境科学, 2008, 27(S2): 1-5. Lin Fengao, Lu Xingwang, Luo Hao, et al. History, status and characteristics of red tide in Bohai Sea[J]. Marine Environmental Science, 2008, 27(S2): 1-5. |
| [13] |
GB/T 12763.6-2007.海洋调查规范第6部分: 海洋生物调查[S]. GB/T 12763.6-2007. Specification for oceanographic survey-Part 6: Marine biological survey[S]. |
| [14] |
Shannon C E, Weaver W. The Mathematical Theory of Communication[M]. Urbana: University of Illinois Press, 1949: 117.
|
| [15] |
Marfalef R. Information theory in ecology[J]. General Systems, 1958, 3: 36-71. |
| [16] |
Pielou E C. An Introduction to Mathematical Ecology[M]. New York: Wiley-Interscience, 1969: 286.
|
| [17] |
Dufrene M, Legendre P. Species assemblages and indicator species:The need for a flexible asymmetrical approach[J]. Ecological Monographs, 1997, 67(3): 345-366. |
| [18] |
孙军, 刘东艳. 中国海区常见浮游植物种名更改初步意见[J]. 海洋与湖沼, 2002, 33(3): 271-286. Sun Jun, Liu Dongyan. The preliminary notion on nomenclature of common phytoplankton in China Seas waters[J]. Oceanologia et Limnologia Sinica, 2002, 33(3): 271-286. DOI:10.3321/j.issn:0029-814X.2002.03.008 |
| [19] |
张秋丰, 尹翠玲, 徐玉山, 等. 2006年夏季渤海湾赤潮重点监控区的网采浮游植物群落[J]. 天津科技大学学报, 2007, 22(3): 19-23. Zhang Qiufeng, Yin Cuiling, Xu Yushan, et al. The phytoplankton community sampled by nets in the dominant area monitoring red tide in Bohai Bay in summer, 2006[J]. Journal of Tianjin University of Science & Technology, 2007, 22(3): 19-23. DOI:10.3969/j.issn.1672-6510.2007.03.006 |
| [20] |
曲克明. 渤海生态环境监测图集[M]. 北京: 科学出版社, 2016. Qu Keming. Atlas of Eco-Environment in the Bohai Sea[M]. Beijing: Science Press, 2016. |
| [21] |
唐启升, 孟田湘. 渤海生态环境和生物资源分布图集[M]. 青岛: 青岛出版社, 1997. Tang Qisheng, Meng Tianxiang. Atlas of Eco-Environment and Biological Resources Distribution in the Bohai Sea[M]. Qingdao: Qingdao Press, 1997. |
| [22] |
王俊, 康元德. 渤海浮游植物种群动态的研究[J]. 海洋水产研究, 1998, 19(1): 43-52. Wang Jun, Kang Yuande. Study on the population dynamics of phytoplankton in the Bohai Sea[J]. Marine Fisheries Research, 1998, 19(1): 43-52. |
| [23] |
苏纪兰. 中国近海的环流动力机制研究[J]. 海洋学报, 2001, 23(3): 1-16. Su Jilan. A review of circulation dynamics of the coastal oceans near China[J]. Acta Oceanologica Sinica, 2001, 23(3): 1-16. |
| [24] |
黄大吉, 陈宗镛, 苏纪兰. 三维陆架海模式在渤海中的应用Ⅰ.潮流、风生环流及其相互作用[J]. 海洋学报, 1996, 8(5): 1-13. Huang Daji, Chen Zongyong, Su Jilan. Application of three-dimensional shelf sea model in Bohai Sea I. Trends, wind-induced circulation and their interactions[J]. Acta Oceanologica Sinica, 1996, 8(5): 1-13. |
| [25] |
徐珊珊, 杨锦坤, 武双全, 等. 渤海中部海域表层潮流和余流特征分析[J]. 海洋通报, 2017, 36(2): 128-134. Xu Shanshan, Yang Jinkun, Wu Shuangquan, et al. Characteristics of surface tidal and residual currents of the central Bohai Sea[J]. Marine Science Bulletin, 2017, 36(2): 128-134. |
| [26] |
栾青杉, 康元德, 王俊. 渤海浮游植物群落的长期变化(1959~2015)[J]. 渔业科学进展, 2018, 39(4): 9-18. Luan Qingshan, Kang Yuande, Wang Jun. Long-term changes of phytoplankton community in the Bohai Sea (1959~2015)[J]. Progress in Fishery Sciences, 2018, 39(4): 9-18. |
| [27] |
杨世民, 董树刚, 李锋, 等. 渤海湾海域生态环境的研究Ⅰ.浮游植物种类组成和数量变化[J]. 海洋环境科学, 2007, 26(5): 442-445. Yang Shimin, Dong Shugang, Li Feng, et al. Study on ecological environment in Bohai Bay I. Species composition and abundance of phytoplankton[J]. Marine Environmental Science, 2007, 26(5): 442-445. DOI:10.3969/j.issn.1007-6336.2007.05.010 |
| [28] |
董婧, 李培军, 刘悦, 等. 黄海北部近岸浮游植物生态特征分析[J]. 水产科学, 1999, 18(5): 12-15. Dong Jing, Li Peijun, Liu Yue, et al. Ecological characteristics of phytoplankton community in Shore of the Northern Yellow Sea[J]. Fisheries Science, 1999, 18(5): 12-15. |
| [29] |
刘述锡, 樊景凤, 王真良. 北黄海浮游植物群落季节变化[J]. 生态环境学报, 2013, 22(7): 1173-1181. Liu Shuxi, Fan Jingfeng, Wang Zhenliang. Seasonal changes of phytoplankton community in the North Yellow Sea, China[J]. Ecology and Environmental Sciences, 2013, 22(7): 1173-1181. DOI:10.3969/j.issn.1674-5906.2013.07.014 |
| [30] |
纪昱彤, 王宁, 陈洪举, 等. 2013年秋季渤黄海浮游植物的群落特征[J]. 中国海洋大学学报(自然科学版), 2018, 48(S2): 31-41. Ji Yutong, Wang Ning, Chen Hongju, et al. Phytoplankton Community structure in the Bohai and Huanghai in Autumn 2013[J]. Periodical of Ocean University of China(Natural Science Edition), 2018, 48(S2): 31-41. |
| [31] |
周成旭, 吴玉霖, 邹景忠. 夜光藻的营养动力学[J]. 海洋与湖沼, 1994, 25(2): 152-157. Zhou Chengxu, Wu Yulin, Zou Jingzhong. Nutrint dynamics of noctiluca scintillans (macartney)[J]. Oceanologia et Limnologia Sinica, 1994, 25(2): 152-157. DOI:10.3321/j.issn:0029-814X.1994.02.006 |
| [32] |
程玲, 王月霞, 马元庆, 等. 蓬莱19-3溢油后莱州湾浮游植物群落结构[J]. 渔业科学进展, 2016, 37(4): 67-73. Chen Ling, Wang Yuexia, Ma Yuanqing, et al. The structure of the phytoplankton community in the Laizhou Bay after the oil spills in Penglai 19-3 oilfield[J]. Progress in Fishery Sciences, 2016, 37(4): 67-73. |
| [33] |
张洪亮, 张爱君, 窦月明, 等.渤海海区赤潮发生特点的研究[C]//中国环境科学学会.中国环境保护优秀论文集.北京: 中国环境科学出版社, 2005: 1107-1111. Zhang Hongliang, Zhang Aijun, Dou Yueming, et al. Study on the characteristics of red tide occurrence in the Bohai Sea area[C]//Chinese Society for Environmental Sciences. Chinese Environmental Protection Excellent Proceedings. Beijing: China Environmental Science Press, 2005: 1107-1111. |
| [34] |
周名江, 朱明远, 张经. 中国赤潮的发生趋势和研究进展[J]. 生命科学, 2001, 13(2): 54-59, 53. Zhou Mingjiang, Zhu Mingyuan, Zhang Jing. Status of harmful algal blooms and related research activities in China[J]. Chinese Bulletin of Life Science, 2001, 13(2): 54-59, 53. DOI:10.3969/j.issn.1004-0374.2001.02.002 |
| [35] |
孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用[J]. 海洋学报, 2004, 26(1): 62-75. Sun Jun, Liu Dongyan. Application of diversity indices in marine phytoplankton studies[J]. Acta Oceanologica Sinica, 2004, 26(1): 62-75. DOI:10.3321/j.issn:0253-4193.2004.01.007 |
| [36] |
郭术津, 李彦翘, 张翠霞, 等. 渤海浮游植物群落结构及其与环境因子的相关性分析[J]. 海洋通报, 2014, 33(1): 95-105. Guo Shujin, Li Yanqiao, Zhang Cuixia, et al. Phytoplankton community in the Bohai Sea and its relationship with environmental factors[J]. Marine Science Bulletin, 2014, 33(1): 95-105. |
| [37] |
吕瑞华, 夏滨, 李宝华, 等. 渤海水域初级生产力10年间的变化[J]. 黄渤海海洋, 1999, 17(3): 80-86. Lü Ruihua, Xia Bin, Li Baohua, et al. The fluctuations of primary productivity in Bohai Sea waters over ten years[J]. Journal of Oceanography of Huanghai & Bohai Seas, 1999, 17(3): 80-86. |
| [38] |
朱树屏, 郭玉洁. 十年来我国海洋浮游植物的研究[J]. 海洋与湖沼, 1959, 2(4): 223-232. Zhu Shuping, Guo Yujie. A decade of marine phytoplankton research in China[J]. Oceanologia et Limnologia Sinica, 1959, 2(4): 223-232. |
| [39] |
康元德. 渤海浮游植物的数量分布和季节变化[J]. 海洋水产研究, 1991, 12: 31-54. Kang Yuande. Distribution and seasonal variation of phytoplankton in the Bohai Sea[J]. Marine Fisheries Research, 1991, 12: 31-54. |
| [40] |
俞建銮, 李瑞香. 渤海、黄海浮游植物生态的研究[J]. 黄渤海海洋, 1993, 11(3): 52-59. Yu Jianluan, Li Ruixiang. The study on the phytoplankton ecology in the Bohai Sea and Yellow Sea[J]. Journal of Oceanography of Huanghai & Bohai Seas, 1993, 11(3): 52-59. |
| [41] |
孙军, 刘东艳, 徐俊, 等. 1999年春季渤海中部及其邻近海域的网采浮游植物群落[J]. 生态学报, 2004, 24(9): 2003-2016. Sun Jun, Liu Dongyan, Xu Jun, et al. The netz-Phytoplankton community of the central Bohai Sea and its adjacent waters in spring, 1999[J]. Acta Ecologica Sinica, 2004, 24(9): 2003-2016. DOI:10.3321/j.issn:1000-0933.2004.09.024 |
| [42] |
于志刚, 米铁柱, 谢宝东, 等. 二十年来渤海生态环境参数的演化和相互关系[J]. 海洋环境科学, 2000, 19(1): 15-19. Yu Zhigang, Mi Tiezhu, Xie Baodong, et al. Changes of the environmental parameters and their relationship in recent twenty years in the Bohai Sea[J]. Marine Environmental Sciences, 2000, 19(1): 15-19. DOI:10.3969/j.issn.1007-6336.2000.01.004 |
| [43] |
魏皓, 赵亮, 于志刚, 等. 渤海浮游植物生物量时空变化初析[J]. 青岛海洋大学学报(自然科学版), 2003, 33(2): 173-179. Wei Hao, Zhao Liang, Yu Zhigang, et al. Variation of the Phytoplankton Biomass in the Bohai Sea[J]. Journal of Ocean University of Qingdao(Natural Science Edition), 2003, 33(2): 173-179. DOI:10.3969/j.issn.1672-5174.2003.02.002 |
| [44] |
王朝晖, 齐雨藻, 陈菊芳, 等. 大亚湾角毛藻细胞数量波动及其与环境因子关系的多元分析[J]. 生态学报, 2006, 26(4): 1096-1102. Wang Zhaohui, Qi Yuzao, Chen Jufang, et al. Population dynamics of Chaetoceros spp. and multivariate analysis of its relationship with environmental factors in Daya Bay South China Sea[J]. Acta Ecologica Sinica, 2006, 26(4): 1096-1102. DOI:10.3321/j.issn:1000-0933.2006.04.016 |
| [45] |
Egge J K. Are diatoms poor competitors at low phosphate concentrations?[J]. Journal of Marine System, 1998, 16: 191-198. DOI:10.1016/S0924-7963(97)00113-9 |
| [46] |
张波. 东、黄海带鱼的摄食习性及随发育的变化[J]. 海洋水产研究, 2004, 25(2): 6-12. Zhang Bo. Feeding habits and ontogenetic diet shift of hairtail fish (Trichiurus lepturus) in East China Sea and Yellow Sea[J]. Marine Fisheries Research, 2004, 25(2): 6-12. |
| [47] |
许思思, 宋金明, 李学刚, 等. 渤海渔获物资源结构的变化特征及其影响因素分析[J]. 自然资源学报, 2014, 29(3): 500-506. Xu Sisi, Song Jinming, Li Xuegang, et al. Variation characteristics of catch structure in the Bohai Sea and its influencing factors[J]. Journal of Natural Resources, 2014, 29(3): 500-506. |
| [48] |
杨纪明. 渤海桡足类(Copepoda)的食性和营养级研究[J]. 现代渔业信息, 2001, 16(6): 6-10. Yang Jiming. A study on food and trophic levels of Bohai Sea Copepoda[J]. Modern Fisheries information, 2001, 16(6): 6-10. DOI:10.3969/j.issn.1004-8340.2001.06.002 |
| [49] |
杨纪明. 渤海鱼类的食性和营养级研究[J]. 现代渔业信息, 2001, 16(10): 10-19. Yang Jiming. A study on food and trophic levels of Bohai Sea fish[J]. Modern Fisheries Information, 2001, 16(10): 10-19. DOI:10.3969/j.issn.1004-8340.2001.10.002 |
 2020, Vol. 44
2020, Vol. 44


