文章信息
- 王瑞旋, 李炳, 林华剑, 陈琦, 陈秀程, 牟红莉, 王江勇. 2020.
- WANG Rui-xuan, LI Bing, LIN Hua-jian, CHEN Qi, CHEN Xiu-cheng, MOU Hong-li, WANG Jiang-yong. 2020.
- 牡蛎体内及其养殖水体中细菌耐药性研究
- Study on antibiotic resistance of bacteria in oysters and their farming water
- 海洋科学, 44(6): 56-63
- Marine Sciences, 44(6): 56-63.
- http://dx.doi.org/10.11759/hykx20191210001
-
文章历史
- 收稿日期:2019-12-10
- 修回日期:2020-02-29
2. 中国水产科学研究院 南海水产研究所, 广东 广州 510300;
3. 广东省水生动物疫病预防控制中心, 广东 广州 511400;
4. 华南师范大学, 广东 广州 510631;
5. 天津农学院, 天津 300384
2. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China;
3. Guangdong Provincal Aquatic Animal Epidemic Disease Prevention and Control Center, Guangzhou 511400, China;
4. South China Normal University, Guangzhou 510631, China;
5. Tianjin Agricultural University, Tianjin 300384, China
牡蛎, 俗称海蛎子、蚝等, 是我国著名的四大养殖经济贝类之一。牡蛎属滤食性动物, 通过不断过滤海水来获取其中的微生物作为食物。在滤食过程中, 随着时间的变化可积聚环境水体中的细菌, 其中包括致病菌[1]。香港牡蛎(Crassostrea hongkongensis)是我国南方重要海水养殖贝类, 主要分布于浙江、江苏、福建、广东和广西等沿海低潮区[2-3]。正常养殖情况下, 其产量高、经济效益良好。然而, 自1992年以来频发的大规模死亡事件严重影响了牡蛎养殖业的发展, 造成了巨大的经济损失[4]。细菌性疾病在贝类养殖病害事件中常扮演重要角色, 尤其在高温季节, 牡蛎大批量异常死亡现象时有发生, 其中以条件致病性著称的弧菌(Vibrio)出现频率最高。在海洋环境中, 弧菌几乎无处不在, 包括海水、底泥等, 甚至健康牡蛎的体内都可能存在弧菌。在养殖过程中, 当牡蛎抵抗力低下且环境中致病性弧菌达到一定阈值时, 即可能导致疾病的发生, 从而引起大量死亡。尤其是刚固着的稚贝更易受到感染, 病原菌往往借助水流及牡蛎自身的滤食性, 在贝体内积累, 当条件适合时, 即可能侵袭贝体韧带、外套膜和鳃, 最后全身感染而死[5]。至今, 与细菌性疾病直接相关的防治手段仍以抗生素为主, 抗生素已被广泛应用于控制人类、畜禽和水生动物的细菌性疾病。由于水环境的复杂性和流动性, 抗生素在水产养殖中的应用很可能对环境产生更为严重的不良影响。甚至在盲目使用抗生素后, 取得的效果常常与养殖户的预期相悖。在抗生素的选择压力下, 耐药菌保留下来并大量繁殖[6-7]。已有报道对杂色鲍Haliotis diversicolor体内及其养殖水体中异养细菌耐药性进行研究, 发现大多数菌株对四环素、青霉素G、卡那霉素、丁胺卡那霉素等产生了抗药性[8]。叶茂华等[9]对贝类中弧菌耐药性研究发现, 受试的28株菌中有25株对氨苄西林耐药, 1株对四环素耐药; 邓欢等[10]对从太平洋牡蛎发病幼体中分离的三种弧菌进行耐药性鉴定, 显示3株菌均对氯霉素、红霉素敏感, 对呋喃唑酮、青霉素耐药; 张占会等[11]对4株香港牡蛎致病菌进行药敏测定, 结果显示菌株均对青霉素类药品具有抗性。而笔者在以往对鲍体内弧菌的耐药性研究中发现, 弧菌对多种药物的耐药率与环境因子显著相关并呈现一定的季节规律性[12]。目前国内关于贝类养殖水体及贝体内细菌的耐药性研究极少, 而牡蛎作为重要的滤食性贝类, 与养殖环境关系密切, 且牡蛎属于河口养殖种类, 更接近人类居住环境及陆地养殖系统, 因此, 对牡蛎养殖环境及其体内细菌的耐药性进行了解和分析具有重要的意义。
本研究对采自阳江的香港牡蛎养殖水体和牡蛎体内的637株异养细菌进行了药物敏感性测试, 并对健康牡蛎和发病牡蛎体内细菌的耐药率进行了比较, 深入了解牡蛎体内外环境异养菌的耐药状况, 以期为贝类细菌性疾病预警防控及河口环境评价提供参考依据。
1 材料与方法 1.1 样品来源2018年1月—12月份定期至阳江的牡蛎主养区(东经: 111°73′, 北纬: 21°79′), 随机分离获得637个菌株, 其中牡蛎养殖水体细菌287株(2216E培养基, 划线法), 健康牡蛎和病牡蛎体内细菌共350株(营养琼脂培养基, 划线法)。健康牡蛎和病牡蛎体内菌株来源如下:在疾病暴发阶段, 从正常养殖区(未发现异常死亡现象)和疫区(出现大量异常死亡现象)进行采样。优选正常养殖区采集健康牡蛎, 从邻近海域疫区采集病牡蛎。初步判别方法:敲击牡蛎贝壳, 健康牡蛎会迅速闭上贝壳; 反之, 如反应迟钝、闭壳肌无力则为活力差的病牡蛎, 且在进一步的解剖过程中可见病牡蛎贝体较消瘦, 闭壳肌无力, 部分出现颜色异常情况。
具体采样情况如表 1所示。
| 月份 | 健康牡蛎体内 | 病牡蛎体内 | 水体 |
| 1 | 19 | 21 | 33 |
| 2(未采样) | — | — | — |
| 3 | 24 | — | 25 |
| 4 | 30 | 19 | 30 |
| 5 | 26 | — | 18 |
| 6 | 23 | — | 16 |
| 7 | 30 | 28 | 25 |
| 8 | 26 | — | 29 |
| 9 | 23 | — | 29 |
| 10 | 29 | — | 30 |
| 11 | 29 | — | 29 |
| 12 | 23 | — | 23 |
| 总计 | 282 | 68 | 287 |
受试药物种类包括:恩诺沙星、卡那霉素、庆大霉素、复合磺胺(甲氧苄啶/磺胺甲
| 抗生素 | 纸片上抗生素含量 | 大肠杆菌ATCC25922 /mm | 金黄色葡萄球菌ATCC25923 /mm |
| 环丙沙星 | 5 μg | 30~40 | 22~30 |
| 恩诺沙星 | 10 μg | 28~36 | 22~28 |
| 庆大霉素 | 10 μg | 19~26 | 19~27 |
| 卡那霉素 | 30 μg | 17~25 | 19~26 |
复合磺胺(甲氧苄啶/磺胺甲 唑) 唑) |
1.25 μg /23.75 μg | 23~29 | 24~32 |
| 呋喃唑酮 | 300 μg | — | — |
| 利福平 | 5 μg | 8~10 | 26~34 |
| 青霉素 | 10 U | — | 26~37 |
| 四环素 | 30 μg | 18~25 | 24~30 |
| 氯霉素 | 30 μg | 21~27 | 19~26 |
营养琼脂培养基、2216E培养基、Mueller-Hinton琼脂(MHA)培养基, 均购自广东环凯微生物科技公司。
1.4 方法 1.4.1 受试菌株的浓度确定及初步鉴定菌株浓度确定:为确定药敏试验时菌液稀释倍数, 选取生长状况良好且具有一定代表性的菌株(编号贝11和贝12), 以无菌生理盐水洗脱于斜面培养基上培养了24 h(28℃)的菌苔, 分别稀释至10–6、10–7, 通过平板涂布法对受试菌株进行了浓度分析[3]。
菌株初步鉴定:煮沸法提取细菌基因组DNA, 作为模板, 将纯培养菌液煮沸(或100℃水浴)10 min后立即冷却, 12 000 r/min离心10 min, 取上清为模板, 通过PCR技术扩增并分析保守区16S rDNA序列, 对所有受试菌株进行初步鉴定(到属水平), 涉及16S rDNA通用引物序列及反应体系、反应条件如下[3]:
引物: 8 f: 5′AGAGTTTGATCCTGGCTCAG 3′, 1492r: 5′GGTTACCTTGTTACGACTT 3′; 反应体系(50 μL):水: 36.5 μL, dNTPs: 4 μL, 10×缓冲液5 μL, Taq酶0.5 μL, 引物8f 1 μL, 引物1492r 1 μL, 模板DNA 2 μL.
反应条件: 95℃5 min, 95℃1 min, 48℃1 min, 72℃2 min 30个循环, 72℃10 min, 4℃保存。
1.4.2 药敏试验采用Kirby-Bauer纸片扩散法(简称K-B法), 针对10种常见抗生素进行了药物敏感性实验, 参照NCCLS抗生素敏感试验标准及相关研究文献进行操作[7, 14-17]。
1.4.3 抑菌圈的测量使用游标卡尺测量抑菌圈的直径, 抑菌环直径判断标准如表 3所示, 根据表 3将药敏测试结果分别判定为R(耐药)、I(中度敏感)、S(敏感), 分别统计各月份牡蛎养殖水体细菌、健康牡蛎体内细菌和病牡蛎体内细菌对各种抗生素的耐药率、敏感率和多重耐药率(耐受3种或3种以上药物)的菌株百分比。
| 抗生素 | 抑菌环直径判断标准/mm | ||||
| S | I | R | |||
| 喹诺酮类 | 环丙沙星 | ≥21 | 16~20 | ≤15 | |
| 恩诺沙星 | ≥21 | 11~20 | ≤10 | ||
| 氨基糖苷类 | 庆大霉素 | ≥15 | 13~14 | ≤12 | |
| 卡那霉素 | ≥18 | 14~17 | ≤13 | ||
| 磺胺类 | 复合磺胺 | ≥16 | 11~15 | ≤10 | |
| 硝基呋喃类 | 呋喃唑酮 | ≥17 | 15~16 | ≤14 | |
| 利福霉素类 | 利福平 | ≥20 | 17~19 | ≤16 | |
| 青霉素类 | 青霉素G | ≥21 | 11~20 | ≤10 | |
| 四环素类 | 四环素 | ≥19 | 15~18 | ≤14 | |
| 氯霉素类 | 氯霉素 | ≥18 | 13~17 | ≤12 | |
| 注: S:敏感, I:中度敏感, R:耐药 | |||||
根据稀释浓度要求, 用于菌悬液的浓度约为108 CFU/mL, 平板涂布结果显示受试的两个菌株浓度约为1.30×108 CFU/mL和2.80×109 CFU/mL, 表明数量级在108~109 CFU/mL, 符合药敏测试要求[14]。
同时, 经引物扩增后对PCR产物进行序列分析, 结果显示80%受试异养菌为弧菌科Vibrionaceae, 主要为弧菌属Vibrio, 其次为希瓦氏菌Shewanella, 其余菌属如黄单胞菌Xanthomonas、芽孢杆菌Bacillus、假单胞菌Pseudomonas等菌群为随机出现, 每月所占比例低于5%。
2.2 健康牡蛎体内及其养殖水体细菌对不同抗生素的药敏测试结果健康牡蛎体内及养殖水体异养菌对10种抗生素药敏测试结果如表 4所示, 健康牡蛎体内细菌对恩诺沙星的敏感率高达83.7%, 对庆大霉素敏感率为83.0%, 依次对复合磺胺、四环素、环丙沙星、氯霉素敏感率在70%以上, 而对卡那霉素、利福平、青霉素G、呋喃唑酮敏感率在60%以下。牡蛎养殖水体菌敏感率最高的药物是氯霉素(达92.3%), 对恩诺沙星敏感率是86.1%, 对环丙沙星、复合磺胺、庆大霉素的敏感率分别为83.6%、79.8%、71.4%, 对四环素、青霉素G、卡那霉素、利福平、呋喃唑酮敏感率在70.0%以下。总体看, 牡蛎体内菌及水体菌对恩诺沙星耐药率最低, 分别为1.4%和0.7%。
| 抗生素 | 体内菌 | 水体菌 | |||||||||
| S | I | R | S | I | R | ||||||
| 喹诺酮类 | 环丙沙星 | 75.2 | 16.7 | 8.2 | 83.6 | 12.2 | 4.2 | ||||
| 恩诺沙星 | 83.7 | 14.9 | 1.4 | 86.1 | 13.2 | 0.7 | |||||
| 氨基糖苷类 | 庆大霉素 | 83.0 | 9.6 | 7.4 | 71.4 | 10.8 | 17.8 | ||||
| 卡那霉素 | 59.6 | 25.9 | 14.5 | 46.7 | 20.6 | 32.8 | |||||
| 磺胺类 | 复合磺胺 | 78.0 | 6.0 | 16.0 | 79.8 | 6.6 | 13.6 | ||||
| 硝基呋喃类 | 呋喃唑酮 | 13.8 | 14.9 | 71.3 | 23.0 | 10.5 | 66.6 | ||||
| 利福霉素类 | 利福平 | 42.6 | 23.8 | 33.7 | 46.7 | 25.4 | 27.9 | ||||
| 青霉素类 | 青霉素G | 41.8 | 28.4 | 29.8 | 47.7 | 22.3 | 30.0 | ||||
| 四环素类 | 四环素 | 75.2 | 10.3 | 14.5 | 65.9 | 20.9 | 13.2 | ||||
| 氯霉素类 | 氯霉素 | 74.8 | 19.5 | 5.7 | 92.3 | 6.3 | 1.4 | ||||
| 注: S:敏感, I:中度敏感, R:耐药 | |||||||||||
病牡蛎对10种抗生素的药敏测试结果见表 5, 受试菌株对庆大霉素最敏感(敏感率最高达92.6%), 其次对复合磺胺和恩诺沙星敏感率分别为88.2%、85.3%, 而对四环素、卡那霉素、青霉素G、利福平等药物的敏感率低于75.0%;病牡蛎体内细菌对利福平、青霉素G耐药率则较高, 均高于40.0%。
| 抗生素 | 体内异养菌 | ||||
| S | I | R | |||
| 喹诺酮类 | 环丙沙星 | 75.0 | 19.1 | 5.9 | |
| 恩诺沙星 | 85.3 | 14.7 | 0.0 | ||
| 氨基糖苷类 | 庆大霉素 | 92.6 | 4.5 | 2.9 | |
| 卡那霉素 | 66.2 | 27.9 | 5.9 | ||
| 磺胺类 | 复合磺胺 | 88.2 | 5.9 | 5.9 | |
| 硝基呋喃类 | 呋喃唑酮 | 5.9 | 17.6 | 76.5 | |
| 利福霉素类 | 利福平 | 26.5 | 20.6 | 52.9 | |
| 青霉素类 | 青霉素G | 42.6 | 10.3 | 47.1 | |
| 四环素类 | 四环素 | 75.0 | 23.5 | 1.5 | |
| 氯霉素类 | 氯霉素 | 72.1 | 26.5 | 1.5 | |
| 注: S:敏感, I:中度敏感, R:耐药 | |||||
从对10种抗生素的耐药率总体来看, 4月、6—10月、12月健康牡蛎体内细菌耐药比例较高(图 1)。其中, 部分异养菌在10月份对恩诺沙星耐药率为13.8%, 其余月份受试菌株对恩诺沙星耐药率几乎为0;而对利福平、呋喃唑酮和青霉素G耐药率明显较高, 其中异养菌对青霉素G最高耐药率为73.3%;卡那霉素、复合磺胺、四环素的耐药率在不同月份变化大。
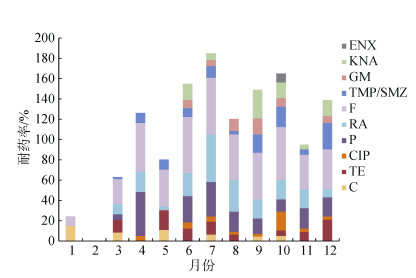 |
| 图 1 健康牡蛎体内异养菌对10种抗生素的耐药率 Fig. 1 Monthly antibiotic resistance rates of heterotrophic bacteria from healthy oysters to 10 antibiotics 注: CIP:环丙沙星; ENX:恩诺沙星; GM:庆大霉素; KNA:卡那霉素; TMP/SMZ:复合磺胺; F:呋喃唑酮; RA:利福平; P:青霉素; TE:四环素; C:氯霉素. |
本次监测研究中, 于出现异常死亡现象的时期(分别是1月、4月和7月)采集到病牡蛎(图 2), 受试牡蛎体内异养菌对恩诺沙星耐药性为0, 对四环素、氯霉素、庆大霉素、环丙沙星耐药率较低。值得注意的是, 此3个月份的病贝体内细菌对呋喃唑酮的耐药率均较高(> 50%), 对利福平和青霉素G的耐药率次之。本结果提示氯霉素、环丙沙星、呋喃唑酮虽已列为禁用药物, 但动物体内仍存在耐药菌, 其原因有待进一步研究确定。此外, 结果表明细菌耐药率于7月份达到峰值。图 2与图 1相比较显示, 健康牡蛎和病牡蛎体内细菌耐药总体趋势相似, 耐药情况呈现逐渐加重趋势。
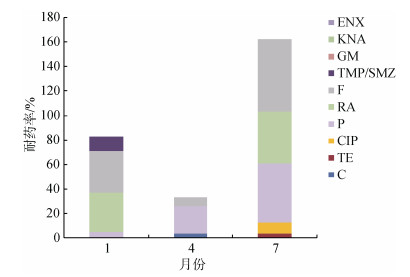 |
| 图 2 病牡蛎的体内异养菌对10种抗生素的耐药率 Fig. 2 Monthly antibiotic resistance rates of heterotrophic bacteria from diseased oysters to 10 antibiotics |
对于牡蛎养殖水体细菌(图 3), 其对恩诺沙星的耐药率几乎为零; 而对呋喃唑酮、利福平、耐药率总体上较高; 对庆大霉素、复合磺胺、环丙沙星、四环素的耐药率变化较大, 不同月份之间差异较明显。对比体内外异养菌耐药程度差异来看, 牡蛎养殖水体异养菌总体耐药状况比体内细菌的严重, 4月份达到最高峰, 而体内菌耐药高峰出现在7月份。
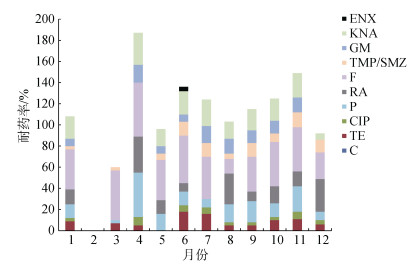 |
| 图 3 牡蛎养殖水体异养菌对10种抗生素的耐药率 Fig. 3 Monthly antibiotic resistance rates of heterotrophic bacteria from farming water to 10 antibiotics |
统计各月及全年阳江牡蛎体内及其养殖水体细菌多重耐药菌株比率(表 6)。总体显示, 无论是健康牡蛎体内细菌、发病牡蛎体内细菌还是养殖水体细菌, 三者的多重耐药情况均较严重, 都在30%以上。其中发病牡蛎体内细菌多重耐药比率最高, 为38.2%。发病牡蛎体内细菌从1月、4月、7月多重耐药菌株比例迅速上升, 7月达到64.7%;健康牡蛎体内细菌多重耐药菌株比例也在7月份最高(66.7%); 牡蛎养殖水体细菌多重耐药菌株比例基本都在20%以上, 其中4月份比率最高, 达到76.7%。总体来看, 健康牡蛎、发病牡蛎体内细菌以及养殖水体细菌的多重耐药状况均不容忽视。综上所述, 受试菌株对10种抗生素中恩诺沙星的耐药率最低, 庆大霉素耐药率相对较低, 而对呋喃唑酮耐药率最高, 其次为利福平、青霉素、卡那霉素。而本次受试菌株显示较严重的多重耐药状况, 尤其牡蛎体内细菌, 且多重耐药率于7月份达到了最高峰。
| 月份 | 健康牡蛎体内菌 | 病牡蛎体内菌 | 水体菌 |
| 1 | 0.0 | 14.3 | 30.3 |
| 2(未采样) | — | — | — |
| 3 | 12.5 | — | 4.0 |
| 4 | 33.3 | 26.3 | 76.7 |
| 5 | 11.5 | — | 27.8 |
| 6 | 47.8 | — | 43.8 |
| 7 | 66.7 | 64.3 | 40.0 |
| 8 | 34.6 | — | 24.1 |
| 9 | 47.8 | — | 31.0 |
| 10 | 41.4 | — | 33.3 |
| 11 | 20.7 | — | 51.7 |
| 12 | 26.1 | — | 21.7 |
| 总计 | 32.3 | 38.2 | 35.5 |
随着养殖业的迅速发展, 大量的抗生素和代谢物可能被释放到环境中, 这一现象被认为是病原菌进化和选择性耐药最重要的因素[15]。而细菌耐药性可通过遗传因子水平传播, 这种传播可使菌群获得耐药性, 从而导致环境中细菌耐药状况越加严重[18]。本研究对牡蛎养殖水体及其体内细菌耐药性进行了分析, 受试菌株对10种常见抗生素的药敏测试结果显示, 牡蛎养殖水体中异养菌对氯霉素耐药率最低, 其次是喹诺酮类如恩诺沙星、环丙沙星, 其中, 氯霉素和环丙沙星作为禁用药至今已有一段时间, 提示相关耐药菌群正在逐渐消失, 可见禁用氯霉素和环丙沙星对于环境菌群的耐药性消除起到一定的积极作用, 而水体菌株对呋喃唑酮的耐药率则明显高于其他9种抗生素, 其原因待进一步查明。本次结果表明, 发病牡蛎及健康牡蛎体内异养菌对庆大霉素和恩诺沙星的耐药率均较低, 而受试的水体菌株及牡蛎体内菌株对青霉素和利福平的耐药率在不同月份均变化较大。值得关注的是, 在时间动态上看, 牡蛎体内细菌耐药高峰期出现于7月份, 而养殖水体菌的耐药高峰期出现于4月份, 与以往的调查研究结果[17]一致, 4月份水体菌多重耐药率也高于牡蛎体内菌, 且养殖水体菌总体比肠道菌耐药率高, 同时养殖水体菌耐药率与牡蛎体内细菌耐药率相比, 峰值时间提前了3个月。该现象提示, 环境水体中微生物通过牡蛎的滤食性与牡蛎体内微生物群不断交换, 部分菌群如弧菌等逐渐在牡蛎体内积累, 这个积累过程需要一定的时间(大约为3个月), 从而使得牡蛎体内菌群耐药率峰值出现于7月份。因此, 从耐药菌株比例角度来看, 养殖环境水体中菌群直接影响牡蛎体内菌群, 可见养殖环境质量的重要性。Starliper等[19]研究则表明了家畜养殖场或城市污水很可能是养殖水体或鱼体内耐药菌株的重要来源, 牡蛎养殖区多数临近人类居住地, 而对牡蛎养殖区水体及贝体内微生物的监测有助于了解人类活动对沿海区域环境生物的影响。
3.2 牡蛎体内及其养殖水体中细菌多重耐药状况本研究发现健康牡蛎体内、发病牡蛎体内及养殖水体中的异养菌多重耐药菌株比率均约占总量的34%。健康牡蛎体内异养菌多重耐药峰值出现于7月份, 达60.0%以上, 病牡蛎体内异养菌多重耐药率与健康牡蛎体内异养菌接近; 而养殖水体异养菌多重耐药率峰值出现在4月份, 最高达76.7%。可见牡蛎养殖区菌群的多重耐药状况严重, 已不容忽视。由于双壳贝类的特殊生活方式, 使其与环境的关系更为密切, 抗生素的不科学使用以及携带残留抗生素的养殖污水、城市污水的不合理排放对养殖区包括养殖贝类都会产生重大影响。其中施用抗生素是引起水生细菌产生抗性的主要原因[20-21], 由于抗生素在动物饲养过程中被长期低剂量使用, 会诱导部分水生细菌对相应药物产生耐药性甚至进一步产生多重耐药性, 而耐药菌一旦出现, 很可能在特定条件下通过耐药基因或耐药质粒传播耐药性[22-24], 甚至包括部分人鱼共患病原菌, 将可能极大威胁人类健康[25]。因此, 在养殖过程不得不使用抗生素时, 应避免以下错误行为: (1)长期反复使用同一种药物。不同菌种甚至同类菌群的不同株系对相同药物的敏感性存在差异, 如长期使用同种药物, 在药物选择压力下, 耐药菌群会逐渐成为优势种群, 最后也将导致药物完全失效[26]。(2)用药浓度偏低。在药源不足时, 养殖者错误地认为用比不用好, 因此在预防时期经常低剂量使用, 或者与其他药物混合使用导致可能出现拮抗作用降低药效, 而低剂量药物极易在短时间内诱导菌群对相应药物产生耐药性甚至多重耐药性。(3)药物施用不均匀。大部分水生细菌具有回避特性, 如施用不均匀可使细菌产生耐药性的可能性增大[27]。
4 结论本次研究结果表明, 来源于牡蛎养殖环境水体及其体内的异养菌多重耐药比例较高, 值得引起注意。受试菌株对不同药物的抗性存在较大差异, 其中牡蛎养殖水体菌及正常体内异养菌对恩诺沙星的耐药率最低, 其次为庆大霉素; 病牡蛎体内细菌对庆大霉素的耐药率最低, 其次为复合磺胺和恩诺沙星。总体看来, 异养细菌对呋喃唑酮的耐药率明显高于对其他受测抗生素的耐药率, 而不同月份来源的菌株对青霉素和利福平的耐药率波动较大; 从时间动态上看, 水体菌耐药率峰值出现于4月份, 而牡蛎体内菌群耐药率峰值出现于7月份。
| [1] |
Yu Q Q, Niu M Y, Yu M Q, et al. Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from retail shellfifish in Shanghai[J]. Food Control, 2016, 60: 263-268. DOI:10.1016/j.foodcont.2015.08.005 |
| [2] |
孙兆跃, 王桃妮, 范瑞良, 等. 香港牡蛎人工繁育研究[J]. 渔业信息与战略, 2019, 34(2): 121-127. Sun Zhaoyue, Wang Taoni, Fan Ruiliang, et al. Artificial breeding of Suminoe oyster Crassostrea ariakensis[J]. Fishery Information and Strategy, 2019, 34(2): 121-127. |
| [3] |
Wang R X, He J, Wang J Y. Heterotrophic bacterial abundance and diversity in the farming environment and guts of the oyster Crassostrea hongkongensis[J]. Journal of Shellfish Research, 2016, 35(2): 343-350. DOI:10.2983/035.035.0208 |
| [4] |
张占会, 张其中, 李春勇, 等. 养殖香港牡蛎致病弧菌的分离与鉴定[J]. 热带海洋学报, 2008, 27(6): 49-56. Zhang Zhanhui, Zhang Zhongqi, Li Chunyong, et al. Isolation and identification of pathogenic vibrios of oyster Crassostrea ariakensis[J]. Journal of Tropical Oceanography, 2008, 27(6): 49-56. DOI:10.3969/j.issn.1009-5470.2008.06.009 |
| [5] |
孟庆显, 余开康. 鱼虾贝蟹疾病诊断和防治[M]. 北京: 中国农业出版社, 1996: 284-286. Meng Qingxian, Yu Kaikang. Diagnosis and treatment of Fish, Shrimp, Shellfish and Crab Diseases[M]. Beijing: China Agriculture Press, 1996: 284-286. |
| [6] |
Wang H H, Schaffner D W. Antibiotic resistance:How much do we know and where do we go from here[J]. Commentary, 2011, 77(20): 7093-7095. |
| [7] |
王瑞旋, 徐力文, 王江勇, 等. 军曹鱼养殖水体及其体内异养细菌的耐药性研究[J]. 海洋环境科学, 2008, 27(6): 588-591. Wang Ruixuan, Xu Liwen, Wang Jiangyong, et al. Antibiotic resistance of heterotrophic bacteria of digestion guts isolated from cobia (Rachycentron canadum Linnaeus) farming waters[J]. Marine Environmental Science, 2008, 27(6): 588-591. DOI:10.3969/j.issn.1007-6336.2008.06.007 |
| [8] |
祝玲, 蔡创华, 周毅频, 等. 九孔鲍体内及其养殖水体中异养细菌抗药性研究[J]. 海洋环境科学, 2005, 24(3): 17-20. Zhu Ling, Cai Chuanghua, Zhou Yipin, et al. Antibiotic resistance of heterotrophic bacteria isolated from abalone (Haliotis diversicolor) farming waters and their digestion guts[J]. Marine Environmental Science, 2005, 24(3): 17-20. DOI:10.3969/j.issn.1007-6336.2005.03.005 |
| [9] |
叶茂华, 柳付明, 陈秀英, 等. 丽水市贝类产品中副溶血性弧菌的血清分型及耐药性研究[J]. 中国病原生物学杂志, 2008, 3(9): 656-658. Ye Maohua, Liu Fuming, Chen Xiuying, et al. Serotype and antibiotic resistance of Vibrio parahaemolyticus from Lishui shellfish products[J]. Chinese Journal of Pathogen Biology, 2008, 3(9): 656-658. |
| [10] |
邓欢, 隋锡林, 王志松. 对太平洋牡蛎弧菌病的初步研究[J]. 水产科学, 1992, 11(10): 1-4. Deng Huan, Sui Xilin, Wang Zhisong. Preliminary study on Pacific oyster vibrio disease[J]. Fisheries Science, 1992, 11(10): 1-4. |
| [11] |
张占会.香港牡蛎致病微生物的筛查与鉴定[D].广州: 暨南大学, 2006. Zhang Zhanhui. Screening and identification pathogenic microorganisms of the oyster Crassostrea ariakensis[D]. Guangzhou: Jinan University, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10559-2007045091.htm |
| [12] |
Wang R X, Wang J Y, Sun Y C, et al. Antibiotic resistance monitoring in Vibrio spp. isolated from rearing environment and intestines of abalone Haliotis diversicolor[J]. Marine Pollution Bulletin, 2015, 101: 701-706. DOI:10.1016/j.marpolbul.2015.10.027 |
| [13] |
张卓然, 夏梦岩, 倪语星. 微生物耐药的基础与临床[M]. 北京: 人民卫生出版社, 2007: 202-215. Zhang Zhuoran, Xia Mengyan, Ni Yuxing. The basis and clinic of microbial antibiotic resistance[M]. Beijing: People's Medical Publishing House, 2007: 202-215. |
| [14] |
National Committee for Clinical Laboratory Standards (NCCLS). Methods for Antimicrobial Dilution and Disk Susceptibility Testing of infrequently isolated or fastidious bacteria: approved guideline, second edition (M45-A2)[S]. Wayne, Pa, USA, 2010.
|
| [15] |
胡继红, 高振翔, 尹铭芳. 美国NCCLS 2002年版抗生素药敏试验操作标准更新内容[J]. 中华检验医学杂志, 2002, 25(6): 367-369. Hu Jihong, Gao Zhengxiang, Yin Minfang. American NCCLS 2002 edition antibiotic antibiotic sensitivity test operation standard update content[J]. Chinese Journal of Laboratory Medicine, 2002, 25(6): 367-369. DOI:10.3760/j:issn:1009-9158.2002.06.022 |
| [16] |
谭瑶, 赵清, 舒为群, 等. K-B纸片扩散法药敏试验[J]. 检验医学与临床, 2010, 7(20): 2292-2293. Tan Yao, Zhao Qing, Shu Weiqun, et al. Antibiotic sensitivity test by k-b disk diffusion method[J]. Laboratory Medicine and Clinical, 2010, 7(20): 2292-2293. DOI:10.3969/j.issn.1672-9455.2010.20.071 |
| [17] |
Wang R X, Wang A L, Wang J Y. Antibiotic resistance monitoring in heterotrophic bacteria from anthropogenic-polluted seawater and the intestines of oyster Crassostrea hongkongensis[J]. Ecotoxicology and Environmental Safety, 2014, 109: 27-31. DOI:10.1016/j.ecoenv.2014.07.028 |
| [18] |
Chen H Y, Chen R H, Jing L J, et al. A metagenomic analysis framework for characterization of antibiotic resistomes in river environment:Application to an urban river in Beijing[J]. Environmental Pollution, 2019, 245: 398-407. DOI:10.1016/j.envpol.2018.11.024 |
| [19] |
Starliper C E, Cooper R K, Shotts E B. Plasmid-mediated romet resistance of Edwardsiella ictaluri[J]. Journal of Aquatic Animal Health, 1993, 5: 1-8. DOI:10.1577/1548-8667(1993)005<0001:PMRROE>2.3.CO;2 |
| [20] |
Danner M C, Robertson A, Beheends V, et al. Antibiotic pollution in surface fresh waters:Occurrence and effects[J]. Science of the Total Environment, 2019, 664: 793-804. DOI:10.1016/j.scitotenv.2019.01.406 |
| [21] |
World Health Organization. Antimicrobial Resistance. 2014. http://www.searo.who.int/thailand/factsheets/fs0023/en/
|
| [22] |
Allen H K, Donato J, Wang H H, et al. Call of the wild:antibiotic resistance genes in natural environments[J]. Nature Reviews Microbiology, 2010, 8: 251-259. DOI:10.1038/nrmicro2312 |
| [23] |
Cabello F C. Heavy use of prophylactic antibiotics in aquaculture:a growing problem for human and animal health and for the environment[J]. Environmental Microbiology, 2006, 8(7): 1137-1144. DOI:10.1111/j.1462-2920.2006.01054.x |
| [24] |
王瑞旋, 耿玉静, 冯娟, 等. 杂色鲍哈维弧菌耐药质粒的鉴定和分析[J]. 南方水产科学, 2012, 8(2): 1-6. Wang Ruixuan, Geng Yujing, Feng Juan, et al. Identification and analysis of resistant plasmid of pathogenic bacteria Vibrio harveyi isolated from Haliotis diversicolor[J]. South China Fisheries Science, 2012, 8(2): 1-6. DOI:10.3969/j.issn.2095-0780.2012.02.001 |
| [25] |
王瑞旋, 耿玉静, 王江勇, 等. 水产致病菌耐药基因的研究[J]. 海洋环境科学, 2012, 31(3): 323-328. Wang Ruixuan, Geng Yujing, Wang Jiangyong, et al. Antibiotic resistant genes in aquacultural bacteria[J]. Marine Environmental Science, 2012, 31(3): 323-328. DOI:10.3969/j.issn.1007-6336.2012.03.004 |
| [26] |
Lu J, Jin M, Nguyen S H, et al. Non-antibiotic antimicrobial triclosan induces multiple antibiotic resistance through genetic mutation[J]. Environment International, 2018, 118: 257-265. DOI:10.1016/j.envint.2018.06.004 |
| [27] |
张曰亮, 牛立国, 王淑华. 谈水产养殖病原体形成耐药性的原因、后果及对策[J]. 黑龙江水产, 2007(4): 47-48. Zhang Yueliang, Niu Liguo, Wang Shuhua. The causes, consequences and countermeasures of the formation of antibiotic resistance to pathogens in aquaculture[J]. Fisheries of Heilongjiang, 2007(4): 47-48. |
 2020, Vol. 44
2020, Vol. 44


