文章信息
- 史宝, 柳学周, 曹亚男, 刘永山, 徐永江, 姜燕, 王滨. 2020.
- SHI Bao, LIU Xue-zhou, CAO Ya-nan, LIU Yong-shan, XU Yong-jiang, JIANG Yan, WANG Bin. 2020.
- 盐度胁迫对黄条鰤消化生理和抗应激指标的影响
- Effects of salinity stress on the digestive physiology and anti-stress index of Yellowtail Kingfish (Seriola aureovittata)
- 海洋科学, 44(6): 64-72
- Marine Sciences, 44(6): 64-72.
- http://dx.doi.org/10.11759/hykx20191219001
-
文章历史
- 收稿日期:2019-12-19
- 修回日期:2020-02-25
2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 烟台市海洋经济研究院, 山东 烟台 264000
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Yantai marine economic research institute, Yantai 264000, China
鱼类通过自身内部调节系统响应外界环境对其生理功能的影响, 其中包括环境因子对鱼类生长相关性状的调控。盐度是一个重要的环境因子, 并且与鱼类生长、发育、繁殖等生理活动密切相关[1-2]。盐度通过影响鱼类的渗透压, 间接影响了鱼类生长存活与摄食转化、物质交换与能量流动等相关生理活动[3]。消化酶是由消化系统分泌的具有消化作用的酶类, 其活性可以在一定程度上反映鱼类的消化吸收能力[4]。许多无机离子是消化酶的激活剂或抑制剂, 水生生物生活环境中的盐度变化直接影响其中无机离子的浓度的变化, 进而影响消化酶活性[5]。黄鳍鲷(Sparus latus)幼鱼的蛋白酶、淀粉酶和脂肪酶活性在盐度20~30时显著高于盐度5~15[6]。同一盐度下饲养的点篮子鱼(Siganus guttatus)各消化器官的脂肪酶酶活性高低顺序依次为:肠道、胃、肝脏和幽门盲囊; 在盐度5和10条件下的点篮子鱼蛋白酶、淀粉酶和脂肪酶活性均显著低于盐度20和盐度30~32组[7]。盐度也是影响鱼类免疫防御活动的主要环境因子, 外界环境盐度的突然升高或降低都会使鱼体产生大量的超氧阴离子自由基(O2–), 对鱼体组织细胞等造成氧化损伤。超氧化物歧化酶(SOD)是鱼体内抗氧防御系统的关键酶, 可通过清除由盐度变化使鱼体产生的过多O2–来保护鱼体[8-9]。另外, 鱼体内大部分生理反应都会有激素的参与。甲状腺激素(T4)是一种内分泌激素, 对鱼类适应盐度起到积极的调节作用, 并能促进鱼体生长, 是一种重要调节激素[10]。
黄条鰤(Seriola aureovittata)属鲈形目(Perciformes)、鲹科(Carangidae)、鰤属(Seriola), 广泛分布于太平洋和大西洋沿岸, 是一种全球性分布的海洋中上层暖温性远洋洄游鱼类, 并在日本、中国、新西兰和澳大利亚等地进行了商业养殖[11-12]。黄条鰤生长速度快、个体大, 肉质鲜美, 含有丰富的EPA、DHA和钙、磷、铁等微量元素, 具有很高的经济价值和食用价值, 深受广大消费者喜爱, 世界范围内消费需求不断增加, 是我国发展深海鱼类养殖的优良品种[13-16]。国内外关于黄条鰤盐度适应性机理研究鲜有报道[17-19], 本研究以黄条鰤幼鱼为实验材料进行盐度突变实验, 通过研究消化酶及SOD活力、T4浓度等指标的变化规律, 初步探讨了黄条鰤对盐度突变的适应性, 从而为深入认识黄条鰤对环境的应激和适应机制提供基础资料, 并为养殖生产提供理论参考。
1 材料与方法 1.1 实验材料实验在大连富谷水产有限公司进行, 实验用鱼为2013年在黄海北部捕获的黄条鰤幼鱼, 经网箱养殖和室内工厂化越冬, 促熟培育、成功产卵后人工培育的批量苗种, 体长为(20.02±2.07) cm, 体重为(115.50±6.67) g。苗种养殖期间自然海水的水温为20~27 ℃、盐度29, 每天投喂鲜杂鱼3~4次, 投喂量为鱼体重的3%~5%。实验开始前所有暂养的实验用鱼停食24 h后再放入各盐度组, 实验期间不投饵。采用自来水(经24 h以上连续曝气)并添加自然海水进行低盐度调节; 高盐度组的海水使用自然海水加海水晶进行人工配置。
1.2 实验方法 1.2.1 实验设计参照本课题组黄条鰤盐度突变的实验方法[17], 设计当前实验。各实验组的盐度调节:低盐度组采用自然海水(盐度29)加自来水调节, 使用的自来水用1 000 L塑料桶作为自来水曝气池, 连续充气、曝气24 h以上使用; 高盐度实验组的海水使用自然海水加海水晶进行人工配置后使用。实验容器为1 000 L实验桶, 每个盐度组放入30条黄条鰤幼鱼, 用纳米充气石持续充气保证溶氧充足。设置实验组盐度为35(S35)、15(S15)、10(S10)和5(S5), 对照组为自然养殖海水盐度29(S29), 实验开始时, 将黄条鰤幼鱼直接放入各盐度组, 持续观察鱼的适应情况, 并按以下时间取各组鱼的组织样品, 取样时间点为6 h、12 h、24 h、48 h、72 h、96 h、120 h。每次随机从不同盐度组中捞取3条鱼取样。每天晚上18: 00换等盐度海水一次, 每次换水量为50%。实验期间各实验组的水质指标控制在水温23~24℃、pH 7.9~8.1、DO 6~7 mg/L、NH4+-N 0.1~0.3 mg/L。升、降盐度采取逐渐换水的方式, 盐度计算公式如下:当水温高于17.5 ℃, S(‰)= 1 305(α – 1) + (t – 17.5) × 0.3式中, S代表盐度; α代表比重; t代表温度。
1.2.2 样品采集与保存每次在取样时间点随机从不同盐度的实验桶中捞取3条鱼取样, 用MS222麻醉剂将黄条鰤幼鱼麻醉, 用无菌1 mL注射器快速从尾部取血, 置于1.5 mL无菌离心管中, 在冰水混合物中静置30 min后, 4℃、5 000 r/min离心10 min, 取上清即为血清。分离出的血清用来检测SOD和T4。用液氮保存胃、肠、肝脏和幽门盲囊, 用于消化酶活力的测定, 所测消化酶包括脂肪酶、淀粉酶、蛋白酶。
1.2.3 样品生化指标测定生化指标的测定参照本课题组黄条鰤盐度渐变研究中的测定方法[18]。
采用脂肪酶测试盒(A054, 南京建成生物工程研究所)测定了黄条鰤幼鱼胃、肠、肝脏和幽门盲囊的脂肪酶活性, 活力单位定义为:在37℃条件下, 每毫升酶液在反应体系中与底物反应1 min, 每消耗1 mmol底物为1个酶活力单位, 即脂肪酶活力单位为(U/gprot)。
采用蛋白酶测试盒(A080, 南京建成生物工程研究所)测定了黄条鰤幼鱼胃、肠、肝脏和幽门盲囊的蛋白酶活性, 其活力单位定义:每毫升组织液37℃每分钟分解生成1 g氨基酸相当于1个酶活力单位, 即蛋白酶活力单位为(U/mL)。
采用碘-淀粉比色法(C016, 南京建成生物工程研究所)测定了黄条鰤幼鱼胃、肠、肝脏和幽门盲囊的淀粉酶活性, 其活力单位定义:组织中每毫克蛋白37℃, 与底物作用30 min, 水解10 mg淀粉定义为1个淀粉酶活力单位, 即淀粉酶活力单位为(U/mgprot)。
使用超氧化物歧化酶(SOD)试剂盒(A001-1, 南京建成生物工程研究所)测定了黄条鰤幼鱼血清总SOD含量, 检测每毫升反应液中SOD抑制率达50%时所对应的SOD量为1个酶活力单位, 即SOD活力单位为(U/mL)。使用Fish T4 ELISA Kit试剂盒(CK-E90004F)测定了黄条鰤血清甲状腺激素(T4)的含量, T4浓度单位为(ng/mL)。
1.3 统计分析使用SPSS 17.0软件的单因素方差分析(One-way ANOVA)和Duncan’s多重比较分析。P < 0.05为差异显著。作图数据均以平均值±标准差(Mean±SD)表示。
2 结果 2.1 脂肪酶活力变化黄条鰤幼鱼胃脂肪酶的活力在各实验组内均随处理时间的增加而降低, 在6 h之内各实验组之间无显著差异(P > 0.05), 随后持续降低, 96 h之后各实验组均趋于稳定; 且在整个处理过程中所有实验盐度组胃脂肪酶活力均低于对照组(图 1)。
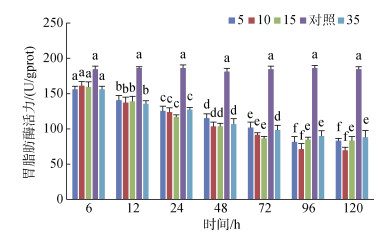 |
| 图 1 不同盐度对胃脂肪酶活力的影响 Fig. 1 Effects of different salinities on lipase activity in the stomach 注:不同字母表示不同盐度下胃脂肪酶活力有显著性差异(P < 0.05) |
肠脂肪酶在S10组的活力在6 h时超过对照组盐度的活力; 随后各实验组肠脂肪酶活力持续降低, 均低于对照组; 随着时间的延长, S5、S15和S35组肠脂肪酶活力整体上呈显著降低趋势(P < 0.05), S5组在48 h之后趋于稳定, S15组在72 h之后趋于稳定, S35组肠脂肪酶活力96 h后趋于稳定(图 2)。
 |
| 图 2 不同盐度对肠脂肪酶活力的影响 Fig. 2 Effects of different salinities on lipase activity in the intestine 注:不同字母表示不同盐度下肠脂肪酶活力有显著性差异(P < 0.05) |
肝脏脂肪酶活力在整个处理过程中各实验组盐度下均低于对照组活力, 且随着时间的增加活力均呈现降低的趋势, 96 h之后各实验组肝脏脂肪酶活力趋于稳定(图 3)。
 |
| 图 3 不同盐度对肝脏脂肪酶活力的影响 Fig. 3 Effects of different salinities on lipase activity in the liver 注:不同字母表示不同盐度下肝脏脂肪酶活力有显著性差异(P < 0.05) |
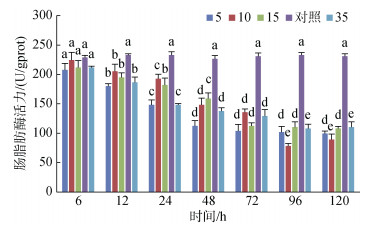
幽门盲囊脂肪酶活力在各实验组盐度下均随时间增加均呈现降低的趋势, 且均低于对照组; S5、S10和S15组幽门盲囊脂肪酶活力在96 h时趋于稳定, 而S35组则持续降低(图 4)。
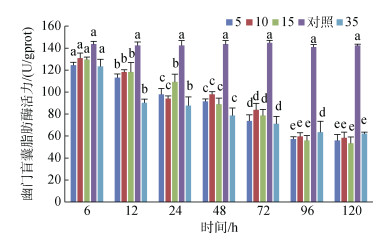 |
| 图 4 不同盐度对幽门盲囊脂肪酶活力的影响 Fig. 4 Effects of different salinities on lipase activity in the pyloric caeca 注:不同字母表示不同盐度下幽门盲囊脂肪酶活力有显著性差异(P < 0.05) |
黄条鰤幼鱼胃蛋白酶的活力随着盐度的增加而增加。S35组活力在6~12 h时显著高于对照组(P < 0.05), 之后显著降低且低于对照组。S5、S10和S15组在整个处理过程中均未超过对照组的活力; 96 h后4个实验盐度组的胃蛋白酶活力趋于稳定, 各实验组与对照组有显著性差异(P < 0.05)(图 5)。
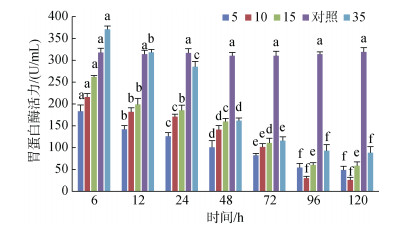 |
| 图 5 不同盐度对胃蛋白酶活力的影响 Fig. 5 Effects of different salinities on protease activity in the stomach 注:不同字母表示不同盐度下胃蛋白酶活力有显著性差异(P < 0.05) |
肠蛋白酶的活力在6 h时, S35组略低于对照组, 其他盐度组肠蛋白酶活力都处于较低水平, 显著低于对照组的活力(P < 0.05), 且均随着时间的增长而降低, 72 h后4个实验组肠蛋白酶活力均趋于稳定(图 6)。
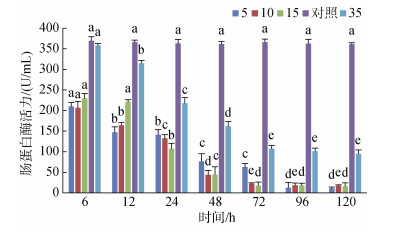 |
| 图 6 不同盐度对肠蛋白酶活力的影响 Fig. 6 Effects of different salinities on protease activity in the intestine 注:不同字母表示不同盐度下肠蛋白酶活力有显著性差异(P < 0.05) |
肝脏蛋白酶活力在6 h和12 h时S35组活力均高于对照组; 6~48 h各实验盐度组活力持续降低, 与对照组有显著性差异(P < 0.05), 96 h之后趋于稳定(图 7)。
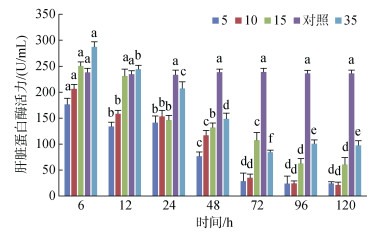 |
| 图 7 不同盐度对肝脏蛋白酶活力的影响 Fig. 7 Effects of different salinities on protease activity in the liver 注:不同字母表示不同盐度下肝脏蛋白酶活力有显著性差异(P < 0.05) |
S15和S35组幽门盲囊蛋白酶活力在6 h时高于对照组, 之后各实验盐度组幽门盲囊蛋白酶活力随着时间的增长而降低, S5组72 h时幽门盲囊蛋白酶活力趋于稳定, 而S10、S15和S35组则在96 h后趋于稳定, 均与对照组有显著性差异(P < 0.05)(图 8)。
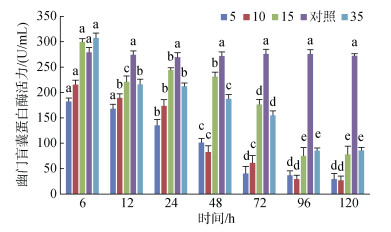 |
| 图 8 不同盐度对幽门盲囊蛋白酶活力的影响 Fig. 8 Effects of different salinities on protease activity in the pyloric caeca 注:不同字母表示不同盐度下幽门盲囊蛋白酶活力有显著性差异(P < 0.05) |
4个实验组黄条鰤幼鱼胃淀粉酶活力在整个处理过程中均未超过对照组的活力, 且整体随时间的增加呈降低的趋势, S10组胃淀粉酶活力随着时间的增加上下波动; S15组胃淀粉酶活力持续降低, S5和S35组则在96 h后趋于稳定(图 9)。
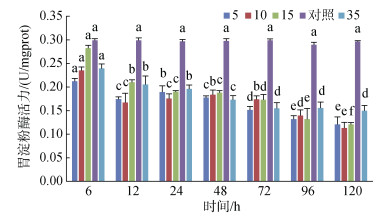 |
| 图 9 不同盐度对胃淀粉酶活力的影响 Fig. 9 Effects of different salinities on amylase activity in the stomach 注:不同字母表示不同盐度下胃淀粉酶活力有显著性差异(P < 0.05) |
肠淀粉酶活力在实验组中也未超过对照组的活力, 总体随时间增加呈下降的趋势, S5和S35组肠淀粉酶活力持续降低, 而S10和S15组则在96 h后趋于稳定(图 10)。
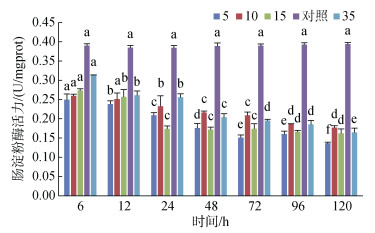 |
| 图 10 不同盐度对肠淀粉酶活力的影响 Fig. 10 Effects of different salinities on amylase activity in the intestine 注:不同字母表示不同盐度下肠淀粉酶活力有显著性差异(P < 0.05) |
4个实验组肝脏淀粉酶活力在6 h和12 h时活力均高于对照组, 且S35组明显高于其他组(P < 0.05); 4个实验盐度组肝脏淀粉酶活力24 h之后则均低于对照组活力, 且各实验组盐度下肝脏淀粉酶活力持续降低, 各组间差异显著(P < 0.05)(图 11)。
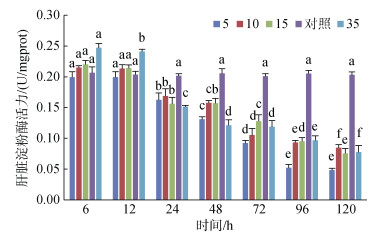 |
| 图 11 不同盐度对肝脏淀粉酶活力的影响 Fig. 11 Effects of different salinities on amylase activity in the liver 注:不同字母表示不同盐度下肝脏淀粉酶活力有显著性差异(P < 0.05) |
幽门盲囊淀粉酶活力在S5、S10和S15组均低于对照组, 且随时间增长呈降低趋势, 其中盐度10组在72 h时趋于稳定; S35组在6 h和12 h时活力显著高于对照组(P < 0.05), 24 h和48 h基本和对照组持平, 随后降低且低于对照组, 96 h后趋于稳定(图 12)。
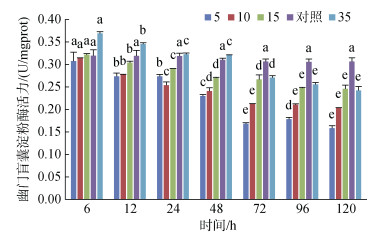 |
| 图 12 不同盐度对幽门盲囊淀粉酶活力的影响 Fig. 12 Effects of different salinities on amylase activity in the pyloric caeca 注:不同字母表示不同盐度下幽门盲囊淀粉酶活力有显著性差异(P < 0.05) |
S5组随着时间的增加, 黄条鰤幼鱼血清SOD活力逐渐降低, 120 h时显著低于其他盐度组(P < 0.05); S10组SOD活力随着时间的增加逐渐升高, 48~96 h之间无显著性差异(P > 0.05); S15组SOD活力在96 h之前一直升高, 且各组间差异显著(P < 0.05), 120 h时略有降低, 与96 h时SOD活力有显著性差异(P < 0.05); S35组SOD活力在6 h和12 h显著低于其他盐度组(P < 0.05), 24 h之后显著升高(P < 0.05), 48 h之后逐渐稳定, 48~96 h组间无显著性差异(P > 0.05), 120 h时SOD活力降低, 接近对照组SOD活力(图 13)。
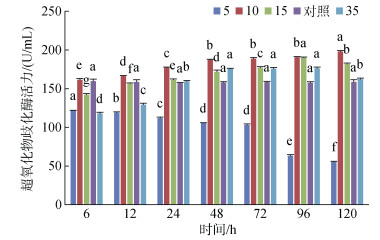 |
| 图 13 不同盐度对血清超氧化物歧化酶活力的影响 Fig. 13 Effects of different salinities on SOD activity of serum 注:不同字母表示不同盐度下血清超氧化物歧化酶活力有显著性差异(P < 0.05) |
黄条鰤在不同盐度海水中, 经过6~120 h后其血清中甲状腺激素(T4)浓度变化情况。96 h之前各实验组黄条鰤幼鱼血清T4浓度显著高于对照组(P < 0.05), 随着时间的增加浓度逐渐降低。S5组T4浓度在6 h和12 h间无显著性差异(P > 0.05), 120 h急剧下降, 与96 h时T4浓度有显著性差异(P < 0.05)。S10组T4浓度持续降低, 在12 h时降低明显, 之后降低幅度变小, 96 h后保持稳定。S15和S35组T4浓度均随时间的增加而降低, 96 h后趋于稳定。各实验组T4浓度均在96 h时降低到较低水平, 随后趋近对照组浓度(图 14)。
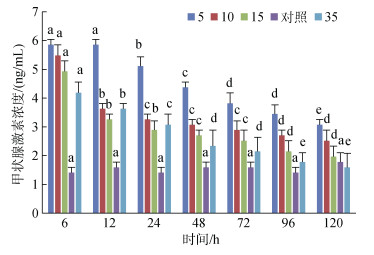 |
| 图 14 不同盐度对血清中甲状腺素浓度的影响 Fig. 14 Effects of different salinities on T4 activity of serum 注; 不同字母表示不同盐度下血清甲状腺激素浓度有显著性差异(P < 0.05) |
消化酶是影响营养吸收转化的关键酶类, 盐度对鱼类消化酶活性有重要的影响[20]。水体的盐度通过影响鱼类消化酶活性来影响对饵料的消化和吸收, 最终影响鱼类的生长发育[21]。有研究表明, 盐度在一定范围内的变化导致鱼体消化道内消化酶活力的变化, 可大致归结为3类:第一类是激活消化酶的作用[22], 第二类是抑制消化酶的作用[23], 第三类是对消化酶作用没有明显影响[24]。张龙岗等[25]对高体革鯻(Scortum barcoo)的研究结果表明在0~13盐度下随着盐度的升高脂肪酶活力受到的抑制逐渐降低, 在盐度超过13后高体革鯻脂肪酶活力开始上升, 脂肪酶活力又受到激活。但是在本研究中黄条鰤幼鱼消化吸收相关的各组织脂肪酶活力并未出现上升情况, 这可能是由于鱼的种类以及盐度设置的不同导致消化系统脂肪酶活力变化的不同。在本研究中黄条鰤幼鱼胃、肠、肝脏和幽门盲囊的脂肪酶活力在6 h之内与对照组无显著差异(P > 0.05), 12 h之后随着处理时间的增长脂肪酶活力降低, 显著低于对照组, 推测可能是由于盐度变化导致了pH等变化, 超出了脂肪酶的适应范围, 进而受到抑制。
大马哈鱼(Oncorhynchus keta)的研究结果表明适当增加盐度能够促进胃蛋白酶活性, 推测其原因是由于氯离子是蛋白酶的激活剂[22]。与该研究类似, 在本研究中高盐度S35组时黄条鰤幼鱼6 h之前胃、肝脏和幽门盲囊的蛋白酶活力显著高于其他盐度组, 但随时间增长蛋白酶活力显著降低; 推测可能是由于Na+、K+、Cl–等离子浓度升高, 导致对黄条鰤幼鱼消化系统蛋白酶的激活作用下降。在点篮子鱼研究中发现, 盐度5和盐度10条件下第24 d和第48 d时点篮子鱼蛋白酶活力均显著低于盐度30~32(对照)组[7]。本研究中, 低盐度S5、S10和S15实验组黄条鰤蛋白酶活力也均显著低于S29(对照)组, 可能是因为低盐度胁迫下黄条鰤无法通过消化酶活性的调节进而维持正常的消化功能。
在花鳗鲡(Anguilla marmorata)和太平洋双色鳗鲡(A. bicolor pacifica)的研究中显示胃、肠淀粉酶活力随着盐度增加而下降[4]。在本研究中黄条鰤幼鱼胃、肠、肝脏和幽门盲囊淀粉酶活力在S35组随着时间的延长均明显下降, 实验结束120 h时显著低于对照组淀粉酶活力, 说明较高盐度对黄条鰤幼鱼淀粉酶活力具有一定的抑制作用, 笔者认为, 这可能与盐度变化产生的O2–清除不及时影响了淀粉酶的活性有关。黄条鰤幼鱼消化器官中蛋白酶、脂肪酶和淀粉酶活力在120 h时最高的均为对照组, 不同盐度海水对黄条鰤幼鱼各消化器官中消化酶活力均有显著性影响, 但各盐度组酶活性在96 h后基本趋于稳定, 说明黄条鰤幼鱼已经慢慢适应环境, 具有较强的调节能力。
3.2 盐度突变下黄条鰤活力的变化规律SOD活力是鱼体内自由基的代谢情况的重要指标, 反映了鱼体的应激能力[26]。环境盐度的变化可使鱼体产生大量的超氧阴离子自由基(O2–), SOD能够将超氧阴离子自由基(O2–)转化成H2O2, 接着由过氧化氢酶将产生的H2O2进一步处理转变为H2O和O2, 保护机体细胞内环境稳定[27]; SOD活力变化可以准确反映鱼体内自由基的代谢情况, 对判断鱼的健康状况具有重要意义[28]。在盐度突变的过程中, 许氏平鲉(Sebastes schlegeli)幼鱼血液中SOD活力在略低的5和15盐度条件下被激活以消除机体中过多的O2–自由基, 从而保护机体内细胞免受其伤害[29]。在本研究中S10组黄条鰤幼鱼血清SOD活力持续升高, 且显著高于对照组; S15组SOD活力24 h后均显著高于对照组, 仅在120 h时略有降低; 说明黄条鰤受到低盐度环境胁迫时, 鱼体进行渗透调节, 代谢加快, 体内产生大量的活性氧自由基, SOD活力升高以清除产生的活性氧自由基。本研究中S5组SOD活力显著低于其他盐度组, 且持续降低, 可能是由于盐度5对黄条鰤幼鱼来说属于重度的低盐度胁迫, 产生的大量自由基在体内积累并对实验鱼造成氧化损伤, 导致鱼体内自由基代谢紊乱, 其SOD活力被抑制, 不能进行正常的抗氧化调节。
3.3 盐度突变下黄条鰤T4浓度的变化规律在鱼体中, 甲状腺激素具有多效性, 它与皮质醇和生长激素有类似的作用, 均参与调控鱼类的生长、发育、新陈代谢和渗透调节[30]。水体盐度的突变会导致金头鲷(Sparus aurata)血浆中T4浓度的变化, 引发甲状腺机能亢进, 进而激活脑垂体、鳃和肾等组织器官参与调节[10], 因此T4浓度变化可以反应鱼体对外界环境变化的应激能力。该研究显示金头鲷在低盐度5和15组, 血浆中T4浓度显著高于盐度40组[10]。本研究中在低盐度组黄条鰤幼鱼血清T4浓度也显著高于对照组, 其浓度的增加表明T4参与了渗透调节, 以适应盐度的剧烈变化, 有助于增加黄条鰤对低盐度变化的适应性。对淡水龟壳攀鲈(Anabas testudineus)的研究发现在高盐度20组血浆中T4浓度显著升高, 在该盐度条件下养殖3周后, 血浆中T4浓度恢复到对照组水平[31]。本研究结果与之相似, 6~24 h高盐度S35组黄条鰤幼鱼血清T4浓度显著高于对照组, 说明黄条鰤在盐度提升后, 通过增加T4含量进而增强其对高盐度海水的耐受性, 96 h之后逐渐稳定接近对照组, 说明黄条鰤对激素的调控作用依懒性降低, 因此分泌的T4减少。
| [1] |
杨板, 赵文, 魏杰, 等. 盐度对透明溞存活、生长和繁殖的影响[J]. 水产科学, 2019, 38(3): 361-367. Yang Ban, Zhao Wen, Wei Jie, et al. Effects of salinity on survival, growth and reproduction in water fleas Daphnia hylina (Crastacea:Cladocera)[J]. Fisheries Science, 2019, 38(3): 361-367. |
| [2] |
Lein I, Tveite B, Gjerde B, et al. Effects of salinity on yolk sac larvae of Atlantic halibut (Hippoglossus hippoglossus L.)[J]. Aquaculture, 1997, 156: 291-303. |
| [3] |
De Silva S, Perera P. Studies on the young grey mullet, Mugil cephalus L.:I. Effects of salinity on food intake, growth and food conversion[J]. Aquaculture, 1976, 7(4): 327-338. |
| [4] |
罗鸣钟, 关瑞章, 靳恒. 盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响[J]. 水生生物学报, 2015, 39(4): 653-660. Luo Mingzhong, Guan Ruizhang, Jin Heng. Effects of the salinity on the growth performance and digestive enzyme activities of Anguilla marmorata elver and A. bicolor pacifica elver[J]. Acta Hydrobiologica Sinica, 2015, 39(4): 653-660. |
| [5] |
沈永龙, 戈贤平, 黄金田, 等. 盐度对瘤背石磺(Onchidium struma)消化酶活性的影响[J]. 动物营养学报, 2012, 24(9): 1839-1846. Shen Yonglong, Ge Xianping, Huang Jintian, et al. Effects of salinity on digestive enzyme activities of Onchidium struma[J]. Chinese Journal Animal Nutrition, 2012, 24(9): 1839-1846. |
| [6] |
李希国, 李加儿, 区又君. 盐度对黄鳍鲷幼鱼消化酶活性的影响及消化酶活性的昼夜变化[J]. 海洋水产研究, 2006, 27(1): 40-45. Li Xiguo, Li Jiaer, Ou Youjun. Effects of salinity on digestive enzyme activity and diurnal variation of digestive enzyme activity of young yellowfin black porgy Sparus latus[J]. Progress in Fishery Sciences, 2006, 27(1): 40-45. |
| [7] |
罗集光, 章龙珍, 庄平, 等. 盐度对点篮子鱼消化酶活性的影响[J]. 海洋渔业, 2011, 33(1): 33-38. Luo Jiguang, Zhang Longzhen, Zhuang Ping, et al. Effects of salinity on digestive enzyme activity in Siganus guttatus[J]. Marine Fisheries, 2011, 33(1): 33-38. |
| [8] |
Sinha A K, Elgawad H A, Zinta G, et al. Nutritional status as the key modulator of antioxidant responses induced by high environmental ammonia and salinity stress in European Sea Bass (Dicentrarchus labrax)[J]. PLoS ONE, 2015, 10(8): e0135091. |
| [9] |
Sui Y M, Huang X Z, Kong H, et al. Physiological responses to salinity increase in blood parrotfish (Cichlasoma synspilum♀×Cichlasoma citrinellum♂)[J]. SpringerPlus, 2016, 1246. |
| [10] |
Ruiz-Jarabo I, Klaren P H M, Louro B, et al. Characterization of the peripheral thyroid system of gilthead seabream acclimated to different ambient salinities[J]. Comparative Biochemistry and Physiology, Part A, 2017, 203: 24-31. |
| [11] |
Chai X L, Li X X, Lu R M, et al. Karyotype analysis of the yellowtail kingfish Seriola lalandi lalandi (Perciformes:Carangidae) from South Australia[J]. Aquculture Research, 2009, 40(15): 1735-1741. |
| [12] |
刘静, 陈咏霞, 马琳. 黄渤海鱼类图志[M]. 北京: 科学出版社, 2015: 172. Liu Jing, Cheng Yongxia, Ma Lin. Fishes of the Bohai Sea and Yellow Sea[M]. Beijing: Science Press, 2015: 172. |
| [13] |
史宝, 柳学周, 刘永山, 等. 黄条鰤线粒体全基因组测定及结构特征分析[J]. 中国水产科学, 2019, 26(3): 405-415. Shi Bao, Liu Xuezhou, Liu Yongshan, et al. Complete sequence and gene organization of the mitochondrial genome of Seriola aureovittata[J]. Journal of Fishery Sciences of China, 2019, 26(3): 405-415. |
| [14] |
柳学周, 徐永江, 李荣, 等. 黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价[J]. 渔业科学进展, 2017, 38(1): 128-135. Liu Xuezhou, Xu Yongjiang, Li Rong, et al. Analysis and evaluation of nutritional composition of the muscle of yellowtail kingfish (Seriola aureovittata)[J]. Progress in Fishery Sciences, 2017, 38(1): 128-135. |
| [15] |
史宝, 刘永山, 柳学周, 等. 黄条鰤(Seriola aureovittata)染色体核型分析[J]. 渔业科学进展, 2017, 38(1): 136-141. Shi Bao, Liu Yongshan, Liu Xuezhou, et al. Study on the karyotype of yellowtail kingfish (Seriola aureovittata)[J]. Progress in Fishery Sciences, 2017, 38(1): 136-141. |
| [16] |
韩羽嘉, 田甲申, 李多慧, 等. 黄条鰤不同组织碳稳定同位素的转化率与分馏[J]. 水产学杂志, 2017, 30(6): 34-40. Han Yujia, Tian Jiashen, Li Duohui, et al. Conservation rate and fractionation of carbon stable isotope from different tissues in yellow tail seriola aureovittata[J]. Chinese Journal of Fisheries, 2017, 30(6): 34-40. |
| [17] |
柳学周, 史宝, 刘永山, 等. 盐度突变对黄条鰤幼鱼渗透调节功能的影响[J]. 大连海洋大学学报, 2019, 34(6): 767-775. Liu Xuezhou, Shi Bao, Liu Yongshan, et al. Effects of sharp changes in salinity on osmotic regulation function in juvenile yellowtail kingfish Seriola aureovittata[J]. Journal of Dalian Ocean University, 2019, 34(6): 767-775. |
| [18] |
史宝, 刘永山, 柳学周, 等. 盐度渐变对黄条鰤消化酶和超氧化物歧化酶活力及甲状腺激素的影响[J]. 中国海洋大学学报(自然科学版), 2020, 50(1): 48-56. Shi Bao, Liu Yongshan, Liu Xuezhou, et al. Effects of gradual salinity on the digestive enzyme activity, superoxide dismutase activity and thyroid hormone content of yellowtail kingfish (Seriola aureovittata)[J]. Periodical of Ocean University of China, 2020, 50(1): 48-56. |
| [19] |
史宝, 刘永山, 柳学周, 等. 盐度渐变过程对黄条鰤(Seriola aureovittata)幼鱼渗透调节的影响[J]. 海岸工程, 2019, 38(1): 63-70. Shi Bao, Liu Yongshan, Liu Xuezhou, et al. Effects of gradual salinity change on osmotic regulation of juvenile yellowtail kingfish (Seriola aureovittata)[J]. Coastal Engineering, 2019, 38(1): 63-70. |
| [20] |
Gheisvandi N, Hajimoradloo A, Ghorbani R, et al. The effects of gradual or abrupt changes in salinity on digestive enzymes activity of Caspian kutum, Rutilus kutum (Kamensky, 1901) larvae[J]. Journal of Applied Ichthyology, 2015, 31(6): 1107-1112. |
| [21] |
田宏杰, 庄平, 高露姣. 生态因子对鱼类消化酶活力影响的研究进展[J]. 海洋渔业, 2006, 28(2): 158-162. Tian Hongjie, Zhuang Ping, Gao Lujiao. Advances on the studies of the effect of ecological factors on activities of digestive enzymes of fish[J]. Marine Fisheries, 2006, 28(2): 158-162. |
| [22] |
Sánchez-Chiang L, Cisternas E, Ponce O. Partial purification of pepsins from adult and juvenile salmon fish Oncorhynchus keta. Effect of NaCl on proteolytic activities[J]. Comparative Biochemistry and Physiology Part B, 1987, 87(4): 793-797. |
| [23] |
林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社, 2011: 213-219. Lin Haoran. Fish Physiology[M]. Guangzhou: Guangdong Higher Education Press, 2011: 213-219. |
| [24] |
Fang L S, Chiou S F. Effect of salinity on the activities of digestive protease from the Tilapia fish, Oreochromis niloticus in different culture environments[J]. Comparative Biochemistry and Physiology, Part A, 1989, 93: 439-443. |
| [25] |
张龙岗, 安丽, 孙栋, 等. 盐度胁迫对高体革鯻幼鱼消化酶活力的影响[J]. 水产学杂志, 2011, 24(3): 21-24. Zhang Longgang, An Li, Sun Dong, et al. Effects of salinity on digestive enzyme activities of juvenile Jade Perch Scortum barcoo[J]. Chinese Journal of Fisheries, 2011, 24(3): 21-24. |
| [26] |
杨静雯, 周演根, 黄铭, 等. 盐度对虹鳟和硬头鳟幼鱼消化酶和抗氧化酶活性的比较研究[J]. 中国海洋大学学报(自然科学版), 2019, 49(3): 119-128. Yang Jingwen, Zhou Yangen, Huang Ming, et al. Comparative studies on digestive and antioxidant enzyme activities between juvenile Rainbow (Oncorhynchus mykiss) and Steelhead Trout (O. mykiss)[J]. Periodical of Ocean University of China, 2019, 49(3): 119-128. |
| [27] |
王妤, 庄平, 章龙珍, 等. 盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J]. 水产学报, 2011, 35(1): 66-73. Wang Yu, Zhuang Ping, Zhang Longzhen, et al. Effects of salinity on survival, growth and antioxidant defense system of Siganus guttatus[J]. Journal of Fisheries of China, 2011, 35(1): 66-73. |
| [28] |
Martínez R M, Morales A E, Sanz A. Antioxidant defenses in fish:biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1-2): 75-88. |
| [29] |
王晓杰, 张秀梅, 李文涛. 盐度胁迫对许氏平鲉血液免疫酶活力的影响[J]. 海洋水产研究, 2005, 26(6): 17-21. Wang Xiaojie, Zhang Xiumei, Li Wentao. Effect of salinity stress on the non-specific immuno-enzymetic activity of Sebastes schlegeli[J]. Marine Fisheries Research, 2005, 26(6): 17-21. |
| [30] |
Peyghan R, Enayati A, Sabzevarizadeh M. Effect of salinity level on TSH and thyroid hormones of grass carp, Ctenophayngodon idella[J]. Veterinary Research Forum, 2013, 4(3): 175-178. |
| [31] |
Rejitha V, Peter V S, Subhash M C. Short-term salinity acclimation demands thyroid hormone action in the climbing perch Anabas Testudineus Bloch[J]. Journal of Endocrinology and Reproduction, 2009, 13(2): 63-72. |
 2020, Vol. 44
2020, Vol. 44


