
文章信息
- 马莹莹, 赵瑾, 解威峰, 姜鹏. 2020.
- MA Ying-ying, ZHAO Jin, XIE Wei-feng, JIANG Peng. 2020.
- 浒苔(Ulva prolifera)漂浮生态型的分枝表型及其可塑性
- Branching phenotype and plasticity in floating ecotype of Ulva prolifera (Ulvophyceae, Chlorophyta)
- 海洋科学, 44(8): 98-105
- Marine Sciences, 44(8): 98-105.
- http://dx.doi.org/10.11759/hykx20200121001
-
文章历史
- 收稿日期:2020-01-21
- 修回日期:2020-03-03
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院 海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院大学, 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
自2007年至今, 我国黄海绿潮连年暴发, 规模居世界首位[1], 已成为常态化发生的海洋灾害。分子鉴定结果表明, 历年绿潮的优势种为石莼属浒苔(Ulva prolifera)[2]。由于浒苔在我国沿海广泛分布, Zhao等进一步开展了群体遗传分析, 发现历年漂浮浒苔在遗传上高度一致, 和其他定生群体具有明显差异, 提出是一种特殊的生态型——漂浮生态型, 进而开发了特异的SCAR分子标记[3]。上述结果提示, 黄海绿潮有重要的生物学成因[4]。
与Ulva属其他物种比较发现, 漂浮浒苔具有较高的生长率、营养盐吸收速率、以及光合效率[5-7], 藻体具更强的漂浮能力[8], 繁殖方式也更加多样[9-11]。通过比较漂浮浒苔和定生浒苔, 发现前者的代谢水平更加旺盛[12], 此外, 其形态较后者也发生了明显变化, 例如, 漂浮浒苔会形成气囊状结构[13]、具有多分枝的表型[10, 14-17], 推测密集分枝结构会产生较强的漂浮能力[18]。
藻体是否产生分枝, 是Ulva属海藻的重要表型, 也是有限的物种形态鉴定指标之一[19]。尽管对于漂浮浒苔具高度分枝已有广泛报导, 但多限于定性的笼统描述, 对于其分枝程度的量化特征、分枝表型的可塑性、以及影响可塑性的因素, 认识仍严重不足。
我们认为, 相关研究的局限主要受制于三个方面:首先, 对于分枝表型缺乏量化表征的具体形态学指标, 从而难以定量区分漂浮浒苔与定生浒苔的分枝差异, 也无法准确描述随不同年份或暴发阶段, 漂浮浒苔群体内自身分枝表型的变异。其次, 缺乏基于大样本量的统计分析。漂浮浒苔连年暴发, 在黄海海域具有大尺度的时空分布; 定生浒苔群体同样在我国不同海域均有分布[3], 而现有研究往往只是基于少量样本, 统计结果缺乏足够的代表性[17]。最后, 表型可塑性是指同一个基因型在不同环境下产生不同表型的现象或能力[20]。黄海沿岸有不同的浒苔定生群体, 与漂浮生态型之间存在明显的遗传差异[3]。目前, 对浒苔分枝表型可塑性的有限研究中, 往往未对研究材料进行准确的分子鉴定[13, 21], 因此, 对于检出的表型差异, 实质上难以确定究竟是来自不同种群或物种间的遗传差异, 还是来自群体内的表型可塑性。
本研究分别采集具足够代表性的漂浮浒苔与定生浒苔样本, 首先基于多分子标记鉴定漂浮生态型, 其次, 采用最高分枝级数与一级分枝密集度两个量化指标, 针对漂浮浒苔与定生浒苔的分枝表型, 分别进行数据统计与比较分析, 并进一步研究了两类浒苔分枝表型的可塑性, 研究结果将为浒苔漂浮生态型的形态鉴定提供可靠依据, 也将为后续浒苔分枝机制研究提供必要基础。
1 材料与方法 1.1 绿藻样本采集在南黄海海域, 于2016年5月—2018年5月绿潮暴发期间搭载多个调查航次采集漂浮绿藻样本(表 1)。另于2017年5月下旬在浙江、2018年5月下旬在江苏与山东沿岸潮间带分别采集定生绿藻样本, 样本采集后置于冷藏箱低温保存, 带回实验室处理。
| 航次时间 | 采样经纬度范围 |
| 2016年5月中旬—5月下旬 | 32°00′—35°00′N, 119°30′—122°30′E |
| 2016年5月下旬—6月上旬 | 32°40′—34°00′N, 120°30′—121°45′E |
| 2016年6月中旬—7月上旬 | 34°00′—36°00′N, 119°30′—124°00′E |
| 2016年6月下旬—7月上旬 | 32°40′—34°00′N, 120°30′—121°45′E |
| 2017年6月上旬—6月下旬 | 34°00′—36°00′N, 119°45′—124°00′ E |
| 2018年5月下旬 | 34°41′—35°00′N, 120°30′—121°20′E |
挑选健康的绿藻单株, 用消毒海水清洗藻体表面, 切取部分藻段用植物基因组提取试剂盒(天根, 北京)提取总DNA。参照Leskinen等的方法进行ITS扩增[22], 引物由上海生物工程有限公司合成。扩增产物经用Super Gel Red(US Everbright Inc, 江苏)染色的1.0%琼脂糖凝胶电泳, 使用琼脂糖凝胶DNA回收试剂盒(天根, 北京)回收纯化目的片段, 送上海桑尼生物科技有限公司测序。下载GenBank中Ulva属物种的12条ITS序列作为参考序列, 以Blidingia属ITS序列为外群, 用Clustal X 2.0进行多序列比对及序列相似性分析, 使用MEGA 6.0基于最大似然法(Maximum Likelihood, ML)构建系统发育树。为了进一步区分浒苔与其近缘种缘管浒苔(U. linza), 参照Shimada等的方法进行5S rDNA间隔序列(5S NTS)扩增[23], 根据两个近缘种中特征片段的大小差异(浒苔最小扩增片段约为450 bp, 缘管浒苔最小扩增片段约为350 bp), 利用琼脂糖凝胶电泳进行初步区分, 测序与构建ML系统发育树的方法与ITS相同。对于分子鉴定为浒苔的样本, 用SCAR分子标记经PCR扩增检测, 根据是否获得约830 bp的特征条带, 判断样本是否为漂浮生态型[3]。
1.3 浒苔分枝表型的量化表征浒苔藻体为单层细胞管状, 藻体上有分枝, 借鉴高等植物中分枝级数的概念[24], 我们将从主干分出的主枝定义为一级分枝, 将从一级分枝上分出的主枝定义为二级分枝, 以此类推, 分别定义三级、四级等多级分枝。进一步, 将一级分枝总数与主干长度的比值定义为一级分枝密集度。
针对经分子鉴定为浒苔的样本, 经形态鉴定, 逐一确定其最高分枝级数, 测量其藻体主干的长度, 计数其一级分枝的总数, 从而计算一级分枝密集度, 使用Microsoft Excel进行数据统计与作图。
1.4 浒苔的诱导生殖与培养分别选择浒苔漂浮生态型与定生浒苔样本, 参照Dan等的方法, 将藻体切成5 mm长左右的藻段, 加入VSE海水培养液, 置于20℃、光强100 μmol photons/(m2·s)、12 h : 12 h光暗周期条件下培养, 诱导浒苔生殖细胞的形成与放散[25]。放散出的生殖细胞在相同培养条件下, 于光照培养箱中进行培养。萌发后, 从漂浮生态型和定生浒苔样本中分别选取约10个单株, 分别在第19 d、23 d、36 d, 逐一测定最高分枝级数与一级分枝密集度两个指标。
2 结果 2.1 分子鉴定经ITS分子鉴定与ML系统发育树分析, 共检出140个聚类为LPP(U. linza-prolifera-procera)簇的样本(图 1)。进一步扩增其5S NTS分子标记, 经琼脂糖凝胶电泳, 发现所有样本均具有浒苔特征性条带(图 2), 挑选部分样本, 将特征性扩增产物回收、纯化、测序并构建ML系统发育树(图 3), 结果表明, 所有检出的LPP簇样本均为浒苔。
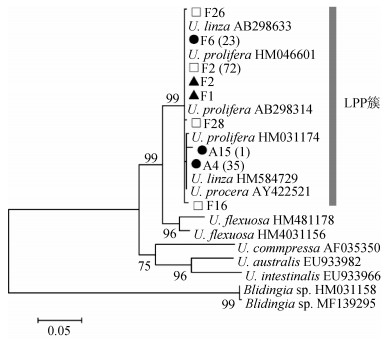 |
| 图 1 ML法构建绿藻ITS系统发育树 Fig. 1 ML phylogenetic tree based on ITS sequences; ▲: 2016; □: 2017; ●: 2018; F: floating samples; A: attached samples. The number in brackets after the sample ID indicates the numbers of identical sequences 注: ▲: 2016年; □: 2017年; ●: 2018年; F:漂浮样本; A:定生样本; 括号里的数字代表具相同序列的样本数 |
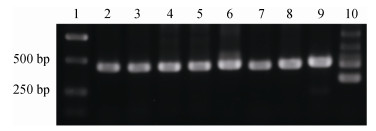 |
| 图 2 5S NTS分子标记扩增产物电泳图 Fig. 2 Electrophoresis pattern of amplified products by 5S NTS primers 1: Trans 2K Plus Ⅱ DNA Marker; 2—5: floating samples; 6—8: attached samples; 9: positive control for U. prolifera; 10: positive control for U. linza 注: 1: Trans 2K Plus Ⅱ DNA Marker; 2—5:漂浮样本; 6—8:定生样本; 9:浒苔阳性对照; 10:缘管浒苔阳性对照 |
 |
| 图 3 ML法构建5S NTS序列系统发育树 Fig. 3 ML phylogenetic tree based on 5S NTS sequences; ▲: 2016; □: 2017; ●: 2018; F: floating samples; A: attached samples. The number in brackets after the sample ID indicates the numbers of identical sequences 注: ▲: 2016年; □: 2017年; ●: 2018年; F:漂浮样本; A:定生样本; 括号里的数字代表具相同序列的样本数 |
针对所有140个浒苔样本扩增检测SCAR分子标记, 经统计共有101株显示SCAR阳性, 且全部来自漂浮样本, 证明均属于浒苔漂浮生态型; 另有39株显示SCAR阴性, 发现均为岸基采集的定生浒苔(图 4)。
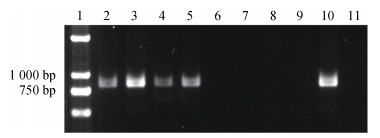 |
| 图 4 SCAR分子标记扩增产物电泳图 Fig. 4 Electrophoresis pattern of amplified products by SCAR primers; 1: Trans 2K Plus Ⅱ DNA Marker; 2―5: floating U. prolifera samples; 6―9: attached U. prolifera samples; 10: positive control; 11: blank control 注: 1: Trans 2K Plus Ⅱ DNA Marker; 2—5:漂浮浒苔样本; 6—9:定生浒苔样本; 10:阳性对照; 11:空白对照 |
经肉眼粗略观察, 来自不同地理居群的定生浒苔样本普遍分枝较少甚至没有分枝(图 5a), 而不同年份采集的漂浮浒苔样本普遍分枝较多(图 5b)。为了能够对浒苔的分枝表型进行量化表征与比较分析, 我们针对不同群体的单株样本, 逐一分别测定了其最高分枝级数和一级分枝密集度两个指标。最高分枝级数的统计结果如图 6所示, 在浒苔定生群体中, 略超过半数的个体仅有一级分枝, 没有分枝的个体与最高可达二级分枝的个体各占约1/4。而浒苔漂浮生态型中, 绝大多数个体(98.0%)均有分枝, 其中近半为三级分枝, 其次为四级和二级分枝, 最高可见五级分枝, 仅有少数个体没有分枝。上述结果表明, 漂浮生态型的分枝级数显著高于所有的浒苔定生群体。一级分枝密集度的统计结果如图 7所示, 定生浒苔平均值约为1.9个/cm, 而漂浮生态型约为11.0个/cm, 是前者的5.8倍, 差异显著。综合上述两个量化指标的结果可以看出, 浒苔漂浮生态型的藻体呈高度分枝, 较定生群体具有显著差异。
 |
| 图 5 浒苔形态 Fig. 5 Morphology of U. prolifera. a: attached U. prolifera, Scale bar 1 cm; b: floating ecotype in highly branching morphology, Scale bar 2 cm; c: floating ecotype without branches, Scale bar 2 cm. 注: a:定生浒苔, 比例尺1 cm; b:漂浮生态型典型的高度分枝形态, 比例尺2 cm; c:漂浮生态型罕见的无分枝形态, 比例尺2 cm |
 |
| 图 6 浒苔不同群体中最高分枝级数的分布占比 Fig. 6 Distribution percentage of top branching order in different populations of U. prolifera |
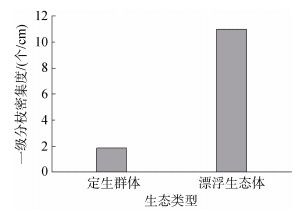 |
| 图 7 浒苔不同生态型的一级分枝密集度 Fig. 7 Primary branch intensity in different ecotypes of U. prolifera |
观察2016—2018连续3年多航次大范围采集的浒苔漂浮生态型样本, 发现高度分枝为其典型特征。但是, 在2016年6月中旬至7月上旬“科学三号”南黄海航次、以及6月下旬至7月上旬乘渔船执行的苏北浅滩近岸航次中, 均检出较为罕见的无分枝个体(图 5c), 且分子鉴定仍全部为漂浮生态型。为了调查其比例, 我们对两个航次各站位的样本, 分别统计了高度分枝与无分枝两种表型的生物量占比。结果如图 8所示, 无分枝个体主要分布在苏北近岸海域(32°40′—34°00′N、120°30′—121°45′E), 在各站位占比50%~100%, 向北主要延伸至35°N断面西侧, 最远到达36°N断面的一个站位。值得注意的是, 在2016年稍早的两个航次、以及2017、2018年航次中, 均未检出无分枝个体。
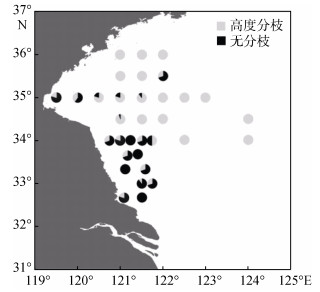 |
| 图 8 2016年6—7月航次漂浮浒苔高度分枝个体与无分枝个体的生物量占比 Fig. 8 Biomass ratio of highly branched and unbranched individuals of floating U. prolifera from June to July in 2016 |
分别选择浒苔漂浮生态型与定生浒苔样本, 均成功实现了生殖细胞的诱导形成与放散。对萌发后的藻体跟踪测定最高分枝级数与一级分枝密集度两个指标, 结果表明, 所有定生浒苔样本均未见分枝发育, 与其原藻体的表型一致, 分枝表型的可塑性并不突出。而漂浮生态型中, 随着藻体生长, 尽管一级分枝总数不断增加, 但一级分枝密集度基本保持恒定, 接近0.5个/cm, 仅为绿潮现场采集样本的约1/20(图 9)。当培养超过60 d时, 藻体长度大约20 cm, 藻体上仍罕见二级分枝, 分枝程度明显低于现场采集的漂浮浒苔样本, 同时也说明, 其分枝表型的可塑性同样强于定生浒苔。
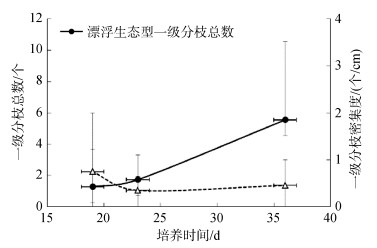 |
| 图 9 浒苔漂浮生态型培养条件下的分枝表型 Fig. 9 Branching phenotypes of floating ecotype of U. prolifera under culture conditions |
文献已广泛报导漂浮浒苔具有高度分枝, 较定生浒苔有明显的差异, 但多限于定性描述[10, 14-16]。也有个别研究尝试进行了量化描述, Gao等采集漂浮绿藻样本, 研究了实验室培养条件下, 温度和盐度对分枝的影响, 测量了单位主干长度的分枝数, 但研究材料未进行分子鉴定, 且缺少与定生浒苔的比较[21]。Hiraoka等开展黄海漂浮浒苔和日本定生浒苔的杂交实验, 使用了类似的量化指标, 但仅对杂交亲本进行了表征, 样本量极其有限[17]。
本实验对2016—2018连续三年绿潮中的漂浮浒苔进行了多航次、大范围的样本采集, 另外在山东、江苏、浙江沿海采集了多个定生浒苔群体, 基于多分子标记, 首先完成了对漂浮生态型和定生浒苔两类群体的鉴定, 在此基础上, 采用最高分枝级数和一级分枝密集度两个量化指标, 分别进行了测量与统计分析。两个量化指标均表明, 漂浮生态型较定生浒苔具有更高的分枝程度, 二者差异显著。需要指出的是, 很多仅达到二级分枝的漂浮浒苔个体, 均采集于绿潮中、后期, 藻体主干的末端多为明显的茬口, 提示是从更大藻体上断裂分离的, 因此原藻体应具有更高的分枝级数。
一级分枝密集度反应了主干发生初级分枝的能力, 而最高分枝级数则代表发生高级分枝的能力, 两个指标联用可以较全面量化表征藻体的分枝表型。浒苔的分枝与主干一样, 均为单层细胞管状, 漂浮浒苔高度分枝的表型可有效提高其比表面积, 我们推测除了可提升浮力、还能增加对海水中营养盐的吸收效率, 利于在绿潮早期于种间竞争中取得优势[26]。因此, 高度分枝的表型很可能是漂浮生态型的一种重要漂浮适应性特征。
统计分析结果还发现, 定生浒苔仅有无分枝或低分枝, 表型变化的幅度较小; 而漂浮生态型中, 既有无分枝, 也有高度分枝, 表型变化的幅度较大, 因此, 漂浮生态型分枝表型的可塑性同样明显强于定生浒苔。表型可塑性是指基于同一基因型在不同环境下产生不同表型的现象或能力[20]。需要指出的是, 本文的定生浒苔, 实质上包含了不同海域的多个群体, 相互间存在一定的遗传距离[3], 但即便如此, 整体上其分枝表型的可塑性仍十分有限; 与之不同的是, 尽管历年漂浮生态型样本的遗传性十分单一[3], 但表型差异极大, 说明其具有极强的可塑性。在2016年的较晚航次中, 区域性出现了无分枝的个体, 且主要分布在绿潮源头海域, 提示缺乏分枝可能不利于藻体的快速漂移。一般认为, 生物的表型可塑性与环境适应、物种进化和种群扩散密切相关[20]。Gao等研究发现, 漂浮浒苔通过分枝表型的调整, 可间接驱动相关生理生化指标的改变, 从而更好地适应环境因子的变化[21]。有理由推测, 漂浮生态型具有极强的分枝表型可塑性, 可能有助于其更好地适应漂浮过程中多变的海洋环境。
生物表型可塑性的呈现, 本质上是环境外因与遗传性内因共同作用的结果。大量研究已经证实, Ulva属绿藻的形态可塑性较为突出[19, 27-28], 藻体形态易受温度[21]、盐度[19, 29]、光照[30]、藻菌互作[31-32]等多种环境外因的影响。作为遗传性单一的漂浮生态型, 在自然条件下可检出无分枝的个体; 在人工培养条件下, 其分枝程度也发生明显退化, 这同样说明, 其分枝表型会受到环境外因的强烈影响。另一方面, 无论是野外现场、还是人工培养, 在相同环境条件下, 漂浮生态型的分枝程度及其可塑性均明显高于定生浒苔, 说明这两个方面的表型特征均存在明显的遗传基础。对浒苔漂浮生态型的分枝表型及其可塑性开展深入研究, 将有利于深刻理解其主导黄海绿潮的生物学机制。
4 结论本研究针对浒苔的分枝表型, 通过广泛采集漂浮浒苔与定生浒苔样本, 基于多标记分子鉴定以及分枝表型量化指标的应用与统计, 证实无论分枝程度还是分枝表型的可塑性, 浒苔漂浮生态型均显著强于定生浒苔, 提示这一特性可能与其主导黄海绿潮相关。上述研究可为后续浒苔形态与适应特征的深入研究提供形态学量化指标和重要理论依据。
| [1] |
Liu D Y, John K K, Xing Q G, et al. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China[J]. Marine Pollution Bulletin, 2009, 58(6): 888-895. DOI:10.1016/j.marpolbul.2009.01.013 |
| [2] |
Zhao J, Jiang P, Liu Z Y, et al. The Yellow Sea green tides were dominated by one species, Ulva (Enteromorpha) prolifera, from 2007 to 2011[J]. Chinese Science Bulletin, 2013, 58(19): 2298-2302. DOI:10.1007/s11434-012-5441-3 |
| [3] |
Zhao J, Jiang P, Qin S, et al. Genetic analyses of floating Ulva prolifera in the Yellow Sea suggest a unique ecotype[J]. Estuarine Coastal and Shelf Science, 2015, 163: 96-102. DOI:10.1016/j.ecss.2015.05.027 |
| [4] |
姜鹏, 赵瑾. 黄海绿潮浒苔漂浮生态型的发现与启示[J]. 海洋与湖沼, 2018, 49(5): 959-966. Jiang Peng, Zhao Jin. Identification of floating ecotype of Ulva prolifera: implication for the green tide in the Yellow Sea[J]. Oceanologia Et Limnologia Sinica, 2018, 49(5): 959-966. |
| [5] |
Luo M B, Liu F, Xu Z L. Growth and nutrient uptake capacity of two co-occurring species, Ulva prolifera and Ulva linza[J]. Aquatic Botany, 2012, 100: 18-24. DOI:10.1016/j.aquabot.2012.03.006 |
| [6] |
Wang Y, Wang Y, Zhu L, et al. Comparative studies on the ecophysiological differences of two green tide macroalgae under controlled laboratory conditions[J]. PLoS ONE, 2012, 7(8): e38245. DOI:10.1371/journal.pone.0038245 |
| [7] |
Wang Y, Liu F, Liu X F, et al. Comparative transcriptome analysis of four co-occurring Ulva species for understanding the dominance of Ulva prolifera in the Yellow Sea green tides[J]. Journal of Applied Phycology, 2019, 31(5): 3303-3316. DOI:10.1007/s10811-019-01810-z |
| [8] |
Fu M Z, Fan S L, Wang Z L, et al. Buoyancy potential of dominant green macroalgal species in the Yellow Sea's green tides, China[J]. Marine Pollution Bulletin, 2019, 140: 301-307. DOI:10.1016/j.marpolbul.2019.01.056 |
| [9] |
Lin A, Shen S D, Wang J W, et al. Reproduction diversity of Enteromorpha prolifera[J]. Journal of Integrative Plant Biology, 2008, 50(5): 622-629. DOI:10.1111/j.1744-7909.2008.00647.x |
| [10] |
Zhang X W, Wang H X, Mao Y Z, et al. Somatic cells serve as a potential propagule bank of Enteromorpha prolifera forming a green tide in the Yellow Sea, China[J]. Journal of Applied Phycology, 2010, 22(2): 173-180. DOI:10.1007/s10811-009-9437-6 |
| [11] |
Liu Q, Yu R C, Yan T, et al. Laboratory study on the life history of bloom-forming Ulva prolifera in the Yellow Sea[J]. Estuarine Coastal and Shelf Science, 2015, 163: 82-88. DOI:10.1016/j.ecss.2014.08.011 |
| [12] |
He Y, Ao Y, Yin Y, et al. Comparative transcriptome analysis between floating and attached Ulva prolifera in studying green tides in the Yellow Sea[J]. Algal Research-Biomass Biofuels and Bioproducts, 2019, 44: 101712. |
| [13] |
Zhang J H, Huo Y Z, Zhang Z L. Variations of morphology and photosynthetic performances of Ulva prolifera during the whole green tide blooming process in the Yellow Sea[J]. Marine Environmental Research, 2013, 92: 35-42. DOI:10.1016/j.marenvres.2013.08.009 |
| [14] |
Wang J F, Jiang P, Cui Y L, et al. Molecular analysis of green-tide-forming macroalgae in the Yellow Sea[J]. Aquatic Botany, 2010, 93(1): 25-31. DOI:10.1016/j.aquabot.2010.03.001 |
| [15] |
Pang S J, Liu F, Shan T F, et al. Tracking the algal origin of the Ulva bloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses[J]. Marine Environmental Research, 2010, 69(4): 207-215. DOI:10.1016/j.marenvres.2009.10.007 |
| [16] |
Liu F, Pang S J, Chopin T, et al. The dominant Ulva strain of the 2008 green algal bloom in the Yellow Sea was not detected in the coastal waters of Qingdao in the following winter[J]. Journal of Applied Phycology, 2010, 22(5): 531-540. DOI:10.1007/s10811-009-9489-7 |
| [17] |
Hiraoka M, Ichihara K, Zhu W R, et al. Culture and hybridization experiments on an Ulva clade including the Qingdao strain blooming in the Yellow Sea[J]. PLoS ONE, 2011, 6(5): e193711-6. |
| [18] |
吴青, 张建恒, 赵升, 等. 黄海绿潮漂浮浒苔对高光强胁迫生态适应机制研究[J]. 上海海洋大学学报, 2016, 25(1): 97-105. Wu Qing, Zhang Jianheng, Zhao Sheng, et al. An adjustment mechanism to high light intensity for free- floating Ulva in the Yellow Sea[J]. Journal of Shanghai Ocean University, 2016, 25(1): 97-105. |
| [19] |
Blomster J, Maggs C A, Stanhope M J. Molecular and morphological analysis of Enteromorpha intestinalis and E. compressa (Chlorophyta) in the British Isles[J]. Journal of Phycology, 1998, 34(2): 319-340. DOI:10.1046/j.1529-8817.1998.340319.x |
| [20] |
Pigliucci M. Evolution of phenotypic plasticity: where are we going now?[J]. Trends in Ecology & Evolution, 2005, 20(9): 481-486. |
| [21] |
Gao G, Zhong Z H, Zhou X H, et al. Changes in morphological plasticity of Ulva prolifera under different environmental conditions: A laboratory experiment[J]. Harmful Algae, 2016, 59: 51-58. DOI:10.1016/j.hal.2016.09.004 |
| [22] |
Leskinen K, Pamilo P. Evolution of the ITS sequences of ribosomal DNA in Enteromorpha (Chlorophyceae)[J]. Hereditas, 1997, 126(1): 17-23. |
| [23] |
Shimada S, Yokoyama N, Arai S, et al. Phylogeography of the genus Ulva (Ulvophyceae, Chlorophyta), with special reference to the Japanese freshwater and brackish taxa[J]. Journal of Applied Phycology, 2008, 20(5): 979-989. DOI:10.1007/s10811-007-9296-y |
| [24] |
臧润国, 蒋有绪. 热带树木构筑学[J]. 林业科学, 1998, 34(5): 112-119. Zang Runguo, Jiang Youxu. Review on the architecture of tropical trees[J]. Scientia Silvae Sinicae, 1998, 34(5): 112-119. DOI:10.3321/j.issn:1001-7488.1998.05.016 |
| [25] |
Dan A, Hiraoka M, Ohno M, et al. Observations on the effect of salinity and photon fluence rate on the induction of sporulation and rhizoid formation in the green alga Enteromorpha prolifera (Müller) J. Agardh (Chlorophyta, Ulvales)[J]. Fisheries Science, 2002, 68(6): 1182-1188. DOI:10.1046/j.1444-2906.2002.00553.x |
| [26] |
Wang S Y, Huo Y Z, Zhang J H, et al. Variations of dominant free-floating Ulva species in the source area for the world's largest macroalgal blooms, China: Differences of ecological tolerance[J]. Harmful Algae, 2018, 74: 58-66. DOI:10.1016/j.hal.2018.03.007 |
| [27] |
Bliding C. A critical survey of European taxa in Ulvales. Ⅱ: Ulva, Ulvaria, Monostroma, Kornmannia[J]. Botaniska Notiser, 1968, 121(4): 535-629. |
| [28] |
Blomster J, Hoey E M, Maggs C A, et al. Species- specific oligonucleotide probes for macroalgae: molecular discrimination of two marine fouling species of Enteromorpha (Ulvophyceae)[J]. Molecular Ecology, 2000, 9(2): 177-186. DOI:10.1046/j.1365-294x.2000.00850.x |
| [29] |
Reed R H, Russell G. Salinity fluctuations and their influence on "bottle brush" morphogenesis in Enteromorpha intestinalis (L.) Link[J]. British Phycological Journal, 1978, 13(2): 149-153. DOI:10.1080/00071617800650171 |
| [30] |
De Silva M W R N, Burrows E M. An experimental assessment of the status of the species Enteromorpha intestinalis (L.) Link and Enteromorpha compressa (L.) Grev[J]. Journal of the Marine Biological Association of the United Kingdom, 1973, 53(4): 895-904. DOI:10.1017/S0025315400022554 |
| [31] |
Matsuo Y, Imagawa H, Nishizawa M, et al. Isolation of an algal morphogenesis inducer from a marine bacterium[J]. Science, 2005, 307(5715): 1598. DOI:10.1126/science.1105486 |
| [32] |
Wichard T, Charrier B, Mineur F, et al. The green seaweed Ulva: a model system to study morphogenesis[J]. Frontiers in Plant Science, 2015, 6: 72. |
 2020, Vol. 44
2020, Vol. 44


