文章信息
- 张辉, 宋琳, 陈晓琳, 李鹏程. 2020.
- ZHANG Hui, SONG Lin, CHEN Xiao-lin, LI Peng-cheng. 2020.
- 土壤退化的原因与修复作用研究
- Study on the causes and remediation of soil degradation
- 海洋科学, 44(8): 147-161
- Marine Sciences, 44(8): 147-161.
- http://dx.doi.org/10.11759/hykx20191114001
-
文章历史
- 收稿日期:2019-11-14
- 修回日期:2020-03-19
2. 青岛科技大学 海洋科学与生物工程学院, 山东 青岛 266042;
3. 中国科学院大学, 北京 100049
2. College of Marine Science and Biological Engineering, Qingdao University of Science and Technology, Qingdao 266042, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
土壤退化意味着土壤生产力和环境调节能力的长期下降, 即土壤质量的下降。据统计, 退化土壤约占全球土地面积的24%[1], 目前, 土壤退化较为突出的问题为土壤盐渍化、土壤酸化、土壤板结和土壤重金属污染。
由于土壤盐渍化的影响, 目前可使用农田可能会减少50%[2], 土壤发生盐渍化后很难得到解决[3]; 酸性土壤约占全球可耕地总面积的50%, 而且这一比例正在逐渐增加[4-5]。当土壤中存在过多的氢离子时, 土壤的缓冲能力遭到破坏, 土壤的pH会显著降低, 土壤酸度的增加会引起土壤微生物的多样性、土壤的物理化学性质发生变化等, 继而引起农作物产量的降低; 土壤板结是指在人为耕作、机械碾压、植物根系穿插和动物穿行等外力作用下土壤孔隙和数量减少乃至结构遭到破坏、硬度增大的现象。土壤发生板结的主要原因是由于过多施用化肥使土壤发生明显的盐渍化和酸化, 导致土壤结构严重破坏, 从而引起土壤板结的发生; 过多的施用化肥不仅会对土壤结构产生影响, 而且会给土壤带来重金属污染, 由于生物体对钴、铜、锰、钼、镍、钒、锌等重金属的需求量很小, 过量的这些元素会对生物体和土壤产生危害。铅、镉、汞和砷金属被视为“主要威胁”, 在我国受重金属污染的耕地土壤面积接近2 000万公顷, 约占耕地总面积的20%[6], 土壤重金属污染的修复需要得到进一步的重视。
海洋生物资源丰富, 目前应用于土壤修复研究的主要有海洋微生物、海洋藻类和海洋生物多糖等。海洋微生物生活在表层海水、极地冰、热液喷口、深海、珊瑚礁和红树林等各种不同的海洋环境中, 由于环境的不同, 它们的生态作用也不同[7]。由于复杂的海洋环境, 海洋微生物的适应能力很强, 能够适应多种复杂的海洋环境。同时许多种类的细菌、真菌, 都能产生胞外多糖[8], 这些胞外多糖有利于改善土壤理化性质, 提高土壤质量[9], 因此利用海洋微生物修复土壤退化潜力无限; 藻类主要包括微藻和大藻, 海藻在土壤中能够为植物提供矿物质营养, 促进植物的生长发育, 同时海藻还能改善土壤的理化性质, 是一种很好的土壤改良剂; 世界范围内渔业废弃物每年超过2 000万吨, 相当于海洋渔业捕捞总量的25%[10-11]。虾蟹壳是常见的渔业废弃物, 其中虾蟹壳中含有丰富的甲壳素, 占比约为20%~30%, 壳聚糖是甲壳素的衍生物之一, 由于壳聚糖的天然来源和独特的生物相容性、生物降解性、无毒性和金属离子螯合性等特性, 在土壤修复中研究较多。
2 土壤退化原因及影响 2.1 土壤盐渍化根据粮农组织土地和营养管理服务(2008年), 全球超过6%的土地, 即超过8亿公顷的土地遭受盐碱化或盐渍化的影响(表 1)[22]。母质、地形特征、气候条件和人为因素对土壤盐渍化的形成和演化起着重要作用[12-13]。由自然因素引起的盐渍化称为原生盐渍化, 人为因素引起的盐渍化称为次生盐渍化。比如松嫩平原发生原生盐渍化的原因主要是由于地表或者地下径流带来丰富的矿物质, 以及高度矿化的地下水盐分表聚所引起[14]; 滨海盐渍化发生的原因主要包括海水的长期侵入和土壤表面盐水的蒸发积累[15]; 黄河三角洲由于海拔较低、淡水供应不足, 导致此地区易受海水的影响[16-17], 靠近海岸线比较近的土壤易受海水的影响。除此之外, 原生盐渍化发生的典型原因是由于干旱、半干旱地带降水不足、蒸发量大, 使含盐量较高的地下水通过毛细管作用到达土壤表层并不断累积, 虽然原生盐渍化发生的过程较为缓慢, 但是盐渍化的程度正在不断扩大。不合理的灌溉和过量的使用化肥等人为因素引起的土壤盐渍化属于次生盐渍化。全世界因灌溉引进的土地盐渍化而造成的作物生产损失每年约为110亿美元[18], 特别是对于干旱地区的灌溉农业。由于灌溉引起的土壤盐渍化会对农作物产量和区域农业生产产生显著不良影响[19], 在水资源匮乏的地区, 利用废水灌溉虽能暂时缓解干旱的问题, 但是增加了土壤中的含盐量, 再加上干旱地区的高蒸发量以及排水受阻等情况使灌溉农业土壤盐渍化越来越严重。土壤中过量的使用化肥也是引起土壤次生盐渍化的重要原因[20]。过多使用化肥后, 土壤中K+、Na+、Ca2+、Mg2+、NO3–、HCO3–、SO42–离子和全盐含量都显著增加, 施入过多的氮肥是温室发生次生盐渍化的主要原因, 这些氮肥超过了植物利用的极限, 绝大部分肥料都积累在土壤中, 给土壤带来过多的盐分[21]。其中次生盐渍化土壤中以NO3–、SO42–、Ca2+离子为主, 这与使用的化肥种类有关, 但是原生盐渍化的典型特征是土壤中含有过多的Na+、Cl–, 因此原生和次生盐渍化土壤中的特征离子存在差别。在设施大棚中, 同样存在温度较高水分蒸发量大的问题, 过多的盐分在土壤表层积累, 这和原生盐渍化产生的原因具有相似之处。
土壤盐渍化会给土壤、植物、微生物带来一系列的影响。当土壤中的Na+、K+含量较高时, 土壤很难形成团粒结构, 同时土壤较为坚硬, 影响了土壤中的透气透水性。高价离子如Ca2+、Mg2+等离子能够将带有负电荷的土壤团粒结合在一起, 使土壤产生絮凝, 有利于土壤孔隙的稳定以及空气和水的流动[23]。土壤盐渍化对植物的影响主要表现在渗透胁迫、离子毒性、营养失衡。土壤中过多的盐分会导致土壤中的渗透压增加, 影响了植物的正常吸水, 产生生理性干旱, 甚至死亡[24]。高Na+会造成植物缺钾, 同时高Na+和Mg2+离子的对植物细胞造成结构损伤, 阻碍光合作用, 降低叶绿素的产生[25]。除了阳离子外, 高浓度的氯离子会干扰光合作用, 对植物产生毒性[26]。土壤盐渍化会提高微生物细胞外的渗透压, 细胞会失去水分[27-28]。许多研究表明, 盐度降低了微生物生物量和微生物活性, 改变了微生物群落结构[29], 直接影响土壤的生物化学活性及土壤养分的组成与转化。
2.2 土壤酸化土壤酸化的原因包括自然因素和人为因素。自然因素包括SO2以及氮氧化物的酸沉降[30], 人为因素可能加重这一影响。土壤酸化的主要原因是由于过量施用氮肥(比如硫酸铵、硝酸铵、尿素等)导致[31-33], 微生物的硝化作用[33]以及尿素的水解都会引入H+。基本过程如下:
| $ \mathrm{NH}_{4}^{+}+\mathrm{O}_{2}=\mathrm{NO}_{3}^{-}+2 \mathrm{H}^{+}+\mathrm{H}_{2} \mathrm{O} $ | (1) |
| $ \mathrm{NH}_{3}+2 \mathrm{O}_{2}=\mathrm{H}^{+}+\mathrm{NO}_{3}^{-}+\mathrm{H}_{2} \mathrm{O} $ | (2) |
| $ \mathrm{CO}\left(\mathrm{NH}_{2}\right)_{2}+4 \mathrm{O}_{2}=2 \mathrm{H}^{+}+2 \mathrm{NO}_{3}^{-}+\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2} $ | (3) |
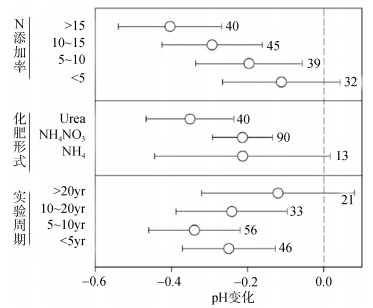
如图 1所示当施氮量大于5 gm–2 yr–1时, 随着施氮量的增加, 土壤pH显著降低, 不同形式的氮对土壤酸化的影响不同, 尿素和硝酸铵的过量使用会使土壤pH显著降低。同时土壤的pH会随着氮肥施入时间的延长而呈现先降低后增高的现象, 氮肥施入土壤20年后, 土壤的pH变化已不再显著[34]。尿素在我国应用较多, 有很多研究表明, 尿素的过多施用会明显降低土壤pH[35-36], 同时植物吸收何种形式的氮源也会与植物释放到土壤中的离子形式息息相关[37]。当植物吸收NH4+和N2时, 为了平衡体内的电荷将会向土壤中释放出H+, 同时土壤中的NH4+和H+离子可以取代土壤胶体表面的碱基阳离子(Ca2+、Mg2+、K+、Na+)。当降雨或者灌溉, 碱基阳离子也会随之淋溶, NO3–离子含量较高会加速碱基阳离子的损失, 进一步增加了土壤的酸化[38-40]。氮肥在土壤中发生硝化或者水解后会引入过多的H+, 这是土壤酸化的直接原因, 但是根本原因是由于过多的氮肥导致土壤缓冲能力的下降, 土壤本身失去了自我调节的功能, 继而引发了一系列的不良影响。
土壤的pH会影响土壤组分的表面电荷, 继而影响土壤组分对溶质的吸附, 也会影响土壤中金属的形态、金属与有机物的络合、沉淀/溶解反应、氧化还原反应、流动性和浸出、胶体的分散以及微量金属的生物利用度[41]。土壤酸度较高时也会影响某些营养元素的有效性, 比如pH较低时, 溶出的铁铝会固定土壤中的磷, 导致磷的生物有效性降低, 同时Ca2+大量淋溶, 会导致土壤结构破坏, 从而导致土壤的透气透水性降低, 土壤易发生板结[42]; 酸化土壤中, 植物生长会受到Al3+, Mn2+, H+离子的限制[43]。土壤溶液中含有过多的铝离子会限制植物根细胞的分裂和伸长, 导致植物根变得短而粗。当植物体吸收过多的铝之后, 植物甚至会中毒死亡; 除了铝之外, 锰离子是对植物毒性较大的金属[44], 主要特征有植物茎发育不良、坏死、皱褶、出现斑点等[45]。土壤pH过低时可以直接限制植物根的生长[46], 同时H+会快速流入细胞, 使质膜电位下降, 引起细胞质酸化, 从而使细胞损伤[47]。高浓度的氢离子会使微生物细胞膜破坏、酶产量降低和繁殖受限等[48]。真菌比细菌更容易在酸性条件下生长[49], 土壤酸度的增加会改变微生物的群落结构, 导致嗜酸性微生物增加。由于土壤真菌和细菌在分解者群落中扮演不同的角色, 较低的土壤pH值会改变这些关系, 影响了植物对养分的吸收[50]。
2.3 土壤板结土壤板结是土壤退化的一种具体表现, 重机械使用产生的土壤压实作用、不合理的耕作、化肥使用过多引起的酸化、盐渍化等都会引起土壤结构破坏, 导致土壤发生硬化板结[51-53]。
由于集约化农业的快速发展, 频繁的使用重型机械进行耕作会对土壤造成严重的压实作用。土壤压实会降低土壤的孔隙度, 导致径流入渗率下降, 土壤易被侵蚀损失。在压实后的土壤中, 土壤团聚体形成较为困难, 同时传统耕作会破坏土壤团聚体, 降低了土壤有机质含量以及微生物的活动, 从而降低了土壤团聚体的稳定性指数, 土壤侵蚀程度高易发生硬化板结现象[54-55]。
过多的施用氮肥会引起土壤酸化、土壤盐渍化[20, 34], 土壤酸化后H+以及化肥中的NH4+会置换出碱基离子, 同时氮肥本身带有的以及微生物硝化作用引入的过多的硝酸根也会加速土壤中高价碱基离子的淋溶损失, 其中Ca2+、Mg2+等高价金属能够促进土壤团聚体的形成, 有利于土壤结构的稳定。高价盐基离子流失后, 土壤团聚体形成较为困难, 土壤结构遭到破坏, 土壤易发生板结[53]; 过多钾肥中的K+也会置换高价的阳离子, 但是K+没有桥键功能, 导致土壤团聚体的分散, 土壤易发生板结。过多的磷肥中含有的P2O5水解后会导致土壤酸化, 磷酸根也会和高价金属离子形成难溶盐, 导致土壤的板结; 土壤中的有机质能够将土壤团聚体粘合起来, 使土壤团聚体更加的稳定, 同时有机质能够为微生物提供C和N源, 促进微生物的活性, 当有机质缺乏后, 土壤结构稳定性降低, 土壤易发生板结[56]。
土壤板结后土壤容重会显著增加, 土壤孔隙会减少, 这使得土壤的透气透水性降低, 土壤容易出现局部缺氧的状况[57], 同时土壤大团聚体的比例、团粒水稳性也显著降低。当降雨或者灌溉时, 土壤团粒结构易破坏, 此时有机质成分缺少了保护措施, 很容易被表面径流冲走流失, 导致土壤的肥力降低; 土壤板结导致土壤硬度增加, 限制了植物根系的生长, 影响了植物根对水分和营养的吸收。比如土壤板结会影响植物对钾和磷的吸收, 对植物吸收磷的影响较大, 因为磷在土壤中移动性很小, 植物根的生长被抑制后, 植物吸收的磷素也必然降低[58]; 板结土壤会影响体型稍大的生物如线虫、螨虫、跳虫和蝇幼虫, 像蚯蚓、白蚁、蚂蚁和甲虫这样的穴居动物可以更好地保护自己, 但仍然会受到负面影响。由于水在板结土壤中渗透较慢, 可能会出现长期的饱和状态, 不利于好氧微生物的生长, 某些厌氧细菌释放的硫化氢, 对植物具有一定的毒害作用, 板结土壤也影响了有机物的分解, 微生物活性也受到了抑制。
2.4 土壤重金属污染在集约农业中, 由于植物营养需求量高, 化肥补充也较为频繁, 除了提供营养元素外, 过量使用化肥给土壤带来了较多的重金属, 比如镉、铅、镍、汞等[59-60]; 过去在农业和园艺中使用的杀虫剂和杀菌剂大部分都是基于含有铜、汞、锰、铅或锌的化合物, 比如波尔多液、噻菌铜、砷酸铅等[59]; 大量的生物固体材料(畜禽肥料、堆肥、城市污泥等)在土地上的应用也带来了镉、铬、铜、铅、汞、镍、硒、钼、锌、铊、锑等重金属[61]; 研究表明:在亚洲和非洲的一些城市, 以污水灌溉为基础的农业产量占城市蔬菜供应的50%[62], 虽然废水中的金属浓度通常较低, 但长期灌溉会导致重金属在土壤中的积累; 金属矿石的开采加工、纺织、制革、石油化工产品、制药等工业活动中也会造成土壤重金属污染[63]。重金属污染率统计信息见表 2, 调查范围954 510 km2~ 1 184 393 km2, 占据中国可耕地面积(1 353 850 km2)的70.50%~87.48%, 该数据覆盖了大部分的农用田地。数据表明中国农田重金属污染中, 镉的污染率最高, 为7.75%, 远远高于其他重金属, 这也说明中国农田最严重的是镉污染[64]。
| 重金属 | 研究数量 | 调查面积/km2 | 样本数量 | 污染率/% |
| Cu | 379 | 978 619 | 104 314 | 3.01 |
| Pb | 510 | 1 113 075 | 126 385 | 0.96 |
| Zn | 328 | 954 510 | 95 213 | 2.09 |
| Cd | 481 | 1 184 393 | 127 422 | 7.75 |
| As | 374 | 984 386 | 119 830 | 1.54 |
| Ni | 192 | 978 356 | 82 746 | 2.88 |
| Cr | 385 | 1 099 987 | 116 261 | 0.60 |
| Hg | 355 | 1 098 668 | 116 800 | 3.65 |
不同的重金属对植物的影响不同, 其中镉、汞、铬、铅对植物危害最为严重。植物暴露于高水平的镉会导致植物的光合作用、水分和养分吸收的减少, 在镉含量高的土壤中生长的植物表现出明显的损伤症状, 表现为萎黄病、生长抑制、根尖褐变, 直至死亡[65-66]; 高水平的汞离子通过触发活性氧的产生, 干扰线粒体活动, 诱导氧化反应; 过量的铬会抑制植物生长, 造成幼叶萎黄、营养失衡、顶叶萎蔫和根系损伤[67]。铬还会影响植物的光合作用、水分关系和矿物质营养吸收; 过量的铅对植物的形态、生长和光合作用产生不利影响。高含量的铅还会抑制酶的活性, 造成水的不平衡, 改变膜的通透性, 干扰矿物质的营养吸收[68]; 随着重金属浓度的增加, 土壤中大多数酶的活性显著降低, 酶活性的降低可能是酶与重金属相互作用的直接结果。重金属污染严重时可以抑制土壤微生物活性, 影响土壤细菌、真菌、放线菌等微生物种群的数量, 产生不同的微生物群落模式, 威胁土壤的生态系统功能[69-70]。
3 土壤退化的修复方法 3.1 土壤盐渍化的修复土壤盐渍化最简单的方法就是利用大量的淡水冲走多余可溶盐分[71], 然而此方法并不适合修复干旱或半干旱缺水地区的盐渍化。深耕能够将表面积累的盐分转移到深层土壤[72], 但是深耕的措施会严重破坏土壤的结构, 同时也会增加土壤水分的蒸发, 可能会加重土壤盐渍化[73]。
石膏、矿渣磷石膏等是化学改良方法中常用的物质[74-75], 其作用机制主要是利用石膏中含量较高的Ca2+替代土壤胶体上的Na+, 从而增加Na+的浸出, 同时Ca2+能够促进土壤团聚体的形成, 提高土壤的阳离子交换能力, 但是石膏物质并不能改良土壤的次生盐渍化, 因为次生盐渍化土壤中的优势离子主要包括Ca2+、Mg2+、NO3–、SO42–等, Na+含量较低。
在土壤中添加有机材料(植物残体、粪肥、堆肥、食品加工废料等)已成为一种普遍改良盐渍化土壤的做法。有机材料的加入能够增加土壤有机质含量和土壤的肥力。如表 3所示为几种有机质加入后土壤电导率的变化, 根据表 3可知不同有机改良剂加入土壤后, 灌溉可引起土壤电导率明显的降低, 没有灌溉或灌溉较少的土壤电导率变化不大甚至出现增加的情况, 在未灌溉的田间试验下, 只有长时间的持续加入有机改良剂, 土壤盐渍化才可以实现明显的改善[82]。
| 土壤种类、实验条件 | 有机材料 | 初始和最终EC/dsm–1 | 实验周期和浸出条件 | 其他效果 |
| 盐碱土、黏壤土、田间实验 | 棉花残渣堆肥家禽粪肥 | EC1:5(初)=9.1, EC1: 5(终)=2.5 |
5年, 没有灌溉 | 有机改良剂的长期使用改善了土壤的物理、化学和生物特性, 特别是高剂量的有机改良剂; 堆肥(稳定的有机质来源)对土壤理化性质的影响更大; 粪肥提供的碳源不稳定[76] |
| 盐碱土、黏壤土、实验室研究 | 绿色垃圾、生物固体材料堆肥 | ECe(初)=23.3, ECe(终)=4.2 |
30天, 浸出液EC为0.96 dsm–1 | 堆肥的使用增加了土壤阳离子交换量, 降低了可交换性钠的比例, 但是淡水对盐的浸出作用较大[77] |
| 盐渍土、黏壤土、盆栽实验 | 橄榄皮和棉花渣堆肥、家禽粪肥 | ECe(初)=13, ECe(终)=1.6 |
250天, 自来水灌溉, EC为0.9 dsm–1 | 自来水的浇灌是土壤电导率降低的主要原因。堆肥和粪肥的使用有利于阳离子交换能力的能加, 钠吸附比的降低[78] |
| 盐渍土、砂壤土、培养实验 | 城市固体废弃物堆肥、城市二级污水污泥 | EC1: 2.5(初)=7.5, EC1: 2.5(终)=8.5 |
70天, 没有灌溉 | 高剂量使用堆肥会增加土壤电导率和重金属含量[79] |
| 盐碱土、砂壤土、盆栽实验 | 木薯废料堆肥 | ECe(初)=4.26, ECe(终)=3.03 |
84天, 灌溉 | 堆肥能够提供营养离子, 比如Ca2+、K+以及C源, 阳离子可以替代土壤胶体上的Na+, 也增加了微生物的活性[80] |
| 盐渍土、粉壤土、盆栽实验 | 棕榈废料、城市固体废物 | EC1: 5(初)=5.13, EC1: 5(终)=5.99(低剂量) EC1: 5(终)=7.58(中剂量) EC1: 5(终)=8.1(高剂量) |
3个月, 当需要的时候用自来水灌溉 | 高剂量的堆肥加入会对微生物产生负面影响, 同时有毒成分的检测也是堆肥使用前的必要环节[81] |
利用耐盐植物来修复土壤盐渍化已在世界范围内广泛应用, 比如能够积累盐分的植物包括Atriplex nummularia Lindl、Atriplex patula、Chenopodium album、Phragmites australis、Salicornia europaea、Salicornia maritima、Distichlis spicata、Spartina pectinata、Spartina anglica、Limonium vulgare、Armeria maritima、Glaux maritima[83-89]等。耐盐植物主要通过两种作用机制来修复土壤盐渍化:一种是耐盐植物能够将土壤中的盐分积累到体内, 从而降低土壤盐分; 另一种是植物能够将吸收的盐分通过叶子分泌到体外, 然后可能通过风的作用将盐分传递到更远的地方[90]。由于盐渍化土壤分布广泛, 盐生植物不一定能够适应当地的气候, 因此选择当地适合的盐生植物很有必要, 同时目前研究集中在盐生植物对土壤中Na+、Cl–的积累, 耐盐植物对于次生盐渍化的修复还需进一步的研究。
3.2 土壤酸化的修复迄今为止, 已经提出了很多方法来缓解土壤酸化问题, 主要包括添加石灰、工业副产品、有机废物和作物残体等。石灰化是改良酸性土壤的常见做法, 但表面施用石灰后对深层土壤酸化的修复效果不佳[91]。据报道工业副产品(如石膏、碱性矿渣和赤泥)会增加土壤的pH值、阳离子交换能力(CEC), 但是这些工业副产品中可能含有较高含量的重金属, 造成土壤的污染[92]。有机废弃物可以提高酸性土壤的pH值, 这主要是由于有机废物中的有机酸阴离子可以吸附土壤中过多的H+[93]。生物炭是碱性的, 因此可以作为改良剂来改善土壤酸化, 提高酸性土壤的质量[94]。如表 4所示为目前常见土壤酸化改良剂的修复效果及主要缺点[117]。
| 主要的土壤改良剂 | 主要影响 | 主要缺点 |
| 石灰 | 土壤pH增加, 酸度降低[95-96] | 地表施用对底层土影响有限[97-98]运输和机械成本高[98-99] |
| 工业副产品 | 土壤pH增加, 酸度降低[100-101]能够降低铝的毒性[102-103] | 具有重金属污染的风险[108] |
| 植物残体、有机废物 | 土壤pH增加, 酸度降低[104-105]能够降低铝的毒性[106]增加土壤有机碳[107] | 与生物炭相比, 碳动力学相对较快[109-110]有机废物会带来重金属污染的风险[111]有机废物可能会导致土壤富营养化[112] |
| 生物炭(大豆秸秆、 玉米秸秆、水稻秸秆等) |
土壤pH增加, 酸度降低[113-114]增加/改变微生物的数量和多样性[115-116] | 生产成本较高[117]重金属和多环芳烃污染风险增加[118-119]性质具有高变性[120] |
土壤有机质的含量可以反应土壤的肥力, 常用的增加有机质的方法有秸秆还田、增施有机肥、实现合理的轮作等[56]。由于土壤有机质容重较低, 土壤中含有较多有机质时可以有效降低土壤容重[121]。同时有机质可以将团聚体粘合在一起, 能够促进土壤团聚体的形成[122], 有利于土壤结构的稳定, 从而缓解土壤板结的问题。
深耕翻土是缓解土壤板结的重要措施。深耕的措施能够打破紧实的地下土层, 增加水的渗透以及根系的生长[123], 但是松土之后的土壤特别容易受到随后的机械、放牧动物的影响而再次压实[124], 同时深耕会破坏土壤团聚体, 造成土壤结构的破坏, 从长远来看并不能彻底解决土壤板结。
3.4 土壤重金属污染的修复已有很多文献综述了土壤重金属污染的修复方法, 其主要包括物理、化学、生物措施来对土壤重金属进行修复。土壤污染范围较小但污染严重的地区一般采用非原位处理的方法, 比如通过重型机械挖掘并运送土壤到处理地点进行冲洗或焚烧等[125], 但是此方法操作较为复杂, 并且成本较高。近年来许多研究表明, 生物炭可以吸附土壤中重金属元素, 对土壤重金属污染具有较强的缓解作用。同时生物炭本身显碱性, 可以产生石灰类物质同样的效应, 从而降低土壤中重金属的生物有效性[126]。
化学方法主要是利用化学物质(硫化物, 硼氢化钠, 黄原酸纤维素等)对重金属进行还原或沉淀, 从而降低重金属的生物活性或者迁移率[127], 但是加入的物质是否对土壤产生其它的负面影响需要进一步的研究。
生物措施主要包括植物和微生物对土壤重金属的修复, 植物修复主要包括两种机制, 一种是植物本身能够积累重金属, 然后收获季节对植物进行处理就可以达到移除重金属的效果。另一种是植物可以通过根际分泌某些物质来降低重金属的迁移率和生物活性[128-130], 但是植物需要很长时间的修复才能达到明显的效果, 而且植物修复措施也会受到植物种类、土壤类型、气候等的影响, 所以选择何种植物进行重金属的修复也很重要。微生物可以通过呼吸、发酵和共代谢利用各种有毒化合物[131], 同时微生物能够在重金属污染的土壤中存活很长时间, 从而有足够的时间进行生物积累、生物矿化、生物吸附和生物转化[127]。细菌、藻类和真菌生物吸附剂都可用于去除土壤中的重金属污染物, 比如真菌可以利用本身较大的比表面积以及较高的代谢活动来改变土壤中重金属的动态行为[132], 但藻类比细菌、真菌吸附剂有更好的修复效果[133]。微生物修复比其他方法更加便宜、环保、高效, 但是仍需要拓展相应功能菌的来源。
总而言之, 土壤退化的修复仍需要进一步的研究, 其中海洋中有丰富的生物资源, 海洋生物修复土壤退化近年来引起越来越多的关注。
3.5 海洋生物资源对土壤退化的修复研究 3.5.1 海洋微生物对土壤退化的修复由于各种各样的自然和人为活动, 重金属污染是最重要的环境问题之一。尽管人们提出了各种方法从环境中去除这些有害金属, 但都具有一定的局限性, 收效甚微[134]。海洋微生物为重金属污染的解决提供了一条有效途径。Vibrio harveyi是海洋中常见的一种细菌, 其每克干的细胞能够吸附23.3 mg的金属镉[135]; 海洋细菌Enterobacter cloaceae具有重金属螯合的特性, 能够通过分泌胞外多糖将重金属从污染环境中清除。在100 mg/L的重金属浓度下, 这种细菌可以螯合高达65%的镉、20%的铜和8%的钴[136]; Rhodobium marinum和Rhodobacter sphaeroides这两种细菌也能通过生物吸附和转化从环境中移除铜、锌、镉和铅[137]。
但是目前关于海洋微生物对重金属的吸附作用研究主要集中在污水的处理, 海洋微生物在土壤修复中的研究还较少, 主要是由于土壤中较为复杂的环境。为了能够让更多有特性的海洋细菌应用到复杂的土壤环境中, 许多研究者在原来基因组中插入外源功能基因以提高其适应性和功能性。有研究将金属硫蛋白的相关基因插入到合适的载体中, 并在海洋细菌中转化, 增加了其对土壤重金属修复的可能性[138]。也有将海洋不动杆菌和酵母菌运用到土壤中, 来进行重金属污染和盐渍土的修复。但是并不是通过海洋细菌直接对重金属进行吸附或者转化, 而是通过和能够吸附重金属的植物联合进行土壤重金属和盐渍化的修复。利用海洋细菌发酵液中含有的生物表面活性剂将土壤中的重金属进行增溶、增流, 提高了植物吸收重金属的效率, 有效解决了化学强化剂易残留、难降解、生物毒性等弊端[139-140]。目前, 直接将海洋微生物用于土壤退化的修复方面研究较少。但是海洋中微生物资源丰富, 在海洋这种特殊的生长环境中, 使其具有很多特殊的生理活性, 将其应用于土壤退化的修复将具有广阔的应用前景。
3.5.2 海洋藻类对土壤退化的修复目前, 已有报道利用海藻生物质作为吸附剂, 成功地去除镉、铅等重金属离子[141], 同时海藻成分的宏观结构有利于其作为生物吸附材料加工使用[142]。以绿藻、红藻和褐藻为原料, 制备了去除毒性铬的混合材料, 主要是由于海藻表面多糖的官能团参与了吸附[143]。也有报道Kappaphycus alvarezii和Eucheuma denticulatum海藻对Cd2+的吸附[144]。以上研究主要是海藻应用于污水中重金属的去除, 也有少数研究将海藻资源应用于土壤重金属污染的修复。研究表明海藻酸盐与土壤中的重金属离子结合形成高分子量的复合体, 同时能够保持土壤水分, 改善团聚结构, 海洋藻类的聚阴离子特性在土壤重金属污染修复中具有重要的应用价值[145-146]。有研究表明海藻肥可以作为土壤重金属的钝化剂, 能够通过沉淀、扩散、离子交换、表面吸附等一系列的方法降低镉在土壤中的活性, 同时海藻肥还可以改变土壤粒度的分级, 使大团聚体的比例升高, 有效固定了金属镉的迁移, 从而控制了镉的有效性[147]。
海藻应用到土壤中可以在一定程度上修复土壤的板结。因为海藻的使用会增加土壤中可交换钙和镁的含量, 提高了土壤团聚体的稳定性和总孔隙度, 改善了土壤的透气透水性, 降低了土壤的容重, 有利于土壤板结的修复[148]。
海藻资源除了应用于土壤重金属污染、土壤板结的修复之外, 在土壤酸化的修复方面也有研究。海藻生物炭是指在生物质热化学分解过程中形成的固体物质, 由于生物炭价格低廉, 对环境友好, 具有广泛的应用[149]。海藻生物炭不同于木质纤维素生物炭, 在海藻生物炭中C的含量很低, 但是N的含量却很高, 大部分海藻生物炭中C/N < 20, 表明海藻生物炭能直接向土壤生物提供可利用氮。海藻生物炭显碱性, pH值均在7.6~11.2之间, 因此海藻生物炭有利于改良土壤酸化的问题[150-151]。
3.5.3 壳聚糖对土壤退化的修复 3.5.3.1 壳聚糖对土壤重金属的修复壳聚糖作为一种良好的螯合剂, 能够将土壤中的重金属进行固定, 降低了重金属的生物活性。有研究对比了壳聚糖、EDTA、柠檬酸钠三种螯合剂对土壤铜和镍的螯合能力。结果表明三种螯合剂对铜和镍的的螯合能力为壳聚糖 > EDTA > 柠檬酸钠, 当壳聚糖螯合剂的pH在3~3.5范围内, 对铜和镍的螯合效果最佳[152]。
壳聚糖衍生物也可以降低土壤中的重金属的生物有效性。当硫代氨基甲酸壳聚糖加入土壤后, 拟南芥对镉的吸收降低了50%[153]。有研究对比了经过钼、铁、过磷酸钙、磷酸二氢钙改性的壳聚糖和壳聚糖颗粒对土壤中锌的影响, 结果表明钼改性的壳聚糖处理后, 植物茎中锌的积累量最少; 只用壳聚糖颗粒时, 茎部锌的积累量最多; 改性壳聚糖比壳聚糖颗粒的比表面积、阳离子交换能力高, 因此对土壤中锌的络合能力强, 这可能是导致植物对锌吸收减少、重金属固定增强的主要原因[154]。
除了对壳聚糖进行改性, 也有研究将壳聚糖和其他物质进行复配, 从而提高对土壤重金属的修复作用。有研究将壳聚糖和生物炭按照不同的浓度混合, 结果表明壳聚糖处理从低浓度到高浓度, 以及生物炭和壳聚糖的混合物在高浓度都显著降低了茄子根、芽和果实中镍、镉、钴、铬和铅的浓度, 特别是高浓度的生物碳和壳聚糖混合时产生的效果最明显[155]。壳聚糖和枯草芽孢杆菌混合也可以增强土壤重金属污染的修复能力。与单独壳聚糖处理相比, 混合之后钝化重金属的能力更强, 两者之间产生一种协同作用。壳聚糖可以作为微生物的碳源和氮源, 壳聚糖的加入促进了微生物在土壤中的生长、胶结和代谢活动, 微生物代谢产生的胞外多糖也能固定土壤中的重金属, 从而降低了重金属在作物中的累积[156]。
3.5.3.2 壳聚糖对土壤板结的修复壳聚糖加入土壤后会改变土壤的理化性质, 使土壤的总孔隙度增加。有研究表明, 在黄棕壤和潮土中加入壳聚糖后, 总孔隙度分别比对照增加了0.47%~1.10%和0.70%~1.18%。在种植蔬菜的土壤中效果更加明显, 总孔隙度增加了0.81%~2.39%。壳聚糖加入土壤的时间越长, 孔隙度增加的比例越大, 同时土壤的保水能力和通气状况也有所改善。除此之外, 壳聚糖的加入也能够增加土壤毛管孔隙的比例, 从而改善土壤板结[157]。
也有研究壳聚糖类水凝胶在土壤中的应用。壳聚糖溶于稀酸后会形成凝胶, 由于凝胶的胶结作用会有利于土壤团聚体的粘合, 有利于土壤结构的稳定。但是使用的酸性溶剂会加重土壤的酸化, 同时壳聚糖水凝胶在土壤中的性质也会受到土壤含水量的影响, 当土壤含水量饱和时, 壳聚糖水凝胶可能不再起作用[158]。壳聚糖和合成高分子的共聚物能够增强对土壤修复的效果。当壳聚糖和丙烯酰胺接枝共聚水凝胶加入土壤后, 土壤的容重减小, 孔隙度增加, 土壤保水能力增加。这说明壳聚糖类物质的加入有利于土壤板结的修复, 壳聚糖是非常有潜力的土壤改良剂[159]。
3.5.3.3 壳聚糖对土壤盐渍化的修复当壳聚糖溶液加入土壤后, 能够增大土壤孔隙度, 同时促进了固氮菌, 放线菌, 纤维分解菌, 乳酸细菌等有益微生物的生长, 并且能够抑制有害微生物的生长。这主要是因为壳聚糖加入后, 土壤理化性质的改善能够为有益菌提供合适的生存环境, 使微生物的数量增加, 从而加速了微生物对矿物质和有机质的分解利用, 有利于土壤盐分的消耗。同时壳聚糖在土壤中也能够对Ca2+、Mg2+等高价离子进行螯合固定, 也有效促进了土壤盐渍化的改良, 但是这方面的文献还较少, 需要进一步深化研究[160]。
4 结语土壤退化是指土地生产能力的丧失, 表现为土壤肥力的丧失、土壤生物多样性的丧失和退化。在过去40年里, 世界上三分之一的可耕地因为各种退化原因而无法耕种。土壤盐渍化、酸化、板结和重金属污染都是常见的土壤退化的类型, 目前土壤的退化已经严重威胁到人类生存的安全性。虽然目前对土壤退化的解决办法很多, 但是仍然存在着一些问题, 比如说修复周期长、修复效果差和修复成本较高等。海洋是一个复杂的生态环境, 包含着丰富的生物资源, 海洋微生物具有快速适应复杂环境的特性, 在土壤退化的生物修复中, 海洋微生物是很有潜力的资源; 海洋藻类在土壤中的应用历史悠久, 海藻能够改善土壤理化性质, 为生物提供营养, 促进植物的生长发育, 并提高其抗逆活性; 壳聚糖及其衍生物都能很好的应用在土壤退化的修复, 并且效果显著。但是大都集中在土壤重金属的修复, 或者土壤理化性质的改良。综上所述, 海洋生物资源在土壤退化修复中的研究还较少, 如何拓展海洋生物资源在土壤退化修复中的应用, 以及如何加强海洋生物资源对土壤退化修复的效果需要进一步的研究。
| [1] |
Ball B C, Batey T, Munkholm L J. Field assessment of soil structural quality-A development of the Peerlkamp test[J]. Soil Use and Management, 2007, 23: 329-337. |
| [2] |
Mahajan S, Tuteja N. Cold, salinity and drought stresses: an overview[J]. Archives of Biochemistry and Biophysics, 2005, 444(2): 139-158. |
| [3] |
Cuevas J, Daliakopoulos I N, del Moral F, et al. A review of soil improving cropping systems for soil salinization[J]. Agronomy, 2019, 9(6): 295. |
| [4] |
Vonuexküll H, Mutert E. Global extent, development and economic impact of acid soils[J]. Plant Soil, 1995, 171: 1-15. |
| [5] |
Kochian L V, Piñeros M A, Liu J, et al. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance[J]. Annual Review of Plant Biology, 2015, 66: 571-598. |
| [6] |
韦朝阳, 陈同斌. 重金属超富集植物及植物修复技术研究进展[J]. 生态学报, 2001, 21(7): 1196-1203. Wei Zhaoyang, Chen Tongbin. Hyperaccumulators and phytoremediation of heavy metal contaminated soil: a review of studies in China and abroad[J]. Acta Ecologica Sinica, 2001, 21(7): 1196-1203. |
| [7] |
Webster N, Hill R. Vulnerability of Marine Microbes on the Great Barrier Reef to Climate change[M]//Johnson J E, Marshall P A. Climate Change and the Great Barrier Reef. Australia: Great Barrier Reef Marine Park Authority and Australian Greenhouse Office, 2007: 96-120.
|
| [8] |
Manivasagan P, Kim S K. Extracellular polysaccharides produced by marine bacteria[J]. Advances in Food and Nutrition Research, 2014, 72(80): 1043-4526. |
| [9] |
Guezennec J. Deep-sea hydrothermal vents: a new source of innovative bacterial exopolysaccharides of biotechnological interest[J]. Journal of Industrial Microbiology and Biotechnology, 2002, 29(4): 204-208. |
| [10] |
Kim S K, Mendis E. Bioactive compounds from marine processing by-products: a review[J]. Food Research International, 2006, 39: 383-393. |
| [11] |
Rustad T. Utilization of marine by-products[J/OL]. https://www.researchgate.net/publication/228773956.
|
| [12] |
Liu Q, Cui B, Yang Z. Dynamics of the soil water and solute in the sodic saline soil in the Songnen Plain, China[J]. Environmental Earth Sciences, 2009, 59(4): 837-845. |
| [13] |
Wang L, Seki K, Miyazaki T, et al. The causes of soil alkalinization in the Songnen Plain of Northeast China[J]. Paddy and Water Environment, 2009, 7(3): 259-270. |
| [14] |
Shang Z B, Gao Q, Dong M. Impacts of the grazing on the alkalinized-salinized meadow steppe ecosystem in the Songnen Plain, China-a simulation study[J]. Plant Soil, 2003, 249: 237-251. |
| [15] |
黄亚捷.土壤属性空间变异与灌区排盐空间配置研究[D].北京: 中国农业大学, 2017. Huang Yajie. Spatial variability of soil properties and spatial sllocation of salt discharge areas for irrigation districts[D]. Beijing: China Agricultural University, 2017. |
| [16] |
Guan Y, Liu G, Liu Q, et al. The study of salt affected soils in the Yellow River Delta based on remote sensing[J]. Journal of Remote Sensing, 2001, 5(1): 46-52. |
| [17] |
Guan Y, Liu G. Remote sensing detection of dynamic variation of the saline land in the Yellow River Delta[J]. Remote Sensing Land and Resources, 2003, 15(2): 19-22. |
| [18] |
Chesworth W. Management of irrigation-induced salt- affected soils[J]. Food and Agricultural Organization, 2008, 611-611. |
| [19] |
Li J, Pu L, Han M, et al. Soil salinization research in China: Advances and prospects[J]. Journal of Geographical Sciences, 2014, 24(5): 943-960. |
| [20] |
Han J, Shi J, Zeng L, et al. Effects of nitrogen fertilization on the acidity and salinity of greenhouse soils[J]. Environmental Science and Pollution Research, 2014, 22(4): 2976-2986. |
| [21] |
Han J, Luo Y, Yang L, et al. Acidification and salinization of soils with different initial pH under greenhouse vegetable cultivation[J]. Journal of soils and sediments, 2014, 14(10): 1683-1692. |
| [22] |
FAO. Saline Soils and Their Management[EB/OL]. http://www.fao.org/3/x5871e/x5871e04.htm.
|
| [23] |
Seelig B D, Richardson J L. Salinity and sodicity in North Dakota soils[J]. North Dakota State University Extension, 2000, 1-16. |
| [24] |
Deinlein U, Stephan A B, Horie T, et al. Plant salt tolerance mechanisms[J]. Trends in Plant Science, 2014, 19(6): 371-379. |
| [25] |
郭全恩.土壤盐分离子迁移及其分异规律对环境因素的响应机制[D].咸阳: 西北农林科技大学, 2010. Guo Quanen. The response mechanism of soil salinity transfer and diversity rule to environment factor[D]. Xianyang: Northwest A & F University, 2010. |
| [26] |
Bernstein L. Effects of salinity and sodicity on plant growth[J]. Annual Review of Phytopathology, 1975, 13(1): 295-312. |
| [27] |
Oren A. Microbial life at high salt concentrations: phylogenetic and metabolic diversity[J]. Saline Systems, 2008, 4(1): 2. |
| [28] |
Kempf B, Bremer E. Uptake and synthesis of compatible solutes as microbial stress responses to high-osmolality environments[J]. Archives of Microbiology, 1998, 170: 319-330. |
| [29] |
Andronov E E, Petrova S N, Pinaev A G, et al. Analysis of the structure of microbial community in soils with different degrees of salinization using T-RFLP and real-time PCR techniques[J]. Eurasian Soil Science, 2012, 45(2): 147-156. |
| [30] |
Vitousek P M, Aber J D, Howarth R W, et al. Human alteration of the global nitrogen cycle: sources and consequences[J]. Ecological Application, 1997, 7: 737-750. |
| [31] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. |
| [32] |
Hartmann A A, Barnard R L, Marhan S, et al. Effects ofdrought and N-fertilization on N cycling in two grassland soils[J]. Oecologia, 2013, 171: 705-717. |
| [33] |
Cai Z, Wang B, Xu M, et al. Nitrification and acidification from urea application in red soil (Ferralic Cambisol) after different long-term fertilization treatments[J]. Soils Sediments, 2014, 14: 1526-1536. |
| [34] |
Tian D, Niu S. A global analysis of soil acidification caused by nitrogen addition[J]. Environmental Research Letters, 2015, 10(2): 024019. |
| [35] |
Schroder J L, Zhang H L, Girma W, et al. Soil acidification from long-term use of nitrogen fertilizers on winter wheat[J]. Soil Science Society of America Journal, 2011, 75: 957-964. |
| [36] |
Tang C X, Conyers M K, Nuruzzaman M, et al. Biological amelioration of subsoil acidity through managing nitrate uptake by wheat crops[J]. Plant Soil, 2011, 338: 383-397. |
| [37] |
Perrin A S, Probst A, Probst J L, et al. Impact of nitrogenous fertilizers on carbonate dissolution in small agricultural catchments: Implications for weathering CO2 uptake at regional and global scales[J]. Geochimica et Cosmochimica Acta, 2008, 72: 3105-3123. |
| [38] |
Matschonat G, Matzner E. Soil chemical properties affecting NH4+ sorption in forest soils[J]. Journal of Plant Nutrition and Soil Science, 1996, 159(5): 505-511. |
| [39] |
Rothwell J J, Futter M N, Dise N B. A classification and regression tree model of controls on dissolved inorganic nitrogen leaching from european forests[J]. Environmental Pollution, 2008, 156: 544-552. |
| [40] |
Gundersen P, Schmidt I K, Raulund-Rasmussen K. Leaching of nitrate from temperate forests-effects of air pollution and forest management[J]. Environmental Reviews, 2006, 14: 1-57. |
| [41] |
Adriano D C. Trace Elements in Terrestrial Environments(2nd edition)[M]. USA: Springer-Verlag New York, 2001: 29-59.
|
| [42] |
Alva A K, Edwards D G, Asher C J, et al. Effects of phosphorus/aluminum molar ratio and calcium concentration on plant response to aluminum toxicity[J]. Soil Science Society of America Journal, 1986, 50(1): 133-137. |
| [43] |
Kidd P S, Proctor J. Effects of aluminium on the growth and mineral composition of Betula pendula Roth[J]. Journal of Experimental Botany, 2000, 51: 1057-1066. |
| [44] |
Foy C, Flemming A, Schwartz J. Opposite aluminum and manganese tolerances in two wheat varieties[J]. Agronomy Journal, 1973, 65: 123-126. |
| [45] |
Alam S, Kamei S, Kawai S. Phytosiderophere release from manganese-induced iron deficiency in barley[J]. Journal of Plant Nutrition, 2000, 23: 1193-1207. |
| [46] |
Yang J L. Aluminium resistance requires resistance to acid stress: a case study with spinach that exudates oxalate rapidly when exposed to Al stress[J]. Journal of Experimental Botany, 2005, 56: 1197-1203. |
| [47] |
Babourina O, Hawkins B, Lew R, et al. K+ transport by Arabidopsis root hairs at low pH[J]. Australian Journal of Plant Physiology, 2001, 28: 635-641. |
| [48] |
Birgander J, Rousk J, Olsson P A. Comparison of fertility and seasonal effects on grassland microbial communities[J]. Soil Biology & Biochemistry, 2014, 76: 80-89. |
| [49] |
Rousk J, Bååth E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal, 2010, 4(10): 1340-1351. |
| [50] |
Rousk J, Brookes P, Bååth E. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization[J]. Applied and Environmental Microbiology, 2009, 75(6): 1589-1596. |
| [51] |
Głąb T. Effect of soil compaction and N fertilization on soil pore characteristics and physical quality of sandy loam soil under red clover/grass sward[J]. Soil and Tillage Research, 2014, 144: 8-19. |
| [52] |
Figueiredo P G, Bicudo S J, Chen S, et al. Effects of tillage options on soil physical properties and cassava-dry-matter partitioning[J]. Field Crops Research, 2017, 204: 191-198. |
| [53] |
韩江培.设施栽培条件下土壤酸化与盐渍化耦合发生机理研究[D].杭州: 浙江大学, 2015. Han Jiangpei. The mechanisms for the coexistence of soil acidification and salinization under greenhouse cultivation[D]. Hangzhou: Zhejiang University, 2015. |
| [54] |
Shah A N, Tanveer M, Shahzad B, et al. Soil compaction effects on soil health and cropproductivity: an overview[J]. Environmental Science and Pollution Research, 2017, 24(11): 10056-10067. |
| [55] |
Wiermann C, Werner D, Horn R, et al. Stress/strain processes in a structured unsaturated silty loam Luvisol under different tillage treatment in Germany[J]. Soil and Tillage Research, 2000, 53: 117-128. |
| [56] |
安晶.东北地区棕壤和黑土旱田土壤板结机理研究[D].沈阳: 沈阳农业大学, 2016. An Jing. Soil compaction mechanisms of black soil and brown earth in the Northeast of China[D]. Shenyang: Shenyang Agricultural University, 2016. |
| [57] |
Schnurr-Pütz S, Drake H L, Kirsten K. Compaction of soil by logging machinery favours occurrence of prokaryotes[J]. FEMS Microbiology Ecology, 2006, 58(3): 503-516. |
| [58] |
Dotan M S, Dowdy R H, Voorhees W B, et al. Corn phosphorus an potassium uptake in response to Soil compaction[J]. Agronomy Journal, 1992, 84(4): 639-642. |
| [59] |
Greenland D J, Hayes M H B. The Chemistry of Soil Process[M]. New York: Wiley, 1981: 593-620.
|
| [60] |
Raven P H, Berg L R, Johnson G B. Environment(2nd edition)[M]. New York: Saunders College Publishing, 1998: 444-446.
|
| [61] |
Basta N T, Ryan J A, Chaney R L. Trace element chemistry in residual-treated soil: key concepts and metal bioavailability[J]. Journal of Environmental Quality, 2005, 34(1): 49-63. |
| [62] |
Bjuhr J. Trace metals in soils irrigated with waste water in a periurban area downstream Hanoi City, Vietnam[J]. Slu/dept of Soil Sciences, 2007, 79. |
| [63] |
DeVolder P S, Brown S L, Hesterberg D, et al. Metal bioavailability and speciation in a wetland tailings repository amended with biosolids compost, wood ash, and sulfate[J]. Journal of Environmental Quality, 2003, 32(3): 851-864. |
| [64] |
Zhang X, Zhong T, Liu L, et al. Impact of soil heavy metal pollution on food safety in china[J]. PLoS One, 2015, 10(8): e0135182. |
| [65] |
Wójcik M, Tukiendorf A. Phytochelatin synthesis and cadmium localization in wild type of Arabidopsis thaliana[J]. Plant Growth Regulation, 2004, 44(1): 71-80. |
| [66] |
Mohanpuria P, Rana N K, Yadav S K. Cadmium induced oxidative stress influence on glutathione metabolic genes of Camellia sinensis (L.) O. Kuntze[J]. Environmental Toxicology, 2007, 22: 368-374. |
| [67] |
Scoccianti V, Crinelli R, Tirillini B, et al. Uptake and toxicity of Cr (Cr3+) in celery seedlings[J]. Chemosphere, 2006, 64(10): 1695-1703. |
| [68] |
Sharma P, Dubey R S. Lead toxicity in plants[J]. Brazilian Journal of Plant Physiology, 2005, 17: 35-52. |
| [69] |
Perezdemora A, Burgos, Madejon, et al. Microbial community structure and function in a soil contaminated by heavy metals: effects of plant growth and different amendments[J]. Soil Biology & Biochemistry, 2006, 38(2): 327-341. |
| [70] |
Dian Chu. Effects of heavy metals on soil microbial community[J]. Earth and Environmental Science, 2018, 113: 012009. |
| [71] |
Ravindran K C, Venkatesan K, Balakrishnan V, et al. Restoration of saline land by halophytes for Indian soils[J]. Soil Biology and Biochemistry, 2007, 39(10): 2661-2664. |
| [72] |
Qi Z, Feng H, Zhao Y, et al. Spatial distribution and simulation of soil moisture and salinity under mulched drip irrigation combined with tillage in an arid saline irrigation district, northwest China[J]. Agricultural Water Management, 2018, 201: 219-231. |
| [73] |
Government of Saskatchewan. Deep Tillage[EB/OL]. https://www.saskatchewan.ca/business/agriculture-natural-resources-and-industry/agribusiness-farmers-and-ranchers/crops-and-irrigation/soils-fertility-and-nutrients/deep-tillage.
|
| [74] |
Gupta R K, Abrol I. Salt-affected soils: their reclamation and management for crop production[J]. Environment, 1990, 33: 566-589. |
| [75] |
Hulugalle N, Weaver T, Ghadiri H, et al. Changes in soil properties of an eastern Australian vertisol irrigated with treated sewage effluent following gypsum application[J]. Land Degradation & Development, 2006, 17(5): 527-540. |
| [76] |
Tejada M, Garcia C, Gonzalez J L, et al. Use of organic amendment as a strategy for saline soil remediation: influence on the physical, chemical and biological properties of soil[J]. Soil Biology and Biochemistry, 2006, 38(6): 1413-1421. |
| [77] |
Chaganti V N, Crohn D M, Šimůnek J. Leaching and reclamation of a biochar and compost amended saline-sodic soil with moderate SAR reclaimed water[J]. Agricultural Water Management, 2015, 158: 255-265. |
| [78] |
Walker D J, Bernal M P. The effects of olive mill waste compost and poultry manure on the availability and plant uptake of nutrients in a highly saline soil[J]. Bioresource Technology, 2008, 99(2): 396-403. |
| [79] |
Lakhdar A, Scelza R, Scotti R, et al. The effect of compost and sewage sludge on soil biologic activities in salt affected soil[J]. Journal of Soil Science and Plant Nutrition, 2010, 10(1): 40-47. |
| [80] |
Oo A N, Iwai C B, Saenjan P. Soil properties and maize growth in saline and nonsaline soils using cassava-industrial waste compost and vermicompost with and without earthworms[J]. Land Degradation and Development, 2015, 26(3): 300-310. |
| [81] |
Ouni Y, Lakhdar A, Scelza R, et al. Effects of two composts and two grasses on microbial biomass and biological activity in a salt-affected soil[J]. Ecological Engineering, 2013, 60: 363-369. |
| [82] |
Leogrande R, Vitti C. Use of organic amendments to reclaim saline and sodic soils: a review[J]. Arid Land Research and Management, 2018, 1-21. |
| [83] |
Silva Y J A, Freire M B G, Lopes E A P, et al. Atriplex nummularia Lindl. as alternative for improving salt- affected soils conditions in semiarid environments: a field experiment[J]. Chilean Journal of Agricultural Research, 2016, 76(3): 343-348. |
| [84] |
Krishnapillai M, Ranjan R S. Evaluating the phytoremediation potential of Atriplex patula on salt contaminated soil[J]. Canadian Society for Engineering in Agricultural, Food, and Biological Systems, 2005, 5-52. |
| [85] |
Hamidov A, Beltrao J, Neves A, et al. Apocynum lancifolium and Chenopodium album-potential species to remediate saline soils[J]. Wseas Transactions on Environment and Development, 2007, 7(3): 123-128. |
| [86] |
McSorley K A, Rutter A, Cumming R, et al. Chloride accumulation vs chloride excretion: phytoextraction potential of three halophytic grass species growing in a salinized landfill[J]. Science of The Total Environment, 2016, 572: 1132-1137. |
| [87] |
Khan M A, Boër B, Özturk M, et al. Sabkha Excosystem[M]. Switzerland: Springer, Cham, 2016: 261-273.
|
| [88] |
Sargeant M, Tang C, Sale P. The ability of Distichlis spicata to grow sustainably within a saline discharge zone while improving the soil chemical and physical properties[J]. Australian Journal of Soil Research, 2008, 46(1): 37-44. |
| [89] |
Rozema J, Gude H, Pollak G. An ecophysiological study of the salt secretion of four halophytes[J]. The New Phytologist, 1981, 88(2): 201-217. |
| [90] |
Litalien A, Zeeb B. Curing the earth: A review of anthropogenic soil salinization and plant-based strategies for sustainable mitigation[J]. Science of the Total Environment, 2019, 698: 134235. |
| [91] |
Tang C, Weligama C, Sale P. Subsurface soil acidification in farming systems: its possible causes and management options[J]. Molecular Environmental Soil Science, 2013, 389-412. |
| [92] |
Li J Y, Wang N, Xu R K, et al. Potential of industrial byproducts in ameliorating acidity and aluminum toxicity of soils under tea plantation[J]. Pedosphere, 2010, 20(5): 645-654. |
| [93] |
Whalen J K, Chang C, Clayton G W, et al. Cattle manure amendments can increase the pH of acid soils[J]. Soil Science Society of America Journal, 2000, 64(3): 962-966. |
| [94] |
Lehmann J, Joseph S. Biochar for Environmental Management: Science, Technology and Implementation(2nd edition)[M]. London and New York: Earthscan from Routledge, 2015: 527-529.
|
| [95] |
Haynes R, Naidu R. Influence of lime, fertilizer and manure applications on soil organic matter content and soil physical conditions: a review[J]. Nutrient Cycling in Agroecosystems, 1998, 51: 123-137. |
| [96] |
Schreffler A, Sharpe W. Effects of lime, fertilizer, and herbicide on forest soil and soil solution chemistry, hardwood regeneration, and hardwood growth following shelterwood harvest[J]. Forest Ecology and Management, 2003, 177: 471-484. |
| [97] |
Conyers M, Mullen C, Scott B. Long-term benefits of limestone applications to soil properties and to cereal crop yields in southern and central New South Wales[J]. Australian Journal of Experimental Agriculture, 2003, 43(1): 71-78. |
| [98] |
Scott B, Conyers M, Poile G, et al. Subsurface acidity and liming affect yield of cereals[J]. Australian Journal of Agricultural Research, 1997, 48(6): 843-854. |
| [99] |
Conyers M, Heenan D, Poile G, et al. Influence of dry land agricultural management practices on the acidification of a soil profile[J]. Soil and Tillage Research, 1996, 37: 127-141. |
| [100] |
Li J Y, Liu Z D, Zhao A Z, et al. Microbial and enzymatic properties in response to amelioration of an acidic ultisol by industrial and agricultural by-products[J]. Journal of Soils Sediments, 2014, 14(2): 441-450. |
| [101] |
Masud M M, Li J Y, Xu R K. Application of alkaline slag and phosphogypsum for alleviating soil acidity in an ultisol profile: a short-term leaching experiment[J]. Journal of Soils and Sediments, 2015, 15: 365-373. |
| [102] |
Garrido F, Lllera V, Vizcayno C, et al. Evaluation of industrial byproducts as soil acidity amendments: chemical and mineralogical implications[J]. European Journal of Soil Science, 2003, 54(2): 411-422. |
| [103] |
Li J Y, Wang N, Xu R K, et al. Potential of industrial byproducts in ameliorating acidity and aluminum toxicity of soils under tea plantation[J]. Pedosphere, 2010, 20: 645-654. |
| [104] |
Wang Y, Liu X, Butterly C, et al. pH change, carbon and nitrogen mineralization in paddy soils as affected by Chinese milk vetch addition and soil water regime[J]. Journal of Soils and Sediments, 2013, 13: 654-663. |
| [105] |
Wang Y, Tang C, Wu J, et al. Impact of organic matter addition on pH change of paddy soils[J]. Journal of Soils and Sediments, 2013, 13: 12-23. |
| [106] |
Haynes R, Mokolobate M. Amelioration of Al toxicity and P deficiency in acid soils by additions of organic residues: a critical review of the phenomenon and the mechanisms involved[J]. Nutrient Cycling in Agroecosystems, 2001, 59: 47-63. |
| [107] |
Martens D A. Plant residue biochemistry regulates soil carbon cycling and carbon sequestration[J]. Soil Biology and Biochemistry, 2000, 32(3): 361-369. |
| [108] |
Yi J, Lv L, Liu G. Research on soil acidification and acidic soil's melioration[J]. Journal of South China University of Tropical Agriculture, 2006, 1: 23-28. |
| [109] |
Herath H, Camps-Arbestain M, Hedley M, et al. Experimental evidence for sequestering C with biochar by avoidance of CO2 emissions from original feedstock and protection of native soil organic matter[J]. GCB Bioenergy, 2015, 7(3): 512-526. |
| [110] |
Whitman T, Pepe-Ranney C, Enders A, et al. Dynamics of microbial community composition and soil organic carbon mineralization in soil following addition of pyrogenic and fresh organic matter[J]. The ISME, 2016, 10(12): 2918-2930. |
| [111] |
Nicholson F, Chambers B, Williams J, et al. Heavy metal contents of livestock feeds and animal manures in England and Wales[J]. Bioresource Technology, 1999, 70(1): 23-31. |
| [112] |
Zhang H L, Dao T H, Basta N T, et al. Remediation techniques for manure nutrient loaded soils[DB/OL]. https://elibrary.asabe.org/abstract.asp?aid=20263.
|
| [113] |
Yuan J H, Xu R K, Qian W, et al. Comparison of the ameliorating effects on an acidic ultisol between four crop straws and their biochars[J]. Journal of Soils and Sediments, 2011, 11: 741-750. |
| [114] |
Xu R K, Zhao A Z, Yuan J H, et al. pH buffering capacity of acid soils from tropical and subtropical regions of China as influenced by incorporation of crop straw biochars[J]. Journal of Soils and Sediments, 2012, 12: 494-502. |
| [115] |
Gomez J, Denef K, Stewart C, et al. Biochar addition rate influences soil microbial abundance and activity in temperate soils[J]. European Journal of Soil Science, 2014, 65(1): 28-39. |
| [116] |
Rutigliano F, Romano M, Marzaioli R, et al. Effect of biochar addition on soil microbial community in a wheat crop[J]. European Journal of Soil Biology, 2014, 60: 9-15. |
| [117] |
Dai Z, Zhang X, Tang C, et al. Potential role of biochars in decreasing soil acidification-A critical review[J]. Science of the Total Environment, 2017, 581-582: 601-611. |
| [118] |
Uchimiya M, Wartelle L H, Klasson K T, et al. Influence of pyrolysis temperature on biochar property and function as a heavy metal sorbent in soil[J]. Journal of Agricultural and Food Chemistry, 2011, 59(6): 2501-2510. |
| [119] |
Freddo A, Cai C, Reid B J. Environmental contextualisation of potential toxic elements and polycyclic aromatic hydrocarbons in biochar[J]. Environmental Pollution, 2012, 171: 18-24. |
| [120] |
Enders A, Hanley K, Whitman T, et al. Characterization of biochars to evaluate recalcitrance and agronomic performance[J]. Bioresource Technology, 2012, 114: 644-653. |
| [121] |
Carter M R. Soil quality for sustainable land management: organic matter and aggregation interactions that maintain soil functions[J]. Agronomy Journal, 2002, 94: 38-47. |
| [122] |
Zhang H. Organic matter incorporation affects mechanical properties of soil aggregates[J]. Soil and Tillage Research, 1994, 31: 263-275. |
| [123] |
Bateman J C, Chanasyk D S. Effects of deep ripping and organic matter amendments on Ap horizons of soil reconstructed after coal strip-mining[J]. Canadian Journal of Soil Science, 2001, 8: 113-120. |
| [124] |
Spoor G. Application of mole drainage in the solution of subsoil management problem[C]//Jayawardane N S, Stewart B A. Subsoil Management Techniques. Chelsea: Lewis Publishers, 1994: 67-109.
|
| [125] |
Banks M K, Schwab A P. Remediation and stabilization of soils contaminated by lead resulting from the removal of paint from bridges[R]. West Lafayette: Purdue University, 2006.
|
| [126] |
Woldetsadik D, Drechsel P, Keraita B, et al. Effects of biochar and alkaline amendments on cadmium immobilization, selected nutrient and cadmium concentrations of lettuce (Lactuca sativa) in two contrasting soils[J]. Springerplus, 2016, 5(1): 397. |
| [127] |
Sodango T H, Li X, Sha J, et al. Review of the spatial distribution, source and extent of heavy metal pollution of soil in China: Impacts and mitigation approaches[J]. Journal of Health and Pollution, 2018, 8(17): 53-70. |
| [128] |
Manara A. Plant responses to heavy metal toxicity[J]. Plants and Heavy Metals, 2012, 27-53. |
| [129] |
Önal E, Özbay N, Yargis A, et al. Performance evaluation of the biochar heavy metal removal produced from tomato factory waste[J]. Progress in Exergy, Energy, and the Environment, 2014, 733-740. |
| [130] |
Park J H, Choppala G K, Bolan N S, et al. Biochar reduces the bioavailability and phytotoxicity of heavy metals[J]. Plant Soil, 2011, 348: 439-451. |
| [131] |
Ayangbenro S A, Babalola O. A new strategy for heavy metal polluted environments: a review of microbial biosorbents[J]. International Journal of Environmental Research and Public Health, 2017, 14(1): 94. |
| [132] |
Torma G A. Remediation processes for heavy metals contaminated soils[R]. United States: AMROT International, 1999.
|
| [133] |
Mustapha M U, Halimoon N. Microorganisms and biosorption of heavy metals in the environment: a review paper[J]. Journal of Microbial & Biochemical Technology, 2015, 7(5): 253-256. |
| [134] |
Wuana R A, Okieimen F E. Heavy metals in contaminated soils: a review of sources, chemistry, risks and best available strategies for remediation[J]. ISRN Ecology, 2011, 1-20. |
| [135] |
Abd-Elnaby H, Abou-Elela G M, EI-Sersy N A. Cadmium resisting bacteria in Alexandria Eastern Harbor (Egypt) and optimization of cadmium bioaccumulation by Vibrio harveyi[J]. African Journal of Biotechnology, 2011, 10(17): 3412-3423. |
| [136] |
Iyer A, Mody K, Jha B. Biosorption of heavy metals by a marine bacterium[J]. Marine Pollution Bulletin, 2005, 50(3): 340-343. |
| [137] |
Panwichian S. Removal of heavy metals by exopolymeric substances produced by resistant purple non sulphur bacteria isolated from contaminated shrimp ponds[J/OL]. http://www.ejbiotechnology.info/index.php/ejbiotechnology/article/view/v14n4-2/1327.
|
| [138] |
Chen W, Bruhlmann F, Richins R D, et al. Engineering of improved microbes and enzymes for bioremediation[J]. Current Opinion in Biotechnology, 1999, 10(2): 137-141. |
| [139] |
葛利云, 邓欢欢, 李少君, 等.一种海洋细菌联合植物修复重金属污染盐碱土壤的方法: CN108723070A[P]. 2018-11-02. Ge Liyun, Deng Huanhuan, Li Shaojun, et al. A method for remediation of heavy metal contaminated saline soil by marine bacteria in combination with plants: CN108723070A[P]. 2018-11-02. |
| [140] |
葛利云, 邓欢欢, 李少君, 等.一种海洋酵母菌联合植物修复重金属污染盐碱土壤的方法: CN108311532A[P]. 2018-07-24. Ge Liyun, Deng Huanhuan, Li Shaojun, et al. A method for remediation of heavy metal contaminated saline soil by marine yeast in combination with plants: CN108311532A[P]. 2018-07-24. |
| [141] |
Kumar V V, Kaladharan P. Biosorption of metals from contaminated water using seaweed[J]. Current Science, 2006, 90(9): 1263-1267. |
| [142] |
Vieira R H, Volesky B. Biosorption: a solution to pollution[J]. International microbiology, 2000, 3(1): 17-24. |
| [143] |
Abirami S, Srisudha S, Gunasekaran P. Comparative study of chromium biosorption using brown, red and green macroalgae[J]. International Journal of Biological & Pharmaceutical Research, 2013, 4(2): 115-129. |
| [144] |
Kang O L, Nazaruddin R, Musa A. Cadmium (Ⅱ) biosorption onto seaweed (Kappaphycus alvarezii and Eucheuma denticulatum) waste biomass: equilibrium and mechanism studies[J]. Middle-East Journal of Scientific Research, 2012, 11(7): 867-872. |
| [145] |
Metting B, Rayburn W R, Reynaud P A. Algae and Human Affairs[M]. Cambridge: Cambridge University Press, 1988: 335-370.
|
| [146] |
Blunden G. Agricultural uses of seaweeds and seaweed extracts[C]//Guiry M D, Blunden G. Seaweed Resources in Europe: Uses and Potential. New York: John Wiley & Sons, 1991: 65-81.
|
| [147] |
王萌, 陈世宝, 李杉杉, 等. 实验室与田间条件下骨炭粉与海藻肥对镉污染土壤修复效果评价[J]. 地学前缘, 2019, 26(6): 82-88. Wang Meng, Chen Shibao, Li Shanshan, et al. Evaluation on the remediation efficiency of Cd polluted soil by bone charcoal and seaweed fertilizer in pot and field experiments[J]. Earth Science Frontiers, 2019, 26(6): 82-88. |
| [148] |
Lopez-Mosquera M E, Pazos P. Effects of seaweed on potato yields and soil chemistry[J]. Biological Agriculture & Horticulture, 1997, 14(3): 199-205. |
| [149] |
Lehmann J, Joseph S. Biochar for Environmental Management: Science, Technology and Implementation(2nd edition)[M]. London and New York: Earthscan from Routledge, 2015: 1-6.
|
| [150] |
王典, 张祥, 姜存仓, 等. 生物质炭改良土壤及对作物效应的研究进展[J]. 中国生态农业学报, 2012, 20(8): 963-967. Wang Dian, Zhang Xiang, Jiang Cuncang, et al. Biochar research advances regarding soil improvement and crop response[J]. Chinese Journal of Ecological Agriculture, 2012, 20(8): 963-967. |
| [151] |
Roberts D A, Paul N A, Dworjanyn S A, et al. Biochar from commercially cultivated seaweed for soil amelioration[J]. Scientific Reports, 2015, 5(1): 9665. |
| [152] |
Wei Jiang, Tao Tao, Zhiming Liao. Removal of heavy metal from contaminated soil with chelating agents[J]. Open Journal of Soil Science, 2011, 1: 70-76. |
| [153] |
Zheng Yin, Jingjing Cao, Zhen Li, et al. Reducing the bioavailability of cadmium in contaminated soil by dithiocarbamate chitosan as a new remediation[J]. Environmental Science and Pollution Research, 2015, 22(13): 9668-9675. |
| [154] |
Tripathi N, Choppala G, Singh R S. Evaluation of modified chitosan for remediation of zinc contaminated soils[J]. Journal of Geochemical Exploration, 2017, 182: 180-184. |
| [155] |
Turan V, Khan S A, Mahmood-ur-Rahman, et al. Promoting the productivity and quality of brinjal aligned with heavy metals immobilization in a wastewater irrigated heavy metal polluted soil with biochar and chitosan[J]. Ecotoxicology and Environmental Safety, 2018, 161: 409-419. |
| [156] |
Cuero R G. Enhanced heavy metal immobilization bu a bacterial-chitosan complex in soil[J]. Biotechnology Letters, 1996, 18(5): 511-514. |
| [157] |
刘金凤.壳聚糖对蔬菜产量品质、根系生长及土壤理化性状的影响[D].武汉: 华中农业大学, 2006. Liu Jinfeng. Effects of chitosan on vegetable yield and quality, root growth and soil physicochemical properties[D]. Wuhan: Huazhong Agricultural University, 2006. |
| [158] |
Hataf N, Ghadir P, Ranjbar N. Investigation of soil stabilization using chitosan biopolymer[J]. Journal of Cleaner Production, 2018, 170: 1493-1500. |
| [159] |
Basuki K T, Swantomo D, Sanyoto N T, et al. Characterization of chitosan-acrylamide hydrogels as soil conditioner[J]. Advanced Materials Research, 2015, 1112: 414-417. |
| [160] |
郭春霞, 沈根祥, 钱晓雍, 等.一种利用农业废弃物作为改良剂修复盐渍化土壤的方法. CN103597925A[P]. 2014-02-26. Guo Chunxia, Shen Genxiang, Qian Xiaoyong, et al. A method for repairing salinized soil with agricultural waste as an amendment. CN103597925A[P]. 2014-02-26. |
 2020, Vol. 44
2020, Vol. 44