文章信息
- 刘宏, 陈晓琳, 孙雨豪, 刘松, 邢荣娥, 王雪芹, 李鹏程. 2020.
- LIU Hong, CHEN Xiao-lin, SUN Yu-hao, LIU Song, XING Rong-e, WANG Xue-qin, LI Peng-cheng. 2020.
- 蜈蚣藻多糖的降解及其体外抗氧化活性研究
- Degradation of sulfated polysaccharides from Grateloupia filicina and their antioxidant activities in vitro
- 海洋科学, 44(8): 186-196
- Marine Sciences, 44(8): 186-196.
- http://dx.doi.org/10.11759/hykx20191017001
-
文章历史
- 收稿日期:2019-10-17
- 修回日期:2019-12-21
2. 海洋药物与生物制品功能实验室, 青岛海洋科学与技术国家实验室, 山东 青岛 266237;
3. 中国科学院 海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院大学, 北京 100049
2. Laboratory for Marine Drugs and Bioproducts of Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
海藻是生长在海洋中的藻类植物, 可分为微型藻和大型藻两大类。其中, 大型藻类主要由褐藻, 绿藻和红藻组成[1]。海藻中富含可溶性膳食纤维、蛋白质、多糖、多不饱和脂肪酸及微量元素等多种营养物, 由于所含物质结构独特, 活性丰富, 已被广泛用于生物制药、食品加工等领域, 某些海藻中所富含的硫酸多糖, 研究证实其具有抗氧化、抗凝血、抗病毒及抗肿瘤等多种生物活性[2]。海藻多糖是由不同单糖以糖苷键相连接而成的长链化合物, 是海藻的重要组成成分, 也是被开发利用最为广泛的活性成分之一[3]。蜈蚣藻(Grateloupia filicina)隶属于海膜科, 蜈蚣藻属, 广泛分布于太平洋和大西洋海域, 是主要生长在潮间带的一种红藻。蜈蚣藻具有一定的药用价值, 中医以其作为基本药材, 治疗喉炎、肠炎等疾病。近年来, 蜈蚣藻逐渐被研究和开发利用, 研究指出, 蜈蚣藻富含的硫酸多糖具有较好的抗血管生成[4]、抗凝血等活性[5], 但是对于蜈蚣藻多糖其他生物活性的研究报道较少。
活性氧是由内源性代谢或外源性物质经氧化反应生成的副产物, 过度积累对机体有很大的损伤, 能够破坏DNA和蛋白结构, 诱发诸如心脏性疾病、肿瘤等多种疾病[6]。抗氧化物质的应用可以保护生物体免受活性氧攻击, 预防多种疾病的发生。自然界中存在多种天然抗氧化物质, 其中对海藻多糖的研究与开发利用, 已经引起了广泛的关注。不同的海藻多糖具有不同的抗氧化性, 主要受其分子量组成、活性基团数量、化学结构等因素决定。研究证实, 分子量是决定多糖活性的一个重要因素, 改变同一种多糖的分子量组成, 能够显著改变该多糖的抗氧化性[7]。在本研究中, 基于分子量对多糖抗氧化性的影响, 主要针对蜈蚣藻多糖进行降解条件研究和优化, 以及对不同分子量多糖的抗氧化性进行研究。以期获得有效的降解方法和较强抗氧化性的蜈蚣藻多糖。
1 材料与仪器 1.1 实验材料与试剂 1.1.1 生物材料蜈蚣藻于2016年采集于青岛市第二海水浴场, 将新鲜海藻用清水洗去泥沙, 平铺于烘箱中, 50~55℃下烘干, 于干燥避光处保存。
1.1.2 试剂重蒸酚(北京索莱宝科技有限公司)、浓硫酸(莱阳经济技术开发区精细化工厂)、BCA试剂盒(P0012-碧云天)、乙腈(德国MERCK公司); 无水乙醇、氢氧化钠、过氧化氢、硫酸钾、浓盐酸、氢氧化钠、1-苯基-3-甲基-5-吡唑啉酮(PMP)、硝酸钠、三氯化铁、二丁基羟基甲苯(BHT)、抗坏血酸(Vc)、番红花T、三氯乙酸(国药集团化学试剂有限公司); 1, 1-二苯基-2-三硝基苯肼(DPPH)、右旋糖苷及各种单糖标准品: D-甘露糖、L-鼠李糖、D-葡萄糖醛酸、D-葡萄糖、D-半乳糖、D-木糖、L-岩藻糖、2-脱氧核糖(Sigma公司)。
1.2 仪器设备YXQ-LS-50SII高压蒸汽灭菌锅(上海博讯实业有限公司)、RV10-DIGITIAL旋蒸仪(德国IKA公司)、CT18RT冷冻离心机(上海天美科学仪器有限公司)、FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司)、超声波微波组合反应系统(南京先欧仪器制造有限公司)、水浴锅(精宏仪器厂)、Agilent 1260 Infinity高效液相色谱仪(美国安捷伦公司)、Shimadzu-20A高效液相色谱仪(日本岛津公司)、YMC-Pack ODS-AQ色谱柱(日本YMC公司)、TSKgel G3000SWXL、G4000SWXL、G5000SWXL色谱柱(日本东曹公司)、TU-1810紫外可见分光光度计(北京普析通用仪器公司)、Thermo Scientific Dionex ICS-5000+离子色谱仪(美国赛默飞公司)、Thermo Scientific Dionex Nicolet-360傅里叶红外光谱仪(美国赛默飞公司)、Hitachi S-3400N扫描电子显微镜(日本日立公司)。
2 实验方法 2.1 多糖制备采用水提-醇沉法提取蜈蚣藻多糖[8], 提取方法稍有修改。具体操作步骤如下:
将20 g烘干的蜈蚣藻剪碎, 加入1.2 L蒸馏水, 在高压灭菌锅中100℃提取4 h。将提取液趁热过300目筛绢, 溶液于50℃减压浓缩, 待冷却至室温后, 用3 500 Da透析袋自来水透析2天, 蒸馏水透析1天。将透析后的溶液于50℃减压浓缩, 浓缩后加入3倍体积乙醇, 4℃下过夜, 离心后取沉淀冷冻干燥, 即得蜈蚣藻多糖。
2.2 多糖降解条件分析称取蜈蚣藻多糖5 g于烧杯中, 加蒸馏水250 mL于70℃下加热溶解, 配成2%蜈蚣藻多糖溶液。
2.2.1 传统加热法与微波辅助降解法的比较2%多糖溶液加入H2O2至终浓度为2%(V/V), 加入1 mol/L HCl溶液调至pH 2, 分别置于水浴锅和微波反应器(600 W)中70℃反应。
2.2.2 微波功率对多糖降解过程中分子量的影响2%多糖溶液在pH 2, 2% H2O2, 70℃条件下, 探究不同微波功率(300 W、600 W、900 W)对蜈蚣藻多糖降解分子量的影响。
2.2.3 降解试剂对多糖降解过程中分子量的影响2%多糖溶液分别添加H2O2和HCl至一定浓度, 设置4种反应条件, 统一在70℃、功率600 W条件下反应: 1)无H2O2、HCl; 2)2% H2O2; 3)pH 2; 4)2% H2O2-pH 2。
2.2.4 H2O2浓度对多糖降解过程中分子量的影响2%多糖溶液在pH 2, 70℃, 600 W的条件下, 探究不同H2O2浓度(0、1%、2%、3%)对蜈蚣藻多糖降解分子量的影响。
2.2.5 pH对多糖降解过程中分子量的影响2%多糖溶液在1% H2O2, 70℃, 600 W的条件下, 用1 mol/L HCl调节pH值, 探究不同pH值(pH 1、pH 2、pH 3)对蜈蚣藻多糖分子量降解的影响。
2.2.6 温度对多糖降解过程中分子量的影响2%多糖溶液在pH 2, 1% H2O2, 600 W的条件下, 探究不同温度(70℃、80℃、90℃)对蜈蚣藻多糖降解分子量的影响。
2.2.7 高效液相色谱法测定多糖分子量在降解过程中每隔15 min, 抽取少量上述反应溶液迅速冷却、中和, 检测分子量。方法如下:
采用Agilent 1260 Infinity高效液相色谱仪, TSKgel G3000SWXL、G4000SWXL、G5000SWXL色谱柱, 流动相0.05 mol/L NaNO3, 流速0.5 mL/min, 柱温30℃, 示差检测器, 进样量20 μL。
标准曲线绘制将分子量分别为1 kDa、5 kDa、12 kDa、25 kDa、50 kDa、80 kDa、270 kDa、410 kDa、670 kDa、1 100 kDa的右旋糖酐标准品配成浓度为4 mg/mL的溶液, 用0.22 μm标准滤膜过滤后, 按上述色谱条件检测, 根据出峰时间绘制标准曲线。
2.3 蜈蚣藻多糖理化性质分析硫酸根含量测定选用离子色谱法[9], 蛋白含量测定参照碧云天BCA试剂盒(P0012)进行, 总糖含量测定采用苯酚-硫酸法, 单糖组成选用高效液相色谱法[10]。红外光谱分析选用Thermo Scientific Nicolet- 360傅里叶红外光谱仪, KBr压片法, 扫描范围4 000~550 cm–1。扫描电镜分析选用Hitachi S-3400N扫描电子显微镜, 将多糖溶液滴在玻片上, 立即冰冻, 冷冻干燥后观察。
2.4 体外抗氧化活性将5种待测多糖样品分别配置浓度为0.5、1、2、4和8 mg/mL多糖溶液。
2.4.1 DPPH自由基清除能力蜈蚣藻多糖DPPH自由基清除能力测定参照文献报道的测定方法[11]。简述如下, 1.5 mL多糖溶液与0.1 mmol/L的DPPH乙醇溶液混合, 室温静置30 min, 然后于517 nm波长下测定溶液吸光度。以相同浓度的Vc溶液作为阳性对照, 以蒸馏水作为空白对照。清除能力按如下公式计算。
| $ {\rm{清除率}} = \left( {1 - \frac{{{A_1} - {A_2}}}{{{A_0}}}} \right) \times 100\% , $ | (1) |
式中, A1为多糖混合DPPH组吸光度, A2为多糖溶液吸光度, A0为空白对照组吸光度。
2.4.2 还原能力测定蜈蚣藻多糖还原能力测定参照文献报道的研究方法并稍作调整[12]。简述如下, 多糖溶液1 mL于50℃静置20 min。然后, 溶液立即冷却处理并加入10%(W/V)三氯乙酸2 mL。静置5 min后, 再加入0.1 %三氯化铁溶液1.25 mL, 30 min后, 于700 nm处测定吸光度。
2.4.3 羟自由基清除能力测定蜈蚣藻多糖的羟自由基清除能力参照文献报道的研究方法[13]。简述如下, 多糖溶液1 mL与2 mmol/L的EDTA-Fe2+溶液混合, 然后加入浓度为360 μg/mL的番红花T溶液1 mL, 3% H2O2 1 mL, 150 mmol/L的pH值为7.4的PBS溶液1 mL, 37℃静置30 min后, 于520 nm下测定吸光度。以蒸馏水作为空白对照。清除能力按如下公式计算。
| $ {\rm{清除率}} = \left( {\frac{{{A_1} - {A_0}}}{{{A_2} - {A_0}}}} \right) \times {\rm{100\% }}, $ | (2) |
式中, A0为空白组吸光度; A1为多糖处理组吸光度; A2为以蒸馏水取代H2O2处理组吸光度。
2.5 数据处理采用SPSS软件(SPSS 17.0 for Windows)进行统计分析。数据分析采用方差分析(ANOVA), 显著性差异采用邓肯多重比较检验。
3 结果与讨论 3.1 不同降解条件对分子量的影响在本研究中, 初始样品蜈蚣藻多糖(GFP)具有高达2 093.4 kDa的分子量, 由于多糖过高的分子量不利于多糖生物活性的发挥, 因此有必要进一步降低GFP的分子量, 从而提高其活性。因此, 一种有效的多糖降解方法就显得尤为重要。
3.1.1 传统加热法和微波辅助降解法对分子量的影响微波辅助法是一种更高效的降解方法。微波辐射凭借其高效的辅助降解功能, 被用作降解多种生物大分子, 在多糖的微波辅助降解方面已有报道[14]。微波作为一种辅助降解方法, 一方面能够提高分子振动频率, 从而产生更多热量; 另一方面, 微波可以增加分子极性, 促使分子键的断裂[15]。
如图 1, 在反应条件pH 2、2% H2O2、70℃下, 多糖分别在水浴锅和微波反应器(600 W)中进行降解反应。两种降解方法都能使分子量降低。但是, 整个降解过程, 相同的反应时间, 微波法降解所测得多糖分子量明显更小, 且数值差距更大。在反应75 min时, 传统加热法可得分子量60 kDa, 而微波辅助法的分子量却能够低至7.6 kDa, 表明微波法更适于低分子量多糖的降解, 可大大提高效率。
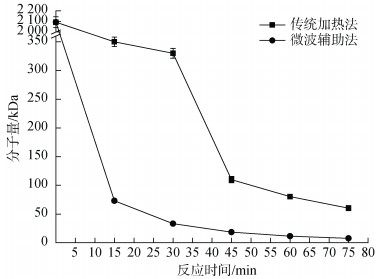 |
| 图 1 传统加热降解和微波辅助降解对蜈蚣藻多糖分子量的影响 Fig. 1 Effect of traditional heating and microwave irradiation methods on molecular weights of GFP |
基于微波辅助法的高效性, 有必要进一步筛选优化微波反应条件降解蜈蚣藻多糖, 首先我们研究了微波功率对多糖分子量的影响。在pH 2、2% H2O2、70℃时, 不同微波功率(300 W、600 W、900 W)对分子量产生了较为明显的影响。如图 2所示, 在反应15 min和30 min时, 分子量分别为182.2 kDa、55.9 kDa (300 W), 73.1 kDa、33.3 kDa(600 W), 108.2 kDa、26.1 kDa (900 W), 所以提升微波功率对于蜈蚣藻多糖降解有一定促进作用。然而, 在反应15 min时, 多糖分子量在600 W(73.1 kDa)反应条件下却小于900 W反应条件下的分子量(108.2 kDa), 该现象可能是由于微波反应器在600 W及以下功率时为持续工作, 而在900 W条件下为间歇工作, 功率不稳定导致。然而, 随着反应时间的延长, 功率的大小对于多糖分子量的影响明显减弱, 在反应45 min后无明显差异, 此时, 样品分子量在30 kDa左右, 说明微波辅助对大分子量多糖的降解效果优于低分子量多糖。
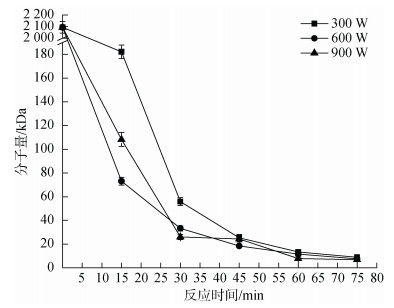 |
| 图 2 微波功率对降解过程中蜈蚣藻多糖分子量的影响 Fig. 2 Effect of microwave power on molecular weights of GFP |
降解过程中, 添加何种降解化学试剂极为关键, 该环节直接决定了降解效果。H2O2和HCl是两种常见的可用于大分子多糖降解的试剂, 兼具高效和低廉的优势, H2O2和HCl分别都能够促使糖苷键断裂, 从而达到降低多糖分子量的目的。但针对蜈蚣藻多糖, 选用何者、如何配比能使蜈蚣藻多糖更快速的降解, 需进一步研究。
如图 3, 在70℃, 功率600 W时, 分别设置四种反应处理组: 1)空白组(不含H2O2、HCl); 2)H2O2 (2%); 3)HCl (pH 2); 4)H2O2 (2%)-HCl (pH 2), 比较对蜈蚣藻多糖分子量降解的影响。4种反应条件下, 各时间点的分子量大小为空白组 > H2O2组 > HCl组 > H2O2- HCl组。由此可得, HCl相比H2O2更有助于降解蜈蚣藻多糖。而第4处理组H2O2-HCl组显示, H2O2和HCl具有协同作用, 以上结果表明, 采用H2O2-HCl协同降解的方法, 降解效率最高。
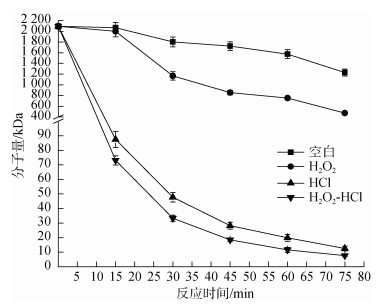 |
| 图 3 H2O2和HCl对降解过程中蜈蚣藻多糖分子量的影响 Fig. 3 Effect of H2O and HCl on molecular weights of GFP |
为进一步确定H2O2–HCl降解体系中二者的配比, 在70℃、pH2、功率600 W的条件下, 探究不同H2O2浓度(0、1%、2%、3%)对分子量的影响。如图 4, 在所研究的浓度范围内, 4种H2O2浓度反应条件下多糖分子量接近, 故提高H2O2浓度对降解多糖分子量无显著作用。但是使用H2O2时, 多糖的分子量明显低于不使用H2O2多糖的分子量, 因此, H2O2对于降解蜈蚣藻多糖有一定作用, 但是酸性条件下单独提高H2O2浓度无显著作用。
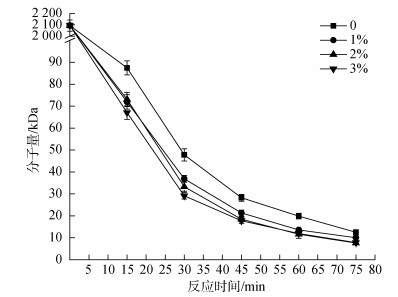 |
| 图 4 H2O2浓度对降解过程中蜈蚣藻多糖分子量的影响 Fig. 4 Effect of H2O2 concentration on molecular weights of GFP |
在70℃、1% H2O2、功率600 W, 探究不同pH值(pH 1、pH 2、pH 3)对分子量的影响。如图 5, 相同反应时间下, 酸性越强, 分子量越低。故酸性越强越有利于多糖降解。但是, pH 1降解条件过于剧烈, 在pH 3条件下, 未能得到低分子量多糖, 而pH 2条件下, 能降解到分子量范围73.1~7.6 kDa的多糖样品, 更有利于在降解过程中控制分子量。
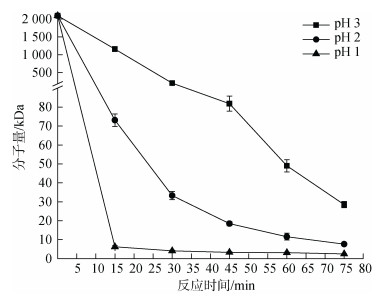 |
| 图 5 pH对降解过程中蜈蚣藻多糖分子量的影响 Fig. 5 Effect of pH on molecular weights of GFP |
在温度选择上, 高温会大大加速降解效果, 但温度过高会造成资源浪费, 对样品分子量难以精确把控等问题。因此, 本研究继续在pH 2、1% H2O2、功率600 W的反应条件下, 探究不同温度(70℃、80℃、90℃)对分子量的影响。图 6随着温度升高, 分子量明显降低, 但80℃、90℃分子量降低过于迅速, 不利于分子量的把控, 高温不仅容易造成分子结构破坏, 还会造成资源浪费, 增加成本。
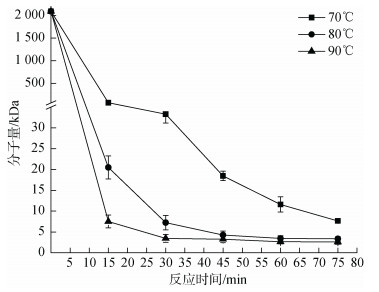 |
| 图 6 温度对降解过程中蜈蚣藻多糖分子量的影响 Fig. 6 Effect of temperature on molecular weights of GFP |
基于以上, 依照提高降解效率和降低生产成本的原则, 本研究确立了蜈蚣藻多糖最佳降解条件为:微波功率600 W, 1% H2O2(V/V), pH 2, 反应温度70℃, 可依据降解时间得到不同分子量蜈蚣藻多糖样品。
3.2 多糖理化性质分析蜈蚣藻多糖GFP及其降解产物LGFP(1-4)的分子量、总糖含量、蛋白含量及单糖组成见表 1及表 2。
| 样品 | 分子量/kDa | 总糖含量/% | 硫酸根含量/% | 蛋白含量/% |
| LGFP-1 | 40.8 | 64.2 ± 1.4 | 25.2 ± 0.3 | 0.29 ± 0.03 |
| LGFP-2 | 22.6 | 65.1 ± 1.0 | 14.0 ± 0.2 | 0.45 ± 0.04 |
| LGFP-3 | 5.1 | 61.6 ± 1.4 | 13.4 ± 0.3 | 0.34 ± 0.01 |
| LGFP-4 | 3.0 | 52.4 ± 1.2 | 14.5 ± 0.3 | 0.95 ± 0.05 |
| 样品 | 单糖组成(摩尔比) | ||||||
| 半乳糖 | 甘露糖 | 鼠李糖 | 葡萄糖醛酸 | 葡萄糖 | 木糖 | 岩藻糖 | |
| GFP | 1 | 0.001 6 | 0.004 6 | 0.005 7 | 0.006 4 | 0.014 9 | 0.005 5 |
| LGFP-1 | 1 | 0.004 7 | 0.005 2 | 0.014 1 | 0.015 0 | / | / |
| LGFP-2 | 1 | 0.008 4 | 0.003 1 | 0.010 9 | 0.015 5 | / | / |
| LGFP-3 | 1 | 0.014 2 | / | 0.045 2 | 0.057 9 | / | / |
| LGFP-4 | 1 | 0.006 8 | / | 0.036 0 | 0.041 7 | / | / |
表 1, 蜈蚣藻多糖GFP起始分子量为2 093.4 kDa, 通过微波辅助法得到4种降解产物, 其分子量显著降低, LGFP-1(40.8 kDa)、LGFP-2(22.6 kDa)、LGFP-3(5.1 kDa)、LGFP-4(3.0 kDa)。总糖含量基本维持在60%以上, 但是LGFP-4低于60%, 这表明长时间的降解会降低总糖含量, LGFP-2、LGFP-3、LGFP-4硫酸根含量较GFP和LGFP-1低10%左右, 以上说明在酸性环境下的长时间降解会使得更多的糖链断裂, 更多的硫酸根脱落, 这些将通过透析法除去。蛋白含量低至0.17%~0.94%。单糖组成见表 2, 在单糖组成中, 主要成分为半乳糖, 另含有少许其他单糖, 其中葡萄糖和葡萄糖醛酸含量略高。
如图 7为不同分子量蜈蚣藻多糖的红外光谱分析。吸收峰3 200~3 400 cm–1为O-H伸缩振动, 2 910~2 960 cm–1为C-H伸缩振动; 1 620~1 640 cm–1和1 405~1 440 cm–1为C=O的不对称、对称伸缩振动, 1 225~1 275 cm–1为S=O伸缩振动。1 000~1 035 cm–1为C-O-H弯曲振动, 而924~930 cm–1处表示有3, 6-内醚半乳糖存在[16], 另外, 当C-O-SO3位于C2或者C4上时, 会在840~850 cm–1处出现吸收峰[17]。对比以上红外谱图, 结果显示不同分子量蜈蚣藻多糖的吸收峰大致相同, 由此说明降解过程并未破坏主要糖链结构。
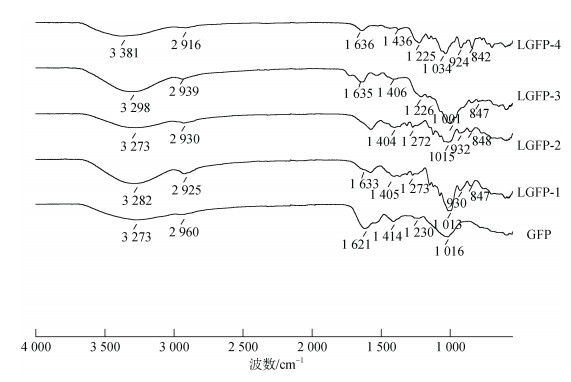 |
| 图 7 不同分子量蜈蚣藻多糖红外光谱分析 Fig. 7 Fourier transform infrared spectra of GFP and LGFP-1-4 from 4 000 to 550 cm−1 |
如图 8, A1-A2, B1-B2, C1-C2, D1-D2, E1-E2分别为GFP, LGFP-1, LGFP-2, LGFP-3, LGFP-4在100×和500×下的扫描电镜图。5种分子量蜈蚣藻多糖分别在100×和500×进行扫描电镜观察。从图A-图E扫描电镜显示, 随着多糖分子量降低, 多糖结构越发松散, 由原本的平面片状结构逐渐变成线状结构, 并出现球状结节, 且分子量越低球状结节越明显, 该结果与前人研究的结果一致[18]。另外, 图D1和D2主要为球状结构且无连接结构, 这可能是在扫描电镜观察过程中的喷金操作所导致。通过扫描电镜观察到的蜈蚣藻多糖的不同结构是否会影响到多糖的生物活性, 该问题还需进一步研究。
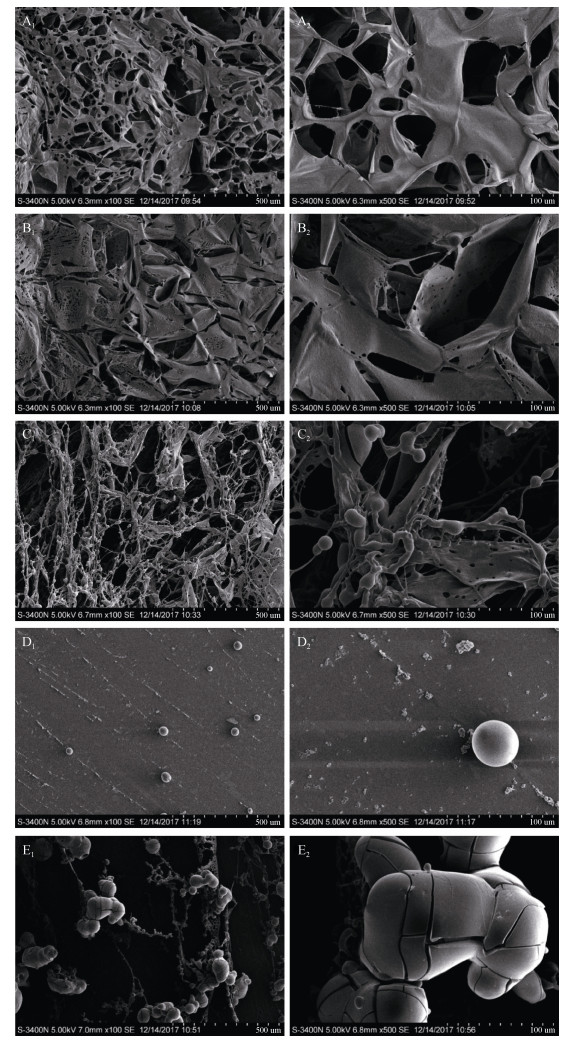 |
| 图 8 不同分子量蜈蚣藻多糖扫描电镜分析 Fig. 8 Scanning electron microscope (SEM) photographs of polysaccharides |
作为自由基类化合物, DPPH自由基与抗氧化性物质接触反应, 能够生成DPPH-H, 从而使其吸光度下降, 因该过程反应稳定, 颜色变化迅速, 被广泛用于抗氧化性的评价。如图 9所示, 随着多糖浓度的增加, 对DPPH自由基的清除率逐渐增强, 当多糖浓度≤1 mg/mL, 各样品组呈现出相似的清除率, 普遍低于30%, 而当多糖浓度≥2 mg/mL时, 相对低分子量的样品组LGFP-2 (22.6 kDa), LGFP-3 (5.1 kDa)和LGFP-4 (3.0 kDa)呈现出较好的DPPH自由基清除率, IC50分别为2.99 mg/mL, 2.47 mg/mL和7.01 mg/mL, 显著优于GFP的19.83 mg/mL。在8 mg/mL时, LGFP-3显示了最强的DPPH清除能力(92%), 效果强于其他处理组(P < 0.05), 其活性与对照组的Vc相近(P > 0.05)。在所有样品中, LGFP-2, LGFP-3和LGFP-4, 显示了相对较好的抗氧化活性, 3个样品较低的分子量可能是提升其抗氧化性的关键因素, 且呈明显浓度依赖性, 该结果与前人所述低分子量可以增强多糖的抗氧化性相一致[19]。在等浓度体积的多糖溶液中, 低分子量多糖具有更多的还原端, 能够更迅速的和自由基进行反应。而LGFP-3在8 mg/mL时具有最强的清除能力, 其本身更少的硫酸根含量可能对结果有所影响, 如有研究指出, 低硫酸根含量的多糖样品, 比同系列部分高硫酸根含量的多糖具有更强DPPH自由基清除能力[20], 但具体机理仍需进一步研究。另外, 生长于不同地区的不同种属的蜈蚣藻, 所提取的蜈蚣藻多糖的DPPH自由基清除能力呈现出巨大差异, 有研究指出, 采集于汕头市广澳地区的蜈蚣藻所提取的多糖, 其DPPH自由基的IC50为3.9 mg/mL, 显著低于本实验中的GFP。其纯化后可进一步提高DPPH自由基清除能力, 效果与LGFP-3相当[11]。
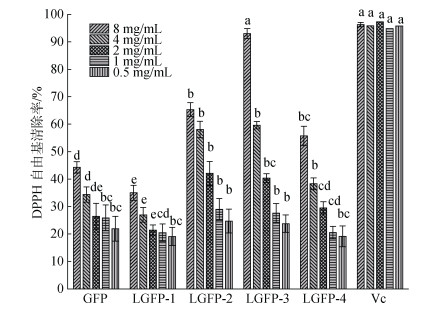 |
| 图 9 GFP和LGFP1-4的DPPH自由基清除能力 Fig. 9 DPPH radical scavenging ability of GFP and LGFP-1-4 注: Vc作为阳性对照, 不同字母表示各处理组之间达到显著性差异(P < 0.05) |
具有还原能力的抗氧化剂能够将三价铁还原成二价铁, 该结果可通过测定700 nm处吸光度来表示, 从而反应该抗氧化剂的抗氧化性, 吸光度越高则表示该测量物抗氧化性越强。由图 10可知, 5组样品都具有一定的还原能力, 当浓度低于2 mg/mL时, 5种样品的还原能力都较弱, 吸光度普遍低于0.2, 但呈现明显浓度依赖性, 当浓度达到8 mg/mL时, 经降解处理的LGFP-2, LGFP-3和LGFP-4显示了更强的还原能力, 吸光度达到0.3以上, 3个样品组之间无显著性差异, 但是效果明显弱于阳性对照BHT。该结果与DPPH清除能力趋势一致, 显示了低分子量多糖具有更强的还原性, 但是效果显著弱于分子量为707 kDa的羊栖菜多糖。由于从不同的海藻中所提取的多糖结构的不同, 单糖组成的差异等原因, 会呈现出不同的还原能力[22]。
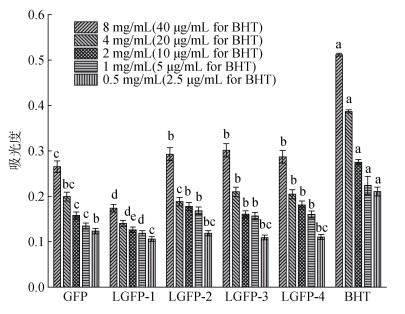 |
| 图 10 GFP和LGFP1-4的还原能力 Fig. 10 Reducing power of GFP and LGFP-1–4 注: BHT作为阳性对照, 不同字母表示各处理组之间达到显著性差异(P < 0.05) |
芬顿反应能够产生羟自由基, 而多糖可以抑制反应的进行并清除已产生的羟自由基, 其清除能力可通过520 nm处的吸光度反应[23]。由图 11, 当多糖浓度≤1 mg/mL, 各样品组呈现出相似的清除率, 普遍低于15%, 随着多糖浓度的增加, 5个样品对羟自由基的清除率逐渐增强, 清除活性呈现明显浓度依赖性, IC50分别为8.83 mg/mL, 9.96 mg/mL, 8.39 mg/mL, 6.69 mg/mL和7.57 mg/mL。低分子量的样品组LGFP-3和LGFP-4呈现出较好的羟自由基清除率。在多糖最大浓度为8 mg/mL时, LGFP-3和LGFP-4的羟自由基清除率分别达到57.1%和55.2%, 低分子量多糖暴露出的更多还原端, 对多糖的抗氧化性提升起到了明显作用。该结果与之前对DPPH自由基抗氧化性以及其还原能力变化趋势一致, 这也与前人研究结论相吻合[24]。
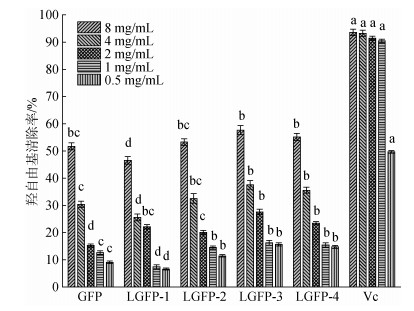 |
| 图 11 GFP和LGFP1-4的还原能力 Fig. 11 Hydroxyl radical scavenging ability of GFP and LGFP-1-4 注: Vc作为阳性对照, 不同字母表示各处理组之间达到显著性差异(P < 0.05) |
本研究探讨了不同降解条件对蜈蚣藻多糖分子量的影响, 通过优化微波功率、H2O2-HCl浓度和配比、降解温度, 最终确立了微波功率600 W, 1% H2O2(V/V), pH 2, 降解温度70℃的最优降解条件, 并以该方法成功降解得到4种低分子量蜈蚣藻多糖。进一步理化性质分析表明降解过程对多糖无显著影响, 在所有样品中, 低分子量蜈蚣藻多糖LGFP-2、LGFP-3、LGFP-4显示出更强的抗氧化活性。
| [1] |
Gupta S, Abu-Ghannam N. Bioactive potential and possible health effects of edible brown seaweeds[J]. Trends in Food Science & Technology, 2011, 22(6): 315-326. |
| [2] |
Mohamed S, Hashim S N, Rahman H A. Seaweeds:a sustainable functional food for complementary and alternative therapy[J]. Trends in Food Science & Technology, 2012, 23(2): 83-96. |
| [3] |
Li S, Shah N P. Antioxidant and antibacterial activities of sulphated polysaccharides from Pleurotus eryngii and Streptococcus thermophilus ASCC 1275[J]. Food Chemistry, 2014, 165(3): 262-270. |
| [4] |
Wang S C, Bligh S W A, Shi S S, et al. Structural features and anti-HIV-1 activity of novel polysaccharides from red algae Grateloupia longifolia and Grateloupia filicina[J]. International Journal of Biological Macromolecules, 2007, 41(4): 369-375. |
| [5] |
Sun Y, Chen X, Song L, et al. Preparation of low molecular weight Sargassum fusiforme polysaccharide and its anticoagulant activity[J]. Chinese Journal of Oceanology & Limnology, 2017, 36(12): 1-10. |
| [6] |
Chandini S K, Ganesan P, Bhaskar N. In vitro antioxidant activities of three selected brown seaweeds of India[J]. Food Chemistry, 2008, 107(2): 707-713. |
| [7] |
Li K, Xing R, Song L, et al. Separation of chito-oligomers with several degrees of polymerization and study of their antioxidant activity[J]. Carbohydrate Polymers, 2012, 88(3): 896-903. |
| [8] |
Song L, Chen X, Liu X, et al. Characterization and comparison of the structural features, immune-modulatory and anti-avian influenza virus activities conferred by three algal sulfated polysaccharides[J]. Marine Drugs, 2016, 14(1): 4. |
| [9] |
Song Y, Shen Y. Determination of sulfate and sulfite in Kudiezi injection by ion chromatography[J]. Chinese Journal of Pharmaceutical Analysis, 2012, 32(5): 857-860. |
| [10] |
Hou N, Zhang M, Xu Y, et al. Polysaccharides and their depolymerized fragments from Costaria costata:molecular weight and sulfation-dependent anticoagulant and FGF/FGFR signal activating activities[J]. International Journal of Biological Macromolecules, 2017, 105: 1511-1518. |
| [11] |
Tang L, Chen Y, Jiang Z, et al. Purification, partial characterization and bioactivity of sulfated polysaccharides from Grateloupia livida[J]. International Journal of Biological Macromolecules, 2017, 94: 642-652. |
| [12] |
Xing A R, Guo Z, Yu H, et al. Relevance of molecular weight of chitosan-2-hydroxypropyl trimethyl ammonium chloride and their antioxidant activities[J]. European Journal of Medicinal Chemistry, 2008, 43(2): 336-340. |
| [13] |
Luo F, Xing R, Wang X, et al. Antioxidant activities of Rapana venosa meat and visceral mass during simulated gastrointestinal digestion and their membrane ultrafiltration fractions[J]. International Journal of Food Science & Technology, 2017, 53(2): 395-403. |
| [14] |
Greene D L, Mingos D M P. Application of microwave dielectric loss heating effects for the rapid and convenient synthesis of ruthenium(II) polypyridine complexes[J]. Transition Metal Chemistry, 1991, 16(1): 71-72. |
| [15] |
Porcelli M, Cacciapuoti G, Fusco S, et al. Non-thermal effects of microwaves on proteins:thermophilic enzymes as model system[J]. Febs Letters, 1997, 402: 102-106. |
| [16] |
Kolsi R B A, Salah H B, Jardak N, et al. Sulphated polysaccharide isolated from Sargassum vulgare:characterization and hypolipidemic effects[J]. Carbohydrate Polymers, 2017, 170: 148-159. |
| [17] |
Wang L, Liu H M, Qin G Y. Structure characterization and antioxidant activity of polysaccharides from Chinese quince seed meal[J]. Food Chemistry, 2017, 234: 314-322. |
| [18] |
Tang H L, Chen C, Wang S K, et al. iochemical analysis and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum. L[J]. International Journal of Biological Macromolecules, 2015, 77: 235-242. |
| [19] |
Shi M J, Wei X, Xu J, et al. Carboxymethylated degraded polysaccharides from Enteromorpha prolifera:preparation and in vitro antioxidant activity[J]. Food Chemistry, 2017, 215: 76-83. |
| [20] |
Xie J H, Wang Z J, Shen M Y, et al. Sulfated modification, characterization and antioxidant activities of polysaccharide from Cyclocarya paliurus[J]. Food Hydrocolloids, 2016, 53: 7-15. |
| [21] |
Peasura N, Laohakunjit N, Kerdchoechuen O, et al. Characteristics and antioxidant of Ulva intestinalis sulphated polysaccharides extracted with different solvents[J]. International Journal of Biological Macromolecules, 2015, 81(4): 912-919. |
| [22] |
刘雪, 王桂宏, 赵福江, 等. 羊栖菜褐藻糖胶的结构表征及其抗氧化活性[J]. 食品工业科技, 2019, 40(3): 79-84. Liu Xue, Wang Guihong, Zhao Fujiang, et al. Structural characterization and antioxidant activities of fucoidan from Sargassum fusiforme[J]. Science and Technology of Food Industry, 2019, 40(3): 79-84. |
| [23] |
Zhang Z, Feng W, Wang X, et al. Extraction of the polysaccharides from five algae and their potential antioxidant activity in vitro[J]. Carbohydrate Polymers, 2010, 82(1): 118-121. |
| [24] |
Li B, Liu S, Xing R, et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J]. Carbohydrate Polymers, 2013, 92(2): 1991-1996. |
 2020, Vol. 44
2020, Vol. 44


