文章信息
- 丁月旻, 颜天, 耿慧霞, 周名江. 2020.
- DING Yue-min, YAN Tian, GENG Hui-xia, ZHOU Ming-jiang. 2020.
- 在流水系统中浒苔对营养盐吸收和转化的模拟实验
- Experimental study of nutrients absorption and transformation by Ulva prolifera in a flowing water system
- 海洋科学, 44(9): 38-46
- Marine Sciences, 44(9): 38-46.
- http://dx.doi.org/10.11759/hykx20190815001
-
文章历史
- 收稿日期:2019-08-15
- 修回日期:2020-03-02
2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 中国科学院海洋大科学研究中心, 山东 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
绿潮是世界沿海各地普遍发生的海洋生态灾害。近几十年, 绿潮的发生频率和地理范围均呈现增长趋势[1-2]。黄海绿潮是目前世界范围内发生规模最大的绿潮灾害, 已经严重地影响了黄海沿岸城市旅游业和水产养殖业, 破坏了沿海的生态环境[3]。黄海绿潮的肇事种类经鉴定为浒苔(Ulva prolifera)[4]。浒苔较高的生长率及其对海水营养盐的快速吸收都是该海域绿潮发生的基础原因[5-6]。大量研究已经表明黄海绿潮发源于黄海江苏省沿岸浅滩区域[7-8], 该海域的海水质量已呈现富营养化[9]。浒苔绿潮发生的过程一般是先在江苏南部沿海海域出现, 随后绿潮的范围逐渐扩张并顺着海流向北移至山东半岛海域, 其覆盖面积可达几千平方公里[10], 据估算其生物量可达几百万吨[11]。
黄海如此大规模的绿潮, 必然会带来一系列不可忽视的问题。浒苔作为一种大型藻类, 能够从海水吸收大量的氮磷营养盐并通过光合作用固定CO2; 同时浒苔利用这些无机形态的生源要素转化为自身需要的物质, 最终随着其死亡分解再将这些物质释放到水体中。因此, 浒苔对生源要素的利用可能影响生态系统物质的生物地球化学循环过程。浒苔对生源要素的吸收利用的研究应从两方面开展:浒苔对生源要素的吸收以及浒苔对生源要素的转化。目前, 浒苔对氮、磷营养盐的吸收动力学和吸收速率主要都是采用静止的、水体不流动的培养体系开展实验[5, 12-13], 当然也有部分研究是在海水围隔系统中开展模拟实验[14]。
本研究建立了一个新的培养体系-流水系统, 运用并模拟了海水中氮、磷营养盐在不断供给的情况下浒苔对它们的吸收和利用, 还测定了浒苔对碳、氮、磷3种生源要素在藻体内的转化速率, 讨论了浒苔在生态系统物质循环中的作用, 将为探讨浒苔绿潮对生态系统的生态效应提供理论依据。
1 材料与方法 1.1 实验用浒苔于山东省青岛市汇泉湾采集漂浮的绿潮藻, 经分子生物学方法结合形态学观察, 鉴定为浒苔(Ulva prolifera), 用过滤灭菌的海水洗涤浒苔, 去除泥沙和附着物, 放置于室内培养架的锥形瓶内, 温度为18~ 20℃, 光强为50 μmol·m–2·s–1, 光照时间14 L: 10 D。培养液为自然海水(取自青岛太平角)经0.45μm的滤膜过滤, 然后在温度121℃, 气压0.56 kg·cm–2, 蒸汽灭菌30 min, 冷却至室温, 并添加f/2培养液配方。
实验前所用浒苔均在经0.22 μm过滤的自然海水中培养一周, 每日更换海水。实验中所用玻璃仪器均用1︰9的盐酸浸泡后高温灭菌(121℃, 30 min)。实验所用的海水均为经0.22 μm滤膜过滤后的自然海水。
1.2 实验设计本实验中所涉及的各种营养盐分别用简写代替全称, 具体指代如下:
DIN(溶解无机氮); DON(溶解有机氮); DTN(溶解态总氮); TN(总氮); DIP(溶解无机磷); DOP(溶解有机磷); DTP(溶解态总磷); DIC(溶解无机碳); DTC(溶解总碳)。
1.2.1 实验用培养浒苔的流动水装置本实验采用流动水装置(图 1)培养浒苔。其中, 1-(a)为供水瓶(5 L), 装有经0.22 μm纤维滤膜过滤的自然海水; 1-(b)为浒苔培养瓶(1 L), 装有浒苔; 1-(c)为出水瓶(5 L), 接收培养瓶中流出的海水。a瓶和b瓶以及b瓶和c瓶之间落差约15 cm。连接a和b的是一根医用注射管, 可控制流入培养瓶的海水流速, 接入b培养瓶中的管头置于培养瓶底部。连接b和c的是一根普通软管, 当b培养瓶中海水高于该管出口, 海水便会自动溢出。三个瓶口均用滤纸包裹, 不密封。
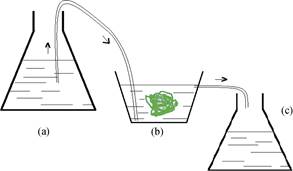 |
| 图 1 培养浒苔的流动水装置 Fig. 1 Flowing water device for culturing U. prolifera |
经预实验调整培养瓶的入水流速保持在0.375 L·h–1。实验开始将b培养瓶中加入700 mL海水, 放入2.5 g湿重的浒苔约112 min后, 接入出水瓶。实验装置置于温度为18~20℃, 光强为50μmol·m–2·s–1, 光照时间12 L: 12 D的培养条件下。每隔12 h, 在a瓶中添加4.5 L经0.22 μm纤维滤膜过滤的自然海水, 取出c接收瓶中的海水, 一部分水样经0.45μm的纤维滤膜过滤后加入三氯甲烷保存于–20℃, 用于测定水体中的NO3-、NO2-、NH4+、PO43-、DTN和DTP; 另一部分经滤膜过滤后加入1滴饱和氯化汞, 保存于4℃, 用于测定DIC、DTC。实验时间持续5天, 每个实验组设置3个平行。取实验前后的浒苔样品, 测定藻体体内的TC、TN、TP、NO3-和PO43-。本实验自然海水的营养盐平均起始浓度, NO3-: 21.36±2.015 μmol·L–1, NO2-: 0.25±0.007 μmol·L–1, NH4+: 0.93±0.071μmol·L–1, DON: 5.45 μmol·L–1, PO43-: 0.465±0.092 μmol·L–1, DOP: 0.282 μmol·L–1, SO42-: 28.47±0.01 mmol·L–1。实验共持续120 h, 其中第1—12 h、第25—36 h、第49— 60 h、第73—84 h、和第97—108 h为光照时段, 第13—24 h、第37—48 h、第61—72 h、第84—96 h和第109—120 h为非光照时段。
1.3 测定方法根据海洋调查规范(GB 17378.4—2007), 水体中NO3-、NO2-、NH4+和PO43-的测定方法分别为锌-镉还原法、萘乙二胺分光光度法、次溴酸盐氧化法和磷钼蓝分光光度法; 水体TN和TP的测定采用过硫酸钾氧化法。水体中DTS的测定方法参考GB/T 17776—1999硝酸消解-氯化钡比浊法并稍作改进。取样品0.5 mL, 加5 mL硝酸(1.04 mol·L–1)溶液水浴煮2.5 h。冷却后, 加入5 mL稳定剂, 定容至50 mL。向水样各加入1 mL氯化钡溶液, 搅拌均匀后超声10 min。静置5 min后于440 nm波长下测定吸光值。水体的DIC和DTC的测定方法采用德国Elementar公司的总有机碳分析仪直接测定。
浒苔体内的TC、TN和TP测定前, 藻体样品于60℃烘箱烘干2 h至恒重, 锡舟包样, 待测。浒苔体内的TOC测定前, 取烘干样品银舟装样, 滴加1 mol·L–1 HCl溶液进行去无机碳处理, 60℃烘箱烘干, 直至样品滴加HCl不再产生气泡, 包样待测。TC、TOC和TN采用德国Elementar公司的元素分析仪加样测定; TP的测定取烘干的样品由美国PerkinElmer的电感耦合等离子体发射光谱仪(ICP-AES)测定。浒苔体内的NO3-的测定和PO43-的测定分别选用了李靖等[15]和赵海超[16]的测定方法。
测定浒苔干重与湿重的方法:取一定重量浒苔于60℃烘箱烘干2 h至恒重, 分别称量浒苔被烘干前的湿重(g)和浒苔烘干后恒定的干重(g)。
1.4 数据处理 1.4.1 营养盐浓度:c(DIN)= c(NO3–)+ c(NH4+)+ c(NO2–)
c(DIP)= c(PO43–)
c(DON)= c(DTN)–c(NO3–)– c(NH4+)– c(NO2–)
c(DOP)= c(DTP)–c(PO43–)
c(DOC)= c(DTC)– c(DIC)
1.4.2 营养盐的吸收| $ 营养盐吸收量 = \left( {{X_0} - {X_t}} \right) \times V \times 100, $ | (1) |
| $ 营养盐的吸收速率 = \left( {{X_0} \times V - {X_{{\rm{tb}}}} \times {V_b} - {X_{{\rm{tc}}}} \times {V_c}} \right)/{N_t}/t, $ | (2) |
其中, X0是营养盐的起始浓度(μmol·L–1); Xtb和Xtc分别是t时间后b瓶中和c瓶中海水营养盐的浓度(μmol·L-1); Vtb和Vtc分别是t时间收集时b瓶中和c瓶中海水的体积(L); V是b瓶中和c瓶中海水的体积之和(L); Nt是t时间后浒苔的生物量(g); t是时间(d)。为了降低取样过程对b瓶营养盐的干扰, 不对浒苔培养瓶直接取样, 计算过程中采用的b瓶中的营养盐浓度与c瓶相同。
不同光照条件下浒苔藻体对营养盐吸收速率的差别得用统计学软件SPSS进行方差分析(ANOVA, analysis of variance), 通过Shapiro-Wilks方法对数据进行正态性检验, 通过Levene方法对数据进行方差齐性检验。
1.4.3 浒苔对营养盐的转化| $ 浒苔体内元素的增加量 = {W_t} \times {P_t} \times 0.191 - {W_0} \times {P_0} \times 0.191, $ | (3) |
其中, Wt为浒苔增重后的湿重(g); Pt为浒苔增重后某元素的含量的百分比(100%); W0为浒苔实验前的湿重(g); P0为浒苔实验前某元素的含量的百分比(100%); 0.191为浒苔干重与湿重的比值(见图 2); t为时间(d)。
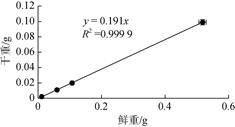 |
| 图 2 浒苔干重与鲜重的线性关系 Fig. 2 Linear relationship between the dry weight and fresh weight of U. prolifera |
浒苔将无机态的元素转化为有机态的转化效率e计算:
其中, 氮和磷的理论上吸收无机形态元素的量(μmol), 是海水中无机形态所占该元素总量的比例与藻体内元素积累量进行乘积。理论上吸收无机碳的量(μmol)为吸收的空气中CO2的量与海水中无机碳减少的量二者的总和; CO2的吸收量(μmol)为浒苔体内所积累的总碳量与海水中总碳的消耗量的差值, 在此忽略碳元素被容器或藻体本身的吸附作用。
2 结果 2.1 在流动水体中浒苔对氮、磷营养盐的吸收在流动海水体系研究中, 计算出浒苔每12 h对氮磷营养盐的吸收量。从图 3中看到, 流动水培养体系中, 这四种有机和无机的营养盐的吸收量均为正数, 说明浒苔对DIN、DON、DIP和DOP都是具有吸收作用的。其中, 浒苔对无机氮和总氮的吸收量随着时间的变化呈现增加的趋势, 这应该是浒苔生长以及生物量有所增加, 吸收了更多的氮营养盐。而浒苔对DIP和DTP的吸收量随着时间变化维持较稳定的趋势。浒苔对DON和DOP的吸收量没有明显的变化趋势。对每12 h收集的海水中无机营养盐和有机营养盐的比例进行研究(图 3)。发现, 与起始海水中DIN所占海水DTN的比例相比, 经过培养浒苔的海水中DIN的比例越来越低。而从浒苔培养海水的DIP占DTP的比例图中, 没有明显的变化趋势。以上说明, 浒苔能够明显改变海水中无机氮和有机氮营养盐的比例。
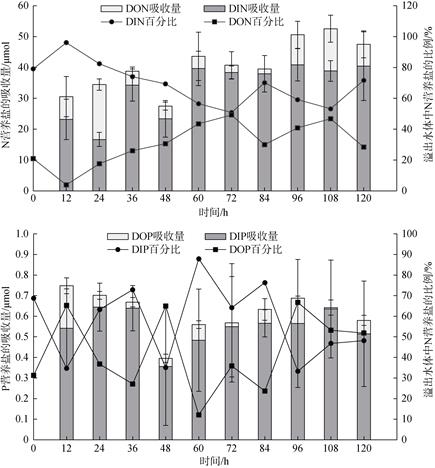 |
| 图 3 流动水体中浒苔对氮、磷营养盐的吸收量和水体中有机和无机营养盐的比例 Fig. 3 Uptake of nitrogen and phosphorus nutrients by U. prolifera and the proportion of nutrients in the flowing seawater |
按照营养吸收速率的公式计算出每个时段内浒苔对各种氮、磷营养盐的吸收速率(表 1), 发现, 每个时段营养盐平均吸收速率的高低与其吸收量具有相同的趋势。仅第0—24 h和第37—48 h两个时段的DIN和DTN平均吸收速率数值低于其他时段的吸收速率; 而第0—36 h的DIP和DOP的平均吸收速率略高于其他时段的吸收速率。以上说明在这个流水系统中浒苔对各个营养盐的吸收速率比较稳定, 没有明显的变化趋势。对比光照和非光照时段发现, 在光照时段内浒苔对DIN、DIP、DOP的平均吸收速率略高于在黑暗时段的平均吸收速率, 而浒苔在光照时段对DON的吸收速率略低于在黑暗时段的平均吸收速率。光照时段浒苔对DTN和DTP的平均吸收速率均略高于黑暗时段的平均吸收速率。分析数据发现, 光照时段的浒苔对DIN、DON、DIP、DOP、DTN和DTP的平均吸收速率与黑暗时段的平均吸收速率并没有显著差异(P > 0.05)。光照对浒苔吸收氮磷营养盐的速率没有明显影响。5天内, 浒苔对DIN、DON、DIP和DOP的平均吸收速率分别为10.87 μmol·g–1·d–1、2.41μmol·g–1·d–1、0.183 μmol·g–1·d–1和0.023 μmol·g–1·d–1。
| 光照条件 | 取样时间 | DIN | DON | DIP | DOP | DTN | DTP |
| 光照 | 第0—12 h | 8.956±2.522 | 2.847±2.513 | 0.209±0.074 | 0.079±0.014 | 11.80±2.517 | 0.289±0.061 |
| 非光照 | 第13—24 h | 6.221±0.851 | 6.644±0.691 | 0.240±0.043 | 0.021±0.007 | 12.86±0.771 | 0.261±0.112 |
| 光照 | 第25—36 h | 12.37±1.879 | 1.625±0.473 | 0.230±0.039 | 0.010±0.008 | 13.99±1.176 | 0.240±0.043 |
| 非光照 | 第37—48 h | 8.136±2.074 | 1.436±0.457 | 0.124±0.099 | 0.013±0.006 | 9.572±1.265 | 0.137±0.044 |
| 光照 | 第49—60 h | 13.35±1.877 | 1.330±2.640 | 0.162±0.083 | 0.025±0.006 | 14.68±2.258 | 0.188±0.040 |
| 非光照 | 第61—72 h | 12.48±0.691 | 0.762±1.424 | 0.178±0.079 | 0.006±0.093 | 13.25±1.058 | 0.184±0.088 |
| 光照 | 第73—84 h | 11.92±1.859 | 0.488±3.054 | 0.177±0.020 | 0.021±0.016 | 12.41±2.457 | 0.198±0.064 |
| 非光照 | 第84—96 h | 12.40±1.598 | 2.956±1.130 | 0.171±0.094 | 0.037±0.002 | 15.36±1.364 | 0.208±0.028 |
| 光照 | 第97—108 h | 11.40±0.981 | 4.017±0.629 | 0.186±0.069 | 0.001±0.010 | 15.42±0.805 | 0.188±0.088 |
| 非光照 | 第109—120 h | 11.46±3.150 | 2.004±0.875 | 0.145±0.072 | 0.018±0.007 | 13.46±2.012 | 0.164±0.175 |
| 光照平均 | 11.60±1.824 a | 2.061±1.862 a | 0.193±0.057 a | 0.027±0.011 a | 13.66±1.843 a | 0.221±0.059 a | |
| 非光照平均 | 10.14±1.673 a | 2.760±0.915 a | 0.172±0.077 a | 0.019±0.023 a | 12.90±1.294 a | 0.191±0.003 a | |
| 注: a表示无显著差异 | |||||||
本研究计算了海水中主要的3种生源要素在海水中的消耗。从表 2结果看到, 浒苔培养体系的海水中无机形态的营养盐消耗量均高于该元素的有机形态消耗量。其中, 无机氮和无机磷的消耗分别占总氮和总磷的87.9%和75.4%, 而无机碳消耗量占总碳消耗量的比例最低, 但是这个数值并不能代表实际上真正的无机碳的消耗量和总碳的消耗量的比值, 因为空气中有一部分CO2进入实验体系中, 以无机碳的形式被吸收。
| 海水中 | 浒苔体内 | ||||||
| 减少的量 | 比例 | 增加的量 | 比例 | 有机转化效率 | |||
| N | 无机氮/μmol | 356.60±11.10 | 87.91% | 7.721±1.092 | 2.34% | 97.33% | |
| 有机氮/μmol | 49.04±13.87 | 12.08% | 321.81±67.44 | 97.66% | |||
| 溶解总氮/μmol | 405.64±16.64 | 329.53±66.35 | |||||
| P | 无机磷/μmol | 4.966±0.313 | 75.40% | 约为0.000 5 | 0.009% | 99.99% | |
| 有机磷/μmol | 1.62±0.32 | 24.60% | 5.316 5±0.221 | 99.991% | |||
| 溶解总磷/μmol | 6.586±0.164 | 5.317±0.221 | |||||
| C | 无机碳/μmol | 6.605±0.87 | 61.28% | 0.363±0.245 | 2.33% | 96.84% | |
| 有机碳/μmol | 4.103±1.08 | 38.72% | 15.250±0.001 | 97.67% | |||
| 溶解总碳/μmol | 10.778±1.29 | 15.613±0.092 | |||||
对浒苔体内主要的3种生源要素的有机和无机形态测定(表 2), 结果显示, 在浒苔的体内, 有机形态成分均远高于无机形态成分, 这是生物体吸收同化无机物并转化为有机物以供自身生长代谢的重要特点。5天内在浒苔体中, 无机氮和无机碳的增长仅占总氮和总碳增长的2.3%左右, 无机磷的增加不到总磷增加量的0.01%, 以上说明无机氮和无机碳进入浒苔机体内很快被转化成为有机氮和有机碳。浒苔对吸收的无机氮、无机磷和无机碳同化为有机形态的转化效率分别为: 97.33%, 99.99%和96.84%。在整个实验体系内, 所测得海水中生源物质的减少量与浒苔体内生源物质的增长量有一定差异, 可能是海水中的营养物质被容器或浒苔吸附而没有被浒苔所吸收造成的。
3 讨论 3.1 流水系统中浒苔的氮、磷吸收速率在普通实验的氮、磷吸收的研究中, 需要短时间内(第0—12 h)监测水体中的营养盐浓度, 一般都是一次性添加营养盐。如果要做连续的营养盐补充实验, 需要每日或者定时向培养系统中添加营养盐, 实验过程工作量较大且不足以反映现场条件下浒苔对营养盐的吸收过程。本研究设计的流水系统能给藻体创造一个相对稳定的培养环境, 以模拟海水不断更新以及补充营养盐的过程, 并且营养盐的补充速度能够被控制。用这个系统来进行模拟实验, 既可以避免现场围隔实验环境因子的不确定性, 也能够较准确地量化浒苔对海水中氮磷营养盐的吸收情况。从得到的数据结果看(表 1), 5 d内浒苔对各个营养盐的吸收速率很稳定, 说明在流水系统中浒苔的生长状态是比较稳定的。
本研究结果中浒苔对DIN、DON、DIP和DOP一直都有吸收作用, 其平均吸收速率分别为10.87 μmol·g–1·d–1、2.41 μmol·g–1·d–1、0.183 μmol·g–1·d–1和0.023 μmol·g–1·d–1。与其他学者的结果进行比较, 史华明[13]和吴晓文等[14]等学者的研究发现浒苔对硝态氮的吸收速率均高于100 μmol·g–1·d–1, 因为他们培养浒苔的水体都添加了营养盐, 提高了水体的氮磷营养盐的浓度, 而黄海现场海水的营养盐浓度并达不到实验设置的浓度。本研究采用自然海水, 可以更好地反映现场条件下浒苔对氮磷营养盐的吸收情况。同时李瑞香等[17]对不做任何添加的海水围隔实验中, 得到氮的平均吸收速率为6.48 μmol·g–1·d–1, 磷的平均吸收速率为0.9 μmol·g–1·d–1, 明显低于本研究中的氮磷平均吸收速率, 而本研究中原始的海水营养盐浓度与该围隔中的浓度相差不大。吸收速率有差异的原因可能是因为现场围隔实验的环境因子(如天气、污染等)有太多的不确定性, 而海水的补充作用没法考虑在其中。Li[18]等通过室内培养实验发现浒苔不仅可以快速吸收海水中的无机态营养盐, 同样对尿素、甘氨酸、腺苷三磷酸及葡萄糖-6-磷酸等小分子有机营养盐也具有较高的吸收速率。
从流水系统中, 五天内收集的溢出的海水的营养盐浓度来看, 海水中的DIN的浓度约为10 μmol/L, 说明流动体系的海水中氮营养盐没有消耗完全; 而且DIN的吸收量确实还随着时间的变化(浒苔生物量的生长)呈现增长趋势, 因此以本实验的DIN吸收速率来模拟浒苔在黄海绿潮发生过程中的吸收速率是可以采用的。而溢出的海水中PO43-的浓度很低, 其吸收量在整个5天内没有太大的变化。来自青岛海域的海水中PO43-为磷限制, 且限制作用较为明显。而发生绿潮的黄海, 也是典型的磷限制海域[19]。那么本研究流水系统下浒苔对磷营养盐的吸收速率可能与浒苔在黄海绿潮发生过程中的吸收速率比较一致。
从浒苔培养海水中的营养盐变化看, 海水中的无机氮和有机氮不仅浓度降低了, 而且在水体中的比例也有所改变, 起始海水中无机氮浓度比有机氮浓度为4︰1, 实验后此比值为1.5︰1到19︰1)。不同的氮源的比例和浓度均会影响海洋藻类的生长、营养组成以及一系列生命活动[20-22]; 混合氮源下, 不同比例的氮源也会影响藻类的生长和光合作用[19, 23]; 不同比例的氮源还会影响藻类之间的生长竞争[24-25]。营养盐结构和氮源比例的变化很有可能会影响整个生态系统的结构和生物多样性。
3.2 浒苔对生源要素的转化效率从浒苔对海水中无机碳和总碳的消耗量的比值来看, 这个数值并不能代表实际上真正的实际值, 因为空气中的CO2是能够溶于海水中的。特别在海水中无机碳浓度有所消耗和下降时, 空气中的CO2能加快其溶于水的速度。因此, 在整个研究体系中, CO2进入该体系的量是未知的, 在此实验中无机碳的消耗量占总碳消耗量的比值高于61%。从浒苔的总碳的增长量来看, 忽略海水中的各种形态的碳的被吸附作用, 5 d内应该有4.835 mmol的CO2被吸收。那么, 被浒苔吸收的CO2与DIC的比例为1︰1.4, 由此看来, 浒苔对CO2的吸收和固定的能力很强, 如果绿潮暴发, 空气中大量的CO2将被吸收固定, 这对碳的海洋物质循环过程有很大的影响。
本研究结果表明浒苔对无机磷转化效率达99.99%, 而且浒苔体内无机磷的增长十分的少, 说明浒苔所吸收无机磷几乎都被转化成为有机磷, 这可能与海水中磷限制有关。浒苔体内无机磷几乎全部被转化利用了, 没有多余的无机态磷储存在细胞里。而浒苔对其他无机营养盐的转化效率均高于95%, 浒苔将各种无机营养元素同化为自身有机的生命结构, 这也是浒苔的正常生理过程。
浒苔绿潮的暴发会使浒苔吸收海水中的大量碳、氮、磷等生源物质以及大气中的CO2, 并将这些无机形态的生源要素转化为有机形态, 从而快速进入物质循环。绿潮浒苔对海水中生源要素的吸收、利用和释放会加快海洋生态系统的物质循环, 从根本上改变生态系统[26-28]; 绿潮这种特殊的灾害可以改变生源要素地球化学循环过程的方向和强度。黄海大规模的绿潮携带如此多的有机态生源要素聚集在黄海, 绿潮消亡后可能会对局部海域的生物地球化学循环过程产生影响, 绿潮后期的生态效应还有待进一步研究。
4 结论黄海绿潮暴发期间以浒苔为主的漂浮绿藻生物量可达数百万吨, 在绿潮发生、发展和消亡过程中, 藻体的快速生长以及死亡分解过程可能会影响海域生源要素的迁移转化。为探讨浒苔在生态系统物质循环中的作用, 本研究在流动海水的模拟系统中研究了浒苔对海水营养盐的吸收和转化过程, 发现浒苔藻体对不同形态的氮、磷均有吸收, 而且能够高效地将无机形态的氮、磷和碳转化为自身有机形态物质, 这为深入探究黄海绿潮的生态效应提供了重要理论依据。绿潮暴发过程中, 漂浮浒苔能够实现对海水中营养盐的快速吸收和转化, 加快生源物质进入生态系统的物质循环过程, 而藻体腐烂分解过程中又将这些营养物质释放到水体中, 可能产生一系列生态效应, 值得进一步研究。
| [1] |
Blomster J, B ck S, Fewer D P, et al. Novel morphology in Enteromorpha (Ulvophyceae) forming green tides[J]. American Journal of Botany, 2002, 89(11): 1756-1763. DOI:10.3732/ajb.89.11.1756 |
| [2] |
Smetacek V, Zingone A. Green and golden seaweed tides on the rise[J]. Nature, 2013, 504(7428): 84-88. |
| [3] |
Zhou M J, Liu D Y, Anderson D M, et al. Introduction to the Special Issue on green tides in the Yellow Sea[J]. Estuarine, Coastal and Shelf Science, 2015, 163: 3-8. DOI:10.1016/j.ecss.2015.06.023 |
| [4] |
Leliaert F, Zhang X W, Ye N H, et al. Research note:Identity of the Qingdao algal bloom[J]. Phycological Research, 2009, 57(2): 147-151. DOI:10.1111/j.1440-1835.2009.00532.x |
| [5] |
田千桃, 霍元子, 张寒野, 等. 浒苔和条浒苔生长及其氨氮吸收动力学特征研究[J]. 上海海洋大学学报, 2010, 19(2): 252-258. Tian Qiantao, Huo Yuanzi, Zhang Hanye, et al. Preliminary study on growth and NH4- -Nuptake kinetics of Enteromorpha prolifera and Enteromorpha clathrata[J]. Journal of Shanghai Ocean University, 2010, 19(2): 252-258. |
| [6] |
梁宗英, 林祥志, 马牧, 等. 浒苔漂流聚集绿潮现象的初步分析[J]. 中国海洋大学学报(自然科学版), 2008, 38(4): 601-604. Liang Zongying, Lin Xiangzhi, Ma Mu, et al. A preliminary study of the Enteromorpha prolifera drift gathering causing the Green Tide phenomenon[J]. Periodical of Ocean University of China, 2008, 38(4): 601-604. |
| [7] |
Liu D Y, Keesing J K, Dong Z J, et al. Recurrence of the world's largest green tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms[J]. Marine Pollution Bulletin, 2010, 60(9): 1423-1432. DOI:10.1016/j.marpolbul.2010.05.015 |
| [8] |
Fan S L, Fu M Z, Wang Z L, et al. Temporal variation of green macroalgal assemblage on Porphyra aquaculture rafts in the Subei Shoal, China[J]. Estuarine, Coastal and Shelf Science, 2015, 163: 23-28. DOI:10.1016/j.ecss.2015.03.016 |
| [9] |
夏斌, 马绍赛, 崔毅, 等. 黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系[J]. 渔业科学进展, 2009, 30(5): 94-101. Xia Bin, Ma Shaosai, Cui Yi, et al. Distribution of temperature, salinity, dissolved oxygen, nutrients and their relationships with green tide in Enteromorpha prolifera outbreak area of the Yellow Sea[J]. Progress in Fishery Sciences, 2009, 30(5): 94-101. |
| [10] |
2012年北海区海洋灾害公报[Z].国家海洋局北海分局, 2012: 21-23. Beihai Marine Disaster Bulletin, 2012[Z]. Beihai Branch of the State Oceanic Administration, 2012: 21-23. |
| [11] |
Ye N H, Zhang X W, Mao Y Z, et al. 'Green tides' are overwhelming the coastline of our blue planet:taking the world's largest example[J]. Ecological Research, 2011, 26: 477-485. DOI:10.1007/s11284-011-0821-8 |
| [12] |
江海英, 罗鹏, 于宗赫, 等. 大亚湾浒苔分子鉴定及其对养殖废水中营养盐的吸收特性研究[J]. 热带海洋学报, 2013, 32(5): 93-98. Jiang Haiying, Luo Peng, Yu Zonghe, et al. Identification of Enteromorpha sp. from Daya Bay and its capacity of absorbing nutrients from aquaculture wastewater[J]. Journal of Tropical Oceangraphy, 2013, 32(5): 93-98. |
| [13] |
史华明.浒苔对氮磷吸收和释放及与中肋骨条藻竞争关系的初步研究[D].青岛: 中国海洋大学, 2009. Shi Huaming. The preliminary study of Enteromorpha absorption and release properties of nitrogen and phosphorus and the competition with Skeletonema costatum[D]. Qingdao: Ocean University of China, 2009. |
| [14] |
吴晓文, 李瑞香, 徐宗军, 等. 营养盐对浒苔生长影响的围隔生态实验[J]. 海洋科学进展, 2010, 28(4): 538-544. Wu Xiaowen, Li Ruixiang, Xu Zongjun, et al. Mesocosm experiments of nutrient effects on Enteromorpha prolifera growth[J]. Advances in Marine Science, 2010, 28(4): 538-544. |
| [15] |
李靖, 李宁云, 敖新宇, 等. 剑湖湿地水生植物金鱼藻与茭草对环境氮素的响应[J]. 贵州农业科学, 2012, 40(4): 143-145. Li Jing, Li Ningyun, Ao Xinyu, et al. Response of Aquatic Plants Ceratophyllum demersum and Zizania caduciflora upon environment nitrohen in Jianhu Lake[J]. Guizhou Agricultural Sciences, 2012, 40(4): 143-145. |
| [16] |
赵海超.不同形态磷在水-沉水植物-沉积物系统中的迁移转化[D].呼和浩特: 内蒙古大学, 2006. Zhao Haichao. Transplant and translation of different forms phosphorus in water-sediment-submerged plan[D]. Hohhot: Inner Mongilia Agriculural unersity, 2006. http://d.wanfangdata.com.cn/thesis/Y919346 |
| [17] |
李瑞香, 吴晓文, 韦钦胜, 等. 不同营养盐条件下浒苔的生长[J]. 海洋科学进展, 2009, 27(2): 211-216. Li Ruixiang, Wu Xiaowen, Wei Qinsheng, et al. Growth of Enteromorpha Prolifera under different Nutrient Conditions[J]. Advances in Marine Science, 2009, 27(2): 211-216. |
| [18] |
Li H, Zhang Y Y, Han X R, et al. Growth responses of Ulva prolifera to inorganic and organic nutrients:Implications for macroalgal blooms in the southern Yellow Sea, China[J]. Scientific Reports, 6: 26498. DOI:10.1038/srep26498 |
| [19] |
夏斌, 马绍赛, 崔毅, 等. 黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系[J]. 渔业科学进展, 2009, 30(5): 94-101. Xia Bin, Ma Shaosai, Cui Yi, et al. Distribution of temperature, salinity, dissolved oxygen, nutrients and their relationships with green tide in Enteromorpha prolifera outbreak area of the Yellow Sea[J]. Progress in Fishery Sciences, 2009, 30(5): 94-101. |
| [20] |
侯继灵.不同氮源和铁对浮游植物生长影响的围隔实验研究[D].青岛: 中国海洋大学, 2006. Hou Jiling. Influence of nitrogen nutrients and iron to the growth of Phytoplankton in mesocosm experiments[D]. Qingdao: Ocean University of China, 2006. |
| [21] |
蒋汉明, 高坤山. 氮源及其浓度对三角褐指藻生长和脂肪酸组成的影响[J]. 水生生物学报, 2004, 28(5): 545-551. Jiang Hanming, Gao Kunshan. Effects of nitrogen sources and concentrations on the growth and fatty acid composition of phaeoda-ctylum tricornutum[J]. Acta Hydrobiologica Sinica, 2004, 28(5): 545-551. |
| [22] |
王菊芳, 吴海珍, 梁世中, 等. 氮源对隐甲藻(Crypthecodiniumcohnii)生长和DHA产量的影响[J]. 海洋通报, 2001, 20(5): 18-23. Wang Jufang, Wu Haizhen, Liang Shizhong, et al. Effects of nitrogen sources on the growth and DHA accumulation in Crypthecodinium cohnii[J]. Marine Science Bulletin, 2001, 20(5): 18-23. |
| [23] |
陈园, 徐宁, 段舜山. 有机氮比例和光强对赤潮藻球形棕囊藻生长和光合作用的影响[J]. 生态环境学报, 2011, 20(3): 499-504. Chen Yuan, Xu Ning, Duan Shunshan. Effects of the ratios of organic nitrogen and light intensity on the growth and photosynthesis of the brown tide Phaeocystis globosa[J]. Ecology and Environmental Sciences, 2011, 20(3): 499-504. |
| [24] |
袁征.铁、不同氮源和光强对海洋微藻生长的交互影响[D].青岛: 中国海洋大学, 2003. Yuan Zheng. Interactions between iron, light and nitrogen nutrients on the growth of marine microalgae[D]. Qingdao: Ocean University of China, 2003. http://d.wanfangdata.com.cn/thesis/Y522947 |
| [25] |
朱艺峰, 林霞, 朱鹏, 等. 混合氮源对扁藻与金藻共培养和单种培养生长的影响[J]. 海洋科学, 2006, 30(8): 34-40. Zhu Yifeng, Lin Xia, Zhu Peng, et al. Effects of mixed nitrogen sources on growth of mixed culture and monoculture of Platymonas subcordiformis and Isochrysis galbana[J]. Marine Sciences, 2006, 30(8): 34-40. |
| [26] |
Valiela I, McClelland J, Hauxwell J, et al. Macroalgal blooms in shallow estuaries:controls and ecophysiological and ecosystem consequences[J]. Limnology and Oceanography, 1997, 42(5): 1105-1118. |
| [27] |
孟祥森, 张文斌, 高丽, 等. 绿潮硬毛藻分解对天鹅湖水体氮磷水平的影响[J]. 环境科学研究, 2017, 30(5): 697-704. Meng Xiangsen, Zhang Wenbin, Gao Li, et al. Effects of the decomposition of Chaetomorpha sp. on nitrogen and phosphorus levels in water from Swan Lake[J]. Research of Environmental Sciences, 2017, 30(5): 697-704. |
| [28] |
Gao L, Zhang L H, Hou J Z, et al. Decomposition of macroalgal blooms influences phosphorus release from the sediments and implications for coastal restoration in Swan Lake, Shandong, China[J]. Ecological Engineering, 2013, 60: 19-28. DOI:10.1016/j.ecoleng.2013.07.055 |
 2020, Vol. 44
2020, Vol. 44


