文章信息
- 于莹, 徐晓甫, 王硕, 张博伦, 张武昌. 2021.
- YU Ying, XU Xiao-fu, WANG Shuo, ZHANG Bo-lun, ZHANG Wu-chang. 2021.
- 天津大神堂海域人工鱼礁区砂壳纤毛虫群落的季节变化
- Seasonal variation of tintinnid community in the artificial fish reef area of Dashentang waters in Tianjin
- 海洋科学, 45(11): 96-104
- Marine Sciences, 45(11): 96-104.
- http://dx.doi.org/10.11759/hykx20210310002
-
文章历史
- 收稿日期:2021-03-10
- 修回日期:2021-05-18
2. 天津市水产研究所, 天津 300457;
3. 中国科学院海洋研究所 中国科学院海洋生态与环境科学重点实验室, 山东 青岛 266071;
4. 青岛海洋科学与技术(试点)国家实验室, 海洋生态与环境科学功能实验室, 山东 青岛 266237;
5. 中国科学院 海洋大科学研究中心, 山东 青岛 266071
2. Tianjin Fisheries Research Institute, Tianjin 300457, China;
3. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
砂壳纤毛虫是一类在海洋中广泛存在的原生动物, 其个体微小, 粒径约为20~200 μm, 虫体外部具有壶形、花瓶形或管形的外壳; 外壳的大小、形状和结构等特征是砂壳纤毛虫分类的主要依据, 目前中国海区共记录砂壳纤毛虫140余种[1]。砂壳纤毛虫主要摄食浮游植物、鞭毛虫、细菌等, 同时又被中型浮游动物和鱼类幼体所摄食, 是连接微食物环和经典食物链的重要中介[2, 3]。
渤海湾位于渤海西部, 是许多经济鱼虾类的产卵场和索饵场, 但随着环渤海经济的快速发展, 高强度营养盐输入和高强度开发造成渤海湾生物资源和生态环境面临十分严峻的形势。人工鱼礁建设是一项重要的渔业资源增殖和海洋生态修复措施, 投放人工鱼礁会改变海区的水动力条件和营养盐结构[4], 进而影响水体的浮游植物[5-6]、浮游动物[7-8]和底栖生物[9-10]等, 形成独特的人工礁区生态系统。本文在渤海湾天津大神堂人工鱼礁区进行砂壳纤毛虫群落的季节调查, 为礁区独特生态系统的研究及渔业资源的可持续发展提供参考资料。
1 材料与方法本研究选取天津大神堂海域2014年4月投放人工鱼礁区进行砂壳纤毛虫群落的调查。该鱼礁区共投放约2 600块礁体, 礁体高于海底约1.02 m, 总面积约为0.36 km2。
于投礁1~2 a后夏季(2015年7月14、20日)、秋季(2015年10月13、16日)和春季(2016年5月5日)在该海域进行砂壳纤毛虫样品的采集。共设10个站位, 其中鱼礁区和对照区各设5个站位, 水深范围为5~10 m (图 1)。
 |
|
图 1 调查站位图 Fig. 1 Location of sampling stations in Dashentang waters |
用YSI Professional Plus便携式水质分析仪测定表层海水的温度和盐度; 取表层500 mL水样经过GF/F滤膜过滤, 滤膜用90%丙酮在黑暗中–20 ℃下萃取24 h后, 用分光光度计测量叶绿素a(Chl a)浓度。
在各站表层取10 L水样, 用孔径20 µm的筛绢过滤浓缩成约150 mL水样, 立即用鲁戈试剂固定, 终浓度为1%, 低温避光保存。在Olympus IX71倒置显微镜下100倍或400倍镜检, 根据文献鉴定种类[1, 11-12]。测量砂壳纤毛虫肉体的体长、体宽等, 按最接近的几何形状(如柱体、球体和锥体)计算体积, 生物量由体积乘转换系数(0.19 pg C/µm3)[13]得来。
根据徐兆礼等[14]所用的公式计算优势度(Y), 公式如下:
式中, ni为第i种的个体数; N为总个体数; fi为第i种在各个站位出现的频率; Y > 0.02时, 该种为优势种。
砂壳纤毛虫群落的多样性采用Shannon指数(H′) [15], 均匀度采用Pielou指数(J)[16], 其公式分别如下:
式中, S为物种种类数; Pi为第i种的个体数与总个体数的比值。
采用Surfer 13软件绘制站位图、折线图和柱状图, 采用SPSS 19软件进行ANOVA单因素方差分析、相关性分析, 采用PRIMER 6软件进行聚类分析, 砂壳纤毛虫丰度数据采用开四次方根处理。
2 结果 2.1 环境因子调查海域表层海水环境因子季节变化明显, 温度夏季高于春季和秋季, 盐度春季高于夏季和秋季, Chl a浓度秋季高于春季和夏季(图 2)。
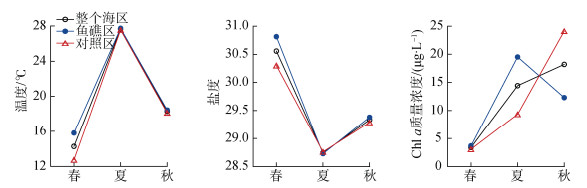 |
| 图 2 大神堂海域3个季节表层海水温度、盐度和Chl a浓度的变化 Fig. 2 Seasonal variation of surface water temperature, salinity and Chl a concentration in Dashentang waters |
鱼礁区和对照区表层海水环境因子存在一定的差异。3个季节鱼礁区温度均高于对照区, ANOVA单因素方差分析表明春季鱼礁区和对照区差异显著(P < 0.05), 夏季和秋季差异不显著(P > 0.05); 除夏季外, 鱼礁区盐度均高于对照区, 其中春季鱼礁区和对照区差异显著(P < 0.05), 夏季和秋季差异不显著(P > 0.05); 除秋季外, 鱼礁区Chl a浓度均高于对照区, 其中春季鱼礁区和对照区差异不显著(P > 0.05), 夏季和秋季差异显著(P < 0.05)(图 2)。
2.2 砂壳纤毛虫种类3个季节共鉴定出砂壳纤毛虫10属31种, 拟铃虫属种类最多(15种, 表 1), 有两个渤海新纪录种——薄壳真铃虫(Eutintinnus tenuis)和小领细壳虫(Stenosemella parvicollis)。夏季鉴定的砂壳纤毛虫种类数最多(20种)。
| 种类 | 优势度 | 最大丰度(个/L) | ||||||||||
| 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | |||||||
| 鱼礁区 | 对照区 | 鱼礁区 | 对照区 | 鱼礁区 | 对照区 | |||||||
| 尖底类瓮虫(Amphorellopsis acuta) | < 0.01 | 5 | 2 | |||||||||
| 鲁西塔尼亚类铃虫(Codonellopsis lusitanica) | < 0.01 | < 0.01 | 1 | 5 | ||||||||
| 运动类铃虫(C. mobilis) | < 0.01 | 30 | ||||||||||
| 薄壳真铃虫*(Eutintinnus tenuis) | < 0.01 | < 0.01 | 7 | 7 | 2 | |||||||
| 管状真铃虫(E. tubulosus) | 0.05 | 0.69 | 49 | 41 | 75 | |||||||
| 钟状网纹虫(Favella campanula) | 0.01 | 18 | 7 | |||||||||
| 巴拿马网纹虫(F. panamensis) | < 0.01 | 10 | 12 | |||||||||
| 长形旋口虫(Helicostomella longa) | < 0.01 | 3 | 17 | |||||||||
| 诺氏薄铃虫(Leprotintinnus nordqvisti) | < 0.01 | < 0.01 | < 0.01 | 2 | 44 | 5 | 3 | |||||
| 简单薄铃虫(L. simplex) | < 0.01 | < 0.01 | < 0.01 | 2 | 2 | 8 | 2 | |||||
| 兆氏类杯虫(Metacylis jorgensenii) | 0.38 | 953 | 237 | |||||||||
| 卵形类杯虫(M. oviformis) | 0.04 | 17 | 62 | |||||||||
| 三亚类杯虫(M. sanyahensis) | 0.13 | < 0.01 | 79 | 199 | 5 | |||||||
| 小领细壳虫*(Stenosemella parvicollis) | 0.11 | 69 | 40 | |||||||||
| 黏粘筒壳虫(Tintinnidium mucicola) | < 0.01 | 2 | 4 | |||||||||
| 原始筒壳虫(T. primitivum) | 0.01 | < 0.01 | 12 | 3 | 7 | |||||||
| 厦门拟铃虫(Tintinnopsis amoyensis) | < 0.01 | 5 | ||||||||||
| 波罗的拟铃虫(T. baltica) | < 0.01 | 3 | ||||||||||
| 百乐拟铃虫(T. beroidea) | < 0.01 | < 0.01 | 2 | 4 | 8 | 7 | ||||||
| 巴西拟铃虫(T. brasiliensis) | 0.61 | 897 | 37 | |||||||||
| 布氏拟铃虫(T. butschlii) | 0.15 | < 0.01 | 82 | 243 | 3 | |||||||
| 清兰拟铃虫(T. chinglanensis) | 0.01 | 67 | ||||||||||
| 寇氏拟铃虫(T. kofoidi) | < 0.01 | 1 | ||||||||||
| 罗氏拟铃虫(T. lohmanni) | < 0.01 | 23 | 16 | |||||||||
| 矮小拟铃虫(T. nana) | < 0.01 | < 0.01 | 7 | 3 | ||||||||
| 根状拟铃虫(T. radix) | < 0.01 | < 0.01 | 1 | 5 | 18 | |||||||
| 圆锥拟铃虫(T. rapa) | 0.08 | 212 | ||||||||||
| 斯氏拟铃虫(T. schotti) | < 0.01 | 1 | ||||||||||
| 妥肯丁拟铃虫(T. tocantinensis) | < 0.01 | < 0.01 | 1 | 4 | 6 | |||||||
| 管状拟铃虫(T. tubulosa) | < 0.01 | < 0.01 | 2 | 22 | 2 | |||||||
| 筒状拟铃虫(T. tubulosoides) | < 0.01 | < 0.01 | 7 | 2 | ||||||||
| *. 渤海新纪录种 | ||||||||||||
砂壳纤毛虫优势种季节变化明显, 春季优势种为巴西拟铃虫(Tintinnopsis brasiliensis)和圆锥拟铃虫(Tintinnopsis rapa); 夏季优势种为兆氏类杯虫(Metacylis jorgensenii)、布氏拟铃虫(Tintinnopsis butschlii)、三亚类杯虫(Metacylis sanyahensis)、管状真铃虫(Eutintinnus tubulosus)和卵形类杯虫(Metacylis oviformis); 秋季优势种为管状真铃虫(Eutintinnus tubulosus)和小领细壳虫。
鱼礁区和对照区砂壳纤毛虫优势种春季不同, 夏季和秋季相同。3个季节鱼礁区第Ⅰ优势种的优势度均比对照区明显高(表 2)。
| 排序 | 鱼礁区 | 对照区 | ||||
| 优势种 | 优势度 | 优势种 | 优势度 | |||
| 春季 | Ⅰ | 巴西拟铃虫 | 0.94 | 圆锥拟铃虫 | 0.78 | |
| Ⅱ | 原始筒壳虫 | 0.03 | 巴西拟铃虫 | 0.07 | ||
| 夏季 | Ⅰ | 兆氏类杯虫 | 0.71 | 布氏拟铃虫 | 0.21 | |
| Ⅱ | 布氏拟铃虫 | 0.09 | 三亚类杯虫 | 0.20 | ||
| Ⅲ | 三亚类杯虫 | 0.06 | 兆氏类杯虫 | 0.10 | ||
| 秋季 | Ⅰ | 管状真铃虫 | 0.80 | 管状真铃虫 | 0.43 | |
| Ⅱ | 小领细壳虫 | 0.13 | 小领细壳虫 | 0.13 | ||
砂壳纤毛虫丰度、生物量和壳的口径存在明显的季节差异。砂壳纤毛虫平均丰度和生物量夏季最高, 秋季最低; 砂壳纤毛虫壳的平均口径夏季最大, 秋季最小(图 3)。
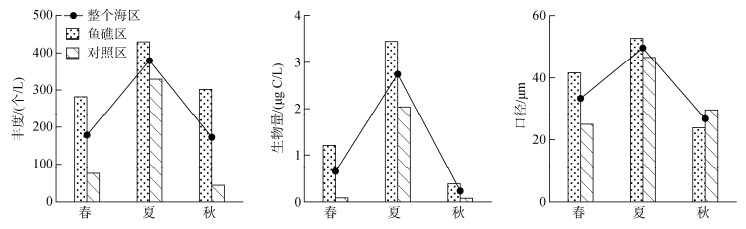 |
| 图 3 3个季节大神堂海域砂壳纤毛虫丰度、生物量和口径的变化 Fig. 3 Seasonal variation of abundance, biomass and lorica oral diameter of tintinnids in Dashentang waters in three seasons |
3个季节鱼礁区砂壳纤毛虫丰度均比对照区高, ANOVA单因素方差分析表明春季和秋季鱼礁区和对照区差异显著(P < 0.05), 夏季差异不显著(P > 0.05); 3个季节鱼礁区砂壳纤毛虫生物量均比对照区高, 其中春季和秋季鱼礁区和对照区差异显著(P < 0.05), 夏季差异不显著(P > 0.05); 春、夏季鱼礁区砂壳纤毛虫口径大于对照区, 且差异显著(P < 0.05), 秋季鱼礁区砂壳纤毛虫口径小于对照区, 且差异不显著(P > 0.05) (图 3)。
2.4 砂壳纤毛虫群落结构聚类分析表明, 除10-DZ4一个站位外, 砂壳纤毛虫群落主要分为3组, 组Ⅰ包括春季所有站位, 组Ⅱ包括秋季9个站位, 组Ⅲ包括夏季所有站位(图 4)。各个季节的砂壳纤毛虫群落分别聚集在一起, 砂壳纤毛虫群落结构表现出明显的季节变化。春季砂壳纤毛虫群落(组Ⅰ)明显分为鱼礁区和对照区两类, 表现出明显的区域变化; 夏季和秋季砂壳纤毛虫群落没有表现出明显的区域变化(图 4)。
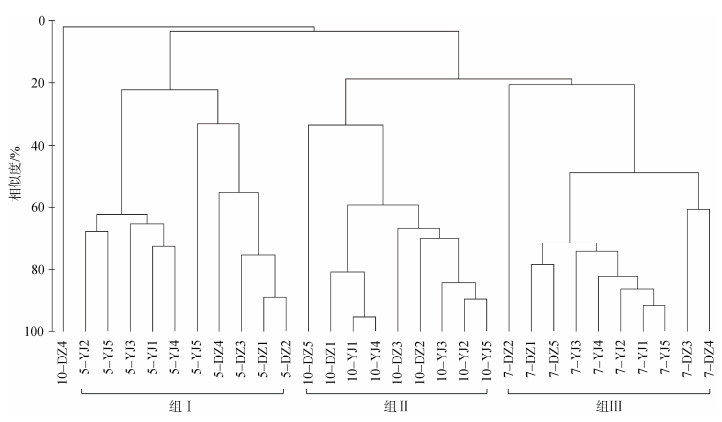 |
| 图 4 大神堂海域3个季节砂壳纤毛虫群落结构的聚类分析 Fig. 4 Hierarchical cluster analysis of tintinnid community structures in Dashentang waters in three seasons YJ. 鱼礁区站位; DZ. 对照区站位 YJ. stations in the artificial fish reef area; DZ. stations in the adjacent area |
砂壳纤毛虫群落多样性指数表现出明显的季节变化。砂壳纤毛虫群落Shannon多样性指数夏季最高, 春季最低; Pielou均匀度指数秋季最高, 春季最低。
3个季节鱼礁区Shannon多样性指数均低于对照区, 且ANOVA单因素方差分析表明3个季节鱼礁区和对照区差异均不显著(P > 0.05); 3个季节鱼礁区Pielou均匀度指数均低于对照区, 且春季和秋季鱼礁区和对照区差异显著(P < 0.05), 夏季差异不显著(P > 0.05, 图 5)。
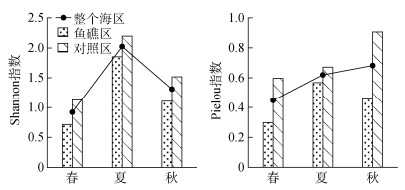 |
| 图 5 3个季节大神堂海域砂壳纤毛虫群落多样性指数的变化 Fig. 5 Seasonal variation of Shannon index and Pielou index of the tintinnid community in Dashentang waters |
砂壳纤毛虫优势种——兆氏类杯虫丰度与温度呈显著的正相关(P < 0.05), 卵形类杯虫、三亚类杯虫和布氏拟铃虫丰度均与温度呈极显著的正相关(P < 0.01); 卵形类杯虫、三亚类杯虫和布氏拟铃虫丰度均与盐度呈显著的负相关(P < 0.05), 巴西拟铃虫丰度与盐度呈显著的正相关(P < 0.05); 各优势种丰度与Chl a浓度均没有显著的相关性(表 3)。
| 优势种丰度/(个/L) | 总丰度/(个/L) | 总生物量/(μg C·L–1) | 种类数/个 | ||||||||
| 管状真铃虫 | 兆氏类杯虫 | 卵形类杯虫 | 三亚类杯虫 | 小领细壳虫 | 巴西拟铃虫 | 布氏拟铃虫 | 圆锥拟铃虫 | ||||
| 温度/℃ | –0.028 | 0.445* | 0.540** | 0.548** | –0.144 | –0.189 | 0.507** | –0.283 | 0.381* | 0.522** | 0.729** |
| 盐度 | –0.149 | –0.340 | –0.416* | –0.447* | –0.122 | 0.444* | –0.401* | 0.209 | –0.207 | –0.314 | –0.543** |
| Chl a浓度/(μg·L–1) | 0.050 | 0.230 | 0.183 | –0.015 | 0.258 | –0.243 | 0.186 | –0.238 | 0.057 | 0.135 | 0.016 |
| *. 差异显著(P < 0.05), **. 差异极显著(P < 0.01) | |||||||||||
砂壳纤毛虫总丰度与温度呈显著的正相关(P < 0.05), 与盐度和Chl a浓度均没有显著的相关性; 总生物量与温度呈极显著的正相关(P < 0.01), 与盐度和Chl a浓度均没有显著的相关性; 种类数与温度呈极显著的正相关(P < 0.01), 与盐度呈极显著的负相关(P < 0.01), 与Chl a浓度没有显著的相关性(表 3)。
3 讨论与中国其他海区相比, 渤海湾砂壳纤毛虫的资料较少, 目前只有两篇报道, 分别于2011年[17]和2015年[18]在渤海湾近岸海区进行了砂壳纤毛虫丰度、生物量和群落结构方面的调查。与之前的研究不同, 本文在渤海湾人工鱼礁区进行调查, 研究礁区独特生态系统中砂壳纤毛虫群落的季节变化。
3.1 季节变化一般情况下, 温带近岸海区如Hiroshima Bay[19]、Nervión River Estuary[20]、桑沟湾[21]等, 砂壳纤毛虫趋向在温度高的夏季丰度较高[22], 种类较多[23]。与之相似, 本研究中砂壳纤毛虫丰度和种类数均与温度呈显著的正相关, 夏季砂壳纤毛虫丰度和种类数均比春季和秋季明显要高。
与我国渤海、北黄海和南黄海大部分温带近岸海湾相比(表 4), 本研究中砂壳纤毛虫丰度和生物量均在已报道的范围之内, 种类数稍多。与渤海湾前期研究[18]相比, 本研究砂壳纤毛虫丰度较低, 生物量(除秋季外)却较高, 这是由于本研究中砂壳纤毛虫群落粒级较大, 导致生物量提高; 与夏季其他海湾[18, 21]相比, 渤海湾砂壳纤毛虫壳的口径明显较大, 这是由于夏季渤海湾的主要优势种兆氏类杯虫、布氏类杯虫、三亚类杯虫壳的口径均较大, 其口径分别为54.3、79.4和43.0 μm, 这可能与砂壳纤毛虫的饵料——浮游植物群落的粒级组成有关[24], 但本文没有分粒级Chl a浓度数据, 无法证实这一推测, 在今后研究中应该增加这方面的研究。
| 海区 | 丰度/(个/L) | 生物量(μg C·L–1) | 壳的口径/μm | 种类数/个 | 文献 | |||||||||||
| 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | 春季 | 夏季 | 秋季 | |||||
| 渤海湾 | 264 | 725 | 278 | 0.39 | 1.59 | 0.53 | 31.5 | 35.9 | 34.8 | 6 | 20 | 8 | [18] | |||
| 莱州湾* | 48 | 63 | 6 | — | — | — | — | — | — | 5 | 18 | 6 | [25] | |||
| 獐子岛 | 248 | 194 | 32 | 1.00 | 3.57 | 0.19 | — | — | — | 10 | 14 | 8 | [26] | |||
| 桑沟湾 | 101 | 2323 | 522 | 0.14 | 2.78 | 0.57 | 25.7 | 26.9 | 23.7 | 5 | 15 | 13 | [21] | |||
| 渤海湾 | 179 | 379 | 173 | 0.65 | 2.74 | 0.23 | 33.3 | 49.6 | 26.8 | 15 | 20 | 13 | 本研究 | |||
| *. 大型砂壳纤毛虫(> 76 μm)群落 | ||||||||||||||||
人工鱼礁建设对浮游生物、底栖生物、游泳动物等生物资源效果评估方面的研究很多, 大多研究表明鱼礁投放后各类群丰度和生物量都有了显著的增加[4, 27-28]; 但目前国内外人工鱼礁建设对微型浮游动物影响的研究很少。QIN等[29]比较了大亚湾珊瑚礁区、人工鱼礁区和对照海区原生生物的群落结构, 发现纤毛门相对丰度在人工鱼礁区最高; WU等[30]研究了大亚湾养殖区、人工鱼礁区和发电站附近海域浮游纤毛虫群落的时空分布, 发现浮游纤毛虫种类数在人工鱼礁区最高。本研究通过对比不同季节鱼礁区和对照区砂壳纤毛虫群落的差异, 初步评价鱼礁投放对微型浮游动物群落的影响。
本研究中, 3个季节鱼礁区砂壳纤毛虫的丰度和生物量均较对照区高, 我们推测这可能是因为投礁后砂壳纤毛虫的适口饵料——nano-浮游植物[31-32]丰度增加, 从而导致其大量生长繁殖。但本次调查中只测定了总Chl a浓度, 没有测定分粒级(pico-, nano-, net-)Chl a浓度, 无法用数据证实这一推测。相关性分析表明, 砂壳纤毛虫丰度和生物量与总Chl a浓度均没有明显的相关性, 这表明在渤海湾近岸海区, 总Chl a浓度不能很好地指示砂壳纤毛虫的饵料水平, 在今后调查中需要增加浮游植物群落粒级组成方面的研究。
多样性指数和均匀度指数能较系统地指示生物群落的结构组成及其稳定性, 一般种类丰富、各种类丰度分布均匀的群落, 其多样性指数较高, 群落较稳定[33-34]。本研究中3个季节渤海湾鱼礁区和对照区的优势种大体相同, 但鱼礁区主要优势种的优势度明显高于对照区, 这导致了鱼礁区砂壳纤毛虫群落Shannon指数和Pielou指数均比对照区的低, 这说明与对照区相比, 鱼礁区砂壳纤毛虫群落结构相对简单, 稳定性较差。这可能是因为本次调查是在投礁1~2 a后开展的, 时间较短, 鱼礁区砂壳纤毛虫群落可能需长时间才能趋于稳定[4, 35], 鱼礁区独特生态系统的变化尚需更长的时间来进行跟踪监测。
| [1] |
张武昌, 丰美萍, 于莹, 等. 砂壳纤毛虫图谱[M]. 北京: 科学出版社, 2012: 1-499. ZHANG Wuchang, FENG Meiping, YU Ying, et al. Tintinnids map[M]. Beijing: Science Press, 2012: 1-499. |
| [2] |
DOLAN R, MONTAGNES J S, AGATH A, et al. The biology and ecology of Tintinnid ciliates: models for marine plankton[M]. Oxford: Wiley-Blackwell, 2013.
|
| [3] |
PIERCE R W, TURNER J T. Ecology of planktonic ciliates in marine food webs[J]. Reviews in Aquatic Sciences, 1992, 6(2): 139-181. |
| [4] |
刘长东, 易坚, 郭晓峰, 等. 荣成俚岛人工鱼礁区浮游植物群落结构及其与环境因子的关系[J]. 中国海洋大学学报(自然科学版), 2016, 46(3): 50-59. LIU Changdong, YI Jian, GUO Xiaofeng, et al. Phytoplankton community structure in artificial reef area around Lidao, Rongcheng, and its relationship with environmental factors[J]. Periodical of Ocean University of China, 2016, 46(3): 50-59. |
| [5] |
陈海峰, 王云龙, 廖勇, 等. 象山港人工鱼礁区浮游植物群落特征[J]. 海洋渔业, 2013, 35(4): 396-404. CHEN Haifeng, WANG Yunlong, LIAO Yong, et al. Community characteristics of phytoplankton in artificial reef areas of Xiangshan Bay[J]. Marine Fisheries, 2013, 35(4): 396-404. |
| [6] |
雷安平, 陈欢, 陈菊芳, 等. 大亚湾人工鱼礁区浮游植物的种类组成和生物量研究[J]. 海洋技术, 2009, 28(4): 83-88. LEI Anping, CHEN Huan, CHEN Jufang, et al. Research on species composition and biomass of phytoplankton in Daya Bay artificial reef area[J]. Ocean Technology, 2009, 28(4): 83-88. |
| [7] |
袁小楠, 梁振林, 吕振波, 等. 威海近岸人工鱼礁布设对生物资源恢复效果[J]. 海洋学报, 2017, 39(10): 54-64. YUAN Xiaonan, LIANG Zhenlin, LV Zhenbo, et al. The effects of ecological restoration of the artificial reef in Weihai offshore[J]. Acta Oceanologica Sinica, 2017, 39(10): 54-64. |
| [8] |
章守宇, 张焕君, 焦俊鹏, 等. 海州湾人工鱼礁海域生态环境的变化[J]. 水产学报, 2006, 30(4): 475-480. ZHANG Shouyu, ZHANG Huanjun, JIAO Junpeng, et al. Change of ecological environment of artificial reef waters in Haizhou Bay[J]. Journal of Fisheries of China, 2006, 30(4): 475-480. |
| [9] |
刘国山, 威海双岛人工鱼礁区大型底栖动物与海藻群落演替特征及其生态作用研究[D]. 青岛: 中国海洋大学, 2014. LIU Guoshan. The succession and ecological functions of macrobenthos and macroalgae in the artificial reef zone of Shuangdao Bay, Weihai[D]. Qingdao: Ocean University of China, 2014. |
| [10] |
张虎, 刘培廷, 汤建华, 等. 海州湾人工鱼礁大型底栖生物调查[J]. 海洋渔业, 2008, 30(2): 97-104. ZHANG Hu, LIU Peiting, TANG Jianhua, et al. Investigation on the macrobenthos of artificial reefs area in the Haizhou Gulf[J]. Marine Fisheries, 2008, 30(2): 97-104. |
| [11] |
徐奎栋, 洪华生, 宋微波, 等. 台湾海峡的砂壳纤毛虫研究(纤毛动物门: 砂壳亚目)[J]. 动物分类学报, 2001, 26(4): 454-466. XU Kuidong, HONG Huasheng, SONG Weibo, et al. Studies on tintinnine ciliates in the Taiwan Strait (Ciliophora: Tintinnina)[J]. Acta Zootaxonomica Sinica, 2001, 26(4): 454-466. |
| [12] |
尹光德. 胶州湾砂壳纤毛虫之初步调查[J]. 山东大学学报, 1952, 2(1): 36-56. YIN Guangde. A preliminary investigation on Jiaozhou Bay tintinnids[J]. Journal of Shandong University, 1952, 2(1): 36-56. |
| [13] |
PUTT M, STOECKER D K. An experimentally determined carbon: volume ratio for marine "oligotrichous" ciliates from estuarine and coastal waters[J]. Limnology and Oceanography, 1989, 34(6): 1097-1103. DOI:10.4319/lo.1989.34.6.1097 |
| [14] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15. XU Zhaoli, CHEN Yaqu. East the Yellow Sea sub dominant species in autumn animal gathered strength and mackerel SCAD fishery related[J]. Journal of Ecology, 1989, 8(4): 13-15. |
| [15] |
SHANNON C E, WEAVER W. The mathematical theory of communication[M]. Urbana: University of Illinois Press, 1949: 1-114.
|
| [16] |
PIELOU E C. The measurement of diversity in different types of biological collections[J]. Journal of Theoretical Biology, 1966, 13: 131-144. DOI:10.1016/0022-5193(66)90013-0 |
| [17] |
于莹, 马玉艳, 陈卫, 等. 春季和夏季渤海湾近岸海域大型砂壳纤毛虫的群落结构[J]. 海洋科学, 2016, 40(11): 57-64. YU Ying, MA Yuyan, CHEN Wei, et al. Community structure of large tintinnids (Ciliophora, Tintinnida) in Bohai Bay during spring and summer[J]. Marine Sciences, 2016, 40(11): 57-64. |
| [18] |
于莹, 周锋, 房恩军, 等. 渤海湾近岸海域浮游纤毛虫丰度和生物量的季节变化[J]. 渔业科学进展, 2018, 39(1): 37-45. YU Ying, ZHOU Feng, FANG Enjun, et al. Seasonal variations of planktonic ciliates in the coastal area of the Bohai Bay[J]. Progress In Fishery Sciences, 2018, 39(1): 37-45. |
| [19] |
KAMIYAMA T. The impact of grazing by microzooplankton in northern Hiroshima Bay, the Seto Inland Seam, Japan[J]. Marine Biology, 1994, 119(1): 77-88. DOI:10.1007/BF00350109 |
| [20] |
URRUTXURTU I. Seasonal succession of tintinnids in the Nervión River estuary, Basque Country, Spain[J]. Journal of Plankton Research, 2004, 26(3): 307-314. DOI:10.1093/plankt/fbh034 |
| [21] |
于莹, 张武昌, 蒋增杰, 等. 桑沟湾浮游纤毛虫丰度和生物量分布的季节变化[J]. 海洋学报(中文版), 2013, 35(3): 215-224. YU Ying, ZHANG Wuchang, JIANG Zengjie, et al. Seasonal variation of planktonic ciliates in Sanggou Bay, Huanghai Sea[J]. Acta Oceanologica Sinica, 2013, 35(3): 215-224. |
| [22] |
LEAKEY R J G, FENTON N, CLARKE A. The annual cycle of planktonic ciliates in nearshore waters at Signy Island, Antarctica[J]. Journal of Plankton Research, 1994, 16(7): 841-856. DOI:10.1093/plankt/16.7.841 |
| [23] |
VERITY P G. Abundance, community composition, size distribution, and production rates of tintinnids in Narragansett Bay, Rhode Island[J]. Estuarine Coastal and Shelf Science, 1987, 24(5): 671-690. DOI:10.1016/0272-7714(87)90106-5 |
| [24] |
DOLAN J R, CLAUSTRE H, CARLOTTI F, et al. Microzooplankton diversity: relationships of tintinnid ciliates with resources, competitors and predators from the Atlantic Coast of Morocco to the Eastern Mediterranean[J]. Deep-Sea Research Part Ⅰ, 2002, 49(7): 1217-1232. DOI:10.1016/S0967-0637(02)00021-3 |
| [25] |
陈雪, 张武昌, 吴强, 等. 莱州湾大型砂壳纤毛虫群落季节变化[J]. 生物多样性, 2014, 22(5): 649-657. CHEN Xue, ZHANG Wuchang, WU Qiang, et al. Seasonal change of the community of large-sized tintinnids (Ciliophora, Tintinnida) in Laizhou Bay[J]. Biodiversity Science, 2014, 22(5): 649-657. |
| [26] |
YU Y, ZHANG W, WANG S, et al. Abundance and biomass of planktonic ciliates in the sea area around Zhangzi Island, Northern Yellow Sea[J]. Acta Ecologica Sinica, 2013, 33: 45-51. |
| [27] |
颜慧慧, 三亚蜈支洲岛海洋牧场旅游区生态环境演变与评价研究[D]. 海口: 海南大学, 2017. YAN Huihui. Studies on the evolution and evaluation of ecological environment in the marine ranching tourism area of Wuzhizhou Island, Sanya[D]. Haikou: Hainan University, 2017. |
| [28] |
张虎, 朱孔文, 汤建华. 海州湾人工鱼礁养护资源效果初探[J]. 海洋渔业, 2005, 27(1): 38-43. ZHANG Hu, ZHU Kongwen, TANG Jianhua. The effect of fishery resource enhancement in the artificial reef area in the Haizhou Gulf[J]. Marine Fisheries, 2005, 27(1): 38-43. |
| [29] |
QIN C, ZHU W, MA H, et al. Are Habitat Changes Driving Protist Community Shifts? A Case Study in Daya Bay, China[J]. Estuarine, Coastal and Shelf Science, 2019, 227. |
| [30] |
WU F, HUANG J, QI Z, et al. Spatial and Seasonal Variations in the Planktonic Ciliate Community and Its Relationship with Environmental Factors in Daya Bay, the South China Sea[J]. Oceanological and Hydrobiological Studies, 2017, 46(2): 212-222. DOI:10.1515/ohs-2017-0021 |
| [31] |
RASSOULZADEGAN F, LAVALPEUTO M, SHELDON R W. Partitioning of the food ration of marine ciliates between pico-and nanoplankton[J]. Hydrobiologia, 1988, 159(1): 75-88. DOI:10.1007/BF00007369 |
| [32] |
SAFI K A, GRIFFITHS F B, HALL J A. Microzooplankton composition, biomass and grazing rates along the WOCE SR3 line between Tasmania and Antarctica[J]. Deep-Sea Research Part Ⅰ, 2007, 54(7): 1025-1041. DOI:10.1016/j.dsr.2007.05.003 |
| [33] |
孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用[J]. 海洋学报(中文版), 2004, 26(1): 62-75. SUN Jun, LIU Dongyan. The application of diversity indices in marine phytoplankton studies[J]. Acta Oceanologica Sinica, 2004, 26(1): 62-75. |
| [34] |
刘素娟, 渤海湾浮游植物的生态研究[D]. 天津: 天津大学, 2007. LIU Sujuan. Ecological research of phytoplankton in Bohai Bay[D]. Tianjin: Tianjin University, 2007. |
| [35] |
王伟定, 梁君, 章守宇. 人工鱼礁建设对浙江嵊泗海域营养盐与水质的影响[J]. 水生生物学报, 2010, 34(1): 78-87. WANG Weiding, LIANG Jun, ZHANG Shouyu. Influence of artificial reef construction on nutrition and water quality in off-shore area of Shengsi, Zhejiang[J]. Acta Hydrobiologica Sinica, 2010, 34(1): 78-87. |
 2021, Vol. 45
2021, Vol. 45


