
文章信息
- 王延清, 张晔, 牟文秀, 庞志鹏, 陈晓丽. 2021.
- WANG Yan-qing, ZHANG Ye, MOU Wen-xiu, PANG Zhi-peng, CHEN Xiao-li. 2021.
- 利用脂肪酸标记法对南极罗斯海桡足类优势物种的食性研究
- Application of fatty acids in the diet analysis of five copepod species in Ross Sea, Antarctic
- 海洋科学, 45(12): 31-38
- Marine Sciences, 45(12): 31-38.
- http://dx.doi.org/10.11759/hykx20201113003
-
文章历史
- 收稿日期:2020-11-13
- 修回日期:2021-04-19
2. 中国科学院 海洋研究所 工程技术部, 山东 青岛 266071;
3. 国家海洋局 东海海洋环境调查勘察中心, 上海 200137;
4. 中国科学院大学, 北京 100049
2. Engineering and Technology Department, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. East Sea Marine Environmental Investigating & Surveying Center, State Oceanic Administration, Shanghai 200137, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
罗斯海位于南大洋的太平洋扇区, 该海域是南大洋生产力最高的区域之一[1]。与南极其它海域相比, 罗斯海的大部分区域一年中约有9个月(2—10月)时间被海冰覆盖[2-3], 并且该海域有常年冰间湖的存在[4]。独特的环境及生物特征, 使得南大洋经典食物链浮游植物-南极大磷虾-大磷虾捕食者不是罗斯海主要的能量及物质传输途径, 取而代之的是通过浮游生物、底栖生物及鱼类向上传递物质和能量, 参与者的多元化也使得该海域食物链具有比较复杂的结构[5]。
浮游动物的食性研究是明晰海洋浮游食物网结构和了解海洋生态系统物质循环与能量流动途径的基础[6]。然而, 对罗斯海浮游动物食性及适应性等方面的研究相对较少[2], 只有在Terra Nova Bay及其邻近海域的浮游动物群落进行过比较深入的相关研究[7-8]。该海域的夏季浮游动物群落主要由桡足类构成, 比如常见的Metridia gerlachei、Calanoides acutus和Calanus propinquus等种类, 并且这些桡足类主要分布在50~100 m水层, 是该区域食物网组成的重要环节[8]。
高纬度海域的浮游动物(主要是桡足类和磷虾类)的显著特点是, 利用夏季短时间的浮游植物水华合成脂类, 如蜡脂、三线甘油脂、磷脂等, 将其作为饵料匮乏季节代谢的主要能量支持[9]。而脂肪酸可在食物链中保守传递[10], 因此, 可以在一定程度上通过分析捕食者的脂肪酸信息来追踪其食物来源, 这使得采用脂肪酸标记的方法研究该区域浮游动物食性具有可行性, 从而对食物链研究具有辅助参考价值。比如, 18: 4n3和16: 1n7已被被广泛应用作为甲藻和硅藻的特征脂肪酸来指示水体颗粒悬浮物中的甲藻、硅藻成分[11]; 植食性桡足类可以大量合成20: 1和22: 1脂肪酸, 从而作为高营养级摄食植食桡足类的指标[12], 而22: 6n3/20: 5n3比值则会随着营养级的升高而升高[10, 13], 所以22: 6n3/20: 5n3可以间接的作为指示生物营养级的指标。
在本研究中, 我们通过分析罗斯海内5种优势桡足类(M. gerlachei、Oncaea curvata、Paraeuchaeta antarctica、C. acutus和C. propinquus)的脂质及其脂肪酸组成情况, 对不同脂质的脂肪酸展示出的食性信息进行分析, 以期验证不同脂质的脂肪酸信息分析法在南大洋浮游动物摄食生态学研究中的作用, 为进一步研究该海区浮游食物网的能量及物质流动提供参考。
1 材料方法 1.1 样品采集本研究的浮游动物样品采集于2013年1月中国第29次南极科学考察期间, 采样区域位于罗斯海(Ross Sea)近岸及陆架边缘海域, 采样站位见图 1。在A站位进行了垂直网作业, 在B站进行了高速采集器作业。从获得的浮游动物活体样品中分类挑取桡足类, 并保证其活性及个体完整。在A点站位挑取了M. gerlachei、O. curvata和P. antarctica 3种桡足类, 在B点挑取了C. acutus和C. propinquus 2种桡足类。每一种类挑取50~100只个体, 分为3份, 分别过滤至450℃煅烧过的GF/F膜(Whatman公司), 并用超纯水淋洗去除盐分, 之后装入冻存管, 放入液氮进行保存, 备测。
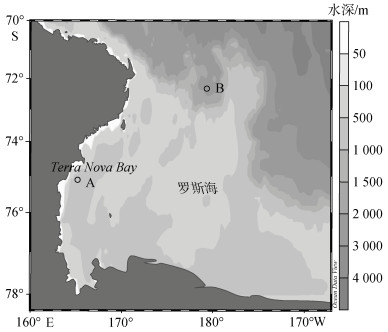 |
| 图 1 罗斯海采样站位(○表示采样站点位置) Fig. 1 Sampling stations in the Ross Sea (○ represents the detailed sample station) |
参照Folch等[14]的方法对已称重的虫体进行脂类提取。首先, 将液氮保存的样品用真空冷冻干燥机冷冻干燥48 h, 称干重。然后, 用二氯甲烷︰甲醇(2︰1, V/V)进行脂质提取、称重。由于小型桡足类O. curvata的个体较小, 无法统计取样个体数, 因此无法获得其个体干重和脂质干重信息, 只对其进行了脂质提取, 分析了其脂质组成信息(百分比含量)。
1.3 脂质分析脂质组成: 参考王延清等[15]用的IATROSCAN MK-6S型TLC/FID棒状薄层色谱方法进行脂质组成分析。具体方法为, 将提取的脂质点样于薄层棒, 经过苯︰氯仿︰乙酸=50︰20︰0.7(V/V)和正己烷︰苯= 1︰1 (V/V)二次展开后, 上机测试。
脂质分离: 用薄层色谱法, 分离不同的脂质种类。具体步骤为: (1) 薄层板活化。薄层硅胶板采用青岛海洋化工厂生产的G型板(厚度0.25 mm), 110 ℃活化1 h。(2) 点样。(3) 平衡和展开。展开试剂为正己烷︰乙醚︰甲酸(42︰28︰0.3, V/V)。(4) 刮板。分别刮取薄层板上的中性脂和极性脂条带, 用二氯甲烷︰甲醇(2︰1, V/V)抽提, 微孔过滤, 然后高纯氮吹干, 待测。
脂肪酸分析: 对分离得到的不同种类脂质, 进行甲酯化后, 用气相色谱法分析脂肪酸组成。具体步骤为: (1) 甲酯化。向吹干的样品加入3 mL 1%浓硫酸甲醇溶液, 充氮保护后, 在50℃水浴中皂化8 h。冷却后加入2 mL纯水和3 mL正己烷︰乙醚(1︰1, V/V)萃取, 分离上层有机相(用2%NaHCO3洗涤), 氮气吹干, 二氯甲烷重溶。(2) FAME纯化。用薄层板对FAME进行纯化, 备测。(3) 气相色谱进行脂肪酸分析。Agilent 7890A型GC; 毛细管色谱柱: DB-FFAP 30 m× 0.32 mm×0.25 μm; 进样口温度220 ℃; 检测器温度280 ℃。自动升温程序150 ℃ (1 min)、220 ℃(33 min)。
1.4 数据统计方法5种浮桡足类的脂肪酸含量以百分比含量给出。结合已有研究[9], 选取中性脂和极性脂中含量较高的脂肪酸: 14: 0、16: 0、16: 1n7、18: 0、18: 1n9、18: 4n3、20: 1n9、EPA、22: 1n9、22: 1n11和DHA(在本研究中可以占全部脂肪酸含量的80%以上)进行主成份分析并作图, 结合常用的反映食物来源的脂肪酸标记: 18: 1n9/18: 1n7、DHA/EPA和18: 1n9/∑herb[12, 16], 对其食性偏好进行分析。主成份分析及作图用R软件的mvstats包完成。
2 结果 2.1 脂质含量与组成通过称重法获得的脂质含量信息显示, P. antarctica具有较高的脂质含量, 脂质可占其干质量的39.5%。此外, C. acutus的脂质含量也较高, 可以占干重的31.1%, 而M. gerlachei和C. propinquus的脂质含量较低, 占其干重的比例分别为17.2%和9.8%左右。
应用TLC-FID的方法, 分析了5种桡足类的脂质构成情况(表 1)。从脂质组成可以看出, 与其他2种桡足类相比, 在M. gerlachei和O. curvata中, 三酰甘油酯的含量高, 分别占总脂含量28.1%和14.0%。而在P. antarctica和C. acutus中则含有较少的三酰甘油酯, 其脂质主要由蜡脂构成, 分别占总脂含量的73.4%和70.9%。与上述4种桡足类不同, C. propinquus不含有蜡脂, 其脂质主要由三酰甘油酯和磷脂构成。
| 种类 | 干质量/(μg/ind) | 总脂/(μg/ind) | 总脂/干质量/% | 蜡脂/(% TL) | 三酰甘油酯/(% TL) | 磷脂/(% TL) |
| M. gerlachei | 353.3±0.9 | 60.8±0.6 | 17.2 | 16.3±5.5 | 28.1±4.9 | 48.3±11.8 |
| O. curvata | na | na | 65.8 | 14.0 | 17.2 | |
| P. antarctica | 2 435.8±167.2 | 961.0±153.4 | 39.5 | 73.4±17.3 | 2.0±0.4 | 13.6±5.1 |
| C. acutus | 544.8±86.9 | 169.6±39.5 | 31.1 | 70.9±13.8 | 2.2±0.1 | 24.4±13.0 |
| C. propinquus | 1 196.5±33.2 | 117.1±1.9 | 9.8 | — | 18.3±4.5 | 77.1±5.0 |
| 注: na代表由于采样量少, 无法获得相关数据; —代表未分析得到该成份。 | ||||||
主成分分析结果表明(图 2), 表示极性脂脂肪酸构成的数据点聚拢在一起, 集中在第一主成分(PC1)的左侧部分, 而表示中性脂脂肪酸的数据点分布相对离散, 主要分布在PC1的右侧部分。在PC1右侧部分, 从上到下依次为C. acutus、C. propinquus、M. gerlachei、O. curvata和P. antarctica的中性脂脂肪酸数据点。其中, C. acutus和C. propinquus中性脂脂肪酸的构成特征是含有较高的20: 1n9和22: 1n11, 而M. gerlachei、O. curvata和P. antarctica的中性脂脂肪酸中18: 1n9含量高, 另外, M. gerlachei具有较高的16: 0含量, O. curvata含有较高的18: 4n3, P. antarctica中16: 1n7含量较高。
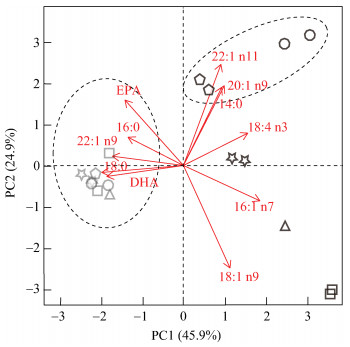 |
| 图 2 脂肪酸组成PCA分析 Fig. 2 PCA analysis of fatty acids 注: 灰色和黑色分别表示极性脂和中性脂脂肪酸 |
结合主成分分析结果, 对照中性脂(蜡质和三酰甘油酯)与极性脂脂肪酸构成数据(见表 2和表 3), 可以看出中性脂脂肪酸, 如16: 0, 16: 1n7, 18: 1n9, 20: 1n9, 22: 1(n9、n11)等, 在各物种间的含量具有差异。如C. acutus中的20: 1n9含量要高于其它3个物种, 而22: 1n11则在C. acutus和C. propinquus含量高于另外2个物种, 16: 0在M. gerlachei和C. propinquus中的含量较高。
| 脂肪酸 | M. gerlachei (n=3) | C. acutus (n=3) | C. propinquus (n=3) | P. Antarctica (n=3) | O. curvata (n=1) |
| 14: 0 | 4.1±0.1 | 3.2±1.3 | 5.0±0.0 | 1.3±0.1 | 1.4 |
| 16: 0 | 13.9±0.6 | 1.7±0.3 | 12.7±0.7 | 0.1±0.1 | 2.9 |
| 16: 1n7 | 9.9±0.0 | 7.6±1.0 | 8.5±0.4 | 21.0±0.5 | 4.5 |
| 18: 0 | 0.9±0.2 | 0.2±0.0 | 1.9±0.3 | 0.1±0.0 | 0.8 |
| 18: 1n9 | 22.9±0.7 | 9.6±1.4 | 7.5±0.9 | 55.4±1.5 | 46.7 |
| 18: 1n7 | 3.9±0.0 | 1.1±0.0 | 1.2±0.1 | 0.3±0.3 | 2.7 |
| 18: 2n6 | 4.2±0.1 | 2.3±0.1 | 2.4±0.3 | 2.0±0.1 | 3 |
| 18: 3n3 | 4.6±0.3 | 1.0±0.1 | 1.1±0.0 | 1.5±0.5 | 4.4 |
| 18: 4n3 | 4.4±0.5 | 4.8±2.7 | 4.0±0.4 | 2.8±0.5 | 7.1 |
| 20: 1n9 | 1.2±0.3 | 23.7±6.3 | 1.9±0.3 | 1.2±0.3 | 1.9 |
| 20: 4n3 | 0.6±0.0 | 1.3±0.5 | 0.7±0.0 | 0.1±0.0 | 0.3 |
| EPA | 10.7±0.4 | 13.6±5.9 | 12.4±1.2 | 4.0±0.5 | 8.2 |
| 22: 1n11 | 0.0±0.0 | 10.0±1.5 | 6.1±1.5 | 0.0±0.0 | 0.1 |
| 22: 1n9 | 0.6±0.1 | 2.9±0.8 | 8.4±1.7 | 0.0±0.0 | 0.2 |
| 22: 5n3 | 0.3±0.0 | 0.8±0.3 | 0.7±0.3 | 0.2±0.0 | 0.4 |
| DHA | 6.3±0.3 | 6.2±2.3 | 7.7±0.9 | 4.1±1.0 | 5.4 |
| 24: 1 | 1.5±0.8 | 0.8±0.1 | 2.3±1.1 | 2.3±1.1 | 0.2 |
| 脂肪酸 | M. gerlachei (n=3) | C. acutus (n=3) | C. propinquus (n=3) | P. Antarctica (n=3) | O.curvata (n=1) |
| 14: 0 | 0.9±0.1 | 1.1±0.1 | 1.1±0.5 | 1.4±0.4 | 1.5 |
| 16: 0 | 11.7±3.8 | 7.8±1.5 | 9.7±0.9 | 9.6±0.0 | 10.6 |
| 16: 1n7 | 1.2±0.0 | 0.9±0.5 | 1.4±0.2 | 1.6±0.7 | 1.2 |
| 18: 0 | 2.7±0.2 | 3.2±0.1 | 2.6±0.0 | 1.8±0.5 | 3.9 |
| 18: 1n9 | 16.0±1.7 | 21.9±2.1 | 16.7±0.7 | 12.6±3.8 | 23.0 |
| 18: 1n7 | 1.4±0.6 | 1.2±0.0 | 1.0±0.0 | 1.6±0.3 | 1.4 |
| 18: 2n6 | 2.8±0.3 | 3.0±0.3 | 2.5±0.1 | 1.4±0.6 | 3.0 |
| 18: 3n3 | 1.4±0.0 | 0.0±0.0 | 0.0±0.0 | 1.0±0.0 | 1.5 |
| 18: 4n3 | 1.1±0.2 | 1.3±0.1 | 1.3±0.1 | 1.1±0.5 | 2.2 |
| 20: 4n3 | 0.5±0.0 | 0.6±0.1 | 0.5±0.0 | 0.0±0.0 | 0.0 |
| EPA | 14.6±1.1 | 13.3±0.7 | 15.3±0.2 | 15.8±5.1 | 9.8 |
| 22: 1n9 | 11.8±0.4 | 15.1±0.8 | 11.4±0.9 | 7.7±0.0 | 12.8 |
| DHA | 26.3±0.7 | 21.3±4.9 | 27.2±0.6 | 40.9±1.8 | 19.4 |
本文分析了几种反映食性的脂肪酸指标(图 3),从图中可以看出, 作为指示生物营养级的DHA/EPA比值显示, P. Antarctica相较于其他几种桡足类占据较高的营养级; 反映肉食性的指标18: 1n9/∑herb显示, C. acutus和C. propinquus的指标值较低, O. curvata和P. antarctica显示出较高值; C. acutus和C. propinquus均具有较高含量的植食性桡足类特有的20: 1和22: 1。
 |
| 图 3 常用脂肪酸指标 Fig. 3 Comparison of different fatty acids markers among five copepods |
在高纬度的极地海域, 一些浮游动物的显著特点, 是利用夏季较短的饵料充足时间, 合成大量脂质并将其储存在体内[9]。P. antarctica和C. acutus是较为典型的南极浮游动物物种, 本文中其脂质含量占干重的比例都在30%以上, 与已有研究的相符合[9]。Alonzo等[18]通过对不同发育期P. antarctica的月度采样分析, 发现P. antarctica个体的脂质含量在1— 4月份处于逐渐积累增加的阶段。本文的样品采集的时间为1月份, 与Alonzo等[17]对C5期P. antarctica的结果基本一致。对C. acutus的生活史研究也有类似的结果[18-19], C. acutus的脂质含量也在1—2月份达到较高水平(占干重的40.0%以上)并持续至4月份。与之相比, 本研究中C. acutus的脂质含量略低(占干重的31.1%), 分析是由于采样时处于其夏季活跃摄食时期的开始, 在良好食物环境条件下其脂质含量可能会进一步增加。这些储存的脂类物质主要以蜡脂、三酰甘油两种较为常见的形式存储, 并被认为主要用于浮游动物在饵料匮乏季节或者浮游动物繁殖旺盛季节的能量消耗[20-21]。已有的研究表明C. acutus在油囊中储存大量蜡脂, 并在冬季前下潜至500~1 000 m深的水层进行休眠, 其存储的脂质可能在其悬浮于特定水层, 并提供能量方面发挥重要作用[9]。虽然P. antarctica的生活史中没有休眠阶段, 但其存储的脂质则可能主要用于其在冬季至初春时的繁殖活动[17]。
在已有的研究中, 对O. curvata脂质含量的相关报道较少, 这可能是由于其个体较小, 脂质提取分析复杂造成的。在本研究中, 虽然通过较多的取样分析, 获得了其脂质构成及脂肪酸组成的信息(百分组成), 但由于其脂质含量小, 无法通过称重获得其个体干重及脂含量信息。已有的对其生活史的研究表明, O. curvata在夏秋季主要在250 m以浅水层活动, 在其它季节则倾向在更深的水层活动, 并且在夏季水华前完成产卵活动[22], 而在此时饵料相对匮乏的环境条件下, 体内存储的脂质可能会起到较为重要的作用。本研究的结果表明, O. curvata体内的脂质主要以蜡脂的形式存在(占干重的65.8%), 而蜡脂是存储性脂质中能量密度较大的脂质种类, 因此, 本研究结果暗示着, 存储蜡脂可能是其适应环境的一种策略选择。
另外两种桡足类C. propinquus、M. gerlachei没有大量存储脂质。C. propinquus以三酰甘油的形式进行脂质储存, 而M. gerlachei则可以存储蜡脂。较少的脂质存储可能与这两种桡足类的生活史特性有关, 已有研究中, 这两种桡足类的生活史阶段中都没有休眠阶段, 在南半球的冬季仍然可以在海洋上层活跃摄食[22-24]。
3.2 基于脂肪酸组成的食性分析由于脂质的存储与其生活史过程密切相关, 同时通过摄食活动获取的脂质通常具有保守传递的特点, 因此这些储存于浮游动物体内的脂质可用于其食物来源的分析[10]。从我们的结果(图 2)可以看出, 各物种的极性脂脂肪酸具有相似的组成信息, 而中性脂的脂肪酸组成信息则呈现出明显的差异, 这可能是由于不同脂质具有不同的功能造成的。极性脂在大部分浮游动物中主要作为结构性脂质存在, 维持极性脂含量和脂肪酸组成稳定, 是对浮游动物生存必须的, 所以其种间差异较小, 而作为能量储存用的中性脂, 其脂肪酸组成可能与其摄食的饵料有关。
根据以往研究, 植食性的桡足类能大量合成20碳和22碳的脂肪酸和脂肪醇类物质[10]。在我们的结果中, C. acutus中性脂的20: 1和22: 1脂肪酸含量(33.7%)明显高于其余种类, 这说明该种桡足类可能以植食性为主, 这与已有的研究相符合[25-26]。C. propinquus中性脂构成中, 这两种脂肪酸的含量也较高, 而且其指示浮游植物的特征脂肪酸16: 1n7和18: 4n3的含量也较高, 也呈现出较为明显的植食性特征。在已有研究中, C. propinquus通常被认为是杂食性物种, 在南大洋的冬季仍然在表层海水中活跃摄食[24, 27], 并且该种在不同的季节可能存在食性转换, 在冬季则是机会摄食者, 而在夏季以植食性为主[27]。在本研究的结果中, C. propinquus呈现出植食性倾向, 这可能是由于我们采样时, 南大洋正处于夏季浮游植物的暴发期, 而此时的C. propinquus可能以浮游植物作为主要饵料, 从而使其呈现出较多指示植食性的脂肪酸信息。
本研究中, M. gerlachei的中性脂脂肪酸组成与植食性桡足类存在明显差异, 除EPA和DHA外, 主要由16碳和18碳的短链脂肪酸构成, 如16: 0、16: 1n7和18: 1n9, 这与Albers等[1]的研究结果类似。M. gerlachei生活史中也没有休眠阶段, 其在南大洋中全年保持活跃状态, 通常被认为是杂食性物种[28]。我们的结果显示, M. gerlachei中植食性桡足类的特征脂肪酸(20: 1和22: 1)含量较低, 而另外两种指示浮游植物摄食的特征脂肪酸(16: 1n7和18: 4n3)含量与C. acutus和C. propinquus相当, 同时, 还含有较多的肉食性桡足类中大量存在的18: 1n9脂肪酸。这说明, M. gerlachei与C. propinquus不同, 即使在浮游植物饵料充足的夏季, M. gerlachei仍然呈现出杂食性的倾向。
肉食性桡足类的一个特点就是含有高比例的18: 1n9, 可以超过总脂肪酸含量的50%[20, 29]。本研究中, P. antarctica中性脂脂肪酸中18: 1n9的含量为55.4%, 呈现明显的肉食性桡足类特点。另外, 其16: 1n7的含量也较高, 而其他指示浮游植物的脂肪酸含量则较低, 这说明P. antarctica可能主要以肉食性为主, 其较高的16: 1n7含量可能是来源于其摄食了一些含有大量16: 1w7标记的植食性浮游动物。
与P. antarctica类似, O. curvata也含有较多的18: 1n9, 只是其含量要低于P. antarctica, 这说明其食性特点可能与P. antarctica相似, 具有指示肉食性的食物来源。此外, O. curvata中较高含量的18: 4n3也指示了其对浮游植物摄食的特点。在以往对小型桡足类Oithona similis和Oncaea borealis的脂肪酸组成的研究中, Kattner等[30]及Lischka等[31]倾向于将小型桡足类的摄食习性归为杂食性。我们的结果显示, O. curvatade肉食性特征并没有P. antarctica明显, 并且指示植食性脂肪酸的含量较高, 也倾向于将O. curvata归为杂食性物种。
综上所述, 食性差异信息主要由中性脂脂肪酸组成的差异给出, 而5种桡足类的极性脂脂肪酸具有相似的组成, 无法给出食性差异信息。通过对中性脂脂肪酸组成的分析, 可以将采集到的5种桡足类的食性特征分为三类: C. acutus和C. propinquus主要摄食浮游植物, P. antarctica更偏向于肉食性, 而M. gerlachei和小型桡足类O. curvata则更倾向于杂食性。
致谢: 感谢“雪龙”号科学考察船在样品采集及保存过程中提供的平台保障, 感谢中国第29次南极科学考察全体队员在航次采样工作中的积极协助, 感谢杨光老师在文章修改时给与的帮助。
| [1] |
ALBERS C S, KATTNER G, HAGEN W. The compositions of wax esters, triacylglycerols and phospholipids in Arctic and Antarctic copepods: evidence of energetic adaptations[J]. Marine Chemistry, 1996, 55(3/4): 347-358. |
| [2] |
SMITH W O, AINLEY D G, ARRIGO K R, et al. The oceanography and ecology of the Ross Sea[J]. Annual Review of Marine Science, 2014, 6: 469-487. DOI:10.1146/annurev-marine-010213-135114 |
| [3] |
JACOBD S S, GIULIVI C F. Thermohaline Data and Ocean Circulation on the Ross Sea Continental Shelf, In: Giancarlo S, Giuseppe M R M eds. Oceanography of the Ross Sea Antarctica[M]. Milan: Springer, 1999: 3-16.
|
| [4] |
ZWALLY H J. Antarctic Offshore Leads and polynyas and oceanographic effects[C]//STANLEY S, JACOBS. Oceanology of the Antarctic Continental shelf. Washington D. C: American Geophysical Union, 1985: 203- 226.
|
| [5] |
LA-MESA M, EASTMAN J T, VACCHI M. The role of notothenioid fish in the food web of the Ross Sea shelf waters: a review[J]. Polar Biology, 2004, 27(6): 321-338. DOI:10.1007/s00300-004-0599-z |
| [6] |
STERNER R W, SCHULZ K L. Zooplankton nutrition: recent progress and a reality check[J]. Aquatic Ecology, 1998, 32(4): 261-279. DOI:10.1023/A:1009949400573 |
| [7] |
CARLI A, PANE L, STOCCHINO C, et al. Ross Sea ecology[M]. Berlin, Heidelberg: Springer Press, 2000: 309-321.
|
| [8] |
PANE L, FELETTI M, FRANCOMACARO B, et al. Summer coastal zooplankton biomass and copepod community structure near the Italian Terra Nova Base (Terra Nova Bay, Ross Sea, Antarctica)[J]. Journal of Plankton Research, 2004, 26(12): 1479-1488. DOI:10.1093/plankt/fbh135 |
| [9] |
LEE R, HAGEN W, KATTNER G. Lipid storage in marine zooplankton[J]. Marine Ecology Progress Series, 2006, 307: 273-306. DOI:10.3354/meps307273 |
| [10] |
DALSGAARD J, MICHAELl J S, KATTNER G, et al. Fatty acid trophic markers in the pelagic marine environment[J]. Advances in Marine Biology, 2003, 46: 225-340. |
| [11] |
KATTNER G, GERCKEN G, HAMMER K D. Development of lipids during a spring plankton bloom in the northern North Sea: Ⅱ. Dissolved lipids and fatty acids[J]. Marine Chemistry, 1983, 14(2): 163-173. DOI:10.1016/0304-4203(83)90039-7 |
| [12] |
FALK-PETERSEN S, SARGENT J R, TANDE K S. Lipid composition of zooplankton in relation to the sub- arctic food web[J]. Polar Biology, 1987, 8(2): 115-120. DOI:10.1007/BF00297065 |
| [13] |
NAPOLITANO G E. Fatty acids as trophic and chemical markers in freshwater ecosystems[M]//ARTS M T, WAINMAN B C. Lipids in freshwater ecosystems. New York: Springer New York, 1999: 21-44.
|
| [14] |
NAPOLITANO G E. Fatty Acids as Trophic and Chemical Markers in Freshwater Ecosystems. In: ARTS M T and WAINMAN B C, eds. Lipids in Freshwater Ecosystems[M]. New York: Springer New York, 1999: 21-44.
|
| [15] |
FOLCH J, LEE M, SLOANE-STANLEY G. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biochemistry, 1956, 226(1): 497-509. |
| [16] |
王延清, 李超伦, 刘梦坛, 等. 黄海春季和秋季中华哲水蚤脂类含量及组成分析[J]. 海洋学报, 2014, 36(2): 99-107. WANG Yanqing, LI Chaolun, LIU Mengtan, et al. Lipid content and composition of Calanus sinicus in the Yellow Sea in spring and autumn[J]. Acta Oceanologica Sinica, 2014, 36(2): 99-107. DOI:10.3969/j.issn.0253-4193.2014.02.011 |
| [17] |
金鑫, 李超伦, 孙松, 等. 基于脂肪酸标记的长江口海区浮游动物常见种食性分析[J]. 海洋与湖沼, 2012, 43(6): 1083-1090. JIN Xin, LI Chaolun, SUN Song, et al. The diet of the common zooplankton species in Changjiang estuary adjacent sea revealed by fatty acid analysis[J]. Ocea nologia et Limnologia Sinica, 2012, 43(6): 1083-1090. |
| [18] |
ALONZO F, MAYZAUD P, RAZOULS S. Egg production, population structure and biochemical composition of the subantarctic copepod Paraeuchaeta antarctica in the Kerguelen Archipelago[J]. Marine Ecology Progress Series, 2000, 205: 207-217. DOI:10.3354/meps205207 |
| [19] |
SCHNACK-SCHIEL S B, WILHELM H. Life-cycle strategies of Calanoides acutus, Calanus propinquus, and Metridia gerlachei (Copepoda: Calanoida) in the eastern Weddell Sea, Antarctica[J]. Journal of Marine Science, 1995, 52(3/4): 541-548. |
| [20] |
SCHNACK-SCHIEL S B, HAGEN W. Life cycle strategies and seasonal variations in distribution and population structure of four dominant calanoid copepod species in the eastern Weddell Sea, Antarctica[J]. Journal of Plankton Research, 1994, 16(11): 1543-1566. DOI:10.1093/plankt/16.11.1543 |
| [21] |
LEE R, NEVENZEL J, LEWIS A. Lipid changes during life cycle of marine copepod, Euchaeta japonica Marukawa[J]. Lipids, 1974, 9(11): 891-898. DOI:10.1007/BF02532615 |
| [22] |
SAITO H, KOTANI Y. Lipids of four boreal species of calanoid copepods: origin of monoene fats of marine animals at higher trophic levels in the grazing food chain in the subarctic ocean ecosystem[J]. Marine Che mistry, 2000, 71(1/2): 69-82. |
| [23] |
ATKINSON A. Life cycle strategies of epipelagic copepods in the Southern Ocean[J]. Journal of Marine Systems, 1998, 15(1): 289-311. |
| [24] |
HAGEN W, KATTNER G, GRAEVE M. Calanoides acutus and Calanus propinquus, Antarctic copepods with different lipid storage modes via wax esters or triacylglycerols[J]. Marine Ecology Progress Series, 1993, 97(2): 135-142. |
| [25] |
METZ C, SCHNACK-SCHIEL S B. Observations on carnivorous feeding in Antarctic calanoid copepods[J]. Marine Ecology Progress Series, 1995, 129: 71-75. DOI:10.3354/meps129071 |
| [26] |
HAGEN W, AUEL H. Seasonal adaptations and the role of lipids in oceanic zooplankton[J]. Zoology, 2001, 104(3/4): 313-326. |
| [27] |
YANG G, LI C L, GUILINI K, et al. Feeding strategies of four dominant copepod species in Prydz Bay, Antarctica: Insights from a combined fatty acid biomarker and stable isotopic approach[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2016, 115: 55-63. |
| [28] |
HAGEN W, KATTNER G, GRAEVE M. Calanoides acutus and Calanus propinquus, Antarctic copepods with different lipid storage modes via wax esters or triacylglycerols[J]. Marine Ecology Progress Series, 1993, 97(2): 135-142. |
| [29] |
GRAEVE M, HAGEN W, KATTNER G. Herbivorous or omnivorous: on the significance of lipid compositions as trophic markers in antarctic copepods[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 1994, 41(5/6): 915-924. |
| [30] |
HAGEN W, KATTNER G, GRAEVE M. On the lipid biochemistry of polar copepods: compositional differences in the Antarctic calanoids Euchaeta antarctica and Euchirella rostromagna[J]. Marine Biology, 1995, 123(3): 451-457. DOI:10.1007/BF00349224 |
| [31] |
KATTNER G, ALBERS C, GRAEVE M, et al. Fatty acid and alcohol composition of the small polar copepods, Oithona and Oncaea: indication on feeding modes[J]. Polar Biology, 2003, 26(10): 666-671. DOI:10.1007/s00300-003-0540-x |
| [32] |
LISCHKA S, HAGEN W. Seasonal lipid dynamics of the copepods Pseudocalanus minutus (Calanoida) and Oithona similis (Cyclopoida) in the Arctic Kongsfjorden (Svalbard)[J]. Marine Biology, 2007, 150(3): 443-454. DOI:10.1007/s00227-006-0359-4 |
 2021, Vol. 45
2021, Vol. 45

