
文章信息
- 褚梦凡, 肖晓彤, 丁杨, 赵美训. 2021.
- CHU Meng-fan, XIAO Xiao-tong, DING Yang, ZHAO Mei-xun. 2021.
- 海南儋州湾红树林区沉积有机质来源及碳储量
- Sediment organic matter sources and carbon stock associated with a mangrove reserve in Danzhou Bay, Hainan, China
- 海洋科学, 45(2): 22-31
- Marine Sciences, 45(2): 22-31.
- http://dx.doi.org/10.11759/hykx20200215001
-
文章历史
- 收稿日期:2020-02-15
- 修回日期:2020-04-26
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China
红树林湿地生态系统多存在于热带和亚热带地区的潮间带, 与海洋和陆地都有密切的有机碳交换。红树林生态系统的面积只占整个边缘海的0.5%, 所输送的有机碳占整个边缘海体系向海洋中输送有机碳的11%和现代海洋沉积物的15%, 是边缘海碳循环不可或缺的一部分[1-2]。
红树林中储存的有机碳通常被称为“蓝碳”, 与陆地生态系统所固定的“绿碳”几乎等量[3], 能够有效减缓大气CO2的上升[4]。反之, 如果红树林生态系统被破坏, 其储存的碳将以CO2的形式返回大气。自1992年《联合国气候变化框架公约》被通过并被国际社会广泛接受, 维护、加强温室气体的汇和库, 以及计算和通报地表有机碳储量成为了热点[5]。然而, 目前的碳储量研究大多聚焦于与陆地生态系统、人类活动和大气圈有密切联系的碳汇, 对滨海湿地生态系统有机碳储存能力的评估鲜有研究。红树林生态系统存储的有机碳对于边缘海乃至全球碳循环有重要影响[1, 4], 有效地衡量以红树林为代表的海洋湿地生态系统中的有机碳储量和有机碳来源, 能够把握和预测其在气候变化下所受的影响, 对制定生态保护措施、减少碳排放均有重要意义[4]。
红树林生态系统中的沉积有机碳主要来源可分为陆源、水源和红树林源。陆源有机碳主要由陆生高等植物产生, 由河流输送至红树林湿地; 水源有机碳包括由潮汐带来的海洋藻类、浮游植物和海草床产生的有机碳, 或是红树林水体中藻类、菌类的初级生产输入; 除了这些外来有机碳以外, 红树植物自身也有很高的光合效率和生产力。由于红树林具有复杂的水文环境和生物特异性, 对红树林有机碳的研究大多需要结合水文条件和气候条件进行综合的分析讨论。一方面, 地形和水文因素比如河流流量、降雨、潮汐等控制了有机物的埋藏和交换的物理过程[6-7]; 另一方面, 生物因素也对红树林中有机碳的埋藏和迁移有重要影响[8]。亚洲地区的红树林在种类方面最为复杂, 树林的物种组成能够决定红树林有机碳的特征[9-10]。这些复杂的环境因素使红树林系统中的有机碳循环在时间、空间尺度上都非常多变。
总有机碳(total organic carbon, TOC)、碳氮元素比(C/N)和稳定碳同位素(δ13C)为研究沉积有机碳来源的传统指标, 同样被应用到红树林有机碳来源的研究中[11-12], 但这些指标的单独应用存在一定的局限性。由于红树植物的C/N值与δ13C值与陆生植物大致相同, 仅仅利用这两种指标无法进行准确的区分。例如, Xue等[13]运用δ13C和C/N调查了漳江口红树林湿地的有机质来源, 并指出6%~37%的沉积物有机质来自红树林。但是, 这种计算方式并不能有效区分陆源有机碳和红树林源有机碳, 所得结果其实是陆生高等植物和红树林的混合。
类脂生物标志物由特定的生物产生, 记载着相应的母源信息, 在沉降和成岩过程中能较稳定存在, 被广泛应用于指示物质来源。维管植物表皮蜡质中的长链正构烷烃(C27, 29, 31, 33 n-alkanes)是表征陆源有机碳的经典指标[14], 但是来源存在重叠, 例如红树植物和陆生植物拥有大致相同的烷烃特征[15]。目前, 学界缺乏一个能够表征所有红树植物的生物标志物。红树属植物(Rhizophora)叶片中大量合成的蒲公英萜醇(taraxerol), 虽然不是其所特有的脂类, 但在其叶片中的含量远高于其他高等植物(干叶中含量为15.9 mg/g[16])。因此, 蒲公英萜醇能够更为具体地量化边缘海系统中红树林来源有机质的分布埋藏情况。需要指出的是, 并非广义上的所有红树植物都能够产生蒲公英萜醇。目前, 蒲公英萜醇仅在红树属(Rhizophora)和榄李属(Lumnitzera)两个属中检出[17-18]。此外, 甾醇和烯酮等生物标志物已经被广泛应用于水环境中浮游植物群落生态结构的重建[19], 以菜子甾醇(brassicasterol)指示硅藻的生产力, 甲藻甾醇(dinosterol)指示甲藻生产力, 长链烯酮(C37∶3, 37∶3 alkenones)来指示颗石藻的生产力[20-22]。
目前, 很多研究聚焦红树林系统中不同来源有机质的地理分布, 但关于这些有机质来源的量化研究相对较少。蒲公英萜醇的应用局限于其(相对)含量, 并未被作为一个指标应用于数学混合模型量化红树林有机质贡献。本文在海南省儋州湾南岸选取柱状沉积物样品, 测定包括长链正构烷烃、甾醇的多种类脂生物标志物, 尤其是红树植物特征标志物蒲公英萜醇含量, 结合δ13C进行混合模型计算, 探索蒲公英萜醇作为特征生物标志物量化红树林源有机质的一种应用; 同时, 估算该地有机碳储量, 为区域性的碳储数据汇总提供依据。
1 研究区域与方法 1.1 研究区域儋州湾(19°54′N, 109°57′E, 图 1)位于海南省西北部的儋州市境内, 是北部湾伸入洋浦半岛构成的半封闭内湾, 面积约50 km2。潮型为不规则半日潮, 平均潮差1.05 m, 年均气温23.1℃。注入儋州湾的河流有大水江与春江, 年径流量分别为4.1×108 m3和2.8×108 m3[23]。儋州湾于1986年被立为市级自然保护区, 红树林面积约133 ha, 主要红树科植物包括红海榄(Rhizophora stylosa), 木榄(Bruguiera gymnorrhiza), 榄李(Lumnitzera racemosa), 海漆(Excoecaria agallocha), 蜡烛果(Aegiceras corniculatum), 秋茄(Kandelia obovate), 海榄雌(Avicennia marina), 黄槿(Hibiscus tiliaceus), 水黄皮(Pongamia pinnata), 海芒果(Cerbera manghas)等[24-25]。儋州湾属于夏季湿润、冬季干燥的季风性气候, 年均降雨量约为1 426 mm/a, 雨季为每年5月到10月, 这期间的降雨约占全年平均降水量的80%。
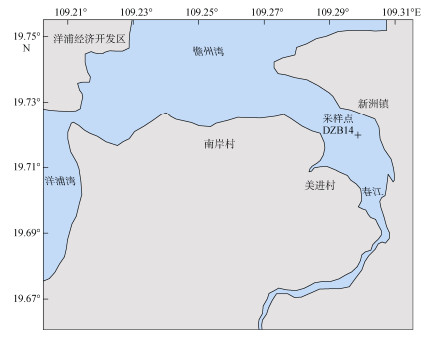 |
| 图 1 儋州湾采样站位示意图 Fig. 1 Sampling stations in Danzhou Bay |
本研究所用柱状样DZB14于2016年11月使用universal coring system (Aquatic Research, 直径68 mm, 长度120 cm), 以重力采样法采集于春江(图 1), 春江上下游沿岸和入海处均有红树林分布。柱状样位于春江入儋州湾口, 据儋州湾口9 431 m。站位水温21.8℃, 手持盐度计WTW Multi 3420测量盐度8.6。柱状样长度40 cm。本研究以2 cm为间隔进行样品处理。同时在入海河流沿岸按盐度梯度采集红海榄叶片。
1.2 研究方法 1.2.1 粒度测定粒度测定方法参照陶舒琴[26]的研究。粒度样品在350℃下烧12 h之后加入5 mL 1 mol/L的六偏磷酸钠溶液, 超声30 min以上, 之后使用Malvern 3000激光粒度仪测试。
1.2.2 总有机碳和稳定碳同位素测定总有机碳测定方法参照操云云等[27]的研究, 稳定碳同位素测定方法参照陶舒琴[26]的研究。将冷冻干燥的沉积物样品除去较大植物碎屑后研磨, 取约1 g样品装入8 mL玻璃瓶中。加入4 mol/L HCl, 去除无机碳。加入超纯水洗去HCl, 直至上清液呈中性。将洗至中性的沉积物样品在55℃下烘干(约24 h)。将烘干的沉积物样品研磨使其均质化。
使用CHN元素分析仪(Thermo Flash 2000 Elemental Analyzer, EA)测定总有机碳含量。所用标准样品为阿托品(Atropina Standard, TOC=70.56%)和标准土(Low Organic Content Soil Standard OAS, TOC= 1.55%)。标准误差为±0.02% (n=6)。使用稳定同位素比质谱仪(Elemental Analyzer -Isotope Ratio Mass Spectrometer, EA-IRMS), 在连续流模式下测定总有机碳稳定碳同位素组成(R=13C/12C), 根据V-PDB (Vienna Pee Dee Belemnite)标准按下式矫正: δ13C(‰)= [Rsample/Rstandard –1]×1 000。所用标准样品为USGS-40 (δ13C= –26.39‰), IAEA-600(δ13C= –27.77‰)和IAEA- CH3 (δ13C= –4.72‰)。使用IAEA-600标准测量所得标准误差为±0.06%(n= 6), 测样精度大于±0.2‰。
1.2.3 类脂生物标志物提取和测定生物标志物的提取和测定方法参照操云云等[27]的研究。将冷冻干燥的样品研磨后称取5 g样品装入50 mL特氟龙样品瓶中, 加入约10 mL二氯甲烷︰甲醇(3∶1)混合溶液, 上层液体澄清后加入n-C19醇和n-C24氘烷内标, 振荡将其充分混合。将混合后样品超声15 min, 离心(2 000 r/min, 2 min), 收集上清液。重复上述步骤3次, 共萃取4次。将得到的总的萃取有机质柔和N2吹干(水浴温度 < 40℃)。向吹干溶剂的萃取物中加入约5 mL的6%氢氧化钾-甲醇溶液, 碱水解8 h。用正己烷萃取、离心(2 000 r/min, 2 min), 将上层清液转移, 重复4次, 萃取液合并后柔和N2吹干。将该组分进行硅胶柱层析分离, 分别用8 mL正己烷淋洗得烷烃组分, 用12 mL 5%甲醇(二氯甲烷∶甲醇=95∶5)淋洗得醇类组分。醇类组分分为二等份, 一份加入衍生化试剂(BSTFA), 70℃加热反应1 h, 用于甾醇和烯酮测定; 另一等份加入吡啶和乙酸酐, 70℃加热反应30 min, 用于蒲公英萜醇测定。
经过化学纯化后的组分用气相色谱(Agilent 7890N GC)进行定量分析。采用PTV进样口不分流进样, 初始温度40℃, 平衡时间0.05 min; 进样量1 μL。色谱柱类型为VF-1ms(30 m×0.25 mm, 膜厚度0.25 μm); 载气为氢气, 流速1.3 mL/min; 色谱柱的升温程序为: 80℃保持1 min, 以25℃/min的速度加热到200℃, 4℃/min加热到250℃, 1.7℃/min加热到300℃, 保持10 min, 5℃/min加热到315℃, 保持5 min后结束。
采用火焰离子化检测仪(Flame Ionization Detector, FID)检测器将有机质燃烧产生的碳转换为电信号并图像化, 检测器温度在整个测定过程中保持在320℃。化合物定性主要通过对比已知浓度的n-C19醇和n-C24氘烷混合标准各峰的保留时间来确定; 定量采用内标法, 对比样品和混合标准对应的化合物的电信号峰面积, 根据混合标准的浓度定量估算样品中该化合物的含量。实验空白加入内标随着样品一起进行前处理, 实验回收率达85%以上。生物标志物GC定量分析过程中的分析误差 < 15%。
2 研究结果 2.1 干密度、粒径、总有机碳和δ13CDZB14沉积物的干密度(bulk density, BD)范围在1.12~1.66 g/cm3(图 2), 在垂直分布上分为两个高值区和两个低值区(T检验P < 0.05), 自下而上干密度分区分别为(1.60±0.07) g/cm3(沉积物深度33 cm以下); (1.18±0.03) g/cm3(18~30 cm); (1.47±0.01) g/cm3 (6~15 cm)和1.12 g/cm3(3 cm以上)。沉积物粒径总体较粗, 均值为87 μm, 范围在66~411 μm。
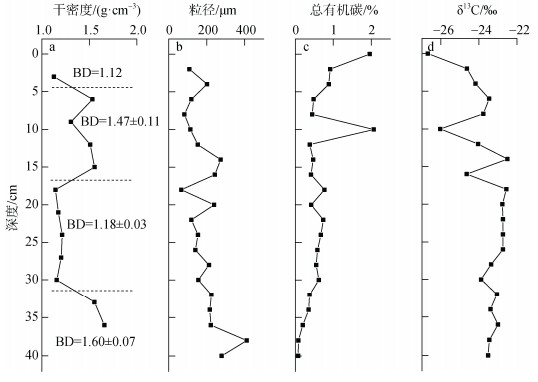 |
| 图 2 干密度、粒径、总有机碳和稳定碳同位素垂直分布 Fig. 2 Vertical distributions of the bulk density (BD), grain size, total organic carbon (TOC), and δ13C at DZB14 |
DZB14总有机碳平均值为0.6±0.5%, 在表层和10 cm处出现极高值, 可能是样品中混有植物碎屑。通常来说, 粗颗粒的砂质沉积物对有机碳的保留程度较低, 矿物粒径也被认为是影响有机质埋藏量的主要因素之一[28]。因此, 总有机碳在0~12 cm的含量较高可能是输入和保存的共同结果。DZB14的δ13C值平均值为–23.7‰±1.1‰, 范围在–22.50‰~ –26.69‰。上层数值普遍较负, 与高等植物有机质特征相吻合, 受植物碎屑输入影响。
2.2 生物标志物含量生物标志物含量使用总有机碳进行校正, 以消除矿物对有机质保存情况和非有机质输入的影响, 表达方式为μg/g TOC, 即每克总有机质中的生标含量。使用长链正构烷烃(C27+29+31+33 n-alkanes)表征高等植物有机质输入, 包括红树植物和陆生植物; 蒲公英萜醇表征红树植物(包括红树属和榄李属)有机质输入; 甲藻甾醇+菜子甾醇+C37∶2, 37∶3烯酮(Phytoplankton Biomarkers, PB)表征海洋浮游植物有机质输入。DZB14柱状样的长链正构烷烃相对含量平均值为(95±34) μg/g TOC(图 3)。PB在表层和26 cm存在两个由于低TOC造成的极大值, 除此之外均值为(18±7) μg/g TOC。蒲公英萜醇同样存在两个极值, 表层为低TOC导致, 10 cm处则可能是样品中混有新鲜红树植物叶片。除去极值, DZB14的蒲公英萜醇含量为(272±149) μg/g TOC。垂直方向上, 长链正构烷烃含量在该地没有明显随时间变化, 蒲公英萜醇略有增加, 而PB略有减少。
 |
| 图 3 长链正构烷烃、浮游生物标志物PB、蒲公英萜醇和T的垂直分布 Fig. 3 Vertical distributions of the concentrations of n-C27+29+31+33 alkanes, phytoplankton biomarker (PB), and taraxerol and T value (T= taraxerol/n-C31 alkane) |
本文所采集的红树属树叶样品中n-C31正构烷烃是含量最高的正构烷烃, 我们定义参数T为蒲公英萜醇与C31正构烷烃含量的比值, 即:
| $ T = {\rm{taraxerol/}}{{\rm{C}}_{31}}\;n - {\rm{alkane, }} $ | (1) |
以此在2.3混合模型中表征红树植物有机质输入。除去表层和10 cm的极大值, DZB14的T值均值为9.5±5.6。表层和10 cm的T极大值与δ13C极低值吻合, 符合红树植物特征。
2.3 有机质来源混合模型虽然蒲公英萜醇在其他高等植物中也有少量存在, 但其含量远小于在红树植物中的含量。例如, 在Setzer等[18]对山麻杆属叶片的分析报告中, 蒲公英萜醇含量仅为新鲜树叶的0.000 7%。而本文所用红树属叶片中蒲公英萜醇含量均值为10 142 μg/g TOC, 以树叶总有机质含量为50%换算, 蒲公英萜醇含量高达干叶总有机质的2%。相反, 长链正构烷烃是在所有高等植物中普遍存在的类脂生物标志物[14]。因此, 通过引入蒲公英萜醇和长链正构烷烃的比值, 能够把来自红树植物的大量的蒲公英萜醇区分出来, 从而进一步消除其他植物来源有机质的影响。例如, Versteegh等[16]运用红树属花粉和taraxerol/ C29正构烷烃在沉积物中识别了来自于红树植物的有机物质, 并证明这两个指标有良好的相关性。
本文选用δ13C和T值进行混合模型计算。根据前人的研究经验, δ13C值能够有效区分高等植物(包括陆生植物和红树植物)和水生植物来源有机质[29-31]; 而T值能够识别红树来源有机质, 以弥补传统指标δ13C在区分陆生植物和红树植物方面的缺陷。红树属树叶样品的δ13C平均值为–(29±0.7)‰, T平均值为280±69。为了更具体地量化该地的有机质来源, 定义δ13C = –16‰(来自中国南海北部浮游植物[32]), T = 0为水生植物端元值; δ13C = –27‰[33], T = 0.05(来自Versteegh等[16]选取的环境本底值)为陆生植物端元值; δ13C = –29‰, T = 280为红树属端元值(树叶样品, n = 4)进行计算。根据吴瑞等[25]的调查结果, 在采样河流中, 榄李属在种群中所占比例较低, 而红树属在红树群落中的相对多度[RA(%)=(某个种在样方中出现的次数/所有出现的次数)×100%]为20.5%。我们用上述方式计算出红树属的有机质贡献后, 再使用当地的红树群落组成校正, 以估算全部红树植物对沉积物的贡献。混合模型使用IsoSource进行计算[34], 模型所采用的端元值见表 1, 计算公式如下:
| $ {{\rm{ \mathsf{ δ} }}^{13}}{{\rm{C}}_{{\rm{sample}}}} = - 27 \times {f_{{\rm{terr}}}} - 29 \times {f_{{\rm{mang}}}} - 16 \times {f_{{\rm{aq}}}}, $ | (2) |
| $ {T_{{\rm{sample}}}} = 0.05 \times \left( {{f_{{\rm{terr}}}} + {f_{{\rm{mang}}}} - {f_{{\rm{Rhi}}}}} \right) + 280 \times {f_{{\rm{Rhi}}{\rm{.}}}}, $ | (3) |
| $ {f_{{\rm{Rhi}}{\rm{.}}}}/{f_{{\rm{mang}}}} = 0.205, $ | (4) |
| $ {f_{{\rm{terr}}}} + {f_{{\rm{mang}}}} + {f_{{\rm{aq}}}} = 1, $ | (5) |
| 端元值 | ||||
| 陆生植物 | 水生浮游植物 | 红树属 | 红树属占所有红树植物的比例 | |
| δ13C/‰ | –27 | –16 | –29 | 20.5% |
| T | 0.05 | 0 | 280 | |
其中, fterr, faq, fmang, 和fRhi.分别代表陆生、水生浮游植物、红树植物和红树属来源有机质的所占的比例。
根据计算结果(图 4), DZB14处陆生植物, 水生植物和红树植物来源有机质所占比例分别为(47±10)%, (36±5)%和(17±10)%。垂直分布上, DZB14的陆生植物有机质贡献比例自下而上逐渐减小(62%~26%), 与之相对的红树植物有机质逐渐增加(5%~44%)。
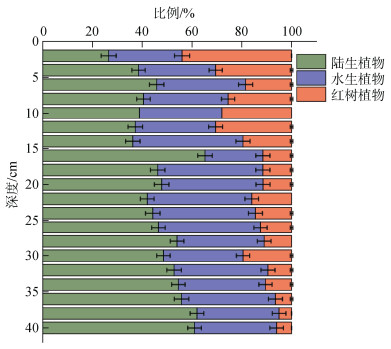 |
| 图 4 混合模型计算结果 Fig. 4 Results of the mixing model |
本文所采用总有机碳TOC和干密度BD来估算沉积物的有机碳储量(carbon stock)[35], 结合混合模型计算得到的fmang进一步计算由红树林贡献的碳储量。由于干密度和总有机碳层数不对应, 而干密度总体变化较小, 在计算中将使用图 3所示的干密度分区平均值。
| $ {\rm{Carbon}}\;{\rm{stock}}\left( {{\rm{t/ha}}} \right) = {\rm{TOC}}\left( \% \right) \times {\rm{BD}}\left( {{\rm{g/c}}{{\rm{m}}^3}} \right) \times 1\left( {{\rm{cm}}} \right), $ | (6) |
| $ {\rm{Mangrove}}\;{\rm{carbon stock}}\left( {{\rm{t/ha}}} \right) = {\rm{carbon stock}}\left( {{\rm{t/ha}}} \right) \times {f_{{\rm{mang}}}}\;. $ | (7) |
如图 5所示, DZB14单位厘米深度沉积物的碳储量范围在0.12~2.90 t/ha, 18~34 cm之间为高值区(均值0.70 t/ha)。从总量上来看, DZB14共40 cm的沉积物中碳储量为34.10 t/ha。按照红树林总面积133 ha计算, 儋州湾南岸红树林保护区表层40 cm沉积物的总碳储量约为4 535 t。按照混合模型计算结果, DZB14单位厘米深度的红树碳储量范围为0.01~0.45 t/ha(fmang>100%或缺失的层数取上下层平均值计算), 均值为0.14 t/ha。同样, 在上述总碳储高值层位中, 红树碳储量也相对较大。辛琨等[36]对红树林土壤碳储量的调查显示, 红树林根系通常在20~40 cm的深度埋藏和降解, 是除表层凋零物之外重要的有机碳来源。因此, 图 5中的碳储量中间高值可能是由于来自红树林根系的有机质输入引起的。
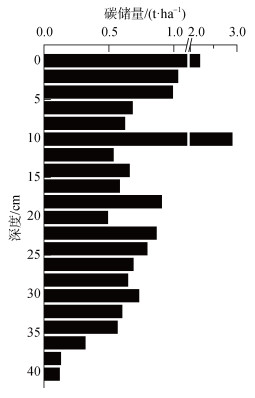 |
| 图 5 单位厘米碳储量垂直分布 Fig. 5 Vertical distribution of the carbon stock per cm |
综合来看, 儋州湾南岸地区沉积物中以陆源有机质为主[(47±10)%], 水源有机质次之[(36±5)%], 红树源有机质比例最低[(17±10)%]。对此的解释有: 第一, 陆源有机质在河口的沉积。DZB14位于河流入海处, 河流携带的大量有机质会在此沉积, 而红树植物庞大的根系能够有效拦截这些陆源有机碳。河口的相关研究指出, 陆生高等植物产生的有机碳是陆源有机质最主要的成分[37-41]。第二, 红树植物有机质的输出。高生产力的红树林会通过潮汐作用向外部水域输出一部分通过初级生产所固定的碳, 几乎占总凋零物的一半[1]。尤其是河流沿岸的红树林由于受单一方向的水流运输影响, 更倾向于输出而非积累有机质[9]。因此, 与红树林极高的净生产力[12, 29]不吻合的是, 红树林源有机碳往往不是红树林下沉积物中最主要的组分[42-44]。本文计算的沉积物样品T均值(9.5)与树叶样品T均值(280)的比例仅为3%, 说明红树植物产生的绝大多数有机质没有被就近埋藏, 而是被输出或分解。但是, 红树林输出的有机质受周边环境(狭窄河道和入海口, 珊瑚海草床等)的限制, 通常不会传输到很远的距离[42-43]。因此, 虽然该处及河流上下游有红树林生长, 但由于红树植物有机质大量和短途的输出特点, 该处红树植物有机碳的比例很可能反而低于儋州湾口无红树林生长的、盐度较高的位置。第三, 原位产生的水源有机质。养殖业是本研究区域当地的传统产业, 高密度养殖和人工施肥会造成水体富营养化, 促进水生藻类的生长[45]。此外, 儋州湾部分地区的生活污水和养殖污水目前直排入海, 这些污水也会干扰自然湿地的有机质循环, 并使红树林系统发生退化。
3.2 有机碳埋藏速率及储量红树林的埋藏速率与盐沼湿地和海草床生态系统相似, 但显著高于淡水泥炭地和陆地森林生态系统[46]。目前, 许多研究使用210Pb和137Cs对红树林沉积物进行定年以测定红树林的碳埋藏速率, Breithaupt等[47]对此进行了总结, 并估算全球红树林平均碳埋藏速率为163 g/(m2·a), 平均每年埋藏26.1×1012 g有机碳。据王秀君等[48]统计, 中国红树林固碳效率高达200 g/(m2·a), 高于全球平均水平。对儋州湾地区的其他柱状样初步定年中, 在长74 cm的柱状样中并未观察到210Pb的衰减曲线和137Cs的活度顶峰(未发表数据)。因此, 本文40 cm的沉积物实际年龄可能小于1965年沉积。假设柱状样最下层自1965年开始沉积(至采样时间51年), 可估算最低沉积速率0.67 t/(ha·yr), 换算单位后为67 g/(m2·a), 远低于全球平均速率。
海滩涂养殖业在历史上是儋州地区的主要经济来源。由于生态环保的需要, “退塘还湿”、保护和修复红树林生态系统的工作正在逐步展开, 但目前其生态环境并没有完全恢复, 且入海河流沿岸有大量人工堤坝和排污口, 这些人为因素都对有机质的埋藏和迁移有极大影响。同时, 碳埋藏量不仅取决于有机碳的初始输入量, 也取决于这些有机碳在沉积物中的保存情况。采样地处于河流外部, 沉积物粒径较粗, 均值为87 μm, 属于砂质沉积物。粗粒径的砂质矿物表面积小, 对有机质的保存较差[49]; 而氧气在粗颗粒土壤中渗透的程度更深, 也会进一步降解有机质[50], 故该处单位厘米有机质含量和总碳储量较其他红树林系统偏低。
3.3 研究展望由于柱状样属于浅层沉积物, 水流和生物活动导致的垂直混合作用较强, 阻碍了对当地有机质来源和碳储量时间变化的深入讨论。将本文的混合模型计算方法和更精确的定年数据结合, 可以进行季节和较长尺度的分析。此外, 在“真红树”类别中, 不同树种的红树植物内部的生物化学过程、其对环境因素的适应程度、能够指示有机质的特异生物标志物均有所不同。同样, 红树林系统中不同植物和动物在潮间带的横向(高、中、低潮位)和纵向(盐度高低)分布也随着不同地域的特点而变化。虽然蒲公英萜醇有良好的示踪能力, 但根据目前的研究, 只有红树和榄李两个属的红树植物才能大量产生蒲公英萜醇。因此, 利用蒲公英萜醇估算有机质来源时, 当地红树林的群落结构对结果影响很大。未来研究应在充分的生态学调查的基础上更准确地估算红树林对沉积有机质的贡献。同时, 随着气候变化加剧, 海平面高度、大气CO2浓度、气温水温及降雨量的变化都会对红树林湿地系统的碳埋藏能力造成影响。对于以红树林系统为代表的的海岸带生态系统的“蓝碳”碳储, 无论是静态碳库还是动态碳通量, 目前都存在多种测量方法。在未来研究中, 建立对“蓝碳”这一相对较新的概念的统一核算标准也有利于进行大范围的统计和分析。
4 结论(1) 在儋州湾南岸采集的柱状样中高等植物生标(长链正构烷烃C27+29+31+33 n-alkanes)含量为(95±34) μg/g TOC, 浮游植物生标(甲藻甾醇、菜籽甾醇、长链烯酮)含量为(18±7) μg/g TOC, 红树植物标志物(蒲公英萜醇)含量为(272±149) μg/g TOC。混合模型表明该处陆源、水源和红树植物有机质所占平均比例分别为47%, 36%和17%, 与生物标志物含量指示相吻合。虽然儋州湾沿岸生长有红树林, 但红树植物有机质并不是沉积物中的主要成分, 相对埋藏量只有3%, 这可能是由陆源有机质的沉积和红树植物有机质的大量输出/分解造成的。
(2) 儋州湾南岸柱状样沉积物单位厘米深度碳储量为0.12~2.90 t/ha, 40 cm长的柱状样总碳储量约34.10 t/ha。据此估计, 儋州湾南岸的红树林保护区表层40 cm沉积物的总碳储约4 535 t。本研究表明, 儋州湾地区沉积物中来自于红树林的有机质比例不高, 且其碳埋藏量低于全球平均水平。2019年, 儋州湾湿地入选《中国沿海湿地保护绿皮书(2019)》“最值得关注的十块滨海湿地”名单, 具有很大的生态价值和发展潜力。修复和保护儋州湾红树林, 能够有效提升湿地的碳埋藏效率、降低大气CO2浓度, 从而减缓气候变化对环境带来的负面影响。
致谢: 张海龙和王子成帮助采集样品, 李莉、侯鹏飞对实验工作进行了帮助, 审稿人给予了专业的修改建议, 作者对此表示诚挚谢意。
| [1] |
Jennerjahn T C, Ittekkot V. Relevance of mangroves for the production and deposition of organic matter along tropical continental margins[J]. Naturwissenschaften, 2002, 89(1): 23-30. DOI:10.1007/s00114-001-0283-x |
| [2] |
Alongi D M. Carbon cycling and storage in Mangrove Forests[J]. Annual Review of Marine Science, 2014, 6(1): 195-219. DOI:10.1146/annurev-marine-010213-135020 |
| [3] |
唐剑武, 叶属峰, 陈雪初, 等. 海岸带蓝碳的科学概念、研究方法以及在生态恢复中的应用[J]. 中国科学: 地球科学, 2018(6): 661-670. Tang Jianwu, Ye Shufeng, Chen Xuechu, et al. Coastal blue carbon: Concept, study method, and the application to ecological restoration[J]. Science China: Earth Sciences, 2018(6): 661-670. |
| [4] |
McLeod E, Chmura G L, Bouillon S, et al. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Frontiers in Ecology and the Environment, 2011, 9(10): 552-560. DOI:10.1890/110004 |
| [5] |
朱耀军, 郭菊兰, 武高洁. 红树林湿地有机碳研究进展[J]. 生态学杂志, 2012, 31(10): 2681-2687. Zhu Yaojun, Guo Julan, Wu Gaojie. Organic carbon in mangrove wetlands: A review[J]. Chinese Journal of Ecology, 2012, 31(10): 2681-2687. |
| [6] |
Lee S Y. Tropical mangrove ecology: Physical and biotic factors influencing ecosystem structure and function[J]. Austral Ecology, 2015, 24(4): 355-366. |
| [7] |
Mao L, Zhang Y, Bi H. Modern Pollen deposits in coastal mangrove swamps from Northern Hainan Island, China[J]. Journal of Coastal Research, 2006, 22(6): 1423-1436. |
| [8] |
Cai W J, Dai M H. Comment on "Enhanced open ocean storage of CO2 from shelf sea pumping"[J]. Science, 2004, 304(5673): 1005-1008. DOI:10.1126/science.1095491 |
| [9] |
Adame M F, Lovelock C E. Carbon and nutrient exchange of mangrove forests with the coastal ocean[J]. Hydrobiologia, 2011, 663(1): 23-50. DOI:10.1007/s10750-010-0554-7 |
| [10] |
Bouillon S, Borges A V, Castaneda-Moya E, et al. Mangrove Production and Carbon sinks: A revision of global budget estimates[J]. Global Biogeochemical Cycles, 2008, 22(2): 1-12. |
| [11] |
Prasad M B K, Kumar A, Ramanathan A L, et al. Sources and dynamics of sedimentary organic matter in Sundarban mangrove estuary from Indo-Gangetic delta[J]. Ecological Processes, 2017, 6(1): 8. DOI:10.1186/s13717-017-0076-6 |
| [12] |
Thimdee W, Deein G, Sangrungruang C, et al. Sources and fate of organic matter in Khung Krabaen Bay (Thailand) as traced by δ13C and C/N atomic ratiosand C/N atomic ratios[J]. Wetlands, 2003, 23(4): 729-738. DOI:10.1672/0277-5212(2003)023[0729:SAFOOM]2.0.CO;2 |
| [13] |
Xue B, Yan C L, Lu H L, et al. Mangrove-derived organic carbon in sediment from Zhangjian Estuary (China) mangrove wetland[J]. Journal of Coastal Research, 2009, 25(4): 949-956. |
| [14] |
Eglinton G, Hamilton R J. Leaf epicuticular waxes[J]. Science, 1967, 156(3780): 1322-1335. DOI:10.1126/science.156.3780.1322 |
| [15] |
Dodd R S, Rafii Z A, Fromard F, et al. Evolutionary diversity among Atlantic coast mangroves[J]. Acta Oecologica, 1998, 19(3): 323-330. DOI:10.1016/S1146-609X(98)80036-2 |
| [16] |
Versteegh G J M, Schefuß E, Dupont L, et al. Taraxerol and Rhizophora pollen as proxies for tracking past mangrove ecosystems[J]. Geochimica et Cosmochimica Acta, 2004, 68(3): 411-422. DOI:10.1016/S0016-7037(03)00456-3 |
| [17] |
He D, Simoneit B R, Cloutier J B, et al. Early diagenesis of triterpenoids derived from mangroves in a subtropical estuary[J]. Organic Geochemistry, 2018, 125: 196-211. DOI:10.1016/j.orggeochem.2018.09.005 |
| [18] |
Setzer W N, Shen X, Bates R B, et al. A phytochemical investigation of Alchornea latifolia[J]. Fitoterapia, 2000, 71(2): 195-198. DOI:10.1016/S0367-326X(99)00133-1 |
| [19] |
丁玲, 邢磊, 赵美训. 生物标志物重建浮游植物生产力及群落结构研究进展[J]. 地球科学进展, 2010, 25(9): 981-989. Ding Ling, Xing Lei, Zhao Meixun. Applications of Biomarkers for Reconstructing Phytoplankton Productivity and Community Structure Changes[J]. Advances in Earth Science, 2010, 25(9): 981-989. |
| [20] |
Werne J P, Hollander D J, Lyons T W, et al. Climate-induced variations in productivity and planktonic ecosystem structure from the Younger Dryas to Holocene in the Cariaco Basin, Venezuela[J]. Paleoceanography, 2000, 15(1): 19-29. DOI:10.1029/1998PA000354 |
| [21] |
Seki O, Ikehara M, Kawamura K, et al. Reconstruction of paleoproductivity in the Sea of Okhotsk over the last 30 kyr[J]. Paleoceanography, 2004, 19(1): PA1016. |
| [22] |
邢磊, 丁玲, 赵美训, 等. Baja California边缘PC14岩芯海水表层温度及生产力变化的百年尺度记录[J]. 海洋与湖沼, 2009, 40(4): 385-392. Xing Lei, Ding Ling, Zhao Meixun, et al. Centennial variations in sea surface temperature and productivity over the last 14ka from core PC-14 off Baja California[J]. Oceanologia et Limnologia Sinica, 2009, 40(4): 385-392. |
| [23] |
尤坤元. 海南岛洋浦湾和三亚湾底质中有孔虫的研究[J]. 南京大学学报: 自然科学版, 1989, 5(3): 174-184. You Kunyuan. A preliminary study of formainifera in the bottom sediments of Yangpu Harbor and Sanya Harbor of Hainan Island[J]. Journal of Nanjing University (Natural Sciences Edition), 1989, 5(3): 174-184. |
| [24] |
陈敏, 陈石泉, 陈春华, 等. 海南岛周边泻湖资源保护与可持续利用研究探讨[J]. 海洋湖沼通报, 2017(4): 107-114. Chen Min, Chen Shiquan, Chen Chunhua, et al. Studies on protection and sustainable utilization of lagoon resource around Hainan Island[J]. Transactions of Oceanology and Limnology, 2017(4): 107-114. |
| [25] |
吴瑞, 陈晓慧, 陈丹丹, 等. 海南省新英湾红树林资源现状调查分析[J]. 热带农业科学, 2016, 36(8): 35-37. Wu Rui, Chen Xiaohui, Chen Dandan, et al. Investigation on current status of mangrove resources in Xinying Bay of Hainan Province[J]. Chinese Journal of Tropical Agricluture, 2016, 36(8): 35-37. |
| [26] |
陶舒琴. 黄河颗粒态及渤、黄海现代沉积有机质的组成和同位素分布特征及源项解析[D]. 青岛: 中国海洋大学, 2014. Tao Shuqin. The composition, isotopic characteristics and sources of organic matter in the Yellow River suspended particulates and adjacent Bohai and Yellow Sea surface sediments[D]. Qingdao: Ocean University of China, 2014. |
| [27] |
操云云, 邢磊, 王星辰, 等. 渤海-北黄海表层沉积物中正构烷烃的组合特征及其指示意义的探讨[J]. 中国海洋大学学报(自然科学版), 2018, 48(3): 104-113. Cao Yunyun, Xing Lei, Wang Xingchen, et al. Study on the Indication of n-alkanes in Surface Sediments from the Bohai Sea and the North Yellow Sea[J]. Periodical of Ocean University of China, 2018, 48(3): 104-113. |
| [28] |
Hemingway J D, Rothman D H, Grant K E, et al. Mineral protection regulates long-term global preservation of natural organic carbon[J]. Nature, 2019, 570(7760): 228-231. DOI:10.1038/s41586-019-1280-6 |
| [29] |
Bao H Y, Wu Y, Tian L X, et al. Sources and distributions of terrigenous organic matter in a mangrove fringed small tropical estuary in South China[J]. Acta Oceanologica Sinica, 2013, 32(4): 18-26. DOI:10.1007/s13131-013-0295-3 |
| [30] |
Bouillon S, Dahdouh-Guebas F, Rao A V V S, et al. Sources of organic carbon in mangrove sediments: variability and possible ecological implications[J]. Hydrobiologia, 2003, 495(1-3): 33-39. DOI:10.1023/A:1025411506526 |
| [31] |
Gonneea M E, Paytan A, Herrera-Silveira J A. Tracing organic matter sources and carbon burial in mangrove sediments over the past 160 years[J]. Estuarine Coastal and Shelf Science, 2004, 61(2): 211-227. DOI:10.1016/j.ecss.2004.04.015 |
| [32] |
Xia P, Meng X W, Li Z, et al. Mangrove development and its response to environmental change in Yingluo Bay (SW China) during the last 150 years: Stable carbon isotopes and mangrove pollen[J]. Organic Geochemistry, 2015, 85: 32-41. DOI:10.1016/j.orggeochem.2015.04.003 |
| [33] |
Dittmar T, Lara R J, Kattner G. River or mangrove? Tracing major organic matter sources in tropical Brazilian coastal waters[J]. Marine Chemistry, 2001, 73(3): 253-271. |
| [34] |
Phillips D L, Gregg J W. Source partitioning using stable isotopes: coping with too many sources[J]. Oecologia, 2003, 136(2): 261-269. DOI:10.1007/s00442-003-1218-3 |
| [35] |
Avelar S, van der Voort T S, Eglinton T I. Relevance of carbon stocks of marine sediments for national greenhouse gas inventories of maritime nations[J]. Carbon Balance and Management, 2017, 12(1): 10. DOI:10.1186/s13021-017-0077-x |
| [36] |
辛琨, 颜葵, 李真, 等. 海南岛红树林湿地土壤有机碳分布规律及影响因素研究[J]. 土壤学报, 2014, 51(5): 1078-1086. Xin Kun, Yan Kui, Li Zhen, et al. Distribution of soil organic carbon in mangrove wetlands of Hainan Island and its influencing factors[J]. Acta Pedologica Sinica, 2014, 51(5): 1078-1086. |
| [37] |
Resmi P, Manju M N, Gireeshkumar T R, et al. Source characterisation of Sedimentary organic matter in mangrove ecosystems of northern Kerala, India: Inferences from bulk characterisation and hydrocarbon biomarkers[J]. Regional Studies in Marine Science, 2016, 7: 43-54. DOI:10.1016/j.rsma.2016.05.006 |
| [38] |
Carreira R S, Cordeiro L G M S, Bernardes M C, et al. Distribution and characterization of organic matter using lipid biomarkers: A case study in a pristine tropical bay in NE Brazil[J]. Estuarine Coastal and Shelf Science, 2016, 168(10): 1-9. |
| [39] |
Xu Y, Mead R N, Jaffé R. A molecular marker-based assessment of sedimentary organic matter sources and distributions in Florida Bay[J]. Hydrobiologia, 2006, 569(1): 179-192. DOI:10.1007/s10750-006-0131-2 |
| [40] |
Alongi D M. The role of bacteria in nutrient recycling in tropical mangrove and other coastal benthic ecosystems[J]. Hydrobiologia, 1994, 285(1-3): 19-32. DOI:10.1007/BF00005650 |
| [41] |
Meng X, Xia P, Li Z, et al. Mangrove development and its response to Asian Monsoon in the Yingluo Bay (SW China) over the last 2000 years[J]. Estuaries and Coasts, 2017, 40(2): 540-552. DOI:10.1007/s12237-016-0156-3 |
| [42] |
Boschker H T S, Brouwer J F C D, Cappenberg T E. The Contribution of macrophyte-derived organic matter to microbial biomass in salt-marsh sediments: Stable carbon isotope analysis of microbial biomarkers[J]. Limnology and Oceanography, 1999, 44(2): 309-319. DOI:10.4319/lo.1999.44.2.0309 |
| [43] |
Bouillon S, Moens T, Dehairs F. Carbon sources supporting benthic mineralization in mangrove and adjacent seagrass sediments (Gazi Bay, Kenya)[J]. Biogeosciences, 2004, 1(1): 71-78. DOI:10.5194/bg-1-71-2004 |
| [44] |
Bouillon S, Boschker H T S. Bacterial carbon sources in coastal sediments: a cross-system analysis based on stable isotope data of biomarkers[J]. Biogeosciences, 2006, 3(2): 175-185. DOI:10.5194/bg-3-175-2006 |
| [45] |
刘萍, 孙萍, 宋洪军, 等. 桑沟湾不同养殖区浮游植物群落时空变化特征[J]. 海洋科学进展, 2019, 37(4): 673-680. Liu Ping, Sun Ping, Song Hongjun, et al. Spatio-temporal distribution of phytoplankton community in different aquaculture areas in the Sanggou Bay[J]. Advances in Marine Science, 2019, 37(4): 673-680. |
| [46] |
Smoak J M, Breithaupt J L, Smith T J, et al. Sediment accretion and organic carbon burial relative to sea-level rise and storm events in two mangrove forests in Everglades National Park[J]. Catena, 2013, 104(2): 58-66. |
| [47] |
Breithaupt J L, Smoak J M, Smith T J, et al. Organic carbon burial rates in mangrove sediments: Strengthening the global budget[J]. Global Biogeochemical Cycles, 2012, 26(3): GB3011. |
| [48] |
王秀君, 章海波, 韩广轩. 中国海岸带及近海碳循环与蓝碳潜力[J]. 中国科学院院刊, 2016, 31(10): 1218-1225. Wang Xiujun, Zhang Haibo, Han Guangxuan. Carbon cycle and "Blue Carbon" potential in China's coastal zone[J]. China Academic Journal, 2016, 31(10): 1218-1225. |
| [49] |
Dunn R J K, Welsh D T, Teasdale P R, et al. Investigating the distribution and sources of organic matter in surface sediment of Coombabah Lake (Australia) using elemental, isotopic and fatty acid biomarkers[J]. Continental Shelf Research, 2008, 28(18): 2535-2549. DOI:10.1016/j.csr.2008.04.009 |
| [50] |
Haas H D, Boer W, Weering T C E V. Recent sedimentation and organic carbon burial in a shelf sea: The North Sea[J]. Marine Geology, 1997, 144(1-3): 131-146. DOI:10.1016/S0025-3227(97)00082-0 |
 2021, Vol. 45
2021, Vol. 45


