
文章信息
- 许星鸿, 甘宏涛, 刘统昊, 孟霄, 丁子媛, 徐国成, 周丽青, 陆子俊, 葛春年. 2021.
- XU Xing-hong, GAN Hong-tao, LIU Tong-hao, MENG Xiao, DING Zi-yuan, XU Guo-cheng, ZHOU Li-qing, LU Zi-jun, GE Chun-nian. 2021.
- 单环刺螠染色体核型分析
- Karyotype analysis of Urechis unicinctus
- 海洋科学, 45(2): 91-98
- Marine Sciences, 45(2): 91-98.
- http://dx.doi.org/10.11759/hykx20200229001
-
文章历史
- 收稿日期:2020-02-29
- 修回日期:2020-05-10
2. 江苏海洋大学 江苏省海洋生物技术重点实验室, 江苏 连云港 222005;
3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室, 山东 青岛 266071
2. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005, China;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Chinese Academy of Fishery Sciences, Qingdao 266071, China
染色体作为遗传物质的载体和细胞功能的组织者, 是生物生长发育、遗传和变异的物质基础, 因此染色体及核型研究是遗传学的重要基础[1]。目前, 关于鱼类[2]、甲壳类[3]和贝类[4]等水生动物的染色体研究已有较多报道。单环刺螠(Urechis unicintus)隶属螠虫动物门螠纲无管螠目刺螠科, 俗称海肠, 为我国沿海分布的唯一无管螠目物种[5]。其肉味鲜美, 富含人体必需氨基酸、不饱和脂肪酸和具有药用价值的提取物, 被称为裸体海参, 并能对改善海洋环境污染起到积极作用, 具有较大的开发利用前景[6-7]。近年来由于过度捕捞, 单环刺螠天然资源量日益减少, 亟待开展人工繁育工作。染色体研究是遗传育种工作的基础, 但目前我国对单环刺螠的研究主要集中在形态特征[5]、生态环境[8]、繁殖发育[9]与增养殖技术[10]等方面, 关于单环刺螠的遗传学基础研究相对薄弱, 仅见不同地理种群遗传多样性分析和微卫星标记开发[11-12], 迄今尚未见有关单环刺螠染色体的文献报道。本研究探索了单环刺螠染色体制备方法, 并进行了核型分析, 以期为相关细胞遗传学和育种研究提供理论基础。
1 材料与方法 1.1 材料实验用单环刺螠体长(10.1±3.2) cm、体质量(15.4±3.5) g, 于2019年4月购自江苏省连云港市海宁路水产品市场, 胚胎和幼体由本课题组人工繁育所得。取成熟精卵进行人工授精, 受精卵洗卵后转入水族缸中, 水温15~16℃, 盐度25, 自然光照, 连续充气, 孵化后日投喂2次金藻(Isochrysis galbana)。胚胎和幼体取样时间分别为受精约18 h(膜内担轮幼虫)、孵化后2 d(担轮幼虫)和孵化后12 d(体节幼虫)。
1.2 方法 1.2.1 成体组织制片前处理: 将单环刺螠成体随机分两组, 一组按10 μg/g体质量向体腔一次性注射植物血球凝集素(phytohaemagglutinin, PHA), 12 h后用秋水仙素处理。另一组不注射PHA, 直接用秋水仙素处理。秋水仙素处理分别采用浸泡法和注射法进行对比, 浓度为0.4和0.6 g/L, 处理时间设置为6、8、10、12和14 h, 以筛选出秋水仙素处理的适宜方法。各组处理温度均为20℃。解剖取呼吸肠和体腔液, 呼吸肠剪碎, 200目筛绢过滤至离心管中; 体腔液于4℃以1 000 r/min离心5 min, 收集沉淀细胞。
低渗: 低渗液用0.075 mol/L KCl溶液, 低渗时间分别为30、45、60和75 min。
固定: 将含有材料的低渗液于4℃以1 000 r/min离心5 min, 弃上清。加入5 mL预冷的卡诺氏固定液(甲醇: 冰醋酸=3: 1), 轻轻吹打混匀, 4℃固定15 min后, 4℃以1 000 r/min离心5 min, 弃上清。更换新固定液3次, 使固定总时间达1 h。
解离: 向沉淀中加入2 mL预冷50%冰乙酸, 吹打混匀, 解离5 min。
滴片: 分别采用热滴片法和冷滴片法, 将细胞悬液滴在载玻片上, 滴片高度1~2 m, 自然风干。
染色: 用10%Giemsa染液染色20~30 min, 用蒸馏水冲洗并晾干。
1.2.2 胚胎和幼体制片分别取胚胎(膜内担轮幼虫)和幼体(担轮幼虫或体节幼虫)于含0.4 g/L秋水仙素的海水中培养12 h, 于4℃以1 000 r/min离心5 min, 弃上清, 取沉淀。低渗、固定、解离等其他步骤同成体材料。
1.3 染色体计数及核型分析染色体标本用尼康(ECLIPSE 90i)光学显微镜观察, 拍照。选取100个分散良好的染色体分裂相, 统计染色体数目, 根据频率分布确定染色体数目。选取10个数目完整、形态清晰的中期分裂相, 采用Adobe Photoshop CC 2018图像处理软件测量染色体长度, 并根据Levan等[13]的分类标准计算单环刺螠染色体的相对长度以及臂比等基本参数, 进行染色体配对和分类。
2 结果 2.1 单环刺brrhzimage: 2:erhhz染色体制片材料和方法的比较对分别以胚胎、幼体以及成体体腔细胞和呼吸肠为材料进行染色体的制片效果进行比较, 结果表明: 以成体体腔细胞、胚胎和幼体为材料均能观察到中期分裂相, 以呼吸肠为材料获得分裂相极少。以成体体腔细胞和幼体为材料得到的分裂相分别为(5.92± 1.03)%和(5.67±0.64)%, 两者差异不显著(P > 0.05)。以胚胎为材料得到的有丝分裂相虽然较多, 但制片杂质很多严重影响观察。
秋水仙素处理以浓度0.4 g/L、浸泡12 h得到的分裂相较清晰, PHA对增加分裂相无显著影响。采用0.075 mol/L KCl处理45 min低渗的染色体分散度较好, 热滴片法制片效果优于冷滴片法。
2.2 单环刺brrhzimage: 3:erhhz染色体的形态采用单环刺螠体腔细胞制备染色体标本, 经Giemsa染色后, 显微镜下呈现清晰的血细胞有丝分裂中期的分裂相, 多数染色体呈X型, 为中部或亚中部着丝粒染色体(图 1a)。体腔中精母细胞分裂相可见处于减数分裂细线期的染色体, 呈长丝状相互连接或缠绕(图 1b), 联会后的二价体则呈短棒状(图 1c)。
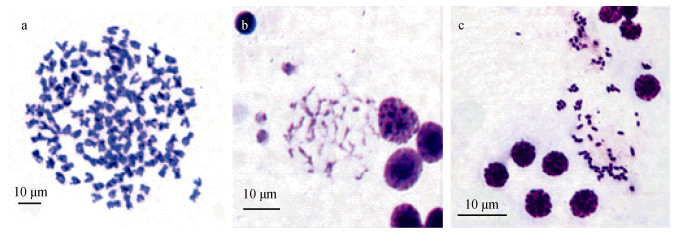 |
| 图 1 单环刺螠体腔细胞分裂相(Giemsa染色) Fig. 1 Division phase of chromosomes of coelomocytes in Urechis unicinctus (Giemsa staining) 注: 子图a: 血细胞分裂中期染色体; b: 精母细胞减数分裂细线期; c: 精母细胞二价体 |
选取单环刺螠染色体分裂相共100个, 其中65个为体腔血细胞有丝分裂中期, 35个为精母细胞减数分裂二价体。对染色体数目及出现的频率统计结果见表 1。单环刺螠染色体众数为146, 出现频率为64.62%, 体腔精母细胞二价体众数为73, 占减数分裂细胞个数的57.14%。结果显示, 单环刺螠二倍体染色体数目为2N=146。
| 结果 | 体腔血细胞染色体数目 | 体腔精母细胞二价体数目 | |||||||||||||||
| ≤140 | 143 | 145 | 146 | 147 | 148 | ≥149 | 总计 | ≤70 | 71 | 72 | 73 | 74 | 75 | ≥76 | 总计 | ||
| 出现频率/次 | 6 | 2 | 6 | 42 | 4 | 2 | 3 | 65 | 3 | 2 | 5 | 20 | 2 | 1 | 2 | 35 | |
| 所占比例/% | 9.23 | 3.08 | 9.23 | 64.62 | 6.15 | 3.08 | 4.61 | 100 | 8.57 | 5.71 | 14.29 | 57.14 | 5.71 | 2.86 | 5.72 | 100 | |
根据Levan等[13]的染色体分类方法, 单环刺螠染色体的核型数据统计结果见表 2。单环刺螠73对染色体可分为4组(图 2), 核型图中染色体按M(metacentric chromosome, M)、SM(submetacentric chromosome, SM)、ST(acrocentric chromosome, ST)、T(telocentric chromosome, T)的顺序分类排列, 同一类型的染色体按相对长度递减的顺序排列。M组(1~29对)共有58条染色体, 臂比值为1.0~1.7, 着丝粒清晰可辨, 为中部着丝粒染色体; SM组(30~42对)共有26条染色体, 臂比值为1.7~3.0, 为亚中部着丝粒染色体; ST组(43~52对)共有20条染色体, 臂比值为3.0~7.0, 为亚端部着丝粒染色体; T组(53~73对)共有42条染色体, 臂比值> 7.0, 为端部着丝粒染色体。单环刺螠核型公式为2N=58M+26SM+20ST+42T, 染色体臂数NF=250, 未发现异形性染色体和随体。
| 染色体编号 | 相对长度/% | 臂比 | 染色体类型 |
| 1 | 2.17±0.31 | 1.12±0.15 | M |
| 2 | 2.12±0.22 | 1.16±0.05 | M |
| 3 | 2.05±0.19 | 1.19±0.05 | M |
| 4 | 1.96±0.27 | 1.25±0.16 | M |
| 5 | 1.85±0.42 | 1.14±0.04 | M |
| 6 | 1.83±0.22 | 1.13±0.37 | M |
| 7 | 1.75±0.18 | 1.19±0.15 | M |
| 8 | 1.71±0.21 | 1.07±0.24 | M |
| 9 | 1.69±0.25 | 1.06±0.08 | M |
| 10 | 1.64±0.12 | 1.14±0.11 | M |
| 11 | 1.62±0.26 | 1.09±0.17 | M |
| 12 | 1.56±0.21 | 1.06±0.13 | M |
| 13 | 1.53±0.34 | 1.15±0.07 | M |
| 14 | 1.52±0.12 | 1.12±0.08 | M |
| 15 | 1.51±0.09 | 1.09±0.05 | M |
| 16 | 1.50±0.27 | 1.06±0.22 | M |
| 17 | 1.47±0.13 | 1.21±0.08 | M |
| 18 | 1.42±0.22 | 1.13±0.04 | M |
| 19 | 1.39±0.27 | 1.05±0.25 | M |
| 20 | 1.37±0.31 | 1.10±0.09 | M |
| 21 | 1.36±0.35 | 1.10±0.17 | M |
| 22 | 1.34±0.17 | 1.13±0.08 | M |
| 23 | 1.34±0.07 | 1.04±0.17 | M |
| 24 | 1.24±0.14 | 1.08±0.04 | M |
| 25 | 1.16±0.08 | 1.06±0.15 | M |
| 26 | 1.13±0.17 | 1.05±0.16 | M |
| 27 | 1.09±0.23 | 1.13±0.23 | M |
| 28 | 1.05±0.13 | 1.08±0.09 | M |
| 29 | 1.03±0.11 | 1.37±0.16 | M |
| 30 | 1.89±0.42 | 2.00±0.46 | SM |
| 31 | 1.86±0.29 | 2.21±0.26 | SM |
| 32 | 1.73±0.09 | 1.87±0.25 | SM |
| 33 | 1.72±0.19 | 1.93±0.14 | SM |
| 34 | 1.52±0.24 | 2.03±0.17 | SM |
| 35 | 1.50±0.15 | 1.80±0.36 | SM |
| 36 | 1.48±0.33 | 2.00±0.41 | SM |
| 37 | 1.44±0.34 | 1.77±0.36 | SM |
| 38 | 1.34±0.35 | 2.10±0.19 | SM |
| 39 | 1.31±0.37 | 2.05±0.26 | SM |
| 40 | 1.29±0.33 | 2.05±0.05 | SM |
| 41 | 1.07±0.13 | 2.21±0.39 | SM |
| 42 | 1.05±0.22 | 1.84±0.25 | SM |
| 43 | 1.83±0.22 | 5.32±0.75 | ST |
| 44 | 1.69±0.25 | 5.62±0.78 | ST |
| 45 | 1.67±0.41 | 5.15±0.37 | ST |
| 46 | 1.56±0.22 | 3.99±0.46 | ST |
| 47 | 1.51±0.15 | 4.21±0.39 | ST |
| 48 | 1.46±0.27 | 4.72±0.69 | ST |
| 49 | 1.41±0.48 | 4.75±0.65 | ST |
| 50 | 1.39±0.42 | 6.02±0.89 | ST |
| 51 | 1.02±0.09 | 3.83±0.56 | ST |
| 52 | 0.90±0.07 | 5.03±0.57 | ST |
| 53 | 1.60±0.17 | ∞ | T |
| 54 | 1.42±0.13 | ∞ | T |
| 55 | 1.32±0.25 | ∞ | T |
| 56 | 1.31±0.37 | ∞ | T |
| 57 | 1.30±0.09 | ∞ | T |
| 58 | 1.25±0.28 | ∞ | T |
| 59 | 1.24±0.18 | ∞ | T |
| 60 | 1.13±0.11 | ∞ | T |
| 61 | 1.12±0.36 | ∞ | T |
| 62 | 1.09±0.20 | ∞ | T |
| 63 | 1.06±0.19 | ∞ | T |
| 64 | 0.96±0.22 | ∞ | T |
| 65 | 0.94±0.06 | ∞ | T |
| 66 | 0.88±0.13 | ∞ | T |
| 67 | 0.87±0.09 | ∞ | T |
| 68 | 0.84±0.15 | ∞ | T |
| 69 | 0.81±0.08 | ∞ | T |
| 70 | 0.77±0.32 | ∞ | T |
| 71 | 0.73±0.17 | ∞ | T |
| 72 | 0.62±0.23 | ∞ | T |
| 73 | 0.59±0.08 | ∞ | T |
 |
| 图 2 单环刺螠染色体核型 Fig. 2 Karyotype of Urechis unicinctus |
选用适宜材料是制作动物染色体标本的关键。鱼类染色体制片一般采用头肾[2, 14], 甲壳类发育期的精巢可以获得较多的中期分裂相[15-16], 鳃和外套膜是贝类染色体制片常用的材料[4, 17]。单环刺螠机体结构简单, 仅由体壁、消化道和肾管组成, 其消化道中有一段壁薄、弹性大, 具有呼吸作用, 称为呼吸肠[5]。单环刺螠生殖腺体积微小, 通过肌束附着于后肠壁和体壁上, 产生的生殖细胞放散于体腔中, 进一步成熟后收集于肾管中[9, 18]。本研究尝试了用单环刺螠的胚胎、幼体、成体的体腔细胞和呼吸肠等材料进行染色体制片, 结果显示用呼吸肠难以获得分裂相, 可能与其分裂指数不高有关。谭杰等[19]以刺参(Apostichopus japonicus)原肠后期胚胎为材料获得了效果良好的中期分裂相染色体, 但本研究以单环刺螠后期胚胎为材料虽然有丝分裂相较多, 但由于其为间黄卵, 卵黄含量显著多于刺参的均黄卵, 因此制片杂质较多而影响观察效果。星虫类机体组成与单环刺螠相近, 取其体腔液细胞制片染色体清晰可见[20]。本研究以单环刺螠成体体腔细胞和幼体为材料均能观察到中期分裂相, 但幼体材料受繁殖季节的限制, 获取幼体的人工繁育手段亦较繁琐, 因此单环刺螠染色体制片以采用成体体腔细胞更方便。取单环刺螠生长期雄体的体腔液既可以得到体腔血细胞的有丝分裂相, 又可以观察到体腔中精母细胞的减数分裂。
PHA作为有丝分裂原可以促进细胞分裂, 常用于鱼类染色体研究[14], 在刺参[19]、锯缘青蟹(Scylla serrata)[21]和贝类[22]中也有良好效果。而本研究中PHA对于增加单环刺螠分裂相没有明显的促进作用。秋水仙素能抑制微管聚合、纺锤体形成, 从而阻止染色体分离, 使细胞停滞于分裂中期, 利于观察染色体。用秋水仙素处理成体多采用注射法, 取材为胚胎、幼体或离体组织时用浸泡法[23-24]。在本研究中, 单环刺螠成体注射秋水仙素的制片效果不如浸泡法, 可能与其体形细长、注射部位作用范围受局限有关。秋水仙素的使用剂量和处理时间是影响染色体制片效果的重要因素[17]。以往文献中用秋水仙素浸泡制片材料的浓度在0.1 g/L~1 g/L之间, 浸泡时间为40 min~24 h, 秋水仙素浓度与处理时间因所用材料而不同。本实验筛选得出单环刺螠适宜的秋水仙素处理浓度为0.4 g/L、浸泡12 h, 与裸体方格星虫(Sipunculus nudus)一致[25]。当秋水仙素用量过大或作用时间过长, 会导致染色体凝缩过度, 反之, 当秋水仙素用量不足或者作用时间过短, 则会导致分裂相少且染色体细长, 相互连接而影响观察。
3.2 单环刺brrhzimage: 9:erhhz染色体数目及核型分析螠虫动物全世界仅约140余种, 最初作为螠虫纲, 与星虫类、沙蚕等同属环节动物门, 后来被单列为螠虫动物门[26]。根据李石磊等[27]对线粒体基因比较及系统发育分析得出, 螠虫类和星虫类、多毛类聚为一进化分枝, 表明其亲缘关系接近。星虫动物染色体数目2N介于18~34, 多为20条[20]。中国沿海常见的可口革囊星虫(Phasolosma esculenta) 核型公式为2N= 20=4M+10SM+6ST[28], 裸体方格星虫染色体数目多于其他星虫(2N=34), 核型公式为2N=26M+8SM[25]。目前已知的多毛类染色体数目2N为18~38条, 如多齿围沙蚕(Perinereis nuntia)核型为2N=28=4M+10SM[29], Nephtys incisa核型为2N=38=4M+3SM+12ST[30]。本研究中单环刺螠具有146条染色体(2N=58M+26SM+ 20ST+42T), 明显多于星虫类和多毛类。李树深[31]认为在特定分类阶元中, 具有较多中部或亚中部着丝粒染色体的是特化类群, 而具有较多端部着丝粒染色体的为原始种群。本研究发现单环刺螠具有58条中部着丝粒染色体和26条亚中部着丝粒染色体, 占染色体总数的57.53%, 表明其为特化种类。根据Admed[32]提出M和SM染色体可使染色体组型稳定, 而T和ST染色体比较多变的观点, 表明单环刺螠有比较稳定的染色体组型。
环节动物门蛭纲和寡毛纲动物的染色体数量2N介于16~32[33-34]。在软体动物门中, 双壳类染色体数量2N为14~48条, 其中约40%具有38条染色体[35]; 腹足类染色体数量2N为14~72条; 头足类染色体数量2N相对较多, 如金乌贼(Sepia esculenta)[36]、长枪乌贼(Heterololigo bleekeri)和莱氏拟乌贼(Sepioteuthis lessoniana)[37]等都含有92条染色体。与软体动物门其他类群相比, 头足类在形态结构上具有高度进化的特征[38]。节肢动物门甲壳类染色体数目2N随种类不同在64~376之间变化较大[39], 如锯缘青蟹98条[21]、日本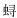
迄今尚无其他螠虫动物的染色体核型研究报道, 很难从纲目科属种的层次上探讨其系统演化关系, 因此需要研究更多的螠虫动物核型及带型, 并结合荧光原位杂交等分子生物学技术手段, 以深入进行螠虫动物的系统分类和进化研究。
4 结论单环刺蜕染色体数目为2N=146, 核型公式为2N=58M+26SM+20ST+42T,染色体臂数NF=250,未发现异形性染色体和随体,在无脊椎动物中处于较特殊的进化地位,核型数据可为相关细胞遗传和育种研究提供基础。
| [1] |
Zhang P, Friebe B, Gill B, et al. Cytogenetics in the age of molecular genetics[J]. Australian Journal of Agricultural Research, 2007, 58(6): 498-506. DOI:10.1071/AR07054 |
| [2] |
Frolov S V. Karyotype and relationships of the endemic char Salvelinus krogiusae from Dal'nee lake (Kamchatka)[J]. Russian Journal of Genetics, 2005, 41(12): 1688-1696. |
| [3] |
González-Tizón A M, Rojo V, Menini E, et al. Karylogical analysis of the shrimp Palaemon serratus (Decapoda: Palaemonidae)[J]. Journal of Crustacean Biology, 2013, 33(6): 843-848. DOI:10.1163/1937240X-00002185 |
| [4] |
García-Souto D, Ríos G, Pasantes J J. Karytype differentiation in tellin shells (Bivalvia: Tellinidae)[J]. BMC Genetics, 2017, 18: 66. |
| [5] |
李诺, 宋淑莲, 唐永政. 单环刺螠[J]. 生物学通报, 1998, 33(8): 12-14. Li Nuo, Song Shulian, Tang Yongzheng. Urechis unicinctus[J]. Bulletin of Biology, 1998, 33(8): 12-14. |
| [6] |
刘万顺, 成慧中, 韩宝芹, 等. 单环刺螠纤溶酶UFE I药效作用和免疫原性的初步研究[J]. 中国海洋大学学报: 自然科学版, 2012, 42(1/2): 88-92. Liu Wanshun, Cheng Huizhong, Han Baoqin, et al. Pharmacologic effect and immunogenicity of fibrinolytic enzyme UFE I from Urechis unicinctus[J]. Periodical of ocean university of China, 2012, 42(1/2): 88-92. |
| [7] |
Ma Y B, Zhang Z F, Shao M Y, et al. Sulfide: quinone oxidoreductase from echiuran worm Urechis unicinctus[J]. Marine Biotechnology, 2011, 13(1): 93-107. DOI:10.1007/s10126-010-9273-3 |
| [8] |
朱晓莹, 甘宏涛, 孟霄, 等. 镉对单环刺螠非特异性免疫及组织蓄积的影响[J]. 生态毒理学报, 2019, 14(1): 106-115. Zhu Xiaoying, Gan Hongtao, Meng Xiao, et al. Effects of cadmium on non-specific immunity and bioaccumulation of Urechis unicinctus[J]. Asian Journal of Ecotoxicology, 2019, 14(1): 106-115. |
| [9] |
李昀, 王航宁, 邵明瑜, 等. 单环刺螠生殖腺的发生及雌体的生殖周期[J]. 中国海洋大学学报, 2012, 42(6): 81-84. Li Yun, Wang Hangning, Shao Mingyu, et al. Gonadal ontogenesis and annual development of ovary and oogenesis in Urechis unicinctus[J]. Periodical of Ocean University of China, 2012, 42(6): 81-84. |
| [10] |
许星鸿, 霍伟, 孟霄, 等. 单环刺螠人工育苗及养殖技术[J]. 科学养鱼, 2016(2): 44-45. Xu Xinghong, Huo Wei, Meng Xiao, et al. Artificial Seedling of Urechis uniconctus[J]. Scientific Fish Farming, 2016(2): 44-45. |
| [11] |
付新华, 刘国宁, 孙凤祥, 等. 基于线粒体COI序列莱州湾单环刺螠遗传多样性分析[J]. 海洋科学, 2019, 43(11): 56-61. Fu Xinhua, Liu Guoning, Sun Fengxiang, et al. Analysis of the genetic diversity of Urechis unicinctus in Laizhou Bay based on the mitochondrial COI gene sequence[J]. Marine Sciences, 2019, 43(1): 56-61. |
| [12] |
常城, 韩慧宗, 王腾腾, 等. 单环刺螠(Urechis unicinctus)微卫星标记开发及5个地理种群遗传结构分析[J]. 海洋与湖沼, 2017, 48(3): 498-507. Chang Cheng, Han Huizong, Wang Tengteng, et al. Microsatellite marker isolation and genetic structure analysis for five populations of Urechis unicinctus[J]. Oceanologia et Limnologia Sinica, 2017, 48(3): 498-507. |
| [13] |
Levan A, Fredga K, Sandberg A. Nomenclature for centromeric position on chromosomes[J]. Hereditas, 1964, 52(2): 201-220. |
| [14] |
刘苏, 杨宇晴, 张海发, 等. 蓝身大斑石斑鱼染色体核型分析[J]. 海洋科学, 2017, 41(12): 46-50. Liu Su, Yang Yuqing, Zhang Haifa, et al. The karyotype of Epinephelus tukula[J]. Marine Sciences, 2017, 41(12): 46-50. |
| [15] |
阎斌伦, 许星鸿, 徐家涛. 日本蟳核型分析[J]. 海洋科学, 2009, 33(2): 41-45. Yan Binlun, Xu Xinghong, Xu Jiatao. Karyotype of Charybdis japonica[J]. Marine Sciences, 2009, 33(2): 41-45. |
| [16] |
张莎, 俞树惠, 邱高峰. 克氏原螯虾染色体及其核型[J]. 水产学报, 2018, 42(10): 1513-1519. Zhang Sha, Yu Shuhui, Qiu Gaofeng. Chromosome and karyotype of the crayfish (Procambarus clarkii)[J]. Journal of Fisheries of China, 2018, 42(10): 1513-1519. |
| [17] |
于瑞海, 王昭萍, 邸炜鹏, 等. 等边浅蛤染色体核型分析的研究[J]. 海洋湖沼通报, 2010, 41(3): 61-64. Yu Ruihai, Wang Zhaoping, Di Weipeng, et al. Analysis of chromosomal karyotype of Gomphina veneriformis[J]. Transactions of Oceanology and Limnology, 2010, 41(3): 61-64. |
| [18] |
王航宁, 邵明瑜, 张志峰. 单环刺螠精巢周期发育及精子发生[J]. 中国水产科学, 2011, 18(5): 1189-1195. Wang Hangning, Shao Mingyu, Zhang Zhifeng. Annual development of testis and spermatogenesis in Urechis unicinctus[J]. Journal of Fishery Sciences of China, 2011, 18(5): 1189-1195. |
| [19] |
谭杰, 孙慧玲, 高菲, 等. 刺参染色体制备的初步研究[J]. 海洋科学, 2011, 35(3): 8-11. Tan Jie, Sun Huiling, Gao Fei, et al. A preliminary study on chromosome preparation of sea cucumber Apostichopus japonicus[J]. Marine Sciences, 2011, 35(3): 8-11. |
| [20] |
Silverstein J T. Karyotypes of some pacific sipunculans[J]. American Zoologist, 1986, 26: 103. |
| [21] |
王桂忠, 陈雷洪, 李少菁, 等. 锯缘青蟹染色体核型的分析研究[J]. 海洋科学, 2002, 26(1): 9-13. Wang Guizhong, Chen Leihong, Li Shaojing, et al. Studies on the chromosomal karyotype of mud crab, Scylla serrata(Forskal)[J]. Marine Sciences, 2002, 26(1): 9-13. |
| [22] |
贾志良, 李智盈, 包振民, 等. 增加贝类染色体分裂相的方法初探[J]. 青岛海洋大学学报, 2001, 31(2): 232-236. Jia Zhiliang, Li Zhiying, Bao Zhenmin, et al. On methods of increasing the metaphase of shellfish[J]. Journal of Ocean University of Qingdao, 2001, 31(2): 232-236. |
| [23] |
Kasiroek W, Indananda C, Luangoon N, et al. First chromosome analysis of the humpback cardinalfish, Fibramia Lateralis (Perciformes, Apogonidae)[J]. Cytologia, 2017, 82(1): 9-15. DOI:10.1508/cytologia.82.9 |
| [24] |
蒋俊, 庄平, 宋超, 等. 凤鲚染色体核型研究[J]. 海洋渔业, 2020, 42(1): 45-52. Jiang Jun, Zhuang Ping, Song Chao, et al. Karyotype of Coilia mystus[J]. Marine Fisheries, 2020, 42(1): 45-52. |
| [25] |
王庆恒, 杜宇宏, 林斯里, 等. 裸体方格星虫染色体组型分析[J]. 动物学杂志, 2008, 43(5): 95-98. Wang Qingheng, Du Yuhong, Lin Sili, et al. Karyotype Analysis of Sipunculus nudus[J]. Chinese Journal of Zoology, 2008, 43(5): 95-98. |
| [26] |
王玮, 周红, 李凤鲁. 中国沿海螠虫动物(螠虫动物门)名录[J]. 黄渤海海洋, 1995, 31(4): 30-35. Wang Wei, Zhou Hong, Li Fenglu, et al. A check list Echiurans (Echiura) from the China coasts[J]. Journal of Oceanography of Huanghai & Bohai Seas, 1995, 31(4): 30-35. |
| [27] |
李石磊, 张明, 王庆志, 等. 16种环节动物线粒体基因排列、特征比较及系统发育分析[J]. 水产科学, 2015, 34(2): 104-112. Li Shilei, Zhang Ming, Wang Qingzhi, et al. Gene Order, Characteristics and phylogenetic analysis of mitochondrial genomes in sixteen members in Annelida[J]. Fisheries Science, 2015, 34(2): 104-112. |
| [28] |
师尚丽, 王庆恒, 邓岳文. 可口革囊星虫染色体组型分析[J]. 广东农业科学, 2013, 40(24): 132-133, 140. Shi Shangli, Wang Qingheng, Deng Yuewen. Karyotype analysis of Phasolosma esculenta[J]. Guangdong Agricultural Sciences, 2013, 40(24): 132-133, 140. |
| [29] |
郑家声, 王梅林, 孙向东, 等. 多齿围沙蚕Perinereis nuntia (Savigny, 1818)染色体组型[J]. 青岛海洋大学学报(自然科学版), 1992, 22(2): 102-106. Zheng Jiasheng, Wang Meilin, Sun Xiangdong, et al. Karyotype studies on Perinereis Nuntia (Savigny, 1818)[J]. Journal of Ocean University of Qingdao, 1992, 22(2): 102-106. |
| [30] |
Pesch G G, Mueller C, Pesch C. Chromosomes of the marine worm Nephtys incisa (Annelida: Polychaeta)[J]. Ophelia, 1988, 28(2): 157-161. DOI:10.1080/00785326.1988.10430809 |
| [31] |
李树深. 鱼类细胞分类学[J]. 生物科学动态, 1981(2): 8-15. Li Shushen. Taxonomy of fish cell[J]. Bio-science, 1981(2): 8-15. |
| [32] |
Admed M. Chromosome cytology of marine pelecypod mollusks[J]. Journal of Science Karachi, 1976, 4: 77-94. |
| [33] |
杨潼, 王铁辉, 郭正科. 日本医蛭的染色体数目和形状[J]. 动物学研究, 1997, 18(1): 50. Yang Tong, Wang Tiehui, Guo Zhengke. Chromosome number and characteristics of a hirudinidae leech Hirudo nipponia[J]. Zoological Research, 1997, 18(1): 50. |
| [34] |
于业辉, 刘超, 张守纯, 等. 沈阳地区红色爱胜蚓核型的研究[J]. 黑龙江畜牧兽医, 2013, 12: 116-117. Yu Yehui, Liu Chao, Zhang Shouchun, et al. Karyotype studies on Eisenia rosea of Shenyang area[J]. Heilongjiang Animal Science and Veterinary Medicine, 2013, 12: 116-117. |
| [35] |
郑小东, 王昭萍, 王如才, 等. 双壳类动物染色体研究现状及进展[J]. 黄渤海海洋, 2000, 18(3): 101-108. Zheng Xiaodong, Wang Zhaoping, Wang Rucai, et al. Progress on bivalve chromosome studies a review[J]. Journal of Oceanography of Huanghai & Bohai Seas, 2000, 18(3): 101-108. |
| [36] |
王晓华, 吴彪, 李琪, 等. 金乌贼染色体核型分析[J]. 动物学杂志, 2011, 46(2): 77-81. Wang Xiaohua, Wu Biao, Li Qi, et al. Karyotype analysis of golden cuttlefish Sepia esculenta[J]. Chinese Journal of Zoology, 2011, 46(2): 77-81. |
| [37] |
Gao Y M, Natsukari Y. Karyological studies on seven cephalopods[J]. Venus, 1990, 49(2): 126-145. |
| [38] |
刘凌云, 郑光美. 普通动物学[M]. 北京: 高等教育出版社, 1997: 221-231. Liu Lingyun, Zheng Guangmei. General Zoology[M]. Beijing: Higher Education Press, 1997: 221-231. |
| [39] |
Tan X, Qin J G, Chen B, et al. Karyological analyses on redclaw crayfish Cherax quadricarinatus (Decapoda: Parastacidae)[J]. Aquaculture, 2004, 34: 65-76. |
| [40] |
Murofuchi M, Deguchi Y. Karyotype evolution in Decapoda Crustacea[A]. Hirano R, Hanyu I, Proc Second Asian Fisheries Forum[C]. Tokyo: Japan Asian Fisheries, 1990: 549-553.
|
| [41] |
常亚青, 曹洁, 张彦娇, 等. 马粪海胆的染色体制备及组型分析[J]. 大连水产学报, 2006, 21(3): 247-251. Chang Yaqing, Cao Jie, Zhang Yanjiao, et al. The chromosome preparation and karyotype analysis of sea urchin Hemicentrotus pulcherrimus[J]. Journal of Dalian Fisheries University, 2006, 21(3): 247-251. |
 2021, Vol. 45
2021, Vol. 45

