文章信息
- 宁利敏, 朱玉翠, 于光, 曹声生, 朱本伟, 姜帅, 周明柱. 2021.
- NING Li-min, ZHU Yu-cui, YU Guang, CAO Sheng-sheng, ZHU Ben-wei, JIANG Shuai, ZHOU Ming-zhu. 2021.
- 几种海藻功能寡糖的结构、制备、活性与应用研究进展
- Recent advances in the structure, preparation, activity, and application of several marine seaweed functional oligosaccharides
- 海洋科学, 45(2): 144-151
- Marine Sciences, 45(2): 144-151.
- http://dx.doi.org/10.11759/hykx20200616004
-
文章历史
- 收稿日期:2020-06-16
- 修回日期:2020-08-20
2. 山东省曲阜市吴村镇人民政府, 山东 曲阜 273100;
3. 南京工业大学食品与轻工学院, 江苏 南京 211816;
4. 宿迁市南京工业大学新材料研究院, 江苏 宿迁 223800
2. People's government of Wucun Town, Qufu 273100, China;
3. College of Food Science and Light Industry, Nanjing Tech University, Nanjing 211816, China;
4. Suqian Advanced Materials Institute, Nanjing Tech University, Suqian 223800, China
海洋多糖是源于海洋的具有多种生理活性的生物大分子, 因其具有抗肿瘤、抗氧化、抗病毒和免疫调节等功能, 目前已广泛应用于医药、食品、化工、农业和环境等多个领域[1]。例如, 从红藻紫菜Porphyra yezoensis和Gracilaria verrucosa提取的多糖在体外和体内均具有刺激巨噬细胞的活性。从褐藻Undaria pinnatifida的孢子叶中分离的岩藻多糖可刺激巨噬细胞产生细胞因子[如白介素6(Interleukin-6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)]和趋化因子[受激活调节正常T细胞表达和分泌因子(regulated upon activation normal T cell expressed and secreted factor, RANTES)、巨噬细胞炎症蛋白1(macrophage inflammatory protein 1, MIP-1)][2]。从红藻中分离得到的卡拉胶多糖可促进小鼠白细胞产生TNF-α[3]。从绿藻Capsosiphon fulvescens分离出的一种硫酸化水溶性多糖可诱导巨噬细胞释放TNF-α和IL-6等细胞因子, 并促进诱导型一氧化氮合酶(iNOS)和环氧合酶-2(COX-2)的表达[4]。然而, 由于多糖的溶解性较差, 多糖的生物利用度也较低, 这大大限制了多糖的进一步应用。海洋功能寡糖是多糖通过物理、化学或酶解方法处理后得的降解产物, 在保留多糖的多种活性的同时, 寡糖的溶解性和生物利用率得到很大提高[5]。因此, 海洋功能寡糖已成为海洋生物资源开发领域的研究热点[6]。本文对目前研究较多的几种海藻功能寡糖的来源、制备、纯化及应用进行了系统总结, 为推动海洋多糖资源利用和海洋生物资源开发提供一些参考与借鉴。
1 褐藻胶寡糖褐藻胶寡糖是褐藻来源的褐藻胶多糖通过酸法或者酶法降解得到的产物, 其聚合度多在2~20之间。在结构上, 褐藻胶寡糖分子中含有两种单糖单元: α-L-甘露糖醛酸和其C5位的差向异构体β-D-古罗糖醛酸[7]。这两种单糖单元随机排列可以形成各种结构的寡糖片段, 如只含有α-L-甘露糖醛酸的甘露糖醛酸寡糖、只含有β-D-古罗糖醛酸的古罗糖醛酸寡糖以及这两种单糖单元都含有的杂合嵌段寡糖(图 1)。
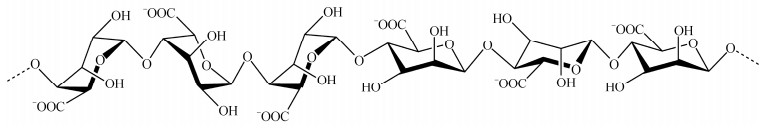 |
| 图 1 褐藻胶寡糖的组成及结构示意图 Fig. 1 Diagram of composition and structure of alginate oligosaccharides |
化学法是制备褐藻胶寡糖时最常用的方法, 如用盐酸、草酸、甲酸和硫酸等水解褐藻胶制备褐藻胶寡糖[8]。Larsen等人利用1 mol/L的草酸可将30%的底物降解为聚合度10~30的褐藻胶寡糖[9]。Chandia等人用三种不同的酸水解褐藻胶, 发现先用90%的甲酸100℃水解6 h, 再用1.5 mol/L甲酸100℃水解2 h可将褐藻胶完全水解[10]。除酸法降解外, 碱水解也可以用于制备褐藻胶寡糖, 例如Niemela等人用强碱在95℃和135℃下水解褐藻胶, 得到了一系列产物, 如脱水异乙醇酸等, 这表明褐藻胶的结构在水解过程中被完全破坏, 因此不适于制备褐藻胶寡糖[11]。此外, H2O2等氧化剂也可用于制备褐藻胶寡糖, 张洪荣等人用5%的H2O2在90℃下水解褐藻胶, 得到了一系列寡糖产物[12]。与酸碱法相比, 氧化法制备的褐藻胶寡糖纯度更高, 副产物和杂质更少, 但是相比于酸碱法, 氧化法的成本较高, 同时产物特异性差, 也限制了其在工业化方面的应用。另外, 微波法也可用于降解褐藻胶制备褐藻胶寡糖, 如胡婷等利用微波法降解褐藻胶, 得到了聚合度1~7的饱和寡糖, 该方法可实现褐藻胶寡糖的可控制备[13], 因而是未来特定聚合度褐藻胶寡糖制备技术的发展方向。
除上述物理和化学法之外, 还可利用褐藻胶裂解酶来制备褐藻胶寡糖, 褐藻胶裂解酶是一种多糖裂解酶, 能够通过β-消除反应产生一系列不饱和的褐藻胶寡糖[14]。根据作用模式, 褐藻胶裂解酶可分为内切酶和外切酶, 内切酶可将褐藻胶随机降解为不同聚合度的寡糖, 而外切酶则是从底物多糖链的一端逐个降解褐藻胶, 产生均一的单糖产物。因此, 内切型褐藻胶裂解酶主要用于制备不同聚合度的褐藻胶寡糖[15]。我们研究团队在该领域做了大量的工作, 获得了一系列具有不同产物分布的褐藻胶裂解酶[16-21], 如我们从海洋弧菌Vibrio sp.W13中得到了一个可特异性制备褐藻胶三糖的工具酶, 其降解产物中三糖的产量约为83%, 因此可用于三糖的规模化制备[22]。此外, Zhang等利用海洋弧菌Vibrio sp.510中的褐藻胶裂解酶制备聚合度2~5的褐藻胶寡糖[23]。Li等利用假单胞菌Pseudomonas sp. HZJ216来源的褐藻胶裂解酶制备聚合度2~7的寡糖[24]。随着酶工程的发展, 不同结构和不同聚合度的褐藻胶寡糖还可以通过理性设计、定向进化等各种方法获得具有各种优良性质的工具酶实现。
褐藻胶寡糖具有多种生物活性, 如抗氧化、抗炎、抗肿瘤及免疫调节等[8]。孙丽萍等人发现褐藻胶寡糖可以清除不同类型的自由基, 因此可作为抗氧化剂[25]; Xu等人研究发现不饱和的古罗糖醛酸寡糖可以通过诱导NO的产生和NO合成酶的表达来抑制炎症, 并且具有显著的剂量依赖关系[26]。Hu等人研究发现褐藻胶寡糖对于肉瘤细胞(Sarcoma cells 180)的清除率可达70.4%[27]。此外, 褐藻胶寡糖还可以调节免疫细胞产生细胞因子等, 从而具有免疫调节的作用。Yamamoto等人研究发现不同聚合度的褐藻胶寡糖可以诱导多种细胞因子(如TNF-α、GCSF等)的产生和分泌[28]。Iwamoto等人发现聚合度3~7的甘露糖醛酸寡糖具有显著的诱导细胞因子的活性[29]。最新研究表明, 褐藻胶寡糖还具有益生元的作用, 可以促进双歧杆菌等有益微生物的增殖, 同时也抑制有害菌的繁殖[30]。最近报道的褐藻胶寡糖的衍生物GV-971能够通过调节肠道微生物菌群来减缓和抑制阿尔茨海默症[31]。因此, 褐藻胶寡糖在新型功能食品和药品开发领域具有巨大潜力。
在农业上, 褐藻胶寡糖具有促进烟草、大豆和马铃薯等植物种子萌发和根系伸长的作用, 例如Natsume等人研究发现褐藻胶寡糖能够促进谷物根系的伸长[32], 马莲菊等人发现一定浓度的褐藻胶寡糖可以促进豌豆种子的萌发[33], 因此, 褐藻胶寡糖可以作为农业上的浸种剂, 在植物移栽过程中可用于移栽后植物的根系重生和伸长。除此之外, 褐藻胶寡糖还可以提高作物的抗旱能力以及作为信号分子诱导植物的抗病能力[32, 34], 例如Liu等人发现0.20%的褐藻胶寡糖能够增强番茄的抗旱能力[35], 张运红等人研究发现叶面喷施褐藻胶寡糖可以增强小麦幼苗的抗旱能力等[36]。因此, 褐藻胶寡糖可作为植物营养剂或开发为新型海藻肥。
2 琼胶寡糖琼胶是从江蓠、石花菜等红藻门植物细胞壁中提取的一类线性多糖。琼胶是由琼脂糖和硫琼胶这两种多糖构成的混合物(图 2), 其中琼脂糖分子是由β-D-半乳糖和3, 6-α-L-半乳糖内醚组成的重复二糖单元构成的, 此外琼脂糖结构中还包含一些硫酸基团[8]。硫琼胶的结构与琼脂糖非常类似, 也是由重复的二糖单元组成的, 只是结构中的一些3, 6-α-L-半乳糖内醚被硫酸基或者甲氧基及丙酮残基所取代。琼脂糖的分子量都在100 000 Da以上, 硫酸基团的含量在0.15%以下, 而硫琼胶的分子量一般在200 000 Da以下, 硫酸基团的含量在5%~8%[37]。
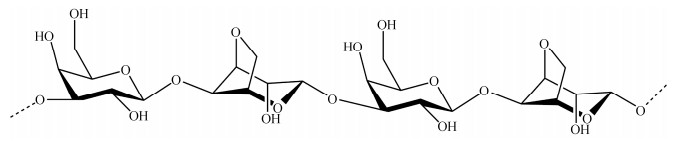 |
| 图 2 琼胶寡糖的组成及结构示意图 Fig. 2 Diagram of composition and structure of agar oligosaccharides |
与褐藻胶寡糖类似, 琼胶寡糖的制备方法也包含化学法和酶法。徐强等人利用0.05 M的盐酸水解琼胶制备低分子量的琼胶寡糖, 但是酸法水解的条件不易控制, 容易造成产物结构的破坏[38]。因此, 酶法制备琼胶寡糖受到了研究者的关注。根据其断裂底物的方式不同, 琼胶酶可分为α-琼胶酶和β-琼胶酶。β-琼胶酶能够识别二糖重复单元, 切割β-1, 4-糖苷键, 释放出一系列以Δ-半乳糖为还原端的新琼寡糖; 而α-琼胶酶可以水解二糖重复单元中的α-1, 3-糖苷键, 产生以内醚半乳糖为还原端的琼胶寡糖[39]。Sun等人采用来源于Streptomyces coelicolor A3的β-琼胶酶制备琼胶寡糖, 并对其体内和体外活性进行了评价[40]。Xu等人对比了酶法和酸法制备的琼胶寡糖聚合度分布情况, 结果表明酶法制备的琼胶寡糖的聚合度为4、6和8, 比酸法得到的琼胶寡糖聚合度分布更具特异性[41]。
作为海洋功能食品开发的热点, 琼胶寡糖的活性研究引起了广大研究者的关注。戚勃等人发现琼胶寡糖可用于食品的保鲜[42]。Li等人发现酶法制备的琼胶寡糖可抑制细菌的生长, 同时还可以促进双歧杆菌(Bifidobacteria)和乳酸菌(Lactobacillus)的生长和繁殖, 因而具有开发为新型益生元的潜力[43]。Sutapa等人研究发现琼胶寡糖可以阻止流感病毒B(influenza virus B)对细胞的黏附作用, 因而可以显著抑制流感病毒B的增殖[44]。此外, 琼胶寡糖还可以通过抑制炎症因子前列腺素PEG2和TNF-α的产生来抑制肿瘤细胞的生长, 王静雪等人研究发现琼胶寡糖对于肉瘤细胞S180的抑制率高达48.7%。有研究表明, 琼胶寡糖还可通过促进人静脉内皮细胞的凋亡抑制血管生成通过诱导细胞因子(如TNF-X、IL-1β、IL-6等)的表达来调节细胞的免疫功能[45], 此外还具有抗氧化、抗炎、促进植物根系生长等多种生物活性, 被广泛应用于食品、农业、环境等领域[46-47]。
3 卡拉胶寡糖卡拉胶是一类从红藻门植物(江蓠、石花菜、角叉菜等)细胞壁中提取得到的硫酸化线性多糖的总称。其结构中包含由3位连接的β-D-半乳吡喃糖和4位连接的α-D-半乳吡喃糖, 或者是4位连接的3, 6-半乳吡喃糖内醚组成的二糖单元(图 3)。根据单糖的连接方式和硫酸基团的数量及位置, 可将卡拉胶分成6种不同的结构, 即Kappa(к)、Iota(τ)、Lambda(λ)、Mu(μ)、Nu(ν)和Theta(θ)型卡拉胶[48]。
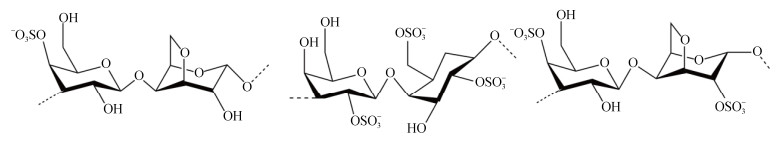 |
| 图 3 卡拉胶寡糖的组成及结构示意图 Fig. 3 Diagram of composition and structure of carrageenan oligosaccharides |
目前, 制备卡拉胶寡糖的方法主要是化学法、物理法和酶法。李桂村等人发现H2O2能够将卡拉胶降解为分子量在1 000~10 000 Da的寡糖[49], 甲醇和盐酸、硫酸可用于制备卡拉胶二糖, Tony等人用酸法温和降解卡拉胶获得了不同聚合度的卡拉胶寡糖[50]。同时, Lii等人采用微波处理卡拉胶获得了较高分子量的卡拉胶寡糖[51]。但是由于化学法和微波法条件难以控制, 产物分布复杂不易于分离, 因此其应用受到了很大的限制。卡拉胶酶是特异性降解特定结构卡拉胶的糖苷水解酶, 根据其底物的不同, 可分为к型卡拉胶酶(EC3.2.1.83)、τ型卡拉胶酶(EC3.2.1.157)和λ-型卡拉胶酶, 其中к型卡拉胶酶和τ型卡拉胶酶分属于糖苷水解酶家族的第16和82家族[52]。卡拉胶酶为内切型糖苷水解酶, 可将卡拉胶降解为一系列的偶数卡拉胶寡糖, 例如Potin等人利用来源于Cytophaga sp. MCA-2的卡拉胶酶制备了一系列低分子量且不同聚合度的卡拉胶寡糖[53]; Duan等人利用重组卡拉胶酶和纤维素酶建立了卡拉胶寡糖的高效制备工艺[54]; Yao等利用来源于Cellulophaga lytica strain N5-2的卡拉胶酶制备了二糖、六糖和八糖[55]。由于具有反应条件温和、产物分布特异性高等优点, 酶法制备卡拉胶寡糖受到了越来越多的关注。
由于卡拉胶寡糖特殊的结构, 其生物活性也被广泛关注和研究, 如Mou等人发现卡拉胶寡糖可以抑制肉瘤细胞S180的生长[56]; Zhou等人发现不同分子量的卡拉胶寡糖对肉瘤细胞S180表现出多种抑制作用[57]; Yuan等人在被S180侵染的小鼠中观察到卡拉胶寡糖可以显著抑制可移植肉瘤细胞S180的生长, 此外还可以促进巨噬细胞的吞噬作用、促进脾淋巴细胞的增殖以及脾细胞分泌抗体、促进NK细胞的活化并提高血清IL-2和TNF-α的水平等[58]。此外, 卡拉胶寡糖还具有抗病毒活性, 可以显著抑制流感病毒(H1N1)的增殖, 其原因可能是卡拉胶寡糖抑制了病毒的吸附过程, 从而阻断了病毒在细胞中的繁殖[59]。
4 岩藻寡糖岩藻多糖, 也称岩藻多糖硫酸酯, 主要来源于海带、墨角藻等藻类植物以及海参、海胆等海洋动物。岩藻多糖中含有大量的硫酸化岩藻糖以及其他种类的单糖, 其结构十分复杂(图 4)。岩藻多糖被降解后得到的寡糖产物称为岩藻寡糖。不同来源的岩藻寡糖在结构上相差很大[8], 如Qu等发现来源于Fucus vesiculosus的岩藻寡糖中主要含有α-1, 3-L-岩藻糖, 而其他海洋动物来源的岩藻寡糖结构中除了岩藻糖构成的骨架之外, 还含有其他种类的单糖如甘露糖、半乳糖、糖醛酸等[60]。
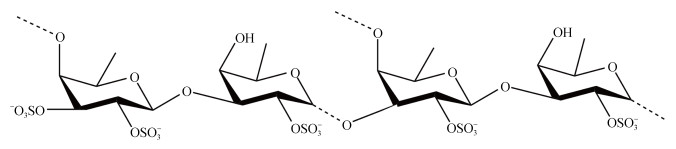 |
| 图 4 岩藻寡糖的组成及结构示意图 Fig. 4 Diagram of composition and structure of fucoidan oligosaccharides |
岩藻寡糖的制备主要包括物理降解、化学水解和酶法制备三种方法。陈亚静等人通过超声降解岩藻多糖, 结果发现岩藻多糖溶液的超声降解速率随超声功率和反应温度的增加以及溶液初始pH值的降低而增加; 另外在测试条件下, 超声降解并未改变多糖的主要结构[61]。Choi等人通过伽马射线辐照制备岩藻寡糖, 发现当样品以10 kGy强度辐照时, 岩藻寡糖分子量迅速降至38 kDa[62], 而Natalie等人利用纯化获得的新的岩藻多糖酶水解岩藻多糖, 发现该岩藻多糖降解酶不经脱硫就可以水解岩藻多糖, 在岩藻多糖降解酶作用的前4 h内未检测到硫酸盐释放, 直到水解后期才检测到岩藻糖[63]。王凤舞等人利用岩藻多糖降解酶对岩藻聚糖硫酸酯进行降解获得了岩藻寡糖, 并对其进行了抗氧化活性测定[64]。岩藻多糖降解酶因可断裂岩藻多糖分子中的硫酸化岩藻糖之间的糖苷键, 因而被称为岩藻多糖降解酶, 但由于不同来源的岩藻多糖的结构差异太大, 因此无法依据底物类型对岩藻多糖降解酶进行分类。但是根据作用特点、水解产物, 可将岩藻多降解糖酶分为三大类: 岩藻多糖酶(EC3.3.1.44)、α-L-岩藻糖苷酶(EC3.2.1.51)和硫酸酯酶(EC3.1.6.-), 其中岩藻多糖酶可作用于岩藻多糖分子内部或者一端的α-1, 3-或者β-1, 4-糖苷键, 并将其将降解为寡糖。
岩藻寡糖具有多种生物学活性, 正成为新一代天然功能保健食品、药物和化妆品开发的新宠。在医药保健品方面, 国内外以岩藻多糖为原料开发上市的商品中, 日本“Power Fucoidan Gold”产品对抗肿瘤效果较佳, Doctor Best公司生产的“Best Fucoidan”具有强抗氧化/增强免疫的功能。在化妆品领域, 北京雷力联合海洋生物公司开发的海洋传奇系列保湿面膜、保湿水等化妆品, 主要成分就是岩藻寡糖功能活性因子, 而且研究表明, 岩藻寡糖的生物学活性与其结构、硫酸根含量及其位置有关。而岩藻多糖的结构差异、高分子量和黏性等限制了其应用, 尤其是作为治疗剂的应用。具有较低分子量的生物活性低聚糖将有助于克服这些问题, 而岩藻多糖降解酶可以特异地降解岩藻多糖, 并且酶解反应可控、反应条件温和、获得的产物均一、不会发生副反应等优点, 因此岩藻多糖降解酶是制备特定岩藻寡糖的最理想的工具[8]。
5 结论与展望随着海洋生物资源的开发, 我们对于海洋寡糖的研究和认识也越来越深入, 借助于分离技术和结构表征手段的发展, 研究者们也构建了海洋特征寡糖库, 对海洋寡糖尤其是海藻寡糖的结构、活性及其相关的构效关系进行了系统详尽的研究。此外, 海洋功能寡糖由于具有抗氧化、抗菌、抗炎、抗肿瘤、抗病毒、抗凝血等多种显著的生物活性, 在食品、农业、医药、环保等领域的应用愈加广泛, 尤其是以海洋藻类寡糖为基础的海洋食品及药物开发领域逐渐成为海洋生物资源利用的重点发展方向, 其中以褐藻胶寡糖为例, 国际著名功能食品生产企业日本大正制药株式会社将褐藻胶寡糖添加到饮料中, 开发出一系列名为“エコバランスCR”的褐藻胶寡糖功能饮料, 可有效抑制对胆固醇的吸收; 青岛博智汇力生物科技有限公司利用褐藻胶寡糖开发出一款功能食品“海洋天使”褐藻胶寡糖片剂; 此外, 新型药物开发也是海藻寡糖应用的重要发展方向, 其中中国海洋大学、上海药物所联合上海绿谷制药有限公司以褐藻来源的甘露醛酸二糖为前体开发出了能够有效抑制轻度至中度阿尔茨海默病, 改善患者认知功能的中国原创、国际首个靶向脑-肠轴的阿尔茨海默症治疗新药。还有红藻来源的卡拉胶寡糖被实验证明具有独特的抗病毒活性, 能够有效地抑制H1N1流感病毒, 具有巨大的药物开发潜力。但是目前海藻功能寡糖开发还存在一些技术瓶颈, 极大地限制了海洋寡糖的深度开发和精细化应用, 如海洋寡糖的具体作用机制仍不明确、高效分离制备方法的缺乏等等, 因此未来的发展方向主要集中在从分子水平上阐明海洋功能寡糖的作用机制、发展连续高效的制备方法上, 从而推动我国海洋生物资源的开发和海洋寡糖资源的利用。
| [1] |
Jiao G, Yu G, Zhang J, et al. Chemical structures and bioactivities of sulfated polysaccharides from marine algae[J]. Marine Drugs, 2011, 9(2): 196-223. DOI:10.3390/md9020196 |
| [2] |
Fethi M, Jamel K, Emma S, et al. A statistical approach for optimization of R-phycoerythrin extraction from the red algae Gracilaria verrucosa by enzymatic hydrolysis using central composite design and desirability function[J]. Journal of Applied Phycology, 2012, 24(4): 915-926. DOI:10.1007/s10811-011-9712-1 |
| [3] |
Ianna W, Edfranck S, José A, et al. Effects of a sulfated polysaccharide isolated from the red seaweed Solieria filiformis on models of nociception and inflammation[J]. Carbohydrate Polymers, 2011, 86(3): 1207-1215. DOI:10.1016/j.carbpol.2011.06.016 |
| [4] |
Shahlizah S, Masataka W, Yujin A, et al. Effect of blanching on the concentration of metabolites in two parts of Undaria pinnatifida, Wakame (leaf) and Mekabu (sporophyll)[J]. Algal Research, 2020, 47: 101829. DOI:10.1016/j.algal.2020.101829 |
| [5] |
Catherine T, Shalini V, Kurt I. The potential of marine oligosaccharides in pharmacy[J]. Bioactive Carbohydrates and Dietary Fibre, 2019, 18: 100178. DOI:10.1016/j.bcdf.2019.100178 |
| [6] |
Daniela B, Leonardo P, Naomi K, et al. Marine prebiotics: Polysaccharides and oligosaccharides obtained by using microbial enzymes[J]. Food Chemistry, 2019, 280: 175-186. DOI:10.1016/j.foodchem.2018.12.023 |
| [7] |
Pannaga P, Asha A, Kashif M. Algae-derived marine oligosaccharides and their biological applications[J]. Frontiers in Marine Science, 2016, 3: 83. |
| [8] |
Zhu B, Ni F, Xiong Q, et al. Marine oligosaccharides originated from seaweeds: Source, preparation, structure, physiological activity and applications[J]. Critical Reviews in Food Science and Nutrition, 2020, 1-15. |
| [9] |
Bjørn L, Arne H. Chemical composition of the brown alga Ascophyllum nodosum (L.) Le Jol.: presence of reducing compounds in ascophyllum nodosum[J]. Nature, 1958, 181(4617): 1224-1224. |
| [10] |
Chandía N, Vásquez A. Alginic acids in Lessonia trabeculata: characterization by formic acid hydrolysis and FT-IR spectroscopy[J]. Carbohydrate Polymers, 2001, 46(1): 81-87. DOI:10.1016/S0144-8617(00)00286-1 |
| [11] |
Klaus N, Eero S. Alkaline degradation of alginates to carboxylic acids[J]. Carbohydrate Research, 1985, 144(2): 241-249. DOI:10.1016/S0008-6215(00)90672-4 |
| [12] |
张洪荣, 王长云, 刘斌, 等. 一种饱和褐藻胶寡糖的制备方法[J]. 中国海洋药物, 2006(3): 1-6. Zhang Hongrong, Wang Changyun, Liu Bin, et al. A method for preparation of saturated oligosaccharides from alginate[J]. Chinese Journal of Marine Drugs, 2006(3): 1-6. |
| [13] |
胡婷, 辛萌, 周晓琳, 等. 微波法制备甘露糖醛酸寡糖及其体外抗氧化活性研究[J]. 中国海洋药物, 2014, 33(3): 27-33. Hu Ting, Xin Meng, Zhou Xiaolin, et al. Preparation of mannuronic acid oligosaccharides by microwave-assistant method and study of their in vitro antioxidant activities[J]. Chinese Journal of Marine Drugs, 2014, 33(3): 27-33. |
| [14] |
Zhu B, Chen M, Yin H, et al. Enzymatic hydrolysis of alginate to produce oligosaccharides by a new purified endo-type alginate lyase[J]. Marine Drugs, 2016, 14(6): 108. DOI:10.3390/md14060108 |
| [15] |
Zhu B, Yin H. Alginate lyase: Review of major sources and classification, properties, structure-function analysis and applications[J]. Bioengineered, 2015, 6(3): 125-131. DOI:10.1080/21655979.2015.1030543 |
| [16] |
Zhu B, Ni F, Sun Y, et al. Elucidation of degrading pattern and substrate recognition of a novel bifunctional alginate lyase from Flammeovirga sp. NJ-04 and its use for preparation alginate oligosaccharides[J]. Biotechnology for Biofuels, 2019, 12(1): 13. DOI:10.1186/s13068-019-1352-8 |
| [17] |
Zhu B, Ni F, Sun Y, et al. Expression and characterization of a new heat-stable endo-type alginate lyase from deep-sea bacterium Flammeovirga sp. NJ-04[J]. Extremophiles, 2017, 21(6): 1027-1036. DOI:10.1007/s00792-017-0962-y |
| [18] |
Hu F, Li Q, Zhu B, et al. Effects of module truncation on biochemical characteristics and products distribution of a new alginate lyase with two catalytic modules[J]. Glycobiology, 2019, 29(12): 876-884. DOI:10.1093/glycob/cwz064 |
| [19] |
Zhu B, Hu F, Yuan H, et al. Biochemical characterization and degradation pattern of a unique pH-stable polyM-specific alginate lyase from newly isolated serratia marcescens NJ-07[J]. Marine Drugs, 2018, 16(4): 129. DOI:10.3390/md16040129 |
| [20] |
Li Q, Hu F, Zhu B, et al. Biochemical characterization and elucidation of action pattern of a novel polysaccharide lyase 6 family alginate lyase from marine bacterium Flammeovirga sp. NJ-04[J]. Marine Drugs, 2019, 17(6): 323. DOI:10.3390/md17060323 |
| [21] |
Zhu B, Sun Y, Ni F, et al. Characterization of a new endo-type alginate lyase from Vibrio sp. NJU-03[J]. International Journal of Biological Macromolecules, 2018, 108: 1140-1147. DOI:10.1016/j.ijbiomac.2017.10.164 |
| [22] |
Zhu B, Li K, Wang W, et al. Preparation of trisaccharides from alginate by a novel alginate lyase Alg7A from marine bacterium Vibrio sp. W13[J]. International Journal of Biological Macromolecules, 2019, 139: 879-885. DOI:10.1016/j.ijbiomac.2019.08.020 |
| [23] |
Zhang Z, Yu G, Guan H, et al. Preparation and structure elucidation of alginate oligosaccharides degraded by alginate lyase from Vibro sp. 510[J]. Carbohydrate Research, 2004, 339(8): 1475-1481. DOI:10.1016/j.carres.2004.03.010 |
| [24] |
Li L, Jiang X, Guan H, et al. Preparation, purification and characterization of alginate oligosaccharides degraded by alginate lyase from Pseudomonas sp. HZJ 216[J]. Carbohydrate Research, 2011, 346(6): 794-800. DOI:10.1016/j.carres.2011.01.023 |
| [25] |
孙丽萍, 薛长湖, 许家超, 等. 褐藻胶寡糖体外清除自由基活性的研究[J]. 中国海洋大学学报(自然科学版), 2005(5): 811-814. Sun Liping, Xue Changhu, Xu Jiachao, et al. A study of the antioxidant abilities of alginate oligosaccharides[J]. Journal of Ocean University of Qingdao, 2005(5): 811-814. |
| [26] |
Xu X, Bi D, Li C, et al. Morphological and proteomic analyses reveal that unsaturated guluronate oligosaccharide modulates multiple functional pathways in murine macrophage RAW264.7 cells[J]. Marine Drugs, 2015, 13(4): 1798-1818. DOI:10.3390/md13041798 |
| [27] |
Hu X, Jiang X, Hwang H, et al. Antitumour activities of alginate-derived oligosaccharides and their sulphated substitution derivatives[J]. European Journal of Phycology, 2004, 39(1): 67-71. DOI:10.1080/09670260310001636695 |
| [28] |
Yamamoto Y, Kurachi M, Yamaguchi K, et al. Stimulation of multiple cytokine production in mice by alginate oligosaccharides following intraperitoneal administration[J]. Carbohydrate Research, 2007, 342(8): 1133-1137. DOI:10.1016/j.carres.2007.02.015 |
| [29] |
Iwamoto M, Kurachi M, Nakashima T, et al. Structure-activity relationship of alginate oligosaccharides in the induction of cytokine production from RAW264.7 cells[J]. FEBS Letters, 2005, 579(20): 4423-4429. DOI:10.1016/j.febslet.2005.07.007 |
| [30] |
李淼, 张晓楠, 马莲菊, 等. 褐藻胶寡糖对双歧杆菌体外生长影响的研究[J]. 食品研究与开发, 2008(11): 16-19. Li Miao, Zhang Xiaonan, Ma Lianju, et al. Effects of alginate derived oligosaccharide on the growth of bifidobacterium in vitro[J]. Food Research and Development, 2008(11): 16-19. |
| [31] |
Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer's disease progression[J]. Cell Research, 2019, 29(10): 787-803. DOI:10.1038/s41422-019-0216-x |
| [32] |
Natsume M, Kamo Y, Hirayama M, et al. Isolation and characterization of alginate-derived oligosaccharides with root growth-promoting activities[J]. Carbohydrate Research, 1994, 258: 187-197. DOI:10.1016/0008-6215(94)84085-7 |
| [33] |
马莲菊, 卜宁, 马纯艳, 等. 褐藻胶寡糖对豌豆种子萌发和幼苗的某些生理特性的影响[J]. 植物生理学通讯, 2007(6): 1097-1100. Ma Lianju, Bu Ning, Ma Chunyan, et al. Effects of Alginate derived Oligosaeeharide on Seed Germination and Some Physiologieal Characters of Seedlings in Garden Pea (Pisum sativum L.)[J]. Plant Physiology Communications, 2007(6): 1097-1100. |
| [34] |
刘瑞志, 江晓路, 管华诗. 褐藻寡糖激发子诱导烟草抗低温作用研究[J]. 中国海洋大学学报(自然科学版), 2009, 8(3): 303-311. Liu Ruizhi, Jiang Xiaolu, Guang Huashi. Effects of alginate-derived oligosaccharide on the low temperature resistance of tobacco leaves[J]. Journal of Ocean University of Qingdao, 2009, 8(3): 303-311. |
| [35] |
Liu R, Jiang X, Guan H, et al. Promotive effects of alginate-derived oligosaccharides on the inducing drought resistance of tomato[J]. Journal of Ocean University of China, 2009, 8(3): 303-311. DOI:10.1007/s11802-009-0303-6 |
| [36] |
张运红, 和爱玲, 姚健, 等. 海藻酸钠寡糖灌根处理对小麦根际土壤特性和养分吸收利用的影响[J]. 江西农业大学学报, 2019, 41(6): 1054-1060. Zhang Yunhong, He Ailing, Yao Jian, et al. Effects of irrigating root with alginate oligosaccharides on rhizosphere soil properties and nutrient absorption and utilization in wheat[J]. Acta Agriculturae Universitatis Jiangxiensis, 2019, 41(6): 1054-1060. |
| [37] |
Hamer G, Bhattacharjee S, Yaphe W. Analysis of the enzymic hydrolysis products of agarose by 13C-n.m.r. spectroscopy[J]. Carbohydrate Research, 1977, 54(1): C7-C10. DOI:10.1016/S0008-6215(00)80567-4 |
| [38] |
徐强, 薛长湖, 赵雪, 等. 酸解法制备琼胶低聚糖及其抗氧化性评价[J]. 中国海洋药物, 2002(1): 19-22. Xu Qiang, Xue Changhu, Zhao Xue, et al. Preparation of agar oligosaccharides by acid hydrolysis and determination of their antioxidative effect[J]. Chinese Journal of Marine Drugs, 2002(1): 19-22. |
| [39] |
Fu X, Kim S. Agarase: review of major sources, categories, purification method, enzyme characteristics and applications[J]. Marine Drugs, 2010, 8(1): 200-218. DOI:10.3390/md8010200 |
| [40] |
Sun J, Lee J, Kim E, et al. In vitro and in vivo investigation for biological activities of neoagarooligosaccharides prepared by hydrolyzing agar with β-agarase[J]. Biotechnology and Bioprocess Engineering, 2017, 22(4): 489-496. DOI:10.1007/s12257-017-0049-8 |
| [41] |
Xu X, Su B, Xie J, et al. Preparation of bioactive neoagaroligosaccharides through hydrolysis of Gracilaria lemaneiformis agar: A comparativestudy[J]. Food Chemistry, 2018, 240: 330-337. DOI:10.1016/j.foodchem.2017.07.036 |
| [42] |
戚勃, 杨贤庆, 李来好, 等. 琼胶寡糖对冻虾仁和罗非鱼片品质的影响[J]. 南方水产科学, 2012, 8(6): 72-79. Qi Bo, Yang Xianqing, Li Laihao, et al. Effect of agar-oligosaccharide on quality offrozen shrimp and tilapia fillets[J]. South China Fisheries Science, 2012, 8(6): 72-79. |
| [43] |
Li J, Han F, Lu X, et al. A simple method of preparing diverse neoagaro-oligosaccharides with β-agarase[J]. Carbohydrate Research, 2007, 342(8): 1030-1033. DOI:10.1016/j.carres.2007.02.008 |
| [44] |
Sutapa M, Prodyut K, Carlos A, et al. Isolation, chemical investigation and antiviral activity of polysaccharides from Gracilaria corticata (Gracilariaceae, Rhodophyta)[J]. International Journal of Biological Macromolecules, 2002, 31(1): 87-95. |
| [45] |
王静雪, 江晓路, 牟海津, 等. 海洋弧菌QJH-12发酵产琼胶酶条件的优化[J]. 海洋科学, 2005, 11(4): 415-420. Wang Jingxue, Jiang Xiaolu, Mou Haijin, et al. Optimization of cultivation conditions of marine agarase-producing strain Vibrio sp. QJH-12[J]. Marine Sciences, 2005, 11(4): 415-420. |
| [46] |
Yasuki H, Yuji N, Tomohisa T, et al. Oligosaccharides from agar in hibit murine intestinal in flammation through the induction of heme oxygenase-1 expression[J]. Journal of Gastroenterology, 2013, 48(8): 897-909. DOI:10.1007/s00535-012-0719-4 |
| [47] |
王秀娟, 陈海敏, 严小军. 琼胶寡糖诱导菜豆活性氧相关防御及机理初探[J]. 中国生物防治学报, 2011, 27(2): 254-259. Wang Xiujuan, Chen Haimin, Yan Xiaojun. Research on the mechanism of agaro-oligosaccharides induced reactive oxygen related defense response against kidney bean (Phaseolus vulgaris L.)[J]. Chinese Journal of Biological Control, 2011, 27(2): 254-259. |
| [48] |
Ruth F, Richard H. Carrageenan from the tetrasporic stage of Gigartina decipiens (Gigartinaceae, Rhodophyta)[J]. Carbohydrate Research, 1998, 307(3): 325-331. |
| [49] |
李桂村, 张志焜, 耿美玉. к-卡拉胶的氧化降解[J]. 青岛化工学院学报(自然科学版), 2002, 23(4): 48-51. Li Guicun, Zhang Zhikun, Geng Meiyu. Oxidative Degradation of κ-Carrageenan[J]. Journal of Qingdao Institute of Chemical Technology, 2002, 23(4): 48-51. |
| [50] |
Tony M, Cauwelaert F. Preparative and analytical separation of oligosaccharides from κ-carrageenan[J]. Journal of Chromatography A, 1990, 504: 369-380. DOI:10.1016/S0021-9673(01)89540-6 |
| [51] |
Lii C, Chen C, Yeh A, et al. Preliminary study on the degradation kinetics of agarose and carrageenans by ultrasound[J]. Food Hydrocolloids, 1999, 13(6): 477-481. DOI:10.1016/S0268-005X(99)00031-4 |
| [52] |
Zhu B, Ni F, Sun Y, et al. Insight into carrageenases: major review of sources, category, property, purification method, structure, and applications[J]. Critical Reviews in Biotechnology, 2018, 38(8): 1261-1276. DOI:10.1080/07388551.2018.1472550 |
| [53] |
Potin P, Sanseau A, Gall Y, et al. Purification and characterization of a new k-carrageenase from a marine Cytophaga-like bacterium[J]. European Journal of Biochemistry, 1991, 201(1): 241-247. DOI:10.1111/j.1432-1033.1991.tb16280.x |
| [54] |
Duan F, Yu Y, Liu Z, et al. An effective method for the preparation of carrageenan oligosaccharides directly from Eucheuma cottonii using cellulase and recombinant kappa-carrageenase[J]. Algal Research, 2016, 15: 93-99. DOI:10.1016/j.algal.2016.02.006 |
| [55] |
Yao Z, Wang F F, Gao Z, et al. Characterization of a kappa-Carrageenase from marine Cellulophaga lytica strain N5-2 and analysis of its degradation products[J]. International Journal of Molecular Science, 2013, 14(12): 24592-24602. DOI:10.3390/ijms141224592 |
| [56] |
Mou H, Jiang X, Guan H. A κ-carrageenan derived oligosaccharide prepared by enzymatic degradation containing anti-tumoractivity[J]. Journal of Applied Phycology, 2003, 15(4): 297-303. DOI:10.1023/A:1025103530534 |
| [57] |
Zhou G, Sun Y, Xin H, et al. In vivo antitumor and immunomodulation activities of different molecular weight lambda-carrageenans from Chondrus ocellatus[J]. Pharmacological Research, 2004, 50(1): 47-53. DOI:10.1016/j.phrs.2003.12.002 |
| [58] |
Yuan H, Song J, Li X, et al. Immunomodulation and antitumor activity of κ-carrageenan oligosaccharides[J]. Cancer Letters, 2006, 243(2): 228-234. DOI:10.1016/j.canlet.2005.11.032 |
| [59] |
Wang W, Zhang P, Hao C, et al. In vitro inhibitory effect of carrageenan oligosaccharide on influenza AH1N1 virus[J]. Antiviral Research, 2011, 92(2): 237-246. DOI:10.1016/j.antiviral.2011.08.010 |
| [60] |
Qu G, Liu X, Wang D, et al. Isolation and characterization of fucoidans from five brown algae and evaluation of their antioxidant activity[J]. Journal of Ocean University of China, 2014, 13(5): 851-856. DOI:10.1007/s11802-014-2260-y |
| [61] |
陈亚静, 王维民, 谌素华, 等. 马尾藻岩藻聚糖硫酸酯降解工艺的研究[J]. 食品工业科技, 2012, 33(20): 284-287. Chen Yajing, Wang Weimin, Kan Suhua, et al. Study on the degradation conditions of fucoidan from Sargassum henslowianum[J]. Science and Technology of Food Industry, 2012, 33(20): 284-287. |
| [62] |
Choi J, Kim H. Preparation of low molecular weight fucoidan by gamma-irradiation and its anticancer activity[J]. CarbohydratePolymers, 2013, 97(2): 358-362. |
| [63] |
Natalie M, Henry I. Enzymic degradation of fucoidan by enzymes from the hepatopancreas of abalone, Haliotus species[J]. Biophysics, 1967, 118(1): 172-177. |
| [64] |
王凤舞, 阙斐, 寇玲赟, 等. 岩藻低聚糖的酶法制备及活性分析[J]. 2018, 39(4): 112-117. Wang Fengwu, Que Fei, Kou Linyun, et al. Enzymatic preparation and activity of fucosylated oligosaccharides[J]. Food Science, 2018, 39(4): 112-117. |
 2021, Vol. 45
2021, Vol. 45


