文章信息
- 孙棋棋, 宋金明, 袁华茂, 李学刚. 2021.
- SUN Qi-qi, SONG Jin-ming, YUAN Hua-mao, LI Xue-gang. 2021.
- 细菌源3-羟基脂肪酸作为环境变化代用指标的研究进展
- Bacterial 3-hydroxy fatty acids as a biomarker of environmental change
- 海洋科学, 45(8): 98-108
- Marine Sciences, 45(8): 98-108.
- http://dx.doi.org/10.11759/hykx20200916001
-
文章历史
- 收稿日期:2020-09-16
- 修回日期:2020-10-23
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237;
3. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院大学, 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266237, China;
3. Center for Ocean Meta-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
新的环境代用指标的发掘有利于评估海洋环境中的气候变化和改善对过去全球气候的理解, 微生物来源的膜脂类化合物即为其中之一[1]。为了应对环境变化, 微生物(细菌、古菌和一些原核生物)通过调整其细胞膜组分维持其流动性并保证细胞膜的最佳状态, 这一内稳态保持机制称为“均黏调试”[2]。具体而言, 细菌通过改变不饱和脂肪酸与饱和脂肪酸的比值、调整支链脂肪酸的比值和减少碳链长度来适应外界温度变化[3]。例如, 在低温时微生物会趋向于增加磷脂脂多糖中熔点较低的羟基脂肪酸的含量, 从而降低膜脂的熔点, 使其在低温下也能够保持较好的流动性, 维持正常的生理代谢[4]。相反地, 在pH较低的条件下微生物会降低支链脂肪酸的含量, 从而降低细胞膜的流动性和渗透性来阻止氢离子的胁迫渗入, 维持细胞内部接近中性的pH[5]。微生物类脂物结构和组成相对稳定, 其完整的分子骨架能保存在地质样品中, 并灵敏地响应地质环境条件的变化[1]。因此基于微生物类脂物结构变化的环境代用指标可以迅速、高分辨地记录古环境变迁, 具有良好的应用前景。
现有的微生物环境代用指标各有优缺点, 准确估测基于生物标志物的古温度或古环境面临巨大的挑战[6]。近年来, 细菌源的支链甘油双烷基甘油四醚(brGDGTs)作为少数能够用来重建陆地温度和pH的有机生物标志物成为研究热点[7]。然而, 其甲基化指数仅在10~25 ℃范围内与温度呈良好的相关性, 基于其重建的温度数据在干旱等极端环境下存在较大偏差[1], 且生物合成来源不明确[8], 因此基于brGDGT的古环境数据须谨慎理解。基于古菌源的类异戊二烯甘油双烷基甘油四醚(iGDGTs)的温度指标TEX86已广泛应用于全球海洋[9]。然而, 基于TEX86的温度估算结果会受到季节变化和其他与温度无关的因素影响而产生偏差[9-10], 在受陆源输入影响较大的边缘海用TEX86重建古温度需慎重。另外, 不同有机生物标志物提供的环境信息可能存在冲突, 独立的指标能够保证古环境重建的可靠性, 因此寻找能够示踪环境变化的独立指标十分必要。
细菌3-羟基脂肪酸(3-hydroxy fatty acids, 3-OH- FAs), 也称为β-羟基脂肪酸, 是革兰氏阴性菌细胞膜外膜(细胞壁)上的脂多糖中类脂A的主要成分[11]。3-羟基脂肪酸最初主要是作为内毒素的特征标志物广泛地应用于人或哺乳动物医药研究和临床生物标志物发掘[12], 近年来逐渐应用于环境健康和环境监测[13-14]、植物识别病原菌的免疫通路[15]等方面。通过对3-羟基脂肪酸的定量, 可以实现对环境和临床样本中细菌内毒素和革兰氏阴性细菌的检测和定量[16]。
本文从结构与分布特征、微生物来源、指示环境变化的原理和优势及其在不同生态系统中的应用等方面归纳总结了一个新的微生物来源的环境变化指示指标3-羟基脂肪酸的研究概况。
1 3-羟基脂肪酸的基本特征 1.1 3-羟基脂肪酸的结构与组成环境中占主导地位的3-羟基脂肪酸包括10到18个碳原子并在距离羧基的第三个碳原子位置上有一个羟基(表 1, 图 1), 通过酯键或酰胺键与大分子结合, 因而不易降解, 能够较为完好的保存在地质环境中[17]。3-羟基脂肪酸的前体物质是革兰氏阴性菌, 在变形菌黄杆菌属[18]、浮游态蓝细菌[19]、新型隐球菌[20]、酵母菌[21]、分枝杆菌[22]等细菌中都能检测到。此外, 革兰氏阳性乳杆菌也能够产生碳链长度为C10到C18的3-羟基脂肪酸[23]。随着碳数增加, 熔点逐渐升高, 低碳数的脂肪酸呈无色液体, 有刺激性气味, 而高碳数的脂肪酸是蜡状固体, 无明显气味。人工合成的3-羟基脂肪酸标准品呈无色粉末状固体, 室温储存, 其中C10至C16的3-羟基脂肪酸均可溶于有机溶剂正己烷, 而C17和C18仅溶于甲醇。
| 编号 | 3-羟基脂肪酸 | 英文名称 | 分子式 | 平均质量/Da |
| 1 | 3-羟基癸酸 | 3-hydroxydecanoic acid | C10H20O3 | 188.26 |
| 2 | 3-羟基十一烷酸 | 3-hydroxyundecanoic acid | C11H22O3 | 202.29 |
| 3 | 3-羟基十二烷酸 | 3-hydroxydodecanoic acid | C12H24O3 | 216.32 |
| 4 | 3-羟基十三烷酸 | 3-hydroxytridecanoic acid | C13H26O3 | 230.34 |
| 5 | 3-羟基十四烷酸 | 3-hydroxytetradecanoic acid | C14H28O3 | 244.37 |
| 6 | 3-羟基十五烷酸 | 3-hydroxypentadecanoic acid | C15H30O3 | 258.40 |
| 7 | 3-羟基十六烷酸 | 3-hydroxyhexadecanoic acid | C16H32O3 | 272.42 |
| 8 | 3-羟基十七烷酸 | 3-hydroxyheptadecanoic acid | C17H34O3 | 286.45 |
| 9 | 3-羟基十八烷酸 | 3-hydroxyoctadecanoic acid | C18H36O3 | 300.48 |
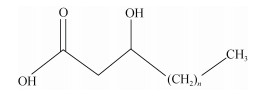 |
| 图 1 3-羟基脂肪酸的结构式(n=6~14) Fig. 1 Structure of 3-hydroxy fatty acids(n=6~14) |
支链脂肪酸(Branched-chain fatty acids, BCFA)是一类碳骨架上带有一个或多个支链(主要是甲基)的脂肪酸, 由于特定的支链结构, 使其区别于直链脂肪酸具有一些特殊的理化性质, 如较低的冻点、良好的热稳定性和氧化稳定性。在一些微生物(芽孢杆菌等)中约90%的膜脂脂肪酸是BCFA, 可使细胞膜具有良好的流动性[24]。末端甲基位置对单甲基BCFA分子构型非常重要: 甲基位于脂肪酸分子碳链骨架倒数第2个碳原子上形成的结构称为异构型(iso), 甲基位于脂肪酸碳链骨架倒数第3个碳原子上形成的结构称为反异构型(anteiso)。不同构型BCFA性质相差较大, 相同碳链长度的BCFA反异构型熔点远低于异构型。微生物通过降低细胞膜中iso/anteiso-BCFA的比例适应外部环境温度的变化, 保持细胞膜的功能性和流动性[25-26]。
1.2 3-羟基脂肪酸在环境中的分布特征3-羟基脂肪酸在环境中普遍存在且含量丰富。研究表明, 来自坦桑尼亚不同气候带的39个土壤样品中总3-羟基脂肪酸的含量为0.8~24.2 μg/g(干重)[27]。北太平洋西海岸边缘海的45个表面沉积物样品中检测到, 总3-羟基脂肪酸的浓度为1.0~36.0 μg/g(干重)[10]。黑海的研究[28]发现, 3-羟基脂肪酸约占黑海颗粒态有机物中总羟基脂肪酸的100%, 约占沉积物中羟基脂肪酸的60%。赤道太平洋、墨西哥湾和北海中超滤可溶有机物(高分子量溶解有机物)的研究[29]表明, 短链的3-羟基脂肪酸占海水超滤可溶有机物的6%~91%, 这表明细菌细胞膜来源的类脂化合物或许是海洋溶解态有机物质的重要组成成分之一。黑海的研究同时还发现, 3-羟基脂肪酸的浓度在30 m的表层水中含量较高, 并随着深度增加而降低。表层水同时具有最高的革兰氏阴性菌丰度和3-羟基脂肪酸含量, 因而推测海洋沉积物中3-羟基脂肪酸可能主要来自于表层水[28]。
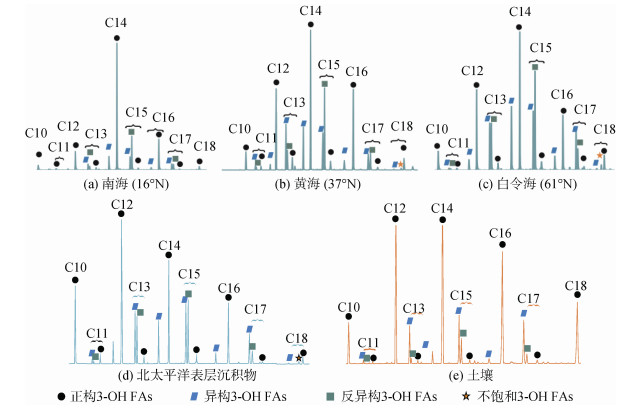
神农架的26个土壤样品包括异构的C11, C13, C15, C16, C17和反异构的C13, C15, C17 3-羟基脂肪酸, 但以正构C14 3-羟基脂肪酸为主碳峰[5]。来自湖北和尚洞一根2.5 m的石笋以n-C10、n-C12、n-C14、n-C16和n-C18 3-羟基脂肪酸的含量最高[30]。最近有研究报道了酸性矿坑水样品中3-羟基脂肪酸的分布特征以n-C12和n-C16为主, 这是首次对极端酸性环境中3-羟基脂肪酸分布的报道[31]。类似的, 坦桑尼亚跨纬度跨气候带的39个土壤样品也以偶数的正构同系物为主, 其中尤以n-C14、C16和C18为最丰富的3-羟基脂肪酸[27]。北太平洋西海岸边缘海的表层沉积物中3-羟基脂肪酸组成主要包括偶数的C12、C14和C16正构同系物和奇数的C15反异构同系物[10]。比较分析发现, 海洋表层沉积物中具有较多的反异构3-羟基脂肪酸, 土壤中则含有较多的正构和异构高分子量3-羟基脂肪酸(C15–C18)。实际上, 无论是土壤[5]还是海洋表层沉积物[10], n-C14都是3-羟基脂肪酸主要的同系物。一般来说, 3-羟基脂肪酸主要的同系物都属于C12、C14或C16之一。与此不同的是, 海南尖峰岭土壤样品经过皂化处理使得通过酯键结合的游离态脂肪酸能够被仪器检测到, 获得了主峰碳为C18的3-羟基脂肪酸, 这与酸解获得的3-羟基脂肪酸分布模式不同, 这是由于皂化不能打断酰胺键, 因此通过酰胺键结合的C14或C16含量较少[32]。
1.3 3-羟基脂肪酸的微生物来源对于微生物环境代用指标而言, 细菌膜脂的不同来源可能混淆或掩盖其反映的环境信息, 判别细菌生物标志物准确的生物合成来源非常必要。基于微生物类脂物的生物标志物和微生物群落都能够反映其所在的环境地球化学条件的变化[33], 二者的耦合关系是现有研究判别3-羟基脂肪酸微生物来源的主要依据。
由于不同的环境条件影响革兰氏阴性菌及其膜脂的组成成分(也就是3-羟基脂肪酸), 目前的研究结果随生态系统的不同而变化。多数研究认为, 以洞穴土壤、滴水和石笋为代表的陆地生态系统中, 3-羟基脂肪酸的生产者是γ-变形菌假单胞菌属Pseudomonas[30]。杨毅等在北太平洋西海岸边缘海的研究[10]探索和比较了海洋沉积物和土壤中不同的3-羟基脂肪酸和微生物分布, 推测海洋沉积物中3-羟基脂肪酸的生产者可能是α-及γ-变形菌, 而土壤中可能是α-、β-、γ-、δ-变形菌和酸杆菌的混合来源。然而在地下水和河口次表层沉积物中尽管n-C16: 0 3-OH-FA占其磷脂脂多糖脂肪酸的16.9%, 却未能在定向培养的4个Gammaproteobacterium菌株中被检测到, 说明γ-变形菌不是该环境条件下沉积物中3-羟基脂肪酸的来源[34]。黑海的系列研究根据革兰氏阴性菌和3-羟基脂肪酸在海洋水柱中一致的分布格局(表层富集, 且随深度下降)推测黑海中3-羟基脂肪酸的生物合成起源可能是微藻、蓝细菌类脂物和一些厌氧甲基营养的细菌[28]。然而, 在2°S的赤道太平洋未能观测到超滤溶解有机物中3-羟基脂肪酸浓度随深度变化的现象[29]。
不同的微生物属/种也能够产生不同组分的3-羟基脂肪酸。对内毒素标准品系的研究指出, 大肠杆菌中只含有3-羟基十四烷酸, 且大肠杆菌型别对3-羟基脂肪酸种类无影响, 认为只要出现3-羟基十四烷酸以外的3-羟基脂肪酸即可断定含有非肠道菌[35]。有研究指出, 有10、12或14个碳原子的3-羟基脂肪酸主要来自不同的假单胞菌属Pseudomonas[36], 而在拟杆菌属和梭杆菌属中最丰富的同系物是C14或C16 3-羟基脂肪酸[37]。菌株培养实验发现Deltaproteobacterium地杆菌属Geobacter species中以3-OH-14: 0和3-OH-16: 0为主要同系物[38]。另一个菌株培养研究却发现i-C15: 0 3-OH-FA或i-C17: 0 3-OH-FA才是脱硫弧菌属Desulfovibrio细胞膜磷脂脂多糖中最主要的羟基脂肪酸[39]。赤道太平洋、墨西哥湾和北海中超滤可溶有机物的研究发现, C12: 0 3-羟基脂肪酸是革兰氏阴性假单胞菌属Pseudomonas fluorescens中羟基酸的主要同系物; 聚球藻属Synechococcus bacillaris中的3-14: 0和3-16: 0 3-羟基脂肪酸占总脂肪酸的10%, 支链(异构和反异构)3-15: 0和3-17: 0 3-羟基脂肪酸仅占总脂肪酸的5%; 束毛藻属Trichodesmium sp.中仅仅包含痕量的(约为1%)C12: 0 3-羟基脂肪酸和C14: 0 3-羟基脂肪酸; 而革兰氏阳性芽孢杆菌属Bacillus subtilis则几乎不存在羟基脂肪酸[29]。
目前关于3-羟基脂肪酸生产者的研究尚未达成一致结论, 仅可推测其生物合成来源可能以变形菌和蓝细菌门为主。现有研究的判别依据主要是环境中3-羟基脂肪酸与特定微生物群落的空间耦合, 或者定向菌株培养实验, 前者不能提供直接强有力的证据, 结果并不可靠, 后者费时费力, 目标靶向性较弱。
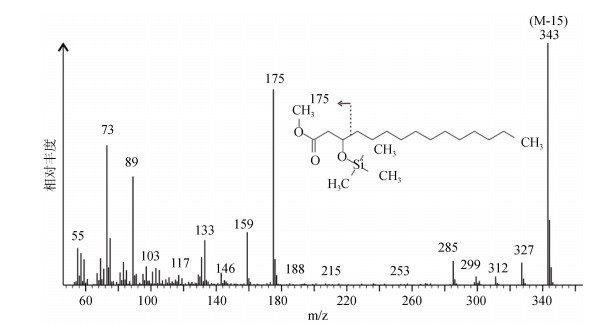
1.4 3-羟基脂肪酸的检测分析3-羟基脂肪酸的前处理流程主要包括: 酸解-萃取-浓缩-甲酯化-柱层析-衍生化等步骤, 内标法判定回收率, 外标法建立标准曲线。3-羟基脂肪酸经过甲酯化和硅烷化后的脂肪酸甲酯的特征离子峰为175 m/z (图 2), 为第3个和第4个碳原子之间的键断裂造成, 是3-羟基脂肪酸区别于其他脂肪酸质谱最重要的特征。基准峰为平均分子质量减去1个甲基(15 Da)。内标为DL-3-羟基十四烷酸, 其特征离子峰为m/z 178, 包括离子碎片中有3个氘原子。
Blyth等[40]首次提出, 酸解法可提高从石笋中获取脂肪酸和3-羟基脂肪酸的效率。在此基础上, Wang等[41]优化了从石笋中获取高产3-羟基脂肪酸的酸解法, 通过对比不同的HCl浓度、加热温度和加热时间, 得到最优的酸解条件为3 mol/L的盐酸、130 ℃加热和3 h的加热时间, 并提出5 g石笋/土壤样品、10 g海洋沉积物即足够用来脂类提取和分析检测。Yang等[42]比较了酸解和皂化两种提取方法对土壤中3-羟基脂肪酸分布模式和浓度的影响, 得出酸解法提取效率显著高于皂化的结论, 这是由于3-羟基脂肪酸的主要分子都是通过酰胺键与大分子相结合, 而酰胺键很难通过皂化断裂。
目前, 气相色谱-质谱联用(gas chromatographic- mass spectrometry, GC-MS)是最常用的细菌3-羟基脂肪酸检测方法[5, 10, 13, 27, 30, 43], 典型的GC-MS谱图见图 2和图 3。科学家们也尝试了其他的检测仪器, 如, 气相色谱-四级杆质谱联用与气相色谱-串联离子阱质谱联用相结合(quadrupole GC-MS and ion trap GC- MS/MS)[44]、液相色谱-串联质谱联用(liquid chromatography coupled to tandem mass spectrometry: LC- MS/MS)[16]等。Larsson等[45]比较了GC-离子阱MC (GC-MS/MS)和传统的四级杆GC-MS检测复杂样品中3-羟基脂肪酸的能力, 发现GC-MS/MS能够获得全部标志物的子离子色谱, 其灵敏度接近GC-MS的检出限, 因此GC-MS/MS作为一个化学标志物分析技术具有广阔的应用前景。也有研究比较了四级杆GC-MS和GC-MS/MS检测室内降尘的效果[44]发现, GC-MS/MS优异的分选特性使其能够呈现清晰可辨的图谱, 而GC-MS获得的图谱由于较高的背景值和混合析出的化合物而难以解读, 因此GC-MS/ MS优于GC-MS。针对目前报道的3-羟基脂肪酸GC-MS/MS分析方法无法实现与其同分异构体2-羟基脂肪酸的分离, 可能导致共流出的2-羟基脂肪酸干扰其定量这一问题, 傅博强等[46]通过优选毛细管色谱柱实现了二者在色谱柱上的基线分离。尽管如此, 基于GC-MS的3-羟基脂肪酸检测方法仍然存在样品准备阶段甲酯化和衍生化耗时费力, 且衍生化会导致多源和多峰现象影响定量结果的问题[16]。近年, 液相色谱-串联质谱联用(liquid chromatography-tandem mass spectrometry, LC-MS/ MS)以其高灵敏度和分选特征开始应用于3-羟基脂肪酸的检测。Uhlig等[16]利用高分辨LC-MS/MS (ultraperformance LC-MS/MS, UPLC- MS/MS)的方法检测到环境中11种3-羟基脂肪酸。他们最新的研究基于结构依赖的保留时间预测模型, 利用UPLC-MS/MS建立了全球通用的判别3-羟基脂肪酸与其同分异构体2-羟基脂肪酸的测定方法[47], 显示了巨大的应用潜力。
由于脂肪酸的支链能够增加细胞膜的流动性[26]和渗透性[48], 细菌可以通过改变细胞膜上3-羟基脂肪酸等不同脂类的甲基支链数来响应环境变化[49]。
3-羟基脂肪酸指示环境中pH变化主要是通过其支链比(异构和反异构3-羟基脂肪酸之和/正构3-羟基脂肪酸之和)与pH的显著正相关关系反演环境中的pH(表 2)。在pH较低的条件下支链比降低反映了化学渗透耦联这一内稳态机制, 即, 细菌产生具有较少支链的同系物从而降低细胞膜的流动性和渗透性来抗衡细胞膜内外较大的氢离子浓度差, 目的是为了维持细胞内部接近中性的pH。细胞内自由态的氢离子能损害DNA转录、蛋白质合成等过程并抑制酶活性。细菌细胞膜两侧氢离子浓度差的存在和维持, 通过影响那些存在于细胞膜核心脂上、传递氢离子的水分子, 对细胞的能量供应至关重要[50], 其大小取决于周围环境中的氢离子浓度。细菌适应较低pH环境的通常策略为: 一方面累积钠离子平衡细胞膜两侧的浓度梯度, 一方面降低3-羟基脂肪酸的支链比, 使得细胞膜组装得更加致密厚实, 建立氢离子化学渗透屏障, 阻止氢离子的被动渗透[31]。同时, 细胞膜渗透性降低可在细胞水平上降低能量流失, 从而帮助微生物在极端酸性条件下幸存。
| 指标 | 定义 | 与pH的关系 | 优势 |
| pH | 支链比=(I+A)/N | 支链比=0.06×exp(0.28×pH) (R2=0.76, P < 0.001) | 不受温度、降水或湿度影响 |
| RIAN= –lg (支链比) | pH=11.10–10.00×RIAN (R2=0.70, P < 0.001) | 与pH线性相关 | |
| 支链指数=(I+A)/(I+A+N) | pH=0.60+20.00×支链指数(R2=0.70, P < 0.001) | 数值为0~1 | |
| RIN=I/N | pH=2.63+12.50×RIN (R2=0.67, P < 0.001) | 无需测定反异构同系物 | |
| 温度 | RAN15=anteiso-C15/normal-C15 3-OH-FA | MAAT=23.03–3.03×RAN15 (R2=0.51, P < 0.001) | 独立于pH |
| RAN17=anteiso-C17/normal-C17 3-OH-FA | MAAT=26.36–9.09×RAN17 (R2=0.48, P < 0.001) | 独立于pH | |
| 注: 其中, N(normal-)代表所有正构3-羟基脂肪酸的和, I(iso-)代表所有异构3-羟基脂肪酸的和, A(anteiso-)代表所有反异构3-羟基脂肪酸的和。MAAT代表年均气温(℃) | |||
3-羟基脂肪酸指示环境中温度的变化主要是通过其C15和C17同系物的反异构/正构之比(RAN15和RAN17)与年均温的显著负相关关系反演环境中的温度(表 2)。3-羟基脂肪酸C15和C17同系物的反异构/正构之比随温度的降低而增加, 即在低温时细菌合成更多的反异构同系物。反异构3-羟基脂肪酸具有独特的物理化学性质, 能够在低温条件下维持微生物细胞膜的液晶状态, 使其保持较好的流动性。反异构脂肪酸具有比正构脂肪酸较低的熔点, 其固液相转变温度显著低于异构脂肪酸[51]。当温度较低时, 细菌为了维持细胞膜的流动性、保持正常的生理代谢, 需要增加反异构3-羟基脂肪酸(RAN指数)。异构与正构3-羟基脂肪酸之比则未能表现出同样的响应特征, 这是由异构和反异构脂肪酸不同的物理化学性质造成的。反异构的甲基支链位于距离甲基终端第3个碳原子上, 异构的甲基支链位于距离碳链末端的第2个碳原子上, 因而反异构支链脂肪酸具有相比异构支链脂肪酸更高的流体化学性质和不同的官能团破坏次序[25]。此外, 反异构脂肪酸具有相比正构饱和脂肪酸和异构脂肪酸更大的横截面积, 能够分散紧密排列的脂肪酰基链, 增强细胞膜的流动性。
2.2 3-羟基脂肪酸指示环境变化的优势相比其他生物标志物, 3-羟基脂肪酸在指示环境变化和重建古气候方面具有独特的优势(表 2)。
所有基于3-羟基脂肪酸的pH代用指标都不受温度、气压、降水和湿度的影响, 是独立的微生物环境代用指标。其中RIAN建立了与pH的线性关系, 简洁明了, 降低了计算难度; 支链指数在0~1变化, 这是其他pH指标不具备的优势; RIN指标仅涉及正构和异构同系物, 不需要测定一般环境中含量最少的反异构同系物, 降低了测定难度和复杂度。有研究比较了3-羟基脂肪酸与其他生物指标在重建古pH时的优缺点[52], 认为相比硅藻组合、δ11B、B/Ca、brGDGTs等指标, 3-羟基脂肪酸的反演结果不受温度、压力等环境因素的影响, 然而作为一种新的生物标志物其成熟度不够, 需要分析较多的样品和多角度数据的支持。
3-羟基脂肪酸在反演过去环境中的温度时独立于pH, 在pH剧烈变化或者可能存在多个混杂变量的环境中存在强大的优势[5]。有研究比较了基于3-羟基脂肪酸的RAN13与基于GDGT的温度指标TEX86[10], 发现在高温(> 25 ℃)的热带区域RAN13与温度的拟合更灵敏, 低温时TEX86对温度不敏感, 而RAN13即使在 < 6 ℃的极地低温情况也与温度有强相关。此外, 通过测定一个较短的柱状沉积物中3-羟基脂肪酸反演过去58 a的温度[10], RAN13记录了1959年至2017年长期的增温现象, 二十世纪七十至八十年代有4 ℃左右的强烈波动, 以及自二十世纪九十年代之后的持续增温。相比之下, TEX86既不能重建长期增温趋势, 又无法精确地捕获到二十世纪七十至八十年代的温度振荡[53]。这些都证明了RAN13是重建海洋古温度的稳健的指标, 即使在西太平洋边缘海不断的季节性陆源输入也未能掩盖或叠加3-羟基脂肪酸及其温度指标对海洋环境温度的敏感响应[10]。
3 3-羟基脂肪酸指示环境变化的研究进展过去3-羟基脂肪酸作为环境中革兰氏阴性细菌的生物标志物, 在土壤[54]、生物膜[55]、大气气溶胶[56]、石笋[57]和新鲜雪水[58]等不同的地质体中检测到。近年来, 王灿发等首次建立了3-羟基脂肪酸对pH和温度的响应公式, 定义了基于3-羟基脂肪酸的环境代用指标体系, 并将其应用于陆地环境(土壤和石笋等)中[5, 30]。神农架26个土壤样品的研究发现, 3-羟基脂肪酸的相对丰度与温度和pH都存在显著相关。具体地, 异构反异构3-羟基脂肪酸之和与总正构3-羟基脂肪酸之和的比值(即RIAN指数)、异构反异构3-羟基脂肪酸之和与总3-羟基脂肪酸的比值(即支链指数), 均与土壤pH显著相关; 3-羟基脂肪酸C15和C17化合物的异构与正构之比(分别为RAN15和RAN17指数)与年均气温MAAT显著负相关[5]。MAAT与RAN15和RAN17相关度相对较弱(表 2), 将来的研究应进一步采集温度差异显著的不同地区土壤样品, 加大样本量, 进一步确定MAAT和RAN15、RAN17间的相互关系。不久前华中地区和尚洞石笋的研究首次将基于3-羟基脂肪酸的环境代用指标应用在古气候重建中, 利用RAN15指数重建了全新世温度, 结果与仪器监测的温度及δ18O的记录相吻合; 根据有效降水与pH之间的关系, 将pH指标RIAN作为定性水文指标重建了过去9 Ka BP的水文变化, 结果与全球模型和区域古气候记录吻合[30]。这些结果证实了3-羟基脂肪酸作为环境代用指标的可靠性。Huguet等[27]将基于3-羟基脂肪酸的环境代用指标推广到国外, 验证了其在坦桑尼亚西南部跨越温带和热带的39个土壤样品中的适用性。结果表明, RAN15和RAN17随着温度降低而相对增加, 但由于坦桑尼亚(半湿润)和神农架(湿润)不同的湿度条件RAN15需要区域校正, RAN17则在0~25 ℃范围之内得以通用。然而, RIAN和pH之间仅存在中等的相关度, 且离散度较大。因此, 基于RIAN重建环境中pH在pH < 5和 > 8的情况下存在估算偏差, 需谨慎使用。
基于3-羟基脂肪酸的环境代用指标在海洋环境中的应用刚刚起步。最近的研究首次将3-羟基脂肪酸应用于海洋环境, 发现海洋沉积物中的温度指标(RAN15和RAN17)与海洋表面温度不相关[10]。鉴于此, 杨毅等利用北太平洋西部边缘海的表层沉积物数据, 首次建立并校正了一个基于3-羟基脂肪酸的能够独立指代海水表层温度的新指标RAN13(反异构和正构C13 3-OH-FAs之比), 并利用它重建了海洋沉积物中古温度信息。结果表明, 该指标与古海洋温度呈现显著的指数关系[10]。同样地, 陆地生态系统基于3-羟基脂肪酸的pH指标(支链比、支链指数、RIAN和RIN)也不能适用于海洋环境, 而3-羟基脂肪酸指示海洋环境中pH变化的成功应用尚未见报道。作为一项重要的细菌脂类生物标志物, 3-羟基脂肪酸在海洋环境中的研究还有待继续开发和深入拓展。
4 结语与展望探究示踪全球环境变化的微生物代用指标意义重大, 3-羟基脂肪酸作为温度和pH变化的代用指标具有独特的优势和巨大的潜力, 本文总结归纳了细菌源3-羟基脂肪酸的研究进展及其在指示环境变化中的应用。然而其在海洋生态系统中的研究刚刚起步, 区域研究需要参数校正, 具体的细菌分类学来源尚不确定。未来的研究可从以下几个方面进一步深入探究:
(1) 3-羟基脂肪酸指示海洋环境变化指标体系的构建。3-羟基脂肪酸作为温度代用指标在陆地和边缘海环境中都有良好的应用, 然而作为海洋环境中的pH替代指标其应用尚未取得进展。实际上, 国际上目前尚未有成功应用有机生物标志物指标重建海水pH的先例, 3-羟基脂肪酸的研究提供了可能性。陆地和近海的环境指标不适用于深海大洋, 海洋缓冲体系的存在使得海洋环境中pH可以在一个较小的范围内(7.7~8.3)保持稳定, 在如此小的变化范围内将3-羟基脂肪酸应用于重建海水pH变化产生极大的挑战, 需要大量模拟实验数据和外海调查案例的支持和验证。推广和校正3-羟基脂肪酸指示海洋环境变化的研究, 在此基础上探索基于3-羟基脂肪酸的环境代用指标在何种程度上能成为全球性的环境代用指标, 成为下一步工作的重点和难点。
(2) 基于3-羟基脂肪酸的新指标、新方法和新应用。3-羟基脂肪酸指示环境变化的研究存在所需数据量较大、最低样品量较多及前处理时间较长等不足, 未来应继续改进前处理方法、探索更加灵敏的检测方法, 使其作为环境代用指标更加经济高效。基于GDGT和3-羟基脂肪酸的环境代用指标各有利弊, 二者相互验证可提高结果的可靠性。随着气相色谱-质谱分离技术的提高, 已有指标新的计算和反演方法、新环境下的参数校正、可能指示的新的环境参数或生态意义以及新指标的构建和应用, 依然是相关研究重要的突破方面。3-羟基脂肪酸在缺氧海水相对于含氧水体的颗粒物中较高的浓度, 以及沉积物中更高的浓度, 表明其可能由厌氧细菌产生, 3-羟基脂肪酸指示大洋缺氧水体的潜力可能成为其应用于海洋生态系统的突破口。
(3) 3-羟基脂肪酸的微生物来源判别。不同环境中3-羟基脂肪酸的生物合成来源存在很大的不确定性, 可能混淆或掩盖其反映的环境信息, 判别细菌生物标志物准确的生物合成来源非常必要。目前已有的将3-羟基脂肪酸及细菌群落的空间关系耦合和定向菌株培养的方法分别存在巨大的缺陷, 如何限定更加具体的细菌属/种来源, 对新的技术手段提出了要求, 也是下一步工作的难点。对微生物生理生态和代谢过程的理解有助于判别特定生态环境下的限制性因子, 弥补微生物环境代用指标在应用中的不足。弄清3-羟基脂肪酸所参与的生物化学过程和代谢路径可能帮助厘清其生物合成来源, 技术上与高通量测序相结合仍是相关研究的重要手段, 微生物宏基因组和代谢组学可能能够提供新的视角。
| [1] |
谢树成, 杨欢, 党心悦, 等. 地质微生物响应地质环境变化的若干问题——兼论环境代用指标的应用[J]. 地质论评, 2018, 64(1): 183-189. XIE Sucheng, YANG Huan, DANG Xinyue, et al. Some issues in microbial responses to environmental change and the application of molecular proxies[J]. Geological Review, 2018, 64(1): 183-189. |
| [2] |
SINENSKY M. Homeoviscous adaptation—a homeostatic process that regulates the viscosity of membrane lipids in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 1974, 71(2): 522-525. DOI:10.1073/pnas.71.2.522 |
| [3] |
SUUTARI M, LAAKSO S. Changes in fatty acid branching and unsaturation of Streptomyces griseus and Brevibacterium fermentans as a response to growth temperature[J]. Applied & Environmental Microbiology, 1992, 58(7): 2338. |
| [4] |
KUMAR G S, JAGANNADHAM M V, RAY M K. Low-temperature-induced changes in composition and fluidity of lipopolysaccharides in the antarctic psychrotrophic bacterium Pseudomonas syringae[J]. Journal of Bacteriology, 2002, 184(23): 6746-6749. DOI:10.1128/JB.184.23.6746-6749.2002 |
| [5] |
WANG C, BENDLE J, YI Y, et al. Impacts of pH and temperature on soil bacterial 3-hydroxy fatty acids: Development of novel terrestrial proxies[J]. Organic Geochemistry, 2016, 94: 21-31. DOI:10.1016/j.orggeochem.2016.01.010 |
| [6] |
谢树成, 黄咸雨, 杨欢, 等. 示踪全球环境变化的微生物代用指标[J]. 第四纪研究, 2013, 33(1): 1-19. XIE Shucheng, HUANG Xianyu, YANG Huan, et al. An overview of microbial proxies for the reconstruction of past global environmental change[J]. Quaternary Sciences, 2013, 33(1): 1-19. DOI:10.3969/j.issn.1001-7410.2013.01.01 |
| [7] |
LI J, NAAFS B D A, PANCOST R D, et al. Distribution of branched tetraether lipids in ponds from Inner Mongolia, NE China: Insight into the source of brGDGTs[J]. Organic Geochemistry, 2017, 112: 127-136. DOI:10.1016/j.orggeochem.2017.07.005 |
| [8] |
DAMSTE J S S, RIJPSTRA W I C, FOESEL B U, et al. An overview of the occurrence of ether- and ester- linked iso-diabolic acid membrane lipids in microbial cultures of the Acidobacteria: Implications for brGDGT paleoproxies for temperature and pH[J]. Organic Geochemistry, 2018, 124: 63-76. DOI:10.1016/j.orggeochem.2018.07.006 |
| [9] |
SCHOUTEN S, HOPMANS E C, DAMSTé J S S. The organic geochemistry of glycerol dialkyl glycerol tetraether lipids: A review[J]. Organic Geochemistry, 2013, 54: 19-61. |
| [10] |
YANG Y, WANG C, BENDLE J A, et al. A new sea surface temperature proxy based on bacterial 3-hydroxy fatty acids[J]. Organic Geochemistry, 2020, 141: 103975. DOI:10.1016/j.orggeochem.2020.103975 |
| [11] |
SZPONAR B, NORIN E, MIDTVEDT T, et al. Limitations in the use of 3-hydroxy fatty acid analysis to determine endotoxin in mammalian samples[J]. Journal of Microbiological Methods, 2002, 50(3): 283-289. DOI:10.1016/S0167-7012(02)00038-6 |
| [12] |
BOGUMIłA S, LEONARD K N, TOMASZ H, et al. Distribution of 3-Hydroxy fatty acids in tissues after intraperitoneal injection of endotoxin[J]. Clinical Chemistry, 2020, 49(7): 1149-1153. |
| [13] |
BINDING N, JASCHINSKI S, WERLICH S, et al. Quantification of bacterial lipopolysaccharides (endotoxin) by GC-MS determination of 3-hydroxy fatty acids[J]. Journal of Environmental Monitoring, 2004, 6(1): 65-70. DOI:10.1039/B309237B |
| [14] |
SORDILLO J E, ALWIS U K, HOFFMAN E, et al. Home characteristics as predictors of bacterial and fungal microbial biomarkers in house dust[J]. Environmental Health Perspectives, 2010, 119(2): 189-195. |
| [15] |
LUO X, WU W, LIANG Y, et al. Tyrosine phosphorylation of the lectin receptor-like kinase LORE regulates plant immunity[J]. Embo Journal, 2020, 39: e102856. |
| [16] |
UHLIG S, NEGÃRD M, HELDAL K K, et al. Profiling of 3-hydroxy fatty acids as environmental markers of endotoxin using liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography A, 2016, 1434: 119-126. DOI:10.1016/j.chroma.2016.01.038 |
| [17] |
HUANG X, CUI J, PU Y, et al. Identifying "free" and "bound" lipid fractions in stalagmite samples: An example from Heshang Cave, Southern China[J]. Applied Geochemistry, 2008, 23(9): 2589-2595. DOI:10.1016/j.apgeochem.2008.05.008 |
| [18] |
YANO I, OHNO Y, MASUI M, et al. Occurrence of 2- and 3-hydroxy fatty acids in high concentrations in the extractable and bound lipids of Flavobacterium meningosepticum and Flavobacterium Ⅱb[J]. Lipids, 1976, 11(9): 685-688. DOI:10.1007/BF02532887 |
| [19] |
LI R, YOKOTA A, SUGIYAMA J, et al. Chemotaxonomy of planktonic cyanobacteria based on non‐polar and 3-hydroxy fatty acid composition[J]. Phycological Research, 2010, 46(1): 21-28. |
| [20] |
SEBOLAI O M, POHL C H, BOTES P J, et al. 3-hydroxy fatty acids found in capsules of Cryptococcus neoformans[J]. Canadian Journal of Microbiology, 2007, 53(6): 809-812. DOI:10.1139/W07-045 |
| [21] |
KOCK J L F, VENTER P, BOTHA A, et al. Production of 3-hydroxy fatty acids by the yeast dipodascopsis uninucleata. Biological Implications[J]. Advances in Experimental Medicine & Biology, 1999, 469: 675-677. |
| [22] |
ALUGUPALLI S, PORTAELS F, LARSSON L. Systematic study of the 3-hydroxy fatty acid composition of mycobacteria[J]. Journal of Bacteriology, 1994, 176(10): 2962-2969. DOI:10.1128/jb.176.10.2962-2969.1994 |
| [23] |
SCHNüRER J, SJÖGREN J, KENNE L, et al. Antifungal 3-hydroxy fatty acids from Lactobacillus plantarum MiLAB 14[J]. Applied and Environmental Microbiology, 2003, 69(12): 7554-7557. DOI:10.1128/AEM.69.12.7554-7557.2003 |
| [24] |
RIETSCHEL E T. Absolute configuration of 3-hydroxy fatty acids present in lipopolysaccharides from various bacterial groups[J]. European Journal of Biochemistry, 2008, 64(2): 423-428. |
| [25] |
RUSSELL N. Mechanisms of thermal adaptation in bacteria: blueprints for survival[J]. Trends in Biochemical Sciences, 1984, 9(3): 108-112. DOI:10.1016/0968-0004(84)90106-3 |
| [26] |
RUSSELL N J, FUKUNAGA N. A comparison of thermal adaptation of membrane lipids in psychrophilic and thermophilic bacteria[J]. Fems Microbiology Letters, 1990, 75(2-3): 171-182. DOI:10.1111/j.1574-6968.1990.tb04093.x |
| [27] |
HUGUET A, COFFINET S, ROUSSEL A, et al. Evaluation of 3-hydroxy fatty acids as a pH and temperature proxy in soils from temperate and tropical altitudinal gradients[J]. Organic Geochemistry, 2019, 129: 1-13. DOI:10.1016/j.orggeochem.2019.01.002 |
| [28] |
WAKEHAM S G. Monocarboxylic, dicarboxylic and hydroxy acids released by sequential treatments of suspended particles and sediments of the Black Sea[J]. Organic Geochemistry, 1999, 30(9): 1059-1074. DOI:10.1016/S0146-6380(99)00084-4 |
| [29] |
WAKEHAM S G, PEASE T K, BENNER R. Hydroxy fatty acids in marine dissolved organic matter as indicators of bacterial membrane material[J]. Organic Geochemistry, 2003, 34(6): 857-868. DOI:10.1016/S0146-6380(02)00189-4 |
| [30] |
WANG C, BENDLE J A, ZHANG H, et al. Holocene temperature and hydrological changes reconstructed by bacterial 3-hydroxy fatty acids in a stalagmite from central China[J]. Quaternary Science Reviews, 2018, 192: 97-105. DOI:10.1016/j.quascirev.2018.05.030 |
| [31] |
PEI H, WANG C, WANG Y, et al. Distribution of microbial lipids at an acid mine drainage site in China: Insights into microbial adaptation to extremely low pH conditions[J]. Organic Geochemistry, 2019, 134: 77-91. DOI:10.1016/j.orggeochem.2019.05.008 |
| [32] |
杨欢. 中国土壤微生物类脂物对现代过程的响应及其古环境意义[D]. 武汉: 中国地质大学, 2010. YANG Huan. The response of microbial lipids to the modern process and its paloenvironment implications[D]. Wuhan: China University of Geosciences, 2010. |
| [33] |
LI Y L, PEACOCK A D, WHITE D C, et al. Spatial patterns of bacterial signature biomarkers in marine sediments of the Gulf of Mexico[J]. Chemical Geology, 2007, 238(3): 168-179. |
| [34] |
PARKER J H, SMITH G A, FREDRICKSON H L, et al. Sensitive assay, based on hydroxy fatty acids from lipopolysaccharide lipid A, for Gram-negative bacteria in sediments[J]. Applied & Environmental Microbiology, 1982, 44(5): 1170-1177. |
| [35] |
岳丽娜. 细菌内毒素检测中问题的研究[D]. 大连: 大连理工大学, 2005. YUE Lina. Study on Bacterial Endotoxin Test[D]. Dalian: Dalian University of Technology, 2005. |
| [36] |
HIROSHI O, KAZUO K. Grouping of Pseudomonas species on the basis of cellular fatty acid composition and the quinone system with special reference to the existence of 3-hydroxy fatty acids[J]. Journal of General & Applied Microbiology, 1983, 29(1): 17-40. |
| [37] |
MIYAGAWA E, AZUMA R, SUTO T. Cellular fatty acid composition in Gram-negative obligately anaerobic rods[J]. The Journal of General and Applied Microbiology, 1979, 25(1): 41-51. DOI:10.2323/jgam.25.41 |
| [38] |
HEDRICK D B, PEACOCK A D, LOVLEY D R, et al. Polar lipid fatty acids, LPS-hydroxy fatty acids, and respiratory quinones of three Geobacter strains, and variation with electron acceptor[J]. Journal of Industrial Microbiology & Biotechnolog, 2009, 36(2): 205-209. |
| [39] |
EDLUND A, NICHOLS P D, ROFFEY R, et al. Extractable and lipopolysaccharide fatty acid and hydroxy acid profiles from Desulfovibrio species[J]. Journal of Lipid Research, 1985, 26(8): 982-988. DOI:10.1016/S0022-2275(20)34302-9 |
| [40] |
BLYTH A J, FARRIMOND P, JONES M. An optimised method for the extraction and analysis of lipid biomarkers from stalagmites[J]. Organic Geochemistry, 2006, 37(8): 882-890. DOI:10.1016/j.orggeochem.2006.05.003 |
| [41] |
WANG C, ZHANG H, HUANG X, et al. Optimization of acid digestion conditions on the extraction of fatty acids from stalagmites[J]. Frontiers of Earth Science, 2012, 6(1): 109-114. DOI:10.1007/s11707-012-0311-5 |
| [42] |
YANG Y, WANG C, ZHANG H, et al. Influence of extraction methods on the distribution pattern and concentration of fatty acids and hydroxy fatty acids in soil samples: Acid digestion versus saponification[J]. Geochemical Society of Janpan, 2016, 50(5): 439-443. DOI:10.2343/geochemj.2.0422 |
| [43] |
JONES P M, BENNETT M J. 3-Hydroxy-Fatty Acid Analysis by Gas Chromatography-Mass Spectrometry[J]. Methods in Molecular Biology, 2010, 603: 229-243. |
| [44] |
SARAF A, PARK J H, MILTON D K, et al. Use of quadrupole GC-MS and ion trap GC-MS-MS for determining 3-hydroxy fatty acids in settled house dust: relation to endotoxin activity[J]. Journal of Environmental Monitoring, 1999, 1(2): 163-168. DOI:10.1039/a809019j |
| [45] |
LARSSON L, SARAF A. Use of gas chromatography ion trap tandem mass spectrometry for the detection and characterization of microorganisms in complex samples[J]. Molecular Biotechnology, 1997, 7(3): 279-287. DOI:10.1007/BF02740818 |
| [46] |
傅博强, 唐治玉, 王晶. 细菌内毒素脂多糖中羟基化脂肪酸的GC-MS/MS分析方法研究[C]//中国毒理学会. 第12届生物毒素研究及医药应用学术大会论文集, 2015年10月9日, 陕西延安, 2015: 35. FU Boqiang, TANG Zhiyu, WANG Jing. GC-MS/MS analysis of hydroxylated fatty acids in bacterial endotoxin lipopolysaccharide[C]//Chinese Society of Toxicology. The 12th Academic Conference on Biotoxin Research and Medical Applications, October 9, 2015, Yan'an, Shanxi Province, 2015: 35. |
| [47] |
LI J, XU J, ZHANG R, et al. Strategy for global profiling and identification of 2-and 3-hydroxy fatty acids in plasma by UPLC-MS/MS[J]. Analytical Chemistry, 2020, 92(7): 5143-5151. DOI:10.1021/acs.analchem.9b05627 |
| [48] |
MCELHANEY R N, GIER J D, VAN DEENEN L L M. The effect of alterations in fatty acid composition and cholesterol content on the nonelectrolyte permeability of Mycoplasma laidlawii B cells and derived liposomes[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1970, 219(1): 245-247. DOI:10.1016/0005-2736(70)90083-0 |
| [49] |
DENICH T J, BEAUDETTE L A, LEE H, et al. Effect of selected environmental and physico-chemical factors on bacterial cytoplasmic membranes[J]. Journal of Microbiological Methods, 2003, 52(2): 149-182. |
| [50] |
MITCHELL P. Chemiosmotic coupling in oxidative and photosynthetic phosphorylation[J]. Biochimica Et Biophysica Acta, 2011, 1807(12): 1507-1538. |
| [51] |
SUUTARI M, LAAKSO S. Microbial fatty acids and thermal adaptation[J]. Critical Reviews in Microbiology, 1994, 20(4): 285-328. |
| [52] |
石鑫, 宋金明, 李学刚, 等. 海洋古pH重建的技术方法[J]. 海洋环境科学, 2019, 38(6): 954-962. SHI Xin, SONG Jinming, LI Xuegang, et al. Methods for reconstruction of oceanic paleo-pH[J]. Marine Environmental Science, 2019, 38(6): 954-962. |
| [53] |
LU X, YANG H, SONG J, et al. Sources and distribution of isoprenoid glycerol dialkyl glycerol tetraethers (GDGTs) in sediments from the east coastal sea of China: Application of GDGT-based paleothermometry to a shallow marginal sea[J]. Organic Geochemistry, 2014, 75: 24-35. DOI:10.1016/j.orggeochem.2014.06.007 |
| [54] |
ZELLES L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review[J]. Biology and Fertility of Soils, 1999, 29(2): 111-129. DOI:10.1007/s003740050533 |
| [55] |
KEINÄNEN M M, KORHONEN L K, MARTIKAINEN P J, et al. Gas chromatographic–mass spectrometric detection of 2- and 3-hydroxy fatty acids as methyl esters from soil, sediment and biofilm[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2003, 783(2): 443-451. |
| [56] |
LEE A K Y, CHAN C K, FANG M, et al. The 3-hydroxy fatty acids as biomarkers for quantification and characterization of endotoxins and Gram-negative bacteria in atmospheric aerosols in Hong Kong[J]. Atmospheric Environment, 2004, 38(37): 6307-6317. |
| [57] |
HUANG X, CUI J, YANG P, et al. Identifying "free" and "bound" lipid fractions in stalagmite samples: An example from Heshang Cave, Southern China[J]. Applied Geochemistry, 2008, 23(9): 2589-2595. |
| [58] |
TYAGI P, YAMAMOTO S, KAWAMURA K. Hydroxy fatty acids in fresh snow samples from northern Japan: long-range atmospheric transport of Gram-negative bacteria by Asian winter monsoon[J]. Biogeosciences Discussions, 2015, 12(16): 13375-13397. |
 2021, Vol. 45
2021, Vol. 45