
文章信息
- 廖丹宁, 郑旻辉, 潘建明, 杨俊毅, 林燈科. 2021.
- LIAO Dan-ning, ZHENG Min-hui, PAN Jian-ming, YANG Jun-yi, LIN Deng-ke. 2021.
- 叶绿素传感器海上应用影响因素研究进展
- Research progress on factors influencing the marine application of chlorophyll sensors
- 海洋科学, 45(9): 99-105
- Marine Sciences, 45(9): 99-105.
- http://dx.doi.org/10.11759/hykx20200902001
-
文章历史
- 收稿日期:2020-09-02
- 修回日期:2020-11-07
2. 自然资源部 第二海洋研究所, 浙江 杭州 310012;
3. 杭州电子科技大学 机械工程学院, 浙江 杭州 310018
2. Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, China;
3. School of Mechanical Engineering, Hangzhou Dianzi University, Hangzhou 310018, China
浮游植物是海洋环境中初级生产力的重要组成部分, 在海洋生态系统中扮演着极为重要的角色。叶绿素浓度是衡量浮游植物丰度的重要指标[1], 通过测量叶绿素含量可获知水体中初级生产力情况和水质的富营养化程度[2], 因此叶绿素含量指标在海洋水质环境监测、赤潮监测预报等方面有着广泛应用。此外, 研究海洋叶绿素和初级生产力情况, 还有助于了解海洋中碳的生物地球化学循环和气候变化, 对全球海洋碳循环研究具有重要意义[3]。由此可见, 快速准确地测定海水中的叶绿素含量, 对于业务化监测和科学研究都具有重要的现实意义。
测定叶绿素的常用方法有分光光度法、荧光萃取法、高效液相色谱法、荧光传感器法、卫星遥感法等。分光光度法、荧光萃取法、高效液相色谱法都属于实验室常规方法, 具有精确度高等优点[4-5], 但该类方法必须经过水样采集和样品处理, 操作步骤繁杂、时间冗长, 使得获得的叶绿素数据在时空上不连续[6]。遥感法具有综合、客观、便捷的特点, 适用于大面积水体的长期动态监测, 但遥感法测定过程较为复杂且易受天气等因素影响, 数据准确性仍较低[7]。与上述几种方法相比, 基于活体荧光法的叶绿素传感器操作简便, 可长期原位在线监测, 能轻易获取大批量实测数据, 是海水叶绿素高精度测量手段的主要发展趋势。
活体荧光法叶绿素传感器的研制最早可追溯到20世纪60年代[8]。经过数十年的持续发展, 目前国际上已有多款商业化产品, 在海洋领域使用较多的包括Turner C3、WETLabs ECO FL、Seapoint SCF等。由于优异的海洋原位探测能力, 近年来叶绿素传感器已被广泛应用于赤潮藻类消亡过程、浮游植物生物量及群落组成, 以及水体垂直剖面和水下运动平台观测等科研活动[5-8]。但叶绿素传感器在实际应用中还存在一些问题, 主要体现在传感器数据与实验室萃取法数值之间存在较大偏差且应用于不同水体时偏差不固定[9-10]。叶绿素传感器在海上应用时会受到海洋中多种环境因素的影响, 科学界此前已在浊度、温度、光照、盐度及藻种差异等因素影响方面开展了一些研究, 并基于获取的影响规律尝试对叶绿素传感器测值进行数据校正。表 1列举了当前科学界在叶绿素传感器测量影响因素方面的主要研究成果。
悬浮颗粒物对叶绿素传感器的影响几乎困扰着传感器应用的全过程, 因此科学家关于悬浮颗粒物对叶绿素传感器测量的影响研究由来已久。海水的悬浮颗粒物一般由悬浮颗粒物浓度和浊度两个参数表征。浊度主要反映水中悬浮物对光线通过时所产生的阻碍程度, 因此更适用于基于光学检测的叶绿素传感器影响研究。早在1980年, 丁永耀等[4]指出: 当水体较浑浊时, 会使叶绿素a的荧光测定结果偏高, 此后王岩峰等[11]的研究结果证实了这一结论。而后, 不断有学者通过实验室藻类培养实验和现场水体环境实测, 验证了浊度对叶绿素传感器测量的影响[12-14]。
大部分学者认为当水体较浑浊时会使叶绿素a的荧光测定结果偏高, 并且部分研究认为在一定浊度范围内, 浊度引起的叶绿素增量与浊度呈显著正相关[4, 11, 13, 15-16]。但也存在一些关于悬浮颗粒物使得叶绿素传感器测值偏低的研究报道[17-19]。郑旻辉[3]通过在清水和藻液中加入福尔马肼浊度标准液较系统地研究了浊度对叶绿素传感器测量的影响, 发现在没有藻液情况下高浊度也会产生叶绿素荧光信号, 在藻液浓度较低时高浊度会使传感器测量值偏高, 藻液浓度较高时则正好相反。可见, 当前科学界尚未完整掌握悬浮颗粒物对叶绿素传感器测量的影响规律。
1.2 浊度影响机理目前关于悬浮颗粒物对叶绿素传感器的影响机理, 科学界仍存在一定分歧。总体来说, 悬浮颗粒物对叶绿素传感器测量的影响主要包括散射作用、反射作用、荧光效用和遮蔽效应等4种解释(图 1)。
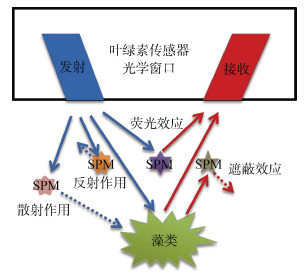 |
| 图 1 悬浮颗粒物(SPM)对叶绿素传感器测量的影响示意图 Fig. 1 Schematic diagram of the influence of suspended particulate matter (SPM) on chlorophyll sensor measurement |
通常来说, 学者们对于悬浮颗粒物影响机理的解释都是围绕各自观察到的实验现象展开。在解释浊度引起的叶绿素测值增大现象时, 多数学者认为悬浮颗粒物的影响主要在于对传感器检测光的散射作用, 放大了藻细胞接收到的激发光强度, 同时放大了传感器接收到的发射光强度, 从而共同引起传感器测量结果偏高[13, 15, 16]。也有学者认为实际海洋水体中存在的叶绿素降解产物碎屑及有色溶解有机物(CDOM)等物质的存在, 是导致叶绿素测值偏高的主要原因[20-22]。
与此相反的是, 观察到悬浮颗粒物使得叶绿素传感器测值偏低现象的学者则认为水中粒子的存在会阻碍传感器检测窗口与藻类细胞间的光线传输, 从而降低传感器信号值[17-18]。而针对实验中发现的悬浮颗粒物多重影响现象, 郑旻辉[3]认为某些悬浮颗粒物本身具有荧光性, 从而推测除了具有反射和散射作用外, 悬浮颗粒物对叶绿素传感器的测量可能还存在“荧光效应”和“遮蔽效应”影响。
需要指出的是, 当前研究结果多为基于有限的实验室模拟结果和现场观测数据所得的表面规律进行的推测分析, 各观点都存在一定局限性, 后续仍需进一步开展机理层面的深入分析和严谨验证。
1.3 浊度影响校正方法在悬浮颗粒物对叶绿素传感器测量影响研究过程中, 多位学者试图获取叶绿素传感器的数据校准公式。基于叶绿素增量与浊度呈显著正相关的认识的学者们一般都采用线性校准公式, 但不同学者给出的校准系数存在较大差异, 浊度影响修正系数在0.006 7~0.017 4[12, 15]。该类研究主要基于实验室内简单的藻类培养模拟实验, 获得的校准公式大多未进行大量重复验证, 也未在实际水体环境进行验证。
在郑旻辉提出悬浮颗粒物的荧光效应和遮蔽效应对叶绿素传感器测量影响的基础上, 叶陈军[23]等通过进一步的研究确认了近海表层沉积物也能适用“荧光效应”和“遮蔽效应”推测, 并尝试建立了一种叶绿素传感器数据的浊度影响校正方法。该方法通过表层沉积物模拟实验分别获取荧光效应系数和遮蔽效应系数(共同构成叶绿素传感器浊度影响校准系数), 在实际应用中将叶绿素和浊度传感器同步数据代入校准公式即可进行现场实时校正。叶陈军等使用该方法在象山港进行了海上现场验证并取得较好效果(图 2), 表明基于该推测的浊度影响校正方法具有一定的实践意义。
 |
| 图 2 叶绿素传感器浊度影响校正方法海上验证结果 Fig. 2 Verification results of turbidity effect correction method of chlorophyll sensor at sea |
不同学者对于悬浮颗粒物对叶绿素传感器影响机理的理解各不相同, 给出的校准系数存在较大差异。由于各自采用的传感器品牌和型号, 以及选用藻种、悬浮颗粒物类型、浓度范围等实验条件并不完全一致, 现有研究难以有效区分传感器自身结构设计和校准实验方法对校准系数差异的贡献程度。多数公式虽然针对当次实验数据有较好的校正效果, 但并未在不同海区实际水体环境得到充分验证, 其方法在多大时空范围内能够适用依然未知。目前尚未有能在不同海区广泛适用并被业界普遍认可叶绿素传感器浊度影响校准方法。
2 光照影响研究 2.1 光照影响规律海洋水体中的光照与天气状况息息相关, 所以光照强度时刻存在波动; 而且对于生活在不同深度的浮游植物, 其接收到的光照强度也会有较大差异。光照会影响叶绿素的合成, 所以不同的光照条件下叶绿素传感器的测定值也会有很大不同。许多学者通过实验研究发现, 通常在弱光条件下藻类的色素含量更高, 即叶绿素传感器的测定值会较高; 而在过强光照下, 传感器的测定值会偏低[24-25]。除此之外, 郑旻辉[3]通过短期和长期光照变化实验, 发现不同程度的光照变化均会对硅藻叶绿素活体荧光造成影响: 不同光暗比下, 光照所占比例越大, 越有利于提高硅藻叶绿素活体荧光水平; 光照突变瞬间硅藻叶绿素活体荧光会随之出现明显变化, 但当光照恢复稳定后, 硅藻叶绿素活体荧光也会回到突变前的水平。
2.2 光照影响机理在光照对叶绿素传感器测定影响的机理方面, 学者们有许多种解释。对于光照强度变化影响叶绿素传感器测定的原因, 大部分学者认为, 因为弱光环境下藻类细胞会聚集光合作用色素以促进它们捕捉更多的光; 而过强光照下, 光合作用色素会减少来防止更多的能量激发和细胞损伤, 所以弱光条件下色素的含量更高。在实际应用中, 处于水体表面的浮游生物叶绿素荧光测定值较底栖浮游植物高[24-25]。而对于强光使叶绿素传感器的测定值偏低的原因, 部分学者认为还有其他的解释, 即强光下发生非化学荧光猝灭, 导致色素荧光降低。荧光淬灭(fluorescence quenching)是指荧光物质分子与溶剂分子之间所发生的导致荧光强度变化或相关的激发峰位变化或荧光峰位变化物理或化学作用过程, 有化学荧光猝灭和非化学荧光猝灭两种类型, 非化学荧光猝灭一般表示光量子产率的降低[26-27]。
由于光照对浮游植物荧光的影响机理很复杂, 在改变环境条件时得到的实验结果也会有较大变化, 很难总结其中的变化规律, 目前科学界尚未有学者探究出关于光照对叶绿素荧光传感器的可重复实验验证的校正公式。另一方面, 自然界中光照变化情况很复杂, 既有受季节影响的昼夜交替引起的光照时长变化, 也有移动云朵遮蔽导致的短时光照强度变化, 用何种方式指征自然界的光照变化自身也是一个需要探究的课题。
3 温盐影响研究 3.1 温盐影响规律海洋水体的温度和盐度变化是一个较为缓慢的过程, 其对叶绿素传感器测值的直接影响难以被轻易捕捉到。由于藻类自身长期生长受到多种影响因素的制约, 难以开展温盐单因子影响实验研究, 长期温度变化对叶绿素传感器的影响尚未见诸报道。当前关于温度和盐度对叶绿素传感器的影响研究多基于在实验室开展的温盐短期快速变化下叶绿素传感器的响应实验。
大多数学者的研究结果显示温度短期快速变化对叶绿素传感器测值无显著影响[15]。也有部分学者认为温度升高会引起叶绿素传感器测值轻微降低[13, 19, 28]。基于藻类培养实验的研究显示, 短期盐度快速变化对叶绿素传感器测量的影响很小, 可忽略不计[3, 6]。
3.2 温盐影响机理通过此前关于温度对叶绿素a标准品及萃取样品保存和测定影响的研究, 人们已经认识到温度升高会提高叶绿素a的降解率, 造成测定结果偏低[30], 关于温度对荧光法测定活体藻中叶绿素a影响的研究则相对较少。当前科学界关于温度对叶绿素传感器可能的影响分析主要包括: (1) 由于温度升高提高了分子动能, 促进了分子间流动, 使液体动力增加粘度减小, 增大了荧光分子和溶剂分子的碰撞机会, 荧光物质分子通过其他分子的碰撞造成内部能量的转移, 从而导致温度淬灭, 降低了荧光物质的荧光强度[28, 30, 31]。(2) 度的升高使部分叶绿素a降解生成了以脱镁叶绿素a为主的降解产物, 两者荧光特性有所差异, 从而降低了叶绿素a的荧光量子产率; (3) 低温会减弱细胞活性, 降低光量子的吸收和荧光物质的发射; 高温则会抑制细胞活性, 促进荧光分子与溶剂分子的扩散和能量转移[6]。但有学者认为, 因为浮游植物的种类不同, 所以随着水温的增加, 叶绿素荧光强度的降幅无法一以概之[25]。
4 藻类生理因素影响研究 4.1 藻种差异影响规律已有多位学者通过实验证实了不同藻类的活体荧光强度具有显著差异。谢尚微[6]的研究结果显示, 在相同叶绿素a浓度的水体中, 中肋骨条藻、球等边金藻和赤潮异弯藻等不同藻类的活体荧光存在显著差异, 即不同藻类的叶绿素活体荧光值与萃取法叶绿素a浓度值之间的比值具有很大不同, 推测是由于不同种类浮游植物的叶绿体的数量、形态和位置不同导致的。Chang等[32]学者培养观察了3种不同的蓝藻在其生长过程中的藻密度和藻蓝蛋白浓度的变化情况。结果显示, 不同藻类的细胞密度随时间变化关系大致相同, 但不同生长阶段中各藻类的相对荧光单位(relative fluorescent unit, RFU)却有较大差异(图 3), 表明藻种之间存在活体荧光差异[29, 32]。
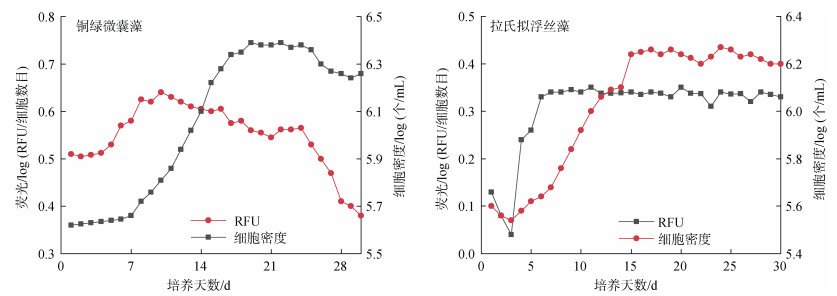 |
| 图 3 不同生长阶段藻类活体荧光与细胞密度变化差异 Fig. 3 Difference of fluorescence and cell density of algae in different growth stages |
此外, 还有学者指出, 藻类自身的某些生理特性也会影响叶绿素活体荧光的测量。菌落形态和分子凝聚会影响藻细胞相对于传感器的位置, 对测定结果造成影响。对蓝藻的荧光值研究表明, 蓝藻菌落发射出的荧光低于单个的蓝藻细胞发出的荧光总和, 这是荧光传感器的激发光束无法穿透整个菌落和光散射造成的[33]。有研究表明, 含有不同藻胆素的浮游植物是藻类荧光测量过程中偏差的来源[34]。藻胆素(phycobilin)是藻类主要的光合色素, 仅存在于红藻和蓝藻中, 常与蛋白质结合为藻胆蛋白, 藻胆素的存在会干扰色素测定。
5 研究展望本文总结了活体荧光法叶绿素传感器在海洋水体环境测量时的影响因素研究现状, 明确各海洋环境因素对叶绿素传感器测量的影响机理是进行相关影响校正的前提。总体而言, 虽然目前科学界已经在浊度、光照、温盐和藻类生理因素等方面开展了一些研究, 基本明确了上述因素对叶绿素传感器测量存在不同影响, 并基于少量实验室模拟结果和现场数据获取了一些影响校准公式, 但对于各因素完整的影响程度、影响机理, 以及相应的数据校正方法等方面研究都还存在很大不足, 导致目前仍然缺乏行之有效的叶绿素传感器数据质量保障方法。
着眼于海洋日常监测与科学研究对于叶绿素传感器数据的实际需求, 结合当前叶绿素传感器海上应用中存在的具体问题和研究进展, 今后围绕叶绿素传感器的数据质量保障方法可采取以下研究思路:
1) 基于影响机理上的本质差异, 在叶绿素传感器影响因素研究过程中, 对于藻类活体荧光强度影响和传感器荧光值测定影响两个方面应予以区分。考虑到海洋实际环境的复杂性, 在进行室内模拟实验时, 实验条件的设置应尽可能贴近于海洋实际环境。
2) 悬浮颗粒物影响方面当前已经取得较多研究结果, 并且已经初步建立了浊度影响校正方法。后续应重点开展影响机理研究, 探究粒度、组分等悬浮颗粒物特性中起决定性的因素, 明确海区悬浮颗粒物差异对于叶绿素传感器测量的影响情况, 针对不同型号传感器进行对比试验, 建立起一种能够广泛适用的浊度影响校正方法并开展大量的海上实测验证。
3) 现阶段光照、温盐、藻种等影响方面仍将以开展室内模拟实验为主要方式, 在逐步掌握可通过实验重现的各因素影响规律基础上, 结合海上各因素实际变化情况, 选择具备较高自动化程度的表征手段, 开展进一步数据校正方法研究。
| [1] |
BABIN M, ROESLER C, CULLEN J. Real-time coastal observing systems for marine ecosystem dynamics and harmful algal blooms: theory, instrumentation and modelling[M]. Unesco, Paris: Oceanographic Methodology Series, 2008.
|
| [2] |
王俊, 李洪志. 渤海近岸叶绿素和初级生产力研究[J]. 海洋水产研究, 2002, 23(1): 23-28. WANG Jun, LI Hongzhi. Study on chlorophyll and primary production in inshore waters of the Bohai Sea[J]. Marine Fisheries Research, 2002, 23(1): 23-28. |
| [3] |
郑旻辉. 硅藻生长过程中活体荧光变化规律及其对叶绿素测量的影响[D]. 武汉: 中国地质大学, 2016. ZHENG Minhui. Variation of in vivo fluorescence during diatom growth and its effect on chlorophyll measurement[D]. Wuhan: China University of Geosciences, 2016. |
| [4] |
丁永耀, 张欣梅, 吕培顶, 等. 荧光法测定海中生物体内的叶绿素a[J]. 海洋学报, 1983, 5(3): 340-348. DING Yongyao, ZHANG Xinmei, LV Peiding, et al. Determination of chlorophyll a in marine organisms by fluorescence method[J]. Acta Oceanologica Sinica, 1983, 5(3): 340-348. |
| [5] |
杨琳. 浮游植物叶绿素a测定方法研究进展[J]. 四川环境, 2019, 38(1): 156-160. YANG Lin. Research progress in determination of phytoplankton chlorophyll-a[J]. Sichuan Environment, 2019, 38(1): 156-160. |
| [6] |
谢尚微. 海洋叶绿素活体荧光检测的生物学影响因素研究[D]. 杭州: 国家海洋局第二海洋研究所, 2015. XIE Shangwei. Research on biological impact of detecting in vivo chlorophyll fluorescence in sea water[D]. Hangzhou: The Second Institute of Oceanography, State Oceanic Administration, 2015. |
| [7] |
邢小罡, 赵冬至, 刘玉光, 等. 叶绿素a荧光遥感研究进展[J]. 遥感学报, 2007, 11(1): 137-144. XING Xiaogang, ZHAO Dongzhi, LIU Yuguang, et al. Progress in fluorescence remote sensing of chlorophyll-a[J]. Journal of Remote Sensing, 2007, 11(1): 137-144. |
| [8] |
LORENZEN C. A method for the continuous measurement of in vivo chlorophyll concentration[J]. Deep-Sea Research, 1966, 13(2): 223-227. |
| [9] |
TSUNEO O, TORU H, SAKAE K, et al. Temporal and spatial patterns in the surface-water biomass of phytoplankton in the North Water[J]. Deep-Sea Research Ⅱ, 2002, 49: 4947-4958. |
| [10] |
李祖华, 李天深, 周文东. 海水自动监测站与实验室国标方法测定海水中叶绿素的比对分析[J]. 仪器仪表与分析监测, 2013, 3: 41-43. LI Zuhua, LI Tianshen, ZHOU Wendong. Comparison of automatic monitoring instrument and laboratorial national standard method to detect chl a in seawater[J]. Instrumentation Analysis Monitoring, 2013, 3: 41-43. |
| [11] |
王岩峰, 张杰, 孙培光, 等. 用于海洋现场监测的小型叶绿素a荧光计和浊度计[J]. 海洋技术学报, 2007, 26(1): 29-33. WANG Yanfeng, ZHANG Jie, SUN Peiguang, et al. The in-situ chlorophyll-a fluorometer and turbidity meter for marine application[J]. Ocean Technology, 2007, 26(1): 29-33. |
| [12] |
赵洋甬, 沈碧君, 胡建林, 等. 浊度对荧光法测定叶绿素a的影响[C]. 昆明: 2013中国环境科学学会学术年会, 2013: 1870-7873. ZHAO Yangyong, SHEN Bijun, HU Jianlin, et al. Turbidity effect on the determination of in situ fluorescence of chlorophyll-a in water[D]. Kunming: Academic Annual Meeting of Chinese Society of Environmental Sciences, 2013: 1870-7873. |
| [13] |
吕鹏翼, 崔建升, 段莉丽. 浊度对荧光光谱法测定水体中叶绿素a的影响[J]. 理化检测-化学分册, 2015, 51: 741-744. LV Pengyi, CUI Jiansheng, DUAN Lili. Effect of turbidity on fluorescence intensity of chlorophyll-a in water[J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis), 2015, 51: 741-744. |
| [14] |
BOWLING L, RYAN D, HOLLIDAY J, et al. Evaluation of in situ fluorometry to determine cyanobacterial abundance in the Murray and Lower Darling Rivers, Australia[J]. River Research and Applications, 2013, 29(8): 1059-1071. |
| [15] |
张丽, 郭翠莲, 张述伟, 等. 荧光法测定叶绿素a的影响因素及其数据校正[J]. 山东科学, 2017, 30(3): 8-11. ZHANG Li, GUO Cuilian, ZHANG Shuwei, et al. The influence factors of fluorescence determination of chlorophyll a and the data correction for them[J]. Shandong Science, 2017, 30(3): 8-11. |
| [16] |
CUI J, LV P. Turbidity effect on the fluorescence determination of chlorophyll-a in water[J]. Applied Mechanics and Materials, 2014, 522-524: 60-63. |
| [17] |
BEUTLER M, WILTSHIRE K, MEYER B, et al. A fluorometric method for the differentiation of algal populations in vivo and in situ[J]. Photosynthesis Research, 2002, 72(1): 39-53. |
| [18] |
GREGOR J, MARSALEK B. Freshwater phytoplankton quantification by chlorophyll a: a comparative study of in vitro, in vivo and in situ methods[J]. Water Research, 2004, 38(3): 517-522. |
| [19] |
刘建华. 荧光法测定水体中叶绿素含量影响因素的研究[D]. 石家庄: 河北科技大学, 2014. LIU Jianhua. Study on influencing factors of chlorophyll content determination in water by fluorescence method[D]. Shijiazhuang: Hebei University of Science and Technology, 2014. |
| [20] |
BAKER J, ENTSCH B, NEILAN B, et al. Monitoring changing toxigenicity of a cyanobacterial bloom by molecular methods[J]. Applied and Environmental Microbiology, 2002, 68(12): 6070-6076. |
| [21] |
PROCTOR C, ROESLER C. New insights on obtaining phytoplankton concentration and composition from in situ multispectral chlorophyll fluorescence[J]. Limnology and Oceanography: Methods, 2010, 8(12): 695-708. |
| [22] |
XING X, CLAUSTRE H, BOSS E, et al. Correction of profiles of in-situ chlorophyll fluorometry for the contribution of fluorescence originating from non-algal matter[J]. Limnology and Oceanography: Methods, 2017, 15(1): 80-93. |
| [23] |
叶陈军, 潘建明, 郑旻辉, 等. 浊度对活体叶绿素荧光检测的影响及修正方法[J]. 海洋学研究, 2018, 36(2): 27-35. YE Chenjun, PAN Jianming, ZHENG Minhui, et al. The influence of turbidity on the measurement of in vivo chlorophyll fluorescence and its correction method[J]. Journal of Marine Science, 2018, 36(2): 27-35. |
| [24] |
ERICKSON J, HASHEMI N, SULLIVAN J, et al. In situ phytoplankton analysis: there's plenty of room at the bottom[J]. Analytical Chemistry, 2012, 84(2): 839-850. |
| [25] |
ZAMYADI A, CHOO F, NEWCOMBE G, et al. A review of monitoring technologies for real-time management of cyanobacteria: Recent advances and future direction[J]. Trends in Analytical Chemistry, 2016, 85: 83-96. |
| [26] |
SACKMANN B, PERRY M, ERIKSEN C. Seaglider observations of variability in daytime fluorescence quenching of chlorophyll-a in Northeastern Pacific coastal waters[J]. Biogeosciences, 2008, 5(4): 2839-2865. |
| [27] |
ROESLER C, UITZ J, CLAUSTRE H, et al. Recommendations for obtaining unbiased chlorophyll estimates from in situ chlorophyll fluorometers: a global analysis of WET Labs ECO sensors[J]. Limnology and Oceanography: Methods, 2017, 15(6): 572-585. |
| [28] |
DOWNING B, PELLERIN B, BERGAMASCHI B, et al. Seeing the light: the effects of particles, dissolved materials, and temperature on in situ measurements of DOM fluorescence in rivers and streams[J]. Limnology and Oceanography: Methods, 2012, 10(10): 767-775. |
| [29] |
CHANG D, HOBSON P, MICHAEL B, et al. Measurement of cyanobacteria using in-vivo fluoroscopye-effect of cyanobacterial species, pigments, and colonies[J]. Water Research, 2012, 46(16): 5037-5048. |
| [30] |
吕鹏翼, 崔建升. 温度对现场荧光法测定水体中叶绿素a的影响[J]. 中国环境监测, 2015, 31(2): 135-139. LV Pengyi, CUI Jiansheng. Temperature effect on the determination of in situ fluorescence of chlorophyll-a in water[J]. Environmental Monitoring in China, 2015, 31(2): 135-139. |
| [31] |
HENDERSON R, BAKER A, MURPHY K, et al. Fluorescence as a potential monitoring tool for recycled water systems: a review[J]. Water Research, 2009, 43(4): 863-881. |
| [32] |
CHANG D, HOBSON P, MICHAEL B, et al. The limitation of measurement in cyanobacteria using in-vivo fluoroscopye[C]. Australia: Sensor Networks and Information Processing, 2011.
|
| [33] |
HODGES C. A validation study of phycocyanin sensors for monitoring cyanobacteria in cultures and field samples[D]. New Zealand: University of Waikato, 2016.
|
| [34] |
PEMBERTON K, SMITH R, SILSBE G, et al. Controls on phytoplankton physiology in Lake Ontario during the late summer: evidence from new fluorescence methods[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2007, 64(1): 58-73. |
 2021, Vol. 45
2021, Vol. 45


