
文章信息
- 魏晓雪, 石峰, 陈子熙, 冯剑丰, 朱琳. 2022.
- WEI Xiao-xue, SHI Feng, CHEN Zi-xi, FENG Jian-feng, ZHU Lin. 2022.
- 三角褐指藻及其藻际细菌对不同无机氮源的响应
- Responses of Phaeodactylum tricornutum and its bacteria in the phycosphere to different inorganic nitrogen sources
- 海洋科学, 46(1): 10-21
- Marine Sciences, 46(1): 10-21.
- http://dx.doi.org/10.11759/hykx20210329001
-
文章历史
- 收稿日期:2021-03-29
- 修回日期:2021-05-23
2. 天津市跨介质复合污染环境治理技术重点实验室, 天津 300350;
3. 科技部科技评估中心, 北京 100081;
4. 深圳大学生命与海洋科学学院, 广东 深圳 518060
2. Tianjin Key Laboratory of Environmental Treatment Technology for Complex Trans-Media Pollution, Tianjin 300350, China;
3. National Center for Science & Technology Evaluation, Beijing 100081, China;
4. College of Life Sciences and Oceanography, Shenzhen University, Shenzhen 518060, China
氮作为地球大气层中最丰富的元素, 具有氧化还原活性, 可以参与生物体的呼吸能量代谢, 也可以与碳形成通用的共价键, 参与氨基酸和核苷酸的合成, 因而其为构成生命体的必需元素之一[1-2]。由于海洋中的生物固氮过程在一定程度上是一个相对限制的过程[3], 即氮在海洋环境中供不应求, 因此, 与其他营养元素相比, 氮经常是主要的限制性资源[4]。而氮循环作为组成海洋生态系统物质循环中重要循环之一, 对维持和修复海洋生态平衡具有重要意义[5]。
浮游植物和细菌之间的生态关系作为海洋生态系统中最重要的生物间联系之一, 可以对氮循环产生重要影响, 并通过串联自下而上的生态效应调节海洋系统的初级生产力和食物网的稳定性[6]。浮游植物通过分泌有机分子在其周围形成藻际环境, 生存于藻际环境的细菌被称为藻际细菌[6]。藻际细菌依赖具有光合作用的浮游植物固定的有机碳维持生长, 其消耗量占浮游植物固定量的50%; 反之, 浮游植物依靠藻际细菌的矿化作用维持生长, 即藻际细菌将有机物转变为无机物, 以供浮游植物利用[7]。最近很多研究发现, 浮游植物和藻际细菌之间的关系是一个更为复杂的体系。二者之间的相互作用涉及辅助因子、微量元素、常量元素、蛋白质和信号分子等物质交换, 而这种交换可以促进二者之间形成竞争、拮抗、互利共生和偏利共生的关系。例如, 藻际细菌和浮游植物可以通过对无机营养盐的竞争, 进而限制对方生长[8]。Croceibacter atlanticus则是通过接触硅藻细胞表面或抑制细胞分裂, 从而使硅藻细胞伸长、细胞质体增加, 进而导致细胞死亡[9]。已有研究表明浮游植物和藻际细菌之间的共生关系是由细菌分泌的营养物质调节, 该种营养物质也可以促进浮游植物的生长, 虽然这种现象的潜在原因仍在探究[10]。Amin等[11]将SA11菌种和多列拟菱形藻(Pseudonitzschia multiseries)在硝态氮过饱和的条件下混合培养, 发现SA11菌种可以吸收硝态氮, 分泌铵态氮, 以供藻类利用; P. multiseries更易利用细菌分泌的铵态氮维持生长, 而不是外部添加的硝态氮。但是, 细菌分泌的铵态氮并不是促进P. multiseries生长的主要影响因子。与硝态氮相比, 藻类对铵态氮的吸收耗能较少, 因此, 当铵态氮和硝态氮同时存在时, 藻类更易利用铵态氮[12]。
综上所述, 藻菌关系极其复杂, 但难以彻底分离。截至目前为止, 藻菌分离方法一般采用辅助方法(如涡旋、超声处理和添加表面活性剂)、分离方法(如微量移液、过滤、离心分离等)和消杀方法(如抗生素、抗菌剂处理、紫外线照射等)相结合的方式[13]。这些分离方法可能对细胞造成损伤, 并且分离后的无菌微藻仍可能存在细菌[13]。
近年来, 有关研究营养盐、浮游植物、细菌三者之间的关系越来越多, 有学者采用无菌的微藻和人工添加的单一菌种作为研究对象。虽然用可控的二者进行研究是较好的实验方法, 但与藻菌的实际状态相比, 这种条件下做出的实验结果仍有差异; 而且在分离过程中受到损伤的微藻细胞也可能对实验结果造成一定的影响[13]。此外, 室内培养的藻菌共栖体系因其体系稳定, 种类丰富、营养充足且无外源生物干扰, 被同领域学者认可并广泛使用[11, 14-15]。本实验室前期研究结果表明在藻菌体系中化学作用在无机氮转化方面不显著[15], 但该体系中藻际细菌在无机氮转化方面的作用以及对浮游植物生长的影响仍不清楚。
本文通过室内培养实验, 在不同形态、不同浓度无机氮条件下, 研究藻际细菌可能产生的影响, 以期了解该实验模式中微生物在无机氮转化方面的作用或响应, 为进一步探究该体系中营养盐、浮游植物、细菌三者之间的关系提供依据。
1 材料和方法 1.1 藻种、菌种及培养条件选用海水模式生物三角褐指藻(Phaeodactylum tricornutum)作为实验藻种, 购自中国科学院海藻种质库, 藻种编号MASCC17, 该藻种分离自我国黄海海域, 未经任何无菌处理。细菌为三角褐指藻原有藻际细菌, 并且在本次实验中未添加菌种或对其进行特殊处理。用人工海水[16]和改良f/2培养基[17]培养至对数生长期后饥饿3 d开始接种, 其初始密度为8×104个/mL。该藻种的培养和整个实验过程均按海洋监测规范[18]中生物试验要求在严格无菌条件下进行, 以防止外部细菌的污染。
所有实验组均采用灭菌的人工海水和改良f/2培养基作为培养液, 其中氮源及其浓度设置如表 1所示。低浓度组中单一氮源的浓度依据研究不同无机氮源条件对藻类生长影响的相关文献设置[19]; 低浓度组中硝态氮-铵态氮的浓度设置是模拟近海海水的总无机氮浓度; 其混合比例(4︰1)是根据近海海水中硝态氮和铵态氮一般比例设置[20]。由于低浓度组中单一氮源和混合氮源处理组研究目的不一样, 即单一氮源体系是为了探究实验环境下低氮条件对藻类生长的影响, 而混合氮源体系是为了模拟实际海水环境, 因而其浓度设计不一样。参考实验室前期的研究结果[15], 确定500 μmol/L为本培养条件下最适三角褐指藻生长的氮摩尔浓度(下文称“氮浓度”), 因此将其作为高浓度组的初始氮浓度。每个实验组设三个平行, 所有处理组和空白对照组均以1 000 mL锥形玻璃瓶为培养容器, 置于人工气候箱(BIC-400, 上海博迅)中培养, 温度为(22±1)℃, 培养体积为880 mL, 光照周期为12(L)︰12(D), 光照强度为110 μmol·m–2·s–1, 每天定时摇瓶3~4次, 并随机变换三角瓶的位置。从接种初始日起, 每隔2 d测定一次藻、菌生物量, 同时测定培养液氮浓度以及藻体内氮浓度, 直至氮源耗尽, 共计12 d。
| 培养体系 | 摩尔浓度/(μmol·L–1) | 氮源 | 缩写 | |
| 低浓度组 | 单一硝态氮培养 | 88.2 | NaNO3 | LN |
| 单一铵态氮培养 | 88.2 | NH4Cl | LA | |
| 硝态氮-铵态氮培养 | 40.0 | NaNO3+NH4Cl(1︰1) | LNA(1︰1) | |
| 硝态氮-铵态氮培养 | 40.0 | NaNO3+NH4Cl(4︰1) | LNA(4︰1) | |
| 高浓度组 | 单一硝态氮培养 | 500.0 | NaNO3 | HN |
| 单一铵态氮培养 | NH4Cl | HA | ||
| 硝态氮-铵态氮培养 | NaNO3+NH4Cl(1︰1) | HNA(1︰1) | ||
| 硝态氮-铵态氮培养 | NaNO3+NH4Cl(4︰1) | HNA(4︰1) | ||
| 空白对照组 | 0.0 | - | - | |
三角褐指藻及其藻际细菌的生物量计数采用SYBR Green I(InvitrogenTM, USA)染色, 流式细胞仪(Accuri C6 Plus, BD)计数的方法[21]。
1.3 培养体系中无机氮浓度测定取适量藻液, 先用0.22 μm滤膜过滤, 滤液用于培养液中无机氮浓度的测定。铵态氮和硝态氮的测定方法分别选用《海洋调查规范》的次溴酸钠氧化法和锌镉还原法[22]。
1.4 藻体内氮浓度测定将100 mL藻液过滤(低气压)在孔径0.7 μm的GF/F(Whatman, UK)膜(预先经450 ℃过夜煅烧, 每个样品一个膜, 膜用于测定经分离所得藻细胞的氮含量)上, 然后用去离子水洗3次, 60 ℃烘干30 min后存于–23 ℃待分析, 用元素分析仪(EURO EA3000, Leeman)测定三角褐指藻体内氮含量[23], 为保证数据的准确性, 每个样品至少上机测2次, 保证其误差小于10%。据藻体内氮含量和藻生物量计算藻体内氮浓度(nitrogen concentration in algae, NCA)。为得到所添加氮的质量平衡结果, 即计算实际有多少氮被藻吸收, 因此藻体内氮浓度用每升培养液中三角褐指藻所有细胞内含氮量来表示, 其计算公式如下所示:
| $ {C_{\rm{a}}} = Q \times {\rho _{\rm{a}}} \div M \times {10^3} $ | (1) |
式中, Ca为藻体内氮浓度(μmol/L), Q为三角褐指藻体内氮含量(pg/个), ρa为藻生物量(个/mL), M为氮的摩尔质量(g/mol)。
1.5 细菌的多样性及群落结构分析根据三角褐指藻的生长阶段, 分别取第0、4、8和12 d的藻液。将其过滤在0.22 μm的聚碳酸酯膜(Merck Millipore, DE)上, 用于细菌群落结构的分析。分析方法采用二代高通量测序[15], 测序平台为Illumina HiSeq2500平台(北京诺禾致源科技股份有限公司), 测序区域为16S rDNA V4区。
1.6 数据分析差异分析使用IBM公司SPSS 22软件进行单因素方差分析和独立样本T检验, P < 0.05表示显著性差异。藻、菌生物量相关性分析使用R 3.1.1的“mgcv”包进行广义加性模型(generalized additive models, GAMs)拟合[24]。由于GAMs模型对不同变量之间的相互关系没有限定, 因而适于描述自然环境中复杂的生态关系, 是一种较灵活预测变量之间相关性的有效工具[25]。本文通过对数转换将藻、菌生物量归一化后, 带入GAMs模型, 其公式如下所示:
| $ \log \left( 藻生物量 \right) = \beta + {f_1}\left[ {\log \left( 菌生物量 \right)} \right] + \varepsilon $ | (2) |
式中, β为截距, f1为非参数光滑样条函数, ε为机误差项[24]。我们可以从模型结果中获得P值, P < 0.01表示显著相关。
根据质量守恒定律, 整个实验周期(从第0 d到第12 d)内溶液中无机氮总消耗量(公式3)和藻体内氮元素总增长量(公式4)的计算公式如下所示:
| $ \Delta {M_{\rm{s}}} = \left( {{C_{\rm{p}}} \times {V_{\rm{p}}} - \mathop \sum \limits_{i = 0}^{12} \left( {{C_i} \times {V_i}} \right) - {C_{\rm{r}}} \times {V_{\rm{r}}}} \right) \times M \times {10^3} $ | (3) |
| $ \Delta {M_{\rm{a}}} = \left( {{C_{{\rm{ar}}}} \times {V_{\rm{r}}} + \mathop \sum \limits_{i = 0}^{12} \left( {{C_{{\rm{a}}i}} \times {V_i}} \right) - {C_{{\rm{ap}}}} \times {V_{\rm{p}}}} \right) \times M \times {10^3} $ | (4) |
式中, ΔMs为溶液中无机氮的总消耗量(mg), ΔMa为藻体内氮含量的总增长量(mg); Cp为不同处理组中无机氮的初始浓度(μmol/L), Cap为不同处理组中藻体内氮的初始浓度(μmol/L); Vp为不同处理组中溶液的初始体积(L); Ci为不同处理组中第0、2、4、6、8、10、12 d溶液的无机氮浓度(μmol/L), Cai为不同处理组中第0、2、4、6、8、10、12 d的藻体内氮浓度(μmol/L); Vi为不同处理组中第0、2、4、6、8、10、12 d用于测定藻、菌生物量、溶液中无机氮浓度、藻体内氮浓度和细菌群落结构所需溶液的总体积(L); Cr为不同处理组中无机氮的最终浓度(μmol/L), Car为不同处理组中藻体内氮的最终浓度(μmol/L); Vr为不同处理组中溶液的最终体积(L), M为氮的摩尔质量(g/mol)。
2 结果和讨论 2.1 细菌群落结构分析不同处理组中细菌群落结构随培养时间变化的情况如图 1所示。双歧杆菌(Bifidobacterium)属于放线菌门, 噬甲基菌属(Methylophaga)、埃希氏杆菌属(Escherichia-Shigella)、大洋柄菌属(Oceanicaulis)、海杆菌属(Marinobacter)、琥珀酸弧菌属(Succinivibrio)、海命菌属(Marivita)都属于变形菌门, 韦荣氏球菌属(Veillonella)、Faecalibacterium属于厚壁菌门。由图 1可见, 该培养体系细菌的优势属属于变形菌门, 这与之前研究硅藻藻际环境的优势菌种为变形菌门的结果一致[10, 26]。
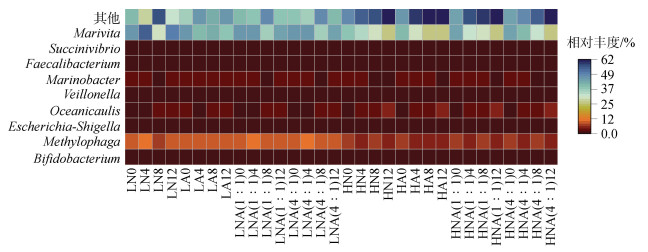 |
| 图 1 不同样品在属水平上的细菌群落结构热图 Fig. 1 Heatmap of bacterial community structures of different samples at the genus level 注: 热度图中的列代表不同样本, LN0、LN4、LN8、LN12分别是LN处理组第0 d、4 d、8 d和12 d的藻液样品; 其他样品缩写词含义依此类推。行代表群落结构, 颜色块代表物种的相对丰度值(由红棕到紫, 相对丰度逐渐升高), 只显示丰度最高的前9个属, 剩余的合并成“其他” |
由图 1结果可知, 同一氮浓度不同氮形态处理组间, 所有细菌相对丰度在各个时间节点上均无显著差异(P > 0.05)。同一形态不同氮浓度未对属于放线菌门、厚壁菌门的细菌以及变形菌门中Escherichia-Shigella、Succinivibrio、Oceanicaulis和Marinobacter属细菌相对丰度产生显著影响(P > 0.05), 但Methylophaga和Marivita属细菌相对丰度存在较大差异(P < 0.05)。具体而言, 单一添加硝态氮的处理组间, Methylophaga属和Marivita属细菌相对丰度高浓度实验组比低浓度组分别减少了约0.6%~5.5%和21%~25%; 单一添加铵态氮的处理组间, Methylophaga属和Marivita属细菌相对丰度高浓度比低浓度组分别减少了约2.6%~4.1%和6.1%~18%; 以1︰1比例混合添加硝态氮和铵态氮的处理组间, Methylophaga属和Marivita属细菌相对丰度高浓度比低浓度组分别减少了约1.4%~5.1%和2%~ 18%; 以4︰1比例混合添加硝态氮和铵态氮的处理组间, Methylophaga属和Marivita属细菌相对丰度高浓度比低浓度组分别减少了约1.9%~5.4%和4%~18%。说明在本实验体系中氮浓度的改变对部分细菌相对丰度的影响较明显, 氮形态的改变对其影响较小。由于低浓度组处于氮限制(即相对于培养液中的其他元素, 氮处于相对不足的状态)状态, 而氮限制可以在一定程度上增强藻类合成胞外聚合物(extracellular polymeric substances, EPS)的能力[27], 许多研究表明EPS可能在很大程度上影响藻际环境微生物的丰度, 进而影响其群落结构[28]。而Methylophaga属中度嗜盐性甲基营养菌[29]和Marivita属[30]细菌均可以参与海洋中含碳、氮或磷的无机和有机化合物的吸收、代谢, 在氮限制状态下, 其可能为藻类提供生长所需的营养, 造成这两种细菌相对丰度发生变化。
在时间尺度上, 所有处理组中属于放线菌门和厚壁菌门的细菌相对丰度均未产生明显变化(P > 0.05), 变形菌门中Escherichia-Shigella和Succinivibrio属细菌相对丰度也未产生明显变化(P > 0.05), 而Methylophaga、Oceanicaulis、Marinobacter和Marivita属细菌相对丰度在高浓度组中均会随时间产生变化(P < 0.05), 即随时间的增加, 高浓度组中Oceanicaulis属相对丰度的平均值从1.6%增加至4.8%, 而Methylophaga、Marinobacter和Marivita属的平均值则分别从7.4%、2.8%和42.0%减少至5.2%、1.6%和26.0%。在低浓度组中未发现明显变化(P > 0.05)。上述现象可能是由于不同种类的细菌对不同氮源的敏感性不同, 藻类对不同氮源的利用方式也不同, 因而形成不同类型的藻菌关系。造成在不同无机氮源条件下, 细菌的相对丰度在时间尺度上的变化程度不同[6]。研究表明, Oceanicaulis属细菌不仅参与合成维生素B族(如B1、B7和B12), 而且在碳限制或寡营养条件下可以有效地吸收水体中的磷元素, 并且它与Ostreopsis cf. ovata藻的生长也密切相关[31]。Marinobacter属细菌也可以产生B12[32]和分泌与铁具有极高亲和性的有机小分子[14], 并且具有可以直接将硝态氮还原为铵态氮, 即硝酸盐异化还原铵(dissimilatory nitrate reduction to ammonium, DNRA)的代谢作用[33], 以供藻类生长利用。段露露等[34]发现当细菌促进藻类生长时, 细菌丰度会发生相应变化; 并且细菌生物量不同, 其对藻类生长的影响也不同。在高浓度处理组中Methylophaga、Oceanicaulis、Marinobacter和Marivita属细菌可能分泌利于藻类生长的物质, 因而其相对丰度随时间发生变化; 由于低浓度处理组细菌的生物量较小, 其可能未对藻类产生影响或影响较小, 因而低浓度组细菌相对丰度未随时间发生明显变化。
2.2 不同培养条件下三角褐指藻及藻际细菌生物量的变化不同处理组中三角褐指藻的藻际细菌生物量随时间的变化如图 2所示。由于培养体系中的细菌为三角褐指藻原有藻际细菌, 其初始数量不易控制, 因此第0 d的细菌在不同处理组中其生物量存在差异。与对照组相比, 高浓度组和低浓度组菌的生物量显著增加(P < 0.05); 其中高浓度组的细菌生物量是对照组的6~10倍, HN、HA、HNA(1︰1)、HNA(4︰1)处理组中细菌的最大生物量分别为1.85×106个/mL、2.61×106个/ mL、2.80×106个/mL和3.38×106个/mL; 低浓度组的细菌生物量是对照组的2~3倍, LN、LA、LNA(1︰1)、LNA(4︰1)处理组中细菌的最大生物量分别为1.17× 106个/mL、1.12×106个/mL、6.52×105个/mL和8.65× 105个/mL。并且, 随着初始添加的无机氮浓度的增加, 细菌生物量的增加幅度也随之升高; 即与对照组相比, 初始添加无机氮浓度为40 μmol/L、88.2 μmol/L和500 μmol/L的培养体系中细菌的生物量分别增加了1.3、2.5和7.2倍。说明培养体系中无机氮浓度可能影响菌的生长状况, 但也可能是三角褐指藻的生长影响细菌生物量的变化。本实验室前期研究发现在同一培养条件下藻菌共培养体系的细菌总生物量显著高于无藻培养体系, 并且细菌的生长均与藻类生长保持一致, 因而在一定程度上, 三角褐指藻分泌的胞外产物影响该培养体系中藻际细菌的生长, 即藻的存在影响细菌的丰度变化[15]。主要原因是所采用的f/2培养基缺乏细菌生长所需的碳源。当外部碳源或缺时, 藻际细菌的生长主要依靠藻类分泌的胞外有机质为碳源[7]。藻、菌丰度相关性分析结果(表 2)也验证了该结论, 即所有处理组和对照组中三角褐指藻的生长与藻际细菌的生长均显著相关, 其相关系数均大于0.6, 说明二者存在较强的正相关。
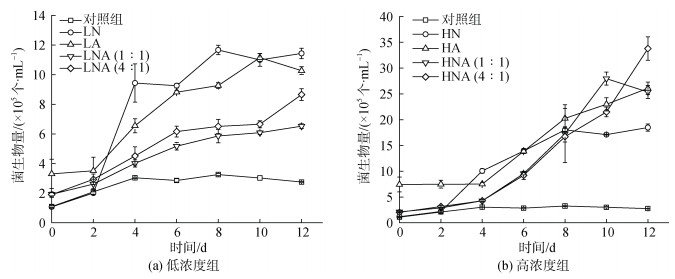 |
| 图 2 不同培养体系中三角褐指藻的藻际细菌生物量变化曲线 Fig. 2 Biomass of bacteria in different culture systems |
| 处理组 | Control | LN | LA | LNA(1︰1) | LNA(4︰1) | HN | HA | HNA(1︰1) | HNA(4︰1) |
| 相关系数 | 0.938** | 0.994** | 0.775** | 0.946** | 0.946** | 0.981** | 0.717** | 0.985** | 0.991** |
| 注: 表中** P < 0.01, 表示三角褐指藻和藻际细菌生物量显著相关 | |||||||||
不同处理组三角褐指藻生物量随时间的变化如图 3所示。与对照组相比, 高、低浓度组的藻细胞密度显著增加(P < 0.05), 其中高浓度组是对照组的18~ 20倍, 低浓度组是对照组的4~5倍; 并且初始添加的无机氮浓度越大, 三角褐指藻达到稳定期时的藻生物量越高, 即初始添加40 μmol/L的培养体系LNA(1︰1)、LNA(4︰1)处理组中, 达到稳定期时的最大密度均为1.48×106个/mL; 添加88.2 μmol/L的LN和LA处理组中藻细胞达到稳定期时的最大生物量分别为1.78×106个/mL和1.90×106个/mL; 添加500 μmol/L的HN、HA、HNA(1︰1)、HNA(4︰1)处理组中藻细胞达到稳定期时的最大生物量分别是6.14×106个/mL、6.29×106个/mL、6.99×106个/mL和6.84×106个/mL。说明在其他条件一致的情况下, 氮元素浓度是促进三角褐指藻生长的主要因素。但是随着时间的增加, 培养体系中无机氮浓度耗尽后, 藻细胞密度仍然维持在一个相对恒定的范围, 这可能是藻细胞利用存储在体内的氮元素进行生长繁殖[35]; 已有研究表明变形菌门的部分细菌可以分泌铵态氮, 为藻类的生长提供氮源[36], 当细菌促进藻类生长时, 细菌生物量会发生相应变化[34]。并且, 本实验体系中藻菌生物量存在显著正相关关系(表 2), 因此, 体系中菌的存在也可能是促进三角褐指藻生长的因素之一。图 1显示Methylophaga属和Marinobacter属菌随时间发生相对丰度变化, 有研究显示Methylop- haga属细菌可以分解环境中的甲胺形成铵态氮[37], 而Marinobacter属菌种则可以将环境中的硝态氮还原为铵态氮[38], 以供藻类利用。
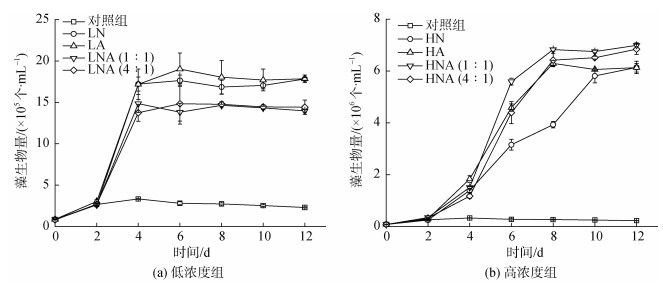 |
| 图 3 不同培养体系中三角褐指藻生物量变化曲线 Fig. 3 Biomass of Phaeodactylum tricornutum in different culture systems |
在海洋环境中, 浮游植物的氮源主要包括人为污染和微生物代谢作用。人为污染主要包括人类过量施肥使氮元素通过河流进入海洋, 其每年输入量可达5.7 Tmol[3]; 而微生物代谢主要包括固氮过程、矿化作用、硝化作用及DNRA等过程。环境中不同形态的氮源进入海洋微藻细胞内先被还原为铵态氮, 而后被谷氨酰胺合成酶和谷氨酸合成酶同化生成氨基酸, 进而合成蛋白质和核酸等物质[39]。本文根据上述理论和质量平衡定律, 研究了外部氮浓度和三角褐指藻体内氮浓度的关系, 其变化趋势如图 4所示。根据Fukuda等[40]测定的海洋细菌体内氮含量为5.8 fg/个可知, 在本实验体系中, 细菌的最大生物量为1.4 μmol/L(以N计); 由图 4可知, 细菌的生物量(以N计)远小于三角褐指藻, 其在计算所添加氮的质量平衡结果中可忽略。因而, 在整个实验周期内, 溶液中无机氮的总消耗量和藻体内氮的总增长量如表 3所示。
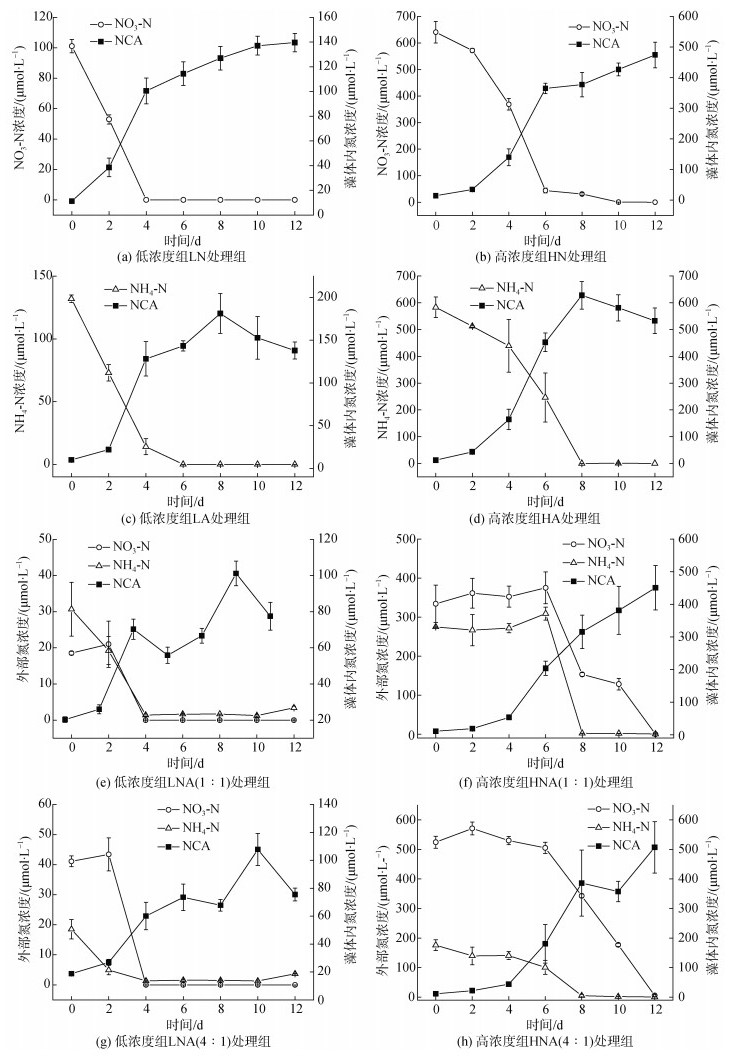 |
| 图 4 不同培养体系中外部氮浓度和藻体内氮摩尔浓度变化 Fig. 4 Variations in the concentration of nitrogen in solution and Phaeodactylum tricornutum in different culture systems |
| 处理组 | LN | LA | LNA(1︰1) | LNA(4︰1) | HN | HA | HNA(1︰1) | HNA(4︰1) |
| 无机氮消耗量/mg | 2.18±0.09 | 2.96±0.06 | 0.98±0.17 | 1.18±0.10 | 12.5±0.83 | 12.10±0.74 | 9.22±0.95 | 10.54±0.86 |
| 藻体内氮增长量/mg | 2.52±0.09 | 2.92±0.20 | 1.14±0.11 | 1.19±0.04 | 8.35±0.51 | 11.18±0.77 | 7.32±0.90 | 8.00±0.90 |
| 藻体内氮增长量/ 无机氮消耗量 | 1.16±0.08* | 0.99±0.07 | 1.20±0.20 | 1.01±0.10 | 0.67±0.07* | 0.93±0.08 | 0.80±0.15* | 0.76±0.08* |
| 注: 表中无机氮消耗量和藻体内氮增长量是以整个实验周期计算, 具体计算方法详见1.6。表中* P < 0.05, 表示无机氮消耗量和藻体内氮增长量差异显著。 | ||||||||
从表 3可知, LA、LNA(1︰1)、LNA(4︰1)、HA处理组中溶液无机氮的总消耗量和藻体内氮的总增长量之间均不存在显著差异(P > 0.05), 说明培养体系中消耗的无机氮大部分进入三角褐指藻体内。HN、HNA(1︰1)、HNA(4︰1)处理组中藻体内氮的总增长量和溶液无机氮的总消耗量之间均存在显著差异(P < 0.05), 且二者的比值均小于1, 说明实验初期添加的外部无机氮大部分被三角褐指藻和其藻际细菌吸收。LN处理组藻体内氮的总增长量和溶液无机氮的总消耗量之间也存在显著差异(P < 0.05), 且二者的比值大于1, 说明虽然促进三角褐指藻生长的氮源主要来自实验初期外部无机氮的添加, 但是具有将环境中的硝态氮还原为铵态氮的细菌, 也可能为藻类生长提供氮源。
通过比较高、低浓度组溶液中氮的变化趋势, 即将图 4中的a、c、e、g分别与b、d、f、h进行对比, 可以发现在无机氮浓度快速消耗的同时藻体内氮浓度迅速增长, 并且藻生物量也迅速增加, 表明三角褐指藻主要依赖于培养体系中的无机氮源进行生长繁殖。此外, 硝态氮作为唯一氮源时比铵态氮作为唯一氮源时其快速消耗所用时间更短; 当两种氮源同时存在时, 硝态氮的消耗均出现了不同程度的延迟, 即与低浓度组相比, 高浓度组硝态氮由第2 d延迟至第6 d才开始消耗。有研究表明铵态氮由于同化作用所需能量少而更易被藻类优先利用, 但是由于硝态氮具有较高的硅藻群落生物被膜渗透率及受相关还原酶活性的影响, 其更易利用硝态氮[41], 而铵态氮对硝态氮吸收的抑制易受氮、光的可利用率以及物种组成等环境条件影响[42]。
不同处理组的外部氮消耗率和三角褐指藻藻体内氮增长率随时间的变化如图 5所示。由图 5可知, 不同培养体系中外部氮消耗率和微藻体内的氮增长率均在0~100%范围内变动。但是, 低浓度组的混合氮源培养体系在第12 d其氮消耗率为负值, 培养体系中存在2.8~3.8 μmol/L的铵态氮, 而同时这两个处理组中藻体内氮的增长率也为负值。这可能是死亡的微藻细胞释放微量的铵态氮, 进而使藻体内氮浓度降低造成的结果。统计结果表明除了LN和LA处理组的外部氮消耗率和微藻体内的氮增长率之间差异显著之外(P < 0.05), 其余处理组二者之间的差异均不显著(P > 0.05); 由于LN和LA处理组中外部氮消耗率在6 d之后均是0或100%, 有效数据较少, 可能造成其与藻体内氮增长率间存在显著差异。总体而言, 高、低浓度组的外部氮消耗率和藻体内氮的增长率均近似相等, 即培养体系中消耗的无机氮基本全部进入三角褐指藻体内, 进一步说明促进三角褐指藻生长的氮源主要来自实验初期外部无机氮的添加。
 |
| 图 5 不同培养体系中外部氮消耗率和藻体内氮增长率的变化 Fig. 5 Changes of external nitrogen consumption rate and internal nitrogen growth rate of Phaeodactylum tricornutum in different culture systems |
综上所述, 三角褐指藻的藻际细菌可能对三角褐指藻的生长过程影响较小。研究证明细菌生物量不同, 其对藻类生长的影响也不同[34]。并且, 在本实验体系中, 细菌的生物量(最大生物量为1.40 μmol/L, 以N计)小于三角褐指藻的生物量(最大生物量为532.7 μmol/L, 以N计), 其对氮的需求和转化较小, 因而其对藻类生长、营养盐利用影响较小。
3 结论实验结果表明, 在无机氮高浓度组Methylophaga属细菌相对丰度比低浓度组有所减少, Methylophaga属和Marinobacter属细菌相对丰度在高浓度组均会随时间降低。
本实验培养体系的条件下, 因藻际细菌生物量较低, 整体对不同形态无机氮的转化能力较弱, 其对三角褐指藻不同形态无机氮吸收利用影响较小, 促进三角褐指藻生长的氮源主要来自外部无机氮的添加。
| [1] |
CASCIOTTI K L. Nitrogen and oxygen isotopic studies of the marine nitrogen cycle[J]. Annual Review of Marine Science, 2016, 8: 379-407. DOI:10.1146/annurev-marine-010213-135052 |
| [2] |
STÜEKEN E E, KIPP M A, KOEHLER M C, et al. The evolution of Earth's biogeochemical nitrogen cycle[J]. Earth-Science Reviews, 2016, 160: 220-239. DOI:10.1016/j.earscirev.2016.07.007 |
| [3] |
RAVEN J A, HANDLEY L L, ANDREWS M. Global aspects of C/N interactions determining plant-environment interactions[J]. Journal of Experimental Botany, 2004, 55(394): 11-25. |
| [4] |
ROGATO A, AMATO A, IUDICONE D, et al. The diatom molecular toolkit to handle nitrogen uptake[J]. Marine Genomics, 2015, 24(1): 95-108. |
| [5] |
蔡小龙, 罗剑飞, 林炜铁, 等. 珠三角养殖水体中参与氮循环的微生物群落结构[J]. 微生物学报, 2012, 52(5): 645-653. CAI Xiaolong, LUO Jianfei, LIN Weitie, et al. Microbial community in nitrogen cycle of aquaculture water of the Pearl River Delta[J]. Acta Microbiologica Sinica, 2012, 52(5): 645-653. |
| [6] |
SEYMOUR J R, AMIN S A, RAINA J B, et al. Zooming in on the phycosphere: the ecological interface for phytoplankton-bacteria relationships[J]. Nature Microbiology, 2017, 2: 17065. DOI:10.1038/nmicrobiol.2017.65 |
| [7] |
BEHRINGER G, OCHSENKÜHN M A, CONG F, et al. Bacterial communities of diatoms display strong conservation across strains and time[J]. Frontiers in Microbiology, 2018, 9: 659. DOI:10.3389/fmicb.2018.00659 |
| [8] |
张艳敏, 王江涛, 谭丽菊. 海水中藻菌共培养体系对碳氮磷的吸收转化[J]. 生态学报, 2017, 37(14): 4843-4851. ZHANG Yanmin, WANG Jiangtao, TAN Liju. Uptake and transformation of carbon, nitrogen and phosphorus in the co-culture system of algae and bacteria in seawater[J]. Acta Ecologica Sinica, 2017, 37(14): 4843-4851. |
| [9] |
VAN TOL H M, AMIN S A, ARMBRUST E V. Ubiquitous marine bacterium inhibits diatom cell division[J]. ISME Journal, 2017, 11(1): 31-42. DOI:10.1038/ismej.2016.112 |
| [10] |
COOPER M B, SMITH A G. Exploring mutualistic interactions between microalgae and bacteria in the omics age[J]. Current Opinion in Plant Biology, 2015, 26: 147-153. DOI:10.1016/j.pbi.2015.07.003 |
| [11] |
AMIN S A, HMELO L R, VAN TOL H M, et al. Interaction and signaling between a cosmopolitan phytoplankton and associated bacteria[J]. Nature, 2015, 522: 98-101. DOI:10.1038/nature14488 |
| [12] |
MARKOU G, VANDAMME D, MUYLAERT K. Microalgal and cyanobacterial cultivation: The supply of nutrients[J]. Water Research, 2014, 65: 186-202. DOI:10.1016/j.watres.2014.07.025 |
| [13] |
VU C H T, LEE H G, CHANG Y K, et al. Axenic cultures for microalgal biotechnology: Establishment, assessment, maintenance, and applications[J]. Biotechnology Advances, 2018, 36: 380-396. DOI:10.1016/j.biotechadv.2017.12.018 |
| [14] |
AMIN S A, GREEN D H, HART M C, et al. Photolysis of iron-siderophore chelates promotes bacterial-algal mutualism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(40): 17071-17076. DOI:10.1073/pnas.0905512106 |
| [15] |
SHI F, WEI X X, FENG J F, et al. Variation of bacterial community associated with Phaeodactylum tricornutum in response to different inorganic nitrogen concentrations[J]. Acta Oceanologica Sinica, 2018, 37(12): 118-128. DOI:10.1007/s13131-018-1272-7 |
| [16] |
GUILLARD R R L. Culture of phytoplankton for feeding marine invertebrates[M]. United States of America: Springer US, 1975: 29-60.
|
| [17] |
GUILLARD R R, RYTHER J H. Studies of marine planktonic diatoms. Ⅰ. Cyclotella nana Hustedt and Detonula confervacea Cleve[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. DOI:10.1139/m62-029 |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋监测规范: 第7部分: GB 17378.7-2007[S]. 北京: 中国标准出版社出版, 2007: 34. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, National Standardization Administration of China. The specification for marine monitoring: Part 7: GB 17378.7-2007[S]. Beijing: Published by China Standards Press, 2007: 34. |
| [19] |
蔡卓平, 段舜山. 不同氮浓度下三角褐指藻生长特性和化学组成(英文)[J]. 生态环境, 2007, 16(6): 1633-1636. CAI Zuoping, DUAN Shunshan. Growth characteristics and chemical compositions of Phaeodactylum tricornutum under different nitrogen concentrations[J]. Ecology and Environmental Sciences, 2007, 16(6): 1633-1636. DOI:10.3969/j.issn.1674-5906.2007.06.010 |
| [20] |
暨卫东. 中国近海海洋环境质量现状与背景值研究[M]. 北京: 海洋出版社, 2011: 17-20, 223. JI Weidong. Research on the current status and background value of China's offshore marine environmental quality[M]. Beijing: Ocean Press, 2011: 17-20, 223. |
| [21] |
MARIE D, PARTENSKY F, JACQUET S, et al. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green Ⅰ[J]. Applied and Environmental Microbiology, 1997, 63(1): 186-193. DOI:10.1128/aem.63.1.186-193.1997 |
| [22] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋调查规范: 第4部分: GB 12763.4-2007[S]. 北京: 中国标准出版社出版, 2007: 111, 117. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, National Standardization Administration of China. Specifications for oceanographic survey: Part 4: GB 12763.4-2007[S]. Beijing: Published by China Standards Press, 2007: 111, 117. |
| [23] |
格拉斯霍夫. 海水分析方法[M]. 陆贤昆, 译. 北京: 科学出版社, 1982: 166-169. GRASSHOFF K. Seawater analysis methods[M]. LU Xiankun, Translation. Beijing: Science Press, 1982: 166-169. |
| [24] |
QIAO Y H, FENG J F, CUI S F, et al. Long-term changes in nutrients, chlorophyll a and their relationships in a semi-enclosed eutrophic ecosystem, Bohai Bay, China[J]. Marine Pollution Bulletin, 2017, 117(1/2): 222-228. |
| [25] |
WOOD S N. Generalized additive models: an introduction with R[M]. United States of America: CRC Press, 2010: 360-361.
|
| [26] |
GROSSART H P, LEVOLD F, ALLGAIER M, et al. Marine diatom species harbour distinct bacterial communities[J]. Environmental Microbiology, 2005, 7(6): 860-873. DOI:10.1111/j.1462-2920.2005.00759.x |
| [27] |
PHILIPPIS R, MARGHERI M C, PELOSI E, et al. Exopolysaccharide production by a unicellular cyanobacterium isolated from a hypersaline habitat[J]. Journal of Applied Phycology, 1993, 5(4): 387-394. DOI:10.1007/BF02182731 |
| [28] |
张圣洁, 蔡中华, 朱伟胜, 等. 藻际环境中胞外聚合物的研究进展[J]. 微生物学报, 2020, 60(8): 1521-1533. ZHANG Shengjie, CAI Zhonghua, ZHU Weisheng, et al. Advances in extracellular polymeric substances in phycosphere environment[J]. Acta Microbiologica Sinica, 2020, 60(8): 1521-1533. |
| [29] |
DENG Y C, GUI Q, DUMONT M, et al. Methylococcaceae are the dominant active aerobic methanotrophs in a Chinese tidal marsh[J]. Environmental Science and Pollution Research, 2019, 26: 636-646. DOI:10.1007/s11356-018-3560-3 |
| [30] |
ZHENG Q, LU J Y, WANG Y, et al. Genomic reconstructions and potential metabolic strategies of generalist and specialist heterotrophic bacteria associated with an estuary Synechococcus culture[J]. FEMS microbiology Ecology, 2019, 95(3): fiz017. |
| [31] |
GUIDI F, PEZZOLESI L, VANUCCI S. Microbial dynamics during harmful dinoflagellate Ostreopsis cf. ovata growth: Bacterial succession and viral abundance pattern[J]. Microbiology Open, 2018, 7(4): e584. |
| [32] |
KUO R C, LIN S J. Ectobiotic and endobiotic bacteria associated with Eutreptiella sp. Isolated from Long Island Sound[J]. Protist, 2013, 164(1): 60-74. DOI:10.1016/j.protis.2012.08.004 |
| [33] |
PODDAR N, SEN R, MARTIN G J O. Glycerol and nitrate utilisation by marine microalgae Nannochloropsis salina and Chlorella sp and associated bacteria during mixotrophic and heterotrophic growth[J]. Algal Research, 2018, 33: 298-309. DOI:10.1016/j.algal.2018.06.002 |
| [34] |
段露露, 程蔚兰, 张靖洁, 等. 共生菌促进斜生栅藻生长和油脂合成[J]. 应用生态学报, 2020, 31(2): 625-633. DUAN Lulu, CHENG Weilan, ZHANG Jingjie, et al. Symbiotic bacteria facilitate algal growth and oil biosynthesis in Scenedesmus obliquus[J]. Chinese Journal of Applied Ecology, 2020, 31(2): 625-633. |
| [35] |
OLOFSSON M, ROBERTSON E K, EDLER L, et al. Nitrate and ammonium fluxes to diatoms and dinoflagellates at a single cell level in mixed field communities in the sea[J]. Scientific Reports, 2019, 9: 1424. DOI:10.1038/s41598-018-38059-4 |
| [36] |
CIRRI E, POHNERT G. Algae-bacteria interactions that balance the planktonic microbiome[J]. New Phytologist, 2019, 223: 100-106. DOI:10.1111/nph.15765 |
| [37] |
SULEIMAN M, ZECHER K, YUECEL O, et al. Interkingdom cross-feeding of ammonium from marine methylamine-degrading bacteria to the diatom Phaeodactylum tricornutum[J]. Applied and Environmental Microbiology, 2016, 82(24): 7113-7122. DOI:10.1128/AEM.01642-16 |
| [38] |
VAIDYA B, KUMAR R, KORPOLE S, et al. Marinobacter nitratireducens sp. nov., a halophilic and lipolytic bacterium isolated from coastal surface sea water[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65: 2056-2063. DOI:10.1099/ijs.0.000218 |
| [39] |
ALIPANAH L, ROHLOFF J, WINGE P, et al. Whole-cell response to nitrogen deprivation in the diatom Phaeodactylum tricornutum[J]. Journal of Experimental Botany, 2015, 66(20): 6281-6296. DOI:10.1093/jxb/erv340 |
| [40] |
FUKUDA R, OGAWA H, NAGATA T, et al. Direct determination of carbon and nitrogen contents of natural bacterial assemblages in marine environments[J]. Applied and Environmental Microbiology, 1998, 64(9): 3352-3358. DOI:10.1128/AEM.64.9.3352-3358.1998 |
| [41] |
LV X N, WU Z X, SONG X X, et al. Nutritional strategy for the preferential uptake of NO3--N by Phaeocystis globose[J]. Hydrobiologia, 2019, 846: 109-122. DOI:10.1007/s10750-019-04055-6 |
| [42] |
DORTCH Q. The interaction between ammonium and nitrate uptake in phytoplankton[J]. Marine Ecology Progress Series, 1990, 61: 183-201. DOI:10.3354/meps061183 |
 2022, Vol. 46
2022, Vol. 46


