
文章信息
- 徐凯, 刘鑫玟, 覃昊, 张珍珍, 阎斌伦, 高焕, 胡广伟. 2022.
- XU Kai, LIU Xin-wen, QIN Hao, ZHANG Zhen-zhen, YAN Bin-lun, GAO Huan, HU Guang-wei. 2022.
- 脊尾白虾抗菌肽Crustin基因的克隆、表达与功能研究
- Cloning, expression, and functional analyses of Crustin in Exopalaemon carinicauda
- 海洋科学, 46(1): 140-147
- Marine Sciences, 46(1): 140-147.
- http://dx.doi.org/10.11759/hykx20210721002
-
文章历史
- 收稿日期:2021-07-21
- 修回日期:2021-09-16
2. 江苏海洋大学 江苏省海洋生物产业技术协同创新中心, 江苏 连云港 222005
2. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Jiangsu Ocean University, Lianyungang 222005, China
近年来我国水产养殖产业一直处于稳步发展态势, 尤其是进入21世纪后, 中国坚持以养为主的发展方针, 有力地促进了中国水产养殖产业朝着多品种、多模式、工厂化和集约化方向发展, 确定了世界第一水产养殖大国的地位。但是随着养殖规模的不断扩大, 水产动物病害频发成为制约水产养殖产业绿色健康发展的主要因素之一。抗生素类药物的使用是目前水产动物病害防治的有效途径, 但是长期过量使用抗生素类药物会导致病原微生物产生抗药性, 严重影响水产养殖业的绿色健康可持续发展, 此外, 药物残留还可能威胁人类健康。抗菌肽(antimicrobial peptides, AMPs)是一类自然界中普遍存在且具有广谱抗菌活性的小分子多肽[1]。作为生物体自身免疫系统的重要组成部分, 抗菌肽具有热稳定性高, 分子量小, 抗菌广谱等特点, 对多数病原菌和寄生虫等均表现出较好杀伤或抑制效果[2-3], 被誉为“天然抗生素”, 有望成为抗生素的天然替代品。
世界上第一个抗菌肽——天蚕素是由瑞典科学家在使用大肠杆菌感染惜古比天蚕蛾(Hyalophora cecropia)时分离获得[4], 目前已从水产动物中分离得到多种多样的抗菌肽[5]。在甲壳动物中分离得到的抗菌肽主要有3种, 分别为抗脂多糖因子(anti-lipopolysaccharide factors, ALFs)、对虾素(Penaeidins)和甲壳素(Crustins)[6]。Crustin是抗菌肽家族的重要成员, 作为一种阳离子抗菌肽, Crustin具有抗菌、抑制蛋白酶、促进伤口愈合等多种功能。目前已经报道的Crustin主要有5种类型, 分别为Crustin Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ型[7], 其区别主要在于氨基酸序列的组成不同。在甲壳动物中常见的主要是Ⅰ、Ⅱ、Ⅲ、Ⅳ型Crustin。Ⅰ型Crustin在鳌虾和蟹类中均有报道, 抑菌实验显示, Ⅰ型Crustin对金黄色葡萄球菌(Staphylococcus aureus)、芽孢杆菌和副溶血弧菌(Vibrio parahaemolyticus)等均具有一定的抑制作用[8-12]。Ⅱ型Crustin主要从对虾中分离得到, 对副溶血性弧菌和对虾白斑综合征病毒(white spot syndromevirus, WSSV)均表现出较好的抑制作用[13], Ⅲ型Crustin对白班综合征病毒具有明显的抑制作用[14], Ⅳ型Crustin的抗菌活性目前还未见报道[15]。
脊尾白虾(Exopalaemon carinicauda)隶属十足目(Decapoda)、长臂虾科(Palaemonidae)、白虾属(Palaemon), 是我国特有的3种经济虾类之一, 养殖规模呈逐年上升的趋势[16-17]。此外, 因脊尾白虾躯体透明、生长快速、繁殖周期短、适应性强等特点使其成为甲壳类研究的潜在模式生物[18]。本研究在前期脊尾白虾转录组基础上, 克隆了一个脊尾白虾Crustin基因的完整编码序列(coding sequence, CDS)序列, 命名为EcCrustin1, 并对其编码的蛋白结构和进化关系进行了分析, 在此基础上分析了EcCrustin1在脊尾白虾不同组织及副溶血弧菌刺激后的表达情况, 最后利用基因工程手段构建了EcCrustin1的原核表达载体, 体外表达获得了目的蛋白, 以期为进一步研究EcCrustin1的作用机理及其在甲壳类中的功能提供基础。
1 材料与方法 1.1 实验材料实验用脊尾白虾来自连云港市佳信水产有限公司, 平均体长(5.35±0.26) cm, 体重(1.60±0.28) g, 实验开始前将其暂养7 d, 暂养期间持续充氧, 每天换水1/3到1/2, 使氨氮控制在0.05 mg·L–1以下, 温度控制在25~30 ℃, 盐度保持在24~26, pH在7.0~8.0之间。
取样时将脊尾白虾置于冰上, 吸干残留水分后用一次性注射器于脊尾白虾围心腔插入, 小心抽取血淋巴组织, 离心收集沉淀, 加入适量Trizol试剂, 混匀后于–80 ℃箱中保存备用。采集血淋巴组织后将虾壳分离, 迅速分离脊尾白虾胃、鳃、肠道、肌肉及肝胰腺组织, 加入Trizol试剂, 匀浆后于–80 ℃冰箱中保存备用。
1.2 实验方法 1.2.1 RNA提取及cDNA第一链的合成总RNA提取方法参照RNA提取试剂盒说明书进行(Total RNA Extractor, 上海生工), 提取后利用Nanodrop 2000检测RNA浓度, 使用琼脂糖凝胶电泳检测RNA完整性。RNA样品检测合格后按照反转录试剂盒(HiScriptⅢ RT SuperMix for qPCR, Vazyme)说明书进行反转录合成cDNA, 于–20 ℃冰箱保存备用。
1.2.2 目的基因克隆与测序根据实验室前期获得的脊尾白虾转录组数据, 使用Primer Premier 6.0软件设计目的基因引物, 分别命名为Cru-F1和Cru-R1(具体信息见表 1), 引物由上海生工生物工程有限公司合成。以脊尾白虾cDNA为模板进行PCR, 扩增获得目的基因CDS序列, 电泳检测后利用胶回收试剂盒(FastPure Gel DNA Extraction Mini kit, Vazyme)回收纯化靶基因片段, 纯化回收的目的PCR产物与载体连接后转化到大肠杆菌中, 挑取阳性克隆, 送上海生工生物工程有限公司测序。
| 名称 | 引物序列(5′→3′) | 用途 |
| Cru-F1 | AGACAGTTCTCAAACACCATC | cDNA序列扩增 |
| Cru-R1 | AACGCAACAGAATTACACGG | |
| Cru-F2 | TCAAACACCATCATGCAACGC | 荧光定量PCR |
| Cru-R2 | CAACCGGGAACAATACCACCT | |
| 18S-F | TATACGCTAGTGGAGCTGGAA | 内参基因引物 |
| 18S-R | GGGGAGGTAGTGACGAAAAAT | |
| Cru-F3 | GAATTCAGACAGTTCTCAAACACCATC | CDS扩增 |
| Cru-R3 | CTCGAGCTCAGAAGAAGAAGACGTTG | |
| 注: 下划线表示酶切位点 | ||
以脊尾白虾不同组织cDNA为模板进行荧光定量PCR反应, 荧光定量PCR反应按照试剂盒(SYBR Premix Ex TaqTMⅡ)说明书进行, 使用ABI 7500实时荧光定量PCR仪进行脊尾白虾目的基因表达定量分析, 以18S rRNA为内参基因[19]。目的基因与内参基因定量引物见表 1。扩增程序: 95 ℃预变性3 min; 95 ℃ 15 s, 60 ℃ 30 s, 进行40个循环。利用2–ΔΔCt法计算目的基因在脊尾白虾各组织中的相对表达量。
1.2.4 副溶血弧菌刺激后靶基因的表达分析将脊尾白虾分成2组, 对照组和实验组(副溶血弧菌刺激), 实验前将副溶血弧菌活化, 活化后测定浓度3.6×108 CFU/mL, 按10 μL/只于第2节腹肢肌肉注射, 注射后分别在0、3、6、12、48、72 h(每组每个时间点随机取3只)采集血淋巴组织并提取RNA, 反转录为cDNA后进行荧光定量PCR, 分析副溶血弧菌刺激后目的基因的表达情况。
1.2.5 原核表达载体构建及目的蛋白纯化设计含有酶切位点(EcoRⅠ/XhoⅠ)的引物, 分别命名为Cru-F3和Cru-R3, 具体信息见表 1, 以脊尾白虾cDNA为模板进行PCR, 扩增目的基因的完整CDS序列, 扩增产物经胶回收纯化后利用限制性内切酶进行双酶切, 酶切产物纯化后与表达载体pET- 32a连接, 获得重组质粒pET-32a-Crustin, 将重组质粒转化至大肠杆菌BL21(DE3)中表达, 挑取阳性克隆, 测序验证后扩大培养, 37 ℃条件下异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)诱导表达, 培养4 h后, 采用离心方法收取细菌, 开展SDS-PAGE与western blot分析。
1.2.6 生物信息学分析利用DNAMan软件对基因序列和氨基酸序列进行预测分析, 包括氨基酸组成、蛋白质分子量、理论等电点。利用软件MEGA 6.0对氨基酸序列进行同源比对, 利用邻接法(neighbor-joining method, NJ)构建系统进化树。同源序列在NCBI数据库检索获得。利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽结构预测, 蛋白质结构域预测利用SMART(http://smart.emblheidelverg.de/smart/set_mode.cgi)进行。
2 结果 2.1 序列分析从脊尾白虾转录组数据库中克隆得到1条Crustin基因序列, 将其命名为EcCrustin1。克隆测序结果显示EcCrustin1基因序列长度为740 bp, 开放阅读框(ORF)长度为477 bp, 编码158个氨基酸, 所编码氨基酸序列分子量为16 kDa, 理论等电点为7.8。编码蛋白具有Crustins家族的典型结构特征, 包括N-端的信号肽序列和C-端的乳清酸蛋白(whey acidic protein, WAP)结构域(图 1), EcCrustin1成熟肽含有12个保守的半胱氨酸, 其中8个在WAP结构域中。
 |
| 图 1 脊尾白虾EcCrustin1序列分析 Fig. 1 Sequence analysis of EcCrustin1 注: EcCrustin1基因序列及其编码的氨基酸序列, 单下划线表示信号肽序列, 双下划线表示甘氨酸富集区(GRR), 方框表示半胱氨酸富集区(CRR), WAP结构域用灰色背景标出, 12个保守半胱氨酸用红色字体表示, 星号表示终止密码子, 加尾信号用斜体字母表示。 |
在NCBI网站(https://www.ncbi.nlm.nih.gov/)上用BLAST对比分析EcCrustin1基因, 选出与脊尾白虾基因序列相似性较高的Crustin氨基酸序列, 然后用DNAMan 6.0进行多重序列比对, 结果如图 2所示, 脊尾白虾EcCrustin1氨基酸序列与Penaeus brasiliensis氨基酸序列同源性最高, 为24.54%, 与Penaeus paulensis氨基酸序列、Penaeus vannamei氨基酸序列、Macrobrachium nipponense氨基酸序列、Penaeus subtilis氨基酸序列的同源性分别为22.69%、22.22%、21.76%和20.83%。系统进化树分析结果如图 3所示, 脊尾白虾EcCrustin1与拟穴青蟹(Scylla paramamosain)亲缘关系最近, 单独聚为一支, 其他物种的Crustin聚为另一大支。
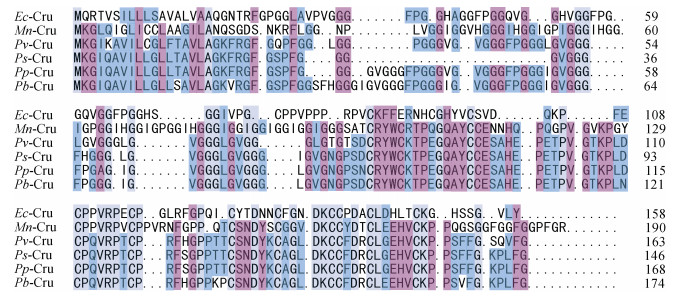 |
| 图 2 EcCrutin1氨基酸序列与其他甲壳动物同型Crustin的序列比对 Fig. 2 Multiple amino acid sequence alignments of EcCrutin1 with the same type of Crustins from other crustaceans 注: Ec: Exopalaemon carinicauda; Mn: Macrobrachium nipponense; Pv: Penaeus vannamei; Ps: Penaeus subtilis; Pp: Penaeus paulensis; Pb: Penaeus brasiliensis |
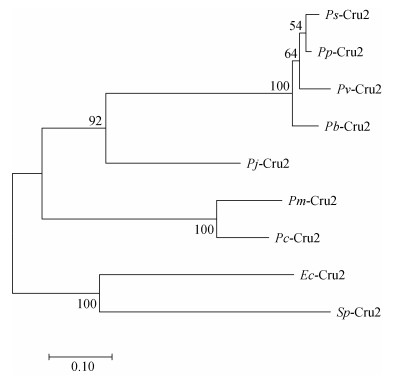 |
| 图 3 基于EcCrustin1氨基酸序列构建的系统进化树 Fig. 3 Phylogenetic tree analysis based on EcCrustin1 amino acid sequence 注: Ps: Penaeus subtilis; Pp: Penaeus paulensis; Pv: Penaeus vannamei; Pj: Panulirus japonicas; Pb: Penaeus brasiliensis; Sp: Scylla paramamosain; Pc: Penaeus chinensis; Pm: Penaeus monodon; Ec: Exopalaemon carinicauda |
以18S rRNA为内参基因, 利用实时定量荧光PCR方法分析了EcCrustin1基因在脊尾白虾胃、血淋巴、鳃、肠、肌肉和肝胰腺中表达情况, 结果如图 4所示, 尾白虾EcCrustin1基因在上述6种组织中都有表达, 但相对表达水平存在差异, 其中EcCrustin1基因在血淋巴中表达量最高且与其他组相比差异显著(P < 0.05), 在肌肉组织中表达量最低。
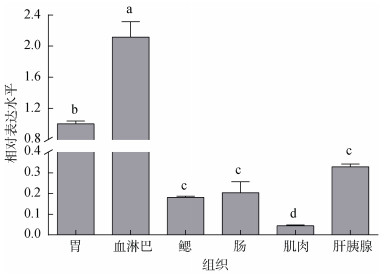 |
| 图 4 EcCrustin1在不同组织中的表达情况 Fig. 4 Expression profile of EcCrustin1 in different tissues 注: 不同小写字母表示EcCrustin1的表达量在不同组织中差异显著(P < 0.05) |
为研究脊尾白虾中EcCrustin1基因对致病菌的应答情况, 本研究利用副溶血弧菌刺激脊尾白虾, 刺激后于不同时间点检测血淋巴中靶基因的表达情况, 结果如图 5所示, 副溶血弧菌刺激后EcCrustin1的表达量显著上调(P < 0.05), 在刺激后6 h达到峰值, 48 h后回落至对照组水平。
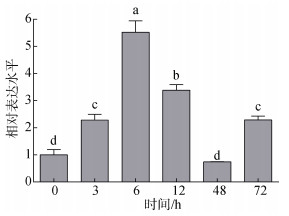 |
| 图 5 副溶血弧菌刺激后EcCrustin1在血淋巴中的表达情况 Fig. 5 Expression patterns of EcCrustin1 in hemolymph after Vibrio parahemolyticus challenges 注: 不同小写字母表示EcCrustin1表达量差异显著(P < 0.05) |
利用1.2.5中描述方法成功构建了脊尾白虾EcCrustin1的原核表达系统, 通过菌落PCR和测序验证了重组质粒的正确性。在此基础上对重组质粒进行诱导表达, 结果如图 6所示, IPTG终浓度为0.5 mM, 37 ℃培养4 h后得到一条18 kDa的条带, western blot结果显示为目的蛋白。可溶性分析结果显示目的蛋白不可溶, 以包涵体形式存在, 进一步放大纯化, 复性后得到目的蛋白。对目的蛋白进行体外抑菌活性实验, 发现目的蛋白对大肠杆菌、金黄色葡萄球菌和副溶血弧菌无明显的抑菌效果。
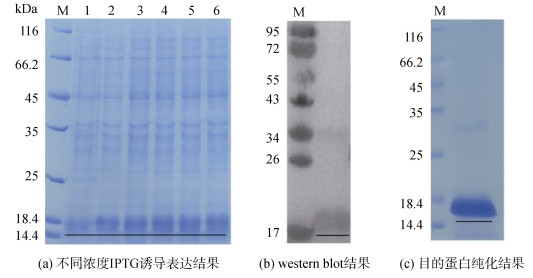 |
| 图 6 蛋白体外诱导表达与纯化结果 Fig. 6 Expression and purification of the protein 注: M为蛋白marker, 1为未加IPTG, 2~6加入不同浓度IPTG, 下划线表示目的蛋白条带 |
甲壳素是甲壳动物抗菌肽家族的重要成员之一, 在机体抵抗病原入侵的免疫应答中发挥重要作用, 典型的甲壳素一般都包含3个功能域, 分别为N-端的信号肽序列, 中间的多域区(multi-domain region)和C-端的WAP结构域[7], 根据多域区中氨基酸组成的不同又进一步将甲壳动物中的Crustin分为4种类型, 即CrustinⅠ、Ⅱ、Ⅲ、Ⅳ型。其中, Ⅰ型Crustin的多域区主要由半胱氨酸富集区(CRR)构成[20]; Ⅱ型Crustin的多域区除了含有CRR还含有一段甘氨酸富集区(GRR), 根据GRR长度的不同, 又可进一步将其分为Ⅱa和Ⅱb两个亚型[21]; Ⅲ型Crustin在信号肽和WAP结构域之间存在1个脯氨酸(PRR)和精氨酸富集区(ARR)[22]; Ⅳ型Crustin较为特殊, 含有2个WAP结构域[23]。本研究获得的脊尾白虾EcCrustin1序列编码158个氨基酸, 具有Crustins家族的典型结构特征(图 1), N-端为一个含有18个氨基酸的信号肽序列, C-端为含有8个半胱氨酸的WAP结构域, 8个半胱氨酸两两之间通过二硫键连接, 共同形成一个紧密的“4 DSC”(four-disulfide core)结构。此外在靠近信号肽的一端还含有一段甘氨酸富集区(GRR), 靠近WAP区域还含有一段半胱氨酸富集区(CRR), 符合典型的Ⅱ型Crustin结构特征, 基于以上特征将本研究得到的EcCrustin1归属为Ⅱ型Crustin。
3.2 EcCrustin1在脊尾白虾中的表达模式分析研究发现, Crustin主要在甲壳动物的血淋巴和鳃中表达, 在其他组织中的表达量相对较低, 如在在克氏原鳌虾(Procambarus clarkii)中, Crustin4主要在血淋巴中表达, 金黄色葡萄球菌刺激后其表达量显著上调[24]; 在拟穴青蟹中的研究结果显示, Crustin (SpCrus5)主要在鳃组织中表达, 副溶血弧菌和金黄色葡萄球菌和刺激后, 鳃组织中的SpCrus5显著上调[25]。在本研究中脊尾白虾EcCrustin1在血淋巴、胃、鳃、肠道、肝胰腺组织中均有表达, 这些组织作为机体抵御病原入侵的第一道防线, 会直接或间接与外部环境接触, EcCrustin1在上述组织中具有较高的表达, 可能与其免疫功能密切相关。副溶血弧菌刺激后, 血淋巴中EcCrustin1的表达量迅速升高, 并在6 h达到峰值, 这一结果与南美白对虾中的研究结果相一致[26], 说明EcCrusitn1在脊尾白虾抵御病原入侵的免疫应答过程中发挥了重要的功能。
3.3 EcCrustin1的功能研究Crustin结构较为保守, 目前已知的Crustin都包含3个区域, 即N-端信号肽序列、多域区和C-端的WAP结构域, 其中WAP结构域在各个物种间高度保守, 这一结构也是Crustin发挥其生物学功能的结构基础[27], 序列比对与同源性分析结果显示, EcCrustin1具有典型的WAP结构域, 推测EcCrusin1可能具有广谱的抗病原菌活性, 基于此本研究构建了EcCrustin1成熟肽的原核表达载体, 通过条件优化成功诱导其表达, western blot结果显示表达的蛋白为目的蛋白。但是进一步研究发现目的蛋白对大肠杆菌、金黄色葡萄球菌和副溶血弧菌没有明显的抑制作用, 这一结果与最近在凡纳滨对虾中的研究结果一致[12], 原因是Crustin的抑菌活性或抑制蛋白酶活性受WAP结构域中半胱氨酸的数量和排列方式影响[28-30], 在本研究中未检测到重组表达的EcCrustin1蛋白具有抑菌活性, 这可能与其独特半胱氨酸排列顺序有关。另外, Crustin的抑菌机制是多种多样的, 可以通过与病原菌直接接触并将其杀死, 也可以通过改变机体肠道菌群结构来抑制病原微生物活性[12], 因此对于脊尾白虾EcCrustin1的抑菌机制仍需进一步研究。
4 结论本研究从脊尾白虾中克隆获得一个Crustin新变体, 命名为EcCrustin1, 序列分析显示目的基因序列具有典型的Ⅱ型Crustin结构特征, 因此将本研究得到的EcCrustin1归属为Ⅱ型Crustin。EcCrustin1主要在血淋巴中表达, 副溶血弧菌诱导实验结果显示EcCrustin1参与脊尾白虾机体的抗细菌免疫过程。利用原核表达成功获得了EcCrustin1重组蛋白, 为进一步研究EcCrustin1抗菌机制奠定了基础。
| [1] |
RAHEEM N, STRAUS S K. Mechanisms of action for antimicrobial peptides with antibacterial and antibiofilm functions[J]. Frontiers in Microbiology, 2019, 10: 2866. DOI:10.3389/fmicb.2019.02866 |
| [2] |
CHUNG C R, JHONG J H, WANG Z, et al. Characterization and identification of natural antimicrobial peptides on different organisms[J]. International Journal of Molecular Sciences, 2020, 21(3): 986. DOI:10.3390/ijms21030986 |
| [3] |
AISENBREY C, MARQUETTE A, BECHINGER B. The mechanisms of action of cationic antimicrobial peptides refined by novel concepts from biophysical investigations[C]//MATSUZAKI K. Antimicrobial Peptides. Singapore: Springer, 2019: 33-64.
|
| [4] |
STEINER H, HULTMARK D, ENGSTRM A, et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. Nature, 1981, 292(5820): 246-248. DOI:10.1038/292246a0 |
| [5] |
齐志涛, 徐杨, 邹钧, 等. 水产动物抗菌肽研究进展[J]. 水产学报, 2020, 44(9): 1572-1583. QI Zhitao, XU Yang, ZOU Jun, et al. Review of antimicrobial peptides from aquatic animals[J]. Journal of Fisheries China, 2020, 44(9): 1572-1583. |
| [6] |
LI F H, XIANG J H. Recent advances in researches on the innate immunity of shrimp in China[J]. Developmental & Comparative Immunology, 2013, 39(1/2): 11-26. |
| [7] |
TASSANAKAJON A, SOMBOONWIWAT K, AMPARYUP P. Sequence diversity and evolution of antimicrobial peptides in invertebrates[J]. Developmental & Comparative Immunology, 2015, 1(48): 324-341. |
| [8] |
LI M, MA C X, ZHU P, et al. A new crustin is involved in the innate immune response of shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2019, 94: 398-406. |
| [9] |
AFSAL V V, ANTONY S P, BRIGHT A R, et al. Molecular identification and characterization of Type Ⅰ crustin isoforms from the hemocytes of portunid crabs, Scylla tranquebarica and Portunus pelagicus[J]. Cellular Immunology, 2013, 284(1/2): 45-50. |
| [10] |
WANG Y, ZHANG X W, WANG H, et al. SpCrus3 and SpCrus4 share high similarity in mud crab (Scylla para-mamosain) exhibiting different antibacterial activities[J]. Developmental & Comparative Immunology, 2018, 82: 139-151. |
| [11] |
DU Z Q, WANG Y, MA H Y, et al. A new crustin homologue (SpCrus6) involved in the antimicrobial and antiviral innate immunity in mud crab, Scylla paramamosain[J]. Fish & Shellfish Immunology, 2019, 84: 733-743. |
| [12] |
LV X J, LI S H, YU Y, et al. The immune function of a novel crustin with an atypical WAP domain in regulating intestinal microbiota homeostasis in Litopenaeus vannamei[J]. Developmental & Comparative Immunology, 2020, 111: 103756. |
| [13] |
SMITH V J, FERNANDES J M O, KEMP G D, et al. Crustins: enigmatic WAP domain-containing antibacterial proteins from crustaceans[J]. Developmental & Comparative Immunology, 2008, 32(7): 758-772. |
| [14] |
JIANG H S, JIA W M, ZHAO X F, et al. Four crustins involved in antibacterial responses in Marsupenaeus japonicus[J]. Fish & Shellfish Immunology, 2015, 43(2): 387-395. |
| [15] |
JIMÉNEZ-VEGA F, VARGAS-ALBORES F. A secretory leukocyteproteinase inhibitor (SLPI)-like protein from Litopenaeus vannamei haemocytes[J]. Fish & Shellfish Immunology, 2007, 23(5): 1119-1126. |
| [16] |
XU W J, XIE J J, SHI H, et al. Hematodinium infections in cultured ridgetail white prawns, Exopalaemon carinicauda, in eastern China[J]. Aquaculture, 2010, 300(1): 25-31. |
| [17] |
LI J T, MA P, LIU P, et al. The roles of Na+/K+-ATPase α-subunit gene from the ridgetail white prawn Exopalaemon carinicauda in response to salinity stresses[J]. Fish & Shellfish Immunology, 2015, 42(2): 264-271. |
| [18] |
ZHANG J Q, WANG J, GUI T S, et al. A copper-induced metallothionein gene from Exopalaemon carinicauda and its response to heavy metal ions[J]. International Journal of Biological Macromolecules, 2014, 70: 246-250. DOI:10.1016/j.ijbiomac.2014.06.020 |
| [19] |
李洋, 刘萍, 李健, 等. 脊尾白虾酚氧化酶原基因克隆及表达分析[J]. 海洋与湖沼, 2014, 45(2): 299-306. LI Yang, LIU Ping, LI Jian, et al. Cloning and expression of prophenoloxidase gene in Exopalaemon Carinicauda[J]. Oceanologia et Limnologia Sinica, 2014, 45(2): 299-306. |
| [20] |
CUI Z X, SONG C W, LIU Y, et al. Crustins from eyestalk cDNA library of swimming crab Portunus trituberculatus: molecular characterization, genomic organization and expression analysis[J]. Fish & Shellfish Immunology, 2012, 33(4): 937-945. |
| [21] |
CHRISTIE A E, RUS S, GOINEY C C, et al. Identification and characterization of a cDNA encoding a crustin-like, putative antibacterial protein from the American lobster Homarus americanus[J]. Molecular Immunology, 2007, 44(13): 3333-3337. DOI:10.1016/j.molimm.2007.02.028 |
| [22] |
JIA Y P, SUN Y D, WANG Z H, et al. A single whey acidic protein domain (SWD)-containing peptide from fleshy prawn with antimicrobial and proteinase inhibitory activities[J]. Aquaculture, 2008, 284(1/4): 246-259. |
| [23] |
DU Z Q, REN Q, ZHAO X F, et al. A double WAP domain (DWD)-containing protein with proteinase inhibitory activity in Chinese white shrimp, Fenneropenaeus chinensis[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2009, 154(2): 203-210. DOI:10.1016/j.cbpb.2009.06.004 |
| [24] |
DU Z Q, LI B, SHEN X L, et al. A new antimicrobial peptide isoform, Pc-crustin 4 involved in antibacterial innate immune response in fresh water crayfish, Procambarus clarkia[J]. Fish & Shellfish Immunology, 2019, 94: 861-870. |
| [25] |
WANG Y, ZHANG C, WANG H, et al. Involvement of a newly identified atypical type Ⅱ crustin (SpCrus5) in the antibacterial immunity of mud crab Scylla paramamosain[J]. Fish & Shellfish Immunology, 2018, 75: 346-356. |
| [26] |
ZHENG Z H, WANG F, AWEYA J J, et al. Comparative transcriptomic analysis of shrimp hemocytes in response to acute hepatopancreas necrosis disease (AHPND) causing Vibrio parahemolyticus infection[J]. Fish & Shellfish Immunology, 2018, 74: 10-18. |
| [27] |
SMITH V J, CHISHOLM J R S. Antimicrobial proteins in crustaceans[C]//Gergory. Phylogenetic Perspectives on the Vertebrate Immune System. Boston: Springer, 2001: 95-112.
|
| [28] |
NAIR D G, FRY B G, ALEWOOD P, et al. Antimicrobial activity of omwaprin, a new member of the waprin family of snake venom proteins[J]. Biochemical Journal, 2007, 402(1): 93-104. DOI:10.1042/BJ20060318 |
| [29] |
ZHANG J Q, LI F H, WANG Z Z, et al. Cloning and recombinant expression of a crustin-like gene from Chinese shrimp, Fenneropenaeus chinensis[J]. Journal of Biotechnology, 2007, 127(4): 605-614. DOI:10.1016/j.jbiotec.2006.08.013 |
| [30] |
ZHAO W J, CARO F, ROBINS W, et al. Antagonism toward the intestinal microbiota and its effect on Vibrio cholerae virulence[J]. Science, 2018, 359(6372): 210-213. DOI:10.1126/science.aap8775 |
 2022, Vol. 46
2022, Vol. 46


