文章信息
- 赵雯, 车宗豪, 刘括, 马倩颖, 刘泽, 霍忠明, 闫喜武. 2022.
- ZHAO Wen, CHE Zong-hao, LIU Kuo, MA Qian-ying, LIU Ze, HUO Zhong-ming, YAN Xi-wu. 2022.
- 日本海神蛤(Panopea japonica)性腺发育生物学零度及有效积温研究
- Biological zero degree and effective accumulated temperature of the geoduck clam Panopea japonica
- 海洋科学, 46(10): 78-84
- Marine Sciences, 46(10): 78-84.
- http://dx.doi.org/10.11759/hykx20210729001
-
文章历史
- 收稿日期:2021-07-29
- 修回日期:2021-08-26
2. 辽宁省贝类良种繁育工程技术研究中心, 辽宁 大连 116023
2. Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province, Dalian 116023, China
日本海神蛤(Panopea japonica)为名贵贝类, 属软体动物门(Mollusca)、双壳纲(Bivalvia)、海螂目(Myoida)、缝栖蛤科(Hiatellidae)、海神蛤属(Panopea), 分布于我国黄海北部、朝鲜半岛和日本北海道等海域[1]。在中国市场上, 日本海神蛤与分布在北美西海岸的高雅海神蛤(P. abtupta)的商业名称均为象拔蚌, 其肉质鲜美、营养丰富[2], 深受消费者喜爱, 市场潜力大。目前我国日本海神蛤的自然资源几近枯竭, 全部依赖进口。20世纪90年代, 中国学者开展了大量的高雅海神蛤(P. abtupta)引种试验[3-4], 在苗种繁育方面取得了突破, 但由于受栖息水温限制, 关于高雅海神蛤在我国大规模养殖的研究尚无系统报道, 制约了象拔蚌产业发展。日本海神蛤为我国北黄海土著贝类资源[1], 有望在我国辽阔的海域推广养殖。近年来, 国外学者和国内大连海洋大学霍忠明等[5-10]相继开展了日本海神蛤繁殖生物学的研究工作, 建立了日本海神蛤人工苗种繁育技术, 为象拔蚌的人工养殖开辟了新途径。
性腺发育的生物学零度和有效积温是海洋贝类繁殖生物学研究的重要指标, 有助于了解性腺发育的特点, 为贝类人工苗种繁育提供理论支撑。目前, 关于海洋贝类的性腺发育的生物学零度和有效积温已有较多报道, 主要包括海湾扇贝(Argopecten irradians Lamarck)[11-13]、虾夷扇贝(Patinopecten yessoensis)[14]、菲律宾蛤仔(Ruditapes philippinarum)[15]、西施舌(Coelomactra antiguata)[16]、缢蛏(Sinonovacula constricta)[17]、褐云玛瑙螺(Achatina fulica Frusaac)[18]等。毕庶万等[13]通过使用二点法、最小二乘法、积温仪计数法对海湾扇贝性腺发育生物学零度和有效积温进行了研究。刘德经等[16]运用回归直线法开展了西施舌生物学零度和有效积温研究。闫喜武[19]通过有效积温公式K=H(T–t), 拟合线性升温曲线, 结合组织学观察求算了菲律宾蛤仔性腺发育生物学零度。田斌等[14]采用有效积温拟合曲线的方法, 计算了虾夷扇贝性腺发育的生物学零度和有效积温。Xue等[17]比较了1龄及2龄缢蛏新品种“申浙1号”性腺发育的生物学零度和有效积温。
目前, 关于海神蛤生物学零度和有效积温的研究尚未见报道。Marshall等[20]研究了温度对高雅海神蛤的性腺发育的影响, 发现高雅海神蛤性腺发育的最佳水温是7 ℃, 繁育水温是11 ℃, 当水温升高到15 ℃以上时高雅海神蛤性腺开始退化, 当水温达到19 ℃时高雅海神蛤的性腺不发育。Aragón-noriega等[21]对球形海神蛤(P. globosa)的性腺发育及繁殖周期进行了研究, 结果表明, 球形海神蛤在水温30 ℃时性腺开始逐渐发育, 当水温逐渐降低至18 ℃时进入繁殖盛期。本研究运用二点法、回归直线法和有效积温法3种方法求算日本海神蛤性腺发育的生物学零度及有效积温, 以期为我国日本海神蛤资源恢复和人工苗种繁育提供科学依据。
1 材料与方法 1.1 亲贝的选择和暂养于2019年1月26日, 在日本海海域采集壳型规整、无损伤, 水管粗壮且收缩力强的日本海神蛤158个作为亲贝低温运输至大连庄河贝类育苗场, 在30 m3的水泥池中进行暂养。室内暂养水温为4.1~4.3 ℃, 盐度30~31, 饵料按球等边金藻(Isochrysis galbana)和角毛藻(Chaetoceros)体积比1∶1混合投喂, 日投饵3~4次, 日投饵量约为(1.2~1.8)×104 cells/mL, 每天全量换水一次。
1.2 亲贝的升温促熟分别在两个水泥池(1号培育池与2号培育池)中按两种升温方式进行日本海神蛤室内人工升温促熟。在亲贝人工升温促熟过程中, 两个实验组饵料投喂等日常管理操作保持一致。1号培育池与2号培育池均于1月27日开始升温, 1号培育池每2日升温0.5 ℃, 2号培育池每日升温0.5 ℃, 每日早、中、晚进行3次水温测量, 根据监测温度计算日均水温, 记录从升温促熟开始到产卵的总天数。
1.3 统计分析数据以平均值±标准差表示, 使用SPSS 17.0软件进行数据分析, 采用Excel软件进行作图。
2 结果经过室内人工升温促熟, 1号培育池在促熟后43 d开始出现产卵排精现象, 平均水温为(7.41±2.37) ℃, 2号培育池在促熟后38 d出现产卵排精现象, 平均水温是(8.50±2.45) ℃。两池人工升温促熟的日均水温见表 1。根据有效积温公式: K=H(T–T0), 其中H为日本海神蛤开始促熟到产卵所需的时间(d); T为升温促熟日均水温(℃); T0为生物学零度; K为有效积温。运用二点法[13]、回归直线法[16, 22-23]和有效积温法[14, 19]3种方法求算日本海神蛤性腺发育的生物学零度T0及有效积温K。
| 时间 | 1号池 | 2号池 | |||
| 日均水温/℃ | 促熟时间/d | 日均水温/℃ | 促熟时间/d | ||
| 1月27日 | 4.1±1.23 | 1 | 4.3±1.29 | 1 | |
| 1月28日 | 2.9±0.76 | 2 | 2.9±0.81 | 2 | |
| 1月29日 | 4.0±0.15 | 3 | 4.2±0.26 | 3 | |
| 1月30日 | 4.1±0.38 | 4 | 4.8±0.38 | 4 | |
| 1月31日 | 4.5±0.46 | 5 | 5.1±0.44 | 5 | |
| 2月1日 | 4.1±0.29 | 6 | 5.0±0.06 | 6 | |
| 2月2日 | 4.4±0.15 | 7 | 5.8±0.06 | 7 | |
| 2月3日 | 4.7±0.43 | 8 | 5.8±0.47 | 8 | |
| 2月4日 | 4.9±0.12 | 9 | 6.2±0.25 | 9 | |
| 2月5日 | 5.3±0.29 | 10 | 6.7±0.25 | 10 | |
| 2月6日 | 5.0±0.50 | 11 | 7.0±0.00 | 11 | |
| 2月7日 | 5.5±0.17 | 12 | 7.4±0.23 | 12 | |
| 2月8日 | 5.7±0.64 | 13 | 7.5±0.06 | 13 | |
| 2月9日 | 5.5±0.15 | 14 | 7.7±0.23 | 14 | |
| 2月10日 | 5.9±0.32 | 15 | 8.3±0.40 | 15 | |
| 2月11日 | 6.4±0.17 | 16 | 8.5±0.06 | 16 | |
| 2月12日 | 6.9±0.21 | 17 | 8.6±0.29 | 17 | |
| 2月13日 | 6.9±0.42 | 18 | 9.0±0.00 | 18 | |
| 2月14日 | 7.3±0.30 | 19 | 9.1±0.40 | 19 | |
| 2月15日 | 6.8±0.20 | 20 | 9.0±0.06 | 20 | |
| 2月16日 | 7.8±0.52 | 21 | 9.5±0.06 | 21 | |
| 2月17日 | 7.9±0.74 | 22 | 9.5±0.06 | 22 | |
| 2月18日 | 7.7±0.46 | 23 | 9.5±0.00 | 23 | |
| 2月19日 | 7.4±0.15 | 24 | 9.4±0.17 | 24 | |
| 2月20日 | 7.8±0.21 | 25 | 9.8±0.40 | 25 | |
| 2月21日 | 7.8±0.06 | 26 | 10.0±0.06 | 26 | |
| 2月22日 | 8.1±0.10 | 27 | 10.1±0.23 | 27 | |
| 2月23日 | 8.5±0.15 | 28 | 10.5±0.00 | 28 | |
| 2月24日 | 8.9±0.26 | 29 | 10.5±0.00 | 29 | |
| 2月25日 | 9.0±0.17 | 30 | 10.6±0.10 | 30 | |
| 2月26日 | 9.3±0.31 | 31 | 10.7±0.21 | 31 | |
| 2月27日 | 9.4±0.12 | 32 | 11.0±0.31 | 32 | |
| 2月28日 | 9.7±0.26 | 33 | 11.2±0.10 | 33 | |
| 3月1日 | 9.5±0.15 | 34 | 11.1±0.06 | 34 | |
| 3月2日 | 9.9±0.21 | 35 | 11.3±0.10 | 35 | |
| 3月3日 | 10.2±0.00 | 36 | 11.5±0.06 | 36 | |
| 3月4日 | 10.4±0.15 | 37 | 11.9±0.15 | 37 | |
| 3月5日 | 9.9±0.61 | 38 | 12.0±0.00 | 38 | |
| 3月6日 | 10.5±0.00 | 39 | |||
| 3月7日 | 10.7±0.15 | 40 | |||
| 3月8日 | 11.1±0.21 | 41 | |||
| 3月9日 | 11.2±0.61 | 42 | |||
| 3月10日 | 11.0±0.15 | 43 | |||
利用两点法计算, 根据有效积温相等, 可得(T1–T0)H1=K=(T2–T0)H2, 其中T1、T2分别为1号培育池、2号培育池升温促熟日均水温(℃); T0为生物学零度; H1、H2分别为1号培育池、2号培育池促熟时间(d), K为有效积温。
整理得, 生物学零度:
式中T1和T2分别为7.41 ℃和8.50 ℃; H1和H2分别为43 d和38 d。结果表明, 日本海神蛤性腺发育生物学零度为–0.874 ℃, 有效积温为356.212 ℃·d。
设性腺发育速率为V, 则
式中促熟天数、日均水温等观测数据见表 2, 将表中数据代入回归直线法计算公式, 求算生物学零度T0和有效积温K值, 结果表明, 日本海神蛤性腺发育生物学零度为–1.14 ℃, 有效积温为366.69 ℃·d。
| 促熟天数H/d | 日均水温T/℃ | 发育速率V | VT | V2 |
| 43 | 7.41 | 0.023 26 | 0.172 4 | 0.000 541 0 |
| 38 | 8.50 | 0.026 32 | 0.223 7 | 0.000 692 7 |
| Σ | 15.91 | 0.049 58 | 0.396 1 | 0.001 233 7 |
记录两批亲贝从开始促熟到自然产卵的日均水温, 根据积温公式K=H(T–T0)拟合线性升温曲线, 利用积温K值相同, 即S1=S2、统计得出生物学零度T0及有效积温K。
日本海神蛤人工升温促熟的两个培育池拟合水温变化见图 1、图 2。
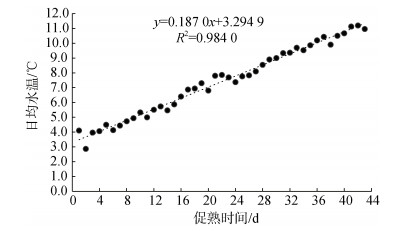 |
| 图 1 1号培育池日本海神蛤人工升温促熟实验水温变化 Fig. 1 Variation of No. 1 pool's seawater temperature of P. japonica during the indoor experiment |
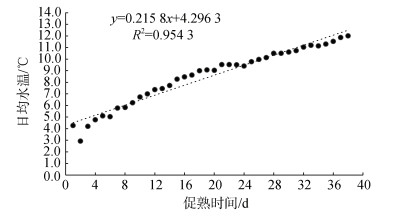 |
| 图 2 2号培育池日本海神蛤人工升温促熟实验水温变化 Fig. 2 Variation of No. 2 pool's seawater temperature of P. japonica during the indoor experiment |
根据日均水温拟合两个实验的升温曲线分别为L1(图 3a)和L2(图 3b)。
| $ {{\text{L}}_{1}}: y= 0.187 0x + 3.294 9 \;\;R^{2} = 0.984 0 $ | (1) |
| $ {{\text{L}}_{2}}: y= 0.215 8x + 4.296 3 \;\; R^{2} = 0.954 3 $ | (2) |
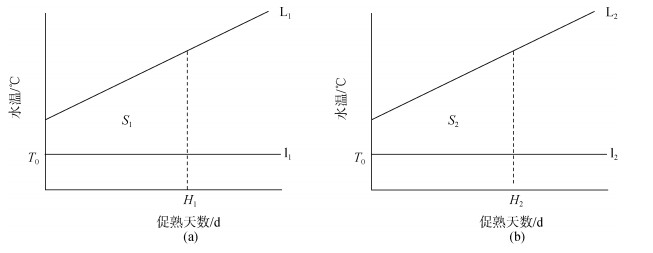 |
| 图 3 实验的积温图(实际) Fig. 3 Effective accumulated temperature of the experiment (in actuality) |
由前两种方法得知, 日本海神蛤的生物学零度T0较低, 亲贝入池水温已高于T0, 故实际实验积温图如图 3:
由S1=S2得,
| $ \int_0^{43} {{{\text{L}}_1}} - \int_0^{43} {{{\text{l}}_1}} = \int_0^{38} {{{\text{L}}_2}} - \int_0^{38} {{{\text{l}}_2}} . $ | (3) |
由(3)解得: T0=–0.900 96
根据生物学零度–0.900 96 ℃, 按有效积温公式K=H(T–T0)推算, 得出在人工促熟条件下, 日本海神蛤的有效积温为(357.305±0.09) ℃·d(见表 3)。
| 1号池 | 2号池 | |
| 总促熟时间H/d | 43 | 38 |
| 超过生物学零度T0时间/d | 43 | 38 |
| 超过生物学零度T0的日平均水温/℃ | 7.41 | 8.50 |
| 有效积温K/(℃·d) | 357.37 | 357.24 |
根据二点法、直线回归法和有效积温法计算获得的日本海神蛤生物学零度和有效积温(见表 4), 求得日本海神蛤生物学零度及有效积温平均值分别为(–0.97±0.14) ℃和(360.07±5.76) ℃·d。
| 生物学零度T0/℃ | 有效积温K/(℃·d) | |
| 二点法 | –0.874 | 356.212 |
| 回归直线法 | –1.135 2 | 366.689 |
| 有效积温法 | –0.900 96 | 357.305 |
| 平均值±标准差 | –0.97±0.14 | 360.07±5.76 |
温度是影响贝类的性腺发育及繁殖周期的重要因素[24-26], 掌握其性腺发育的生物学零度和产卵的有效积温, 可通过调节生境温度的方法, 可以加快性腺发育速度, 达到提早繁育效果, 为贝类室内人工升温促熟苗种繁育提供科学的理论依据[27]。目前关于贝类的生物学零度的计算方法较多, 如二点法、回归直线法和有效积温法。利用二点法计算, 需要样本数少, 计算方法简单, 可快速得到数据, 但由于代入数值为日均温度, 存在精度不足的问题。回归直线法将发育起点温度转化为求算直线回归系数, 简化了计算过程, 但是这种方法在计算过程中颠倒了自变量和因变量的关系, 将原来的自变量变成了因变量。二点法及回归直线法法均为早期方法, 计算较为简便, 首先在昆虫等变温性动物中应用[22, 28], 后被引入贝类等水产动物。闫喜武[19]在计算菲律宾蛤仔时应用了有效积温法, 根据K=H(T–t)拟合线性升温曲线, 利用有效积温K值进行数理统计得出性腺发育生物学零度, 再通过组织学方法进行验证。此方法适用于实际生产。拟合线性升温曲线, 一定程度上减少了实验温度不稳定原因造成的影响, 再结合组织学方法进行验证, 具有较强的说服力。本文采用3种方法计算得出日本海神蛤生物学零度分别为–0.874 ℃、–1.1352 ℃和–0.900 96 ℃, 有效积温分别为356.212 ℃·d、366.689 ℃·d及357.305 ℃·d, 结果较为相近。综合3种方法, 求得日本海神蛤的生物学零度平均值为(–0.97±0.14) ℃, 有效积温平均值为(360.07±5.76) ℃·d。
本研究表明日本海神蛤性腺发育生物学零度较低, 这可能与日本海神蛤冷水生活环境适应性和繁殖习性有关。在目前已有的报道中, 性腺发育生物学零度低于0 ℃的水产动物较少, 王妍妍等[29]研究表明条斑星鲽(Verasper moseri)胚胎发育的生物学零度为–0.1 ℃, 分析指出这可能与条斑星鲽为冷温性鱼类, 与其性腺早期在较低水温开始发育有关。日本海神蛤为冷水性贝类, 成年个体生活适温为8~ 22 ℃。李莹[30]通过日本海神蛤周年性腺发育组织切片观察发现, 几乎全年都存在性腺发育处于增殖期的雌性个体, 3—9月出现性腺发育处于成熟期雌性个体; 而雄性日本海神蛤全年都存在性腺发育处于成熟期个体; 雌雄日本海神蛤性腺发育具有不同步的特点。本实验计算求得日本海神蛤性腺发育生物学零度为–0.97 ℃, 与日本海神蛤自然水域的性腺发育实际情况相一致。
4 结论本研究计算日本海神蛤生物学零度及有效积温的平均值分别为(–0.97±0.14) ℃和(360.07±5.76) ℃·d。在日本海神蛤室内人工苗种繁育过程中, 结合日本海神蛤性腺发育的生物学零度和产卵的有效积温特点, 通过调控生境水温, 可以加快性腺发育速度, 达到提早繁育效果。
| [1] |
齐钟彦, 马绣同. 黄渤海的软体动物[M]. 北京: 农业出版社, 1989: 228-229. QI Zhongyan, MA Xiutong. Mollusca of Huanghai and Bohai[M]. Beijing: Agriculture Press, 1989: 228-229. |
| [2] |
李春艳, 阎磊, 王品虹, 等. 日本海神蛤营养成分分析与评价[J]. 营养学报, 2008, 30(1): 113-114, 116. LI Chunyan, YAN Lei, WANG Pinhong, et al. Analysis of Nutritional Compositions in Geoduck Panopea japonica[J]. Acta Nutrimenta Sinica, 2008, 30(1): 113-114, 116. |
| [3] |
魏振华, 魏利平. 象拔蚌引种及人工育苗技术[J]. 齐鲁渔业, 2004, 21(8): 4-7. WEI Zhenhua, WEI Liping. Studies on artificial introduction and reproduction of the Pacific geoduck Panopea abrupta[J]. Shandong Fisheries, 2004, 21(8): 4-7. |
| [4] |
刘明坤, 王昌勃, 孔令锋, 等. 象拔蚌人工育苗技术研究[J]. 海洋科学, 2013, 37(8): 103-106. LIU Mingkun, WANG Cangbo, KONG Lingfeng, et al. Studies on artificial reproduction of the Pacific geoduck Panopea generosa[J]. Marine Sciences, 2013, 37(8): 103-106. |
| [5] |
Nam M M, Chu L, Kim M K, et al. Development and growth in fertilized eggs and larvae of the Japanese geoduck, Panopea japonica reared in the laboratory[J]. The Korean Journal of Malacology, 2014, 30(4): 303-309. DOI:10.9710/kjm.2014.30.4.303 |
| [6] |
LEE C S, BAIK K K, HONG K E. Ecological Studies on the habitat of geoduck clam, Panope japonica[J]. Journal of Aquaculture, 1998, 11(1): 105-111. |
| [7] |
霍忠明, 赵雯, 肖友翔, 等. 日本海神蛤人工繁殖及早期生长发育[J]. 水产学报, 2021, 45(2): 235-245. HUO Zhongming, ZHAO Wen, XIAO Youxiang, et al. Artificial breeding, early growth and development of Panopea japonica[J]. Journal of Fisheries of China, 2021, 45(2): 235-245. |
| [8] |
Huo Z M, Rbbani M G, Cui H, et al. Larval development, juvenile survival, and burrowing rate of geoduck clams (Panopea japonica) under different pH conditions[J]. Aquaculture International, 2019, 27(5): 1331-1342. |
| [9] |
Huo Z M, RBBANI M G, Tian Y, et al. Nitrite tolerance of larvae and juveniles of geoduck clam Panopea japonica[J]. Aquaculture Research, 2018, 49(8): 2913-2917. |
| [10] |
Huo Z M, Guan H W, RBBANI M G, et al. Effects of environmental factors on growth, survival, and metamorphosis of geoduck clam Panopea japonica (A. Adams, 1850) larvae[J]. Aquaculture Reports, 2017, 8: 31-38. |
| [11] |
周玮. 海湾扇贝性腺发育的生物学零度[J]. 水产学报, 1991, 15(1): 82-84. ZHOU Wei. The biological zero of gonad development of Bay scallop Agropecten irradians (Lamarck)[J]. Journal of Fisheries of China, 1991, 15(1): 82-84. |
| [12] |
田传远, 梁英, 王如才. 海湾扇贝性腺发育的生物学零度[J]. 青岛海洋大学学报, 1995(1): 56-58. TIAN Chuanyuan, LIANG Ying, WANG Rucai. Study on the biological zero of gonad development of Bay scallop Agropecten irradians[J]. Journal of Ocean University Of Qingdao, 1995(1): 56-58. |
| [13] |
毕庶万, 徐宗发, 于光溥, 等. 海湾扇贝控温育苗采卵时间的预报方法[J]. 海洋与湖沼, 1996, 27(1): 93-97. BI Shuwan, XU Zongfa, YU Guangpu, et al. Forecast of the egg-collection time in seed rearing of Argopecten irradians in temperature-controlled water[J]. Oceanologia et Limnologia Sinica, 1996, 27(1): 93-97. |
| [14] |
田斌, 王璐. 虾夷扇贝性腺发育的生物学零度与有效积温研究[J]. 中国水产, 2018(5): 93-96. TIAN Bin, WANG Lu. Study on the biological zero of gonad development of Japanese scallop Patinopecten yessoensis[J]. China Fisheries, 2018(5): 93-96. |
| [15] |
闫喜武, 张国范, 杨凤, 等. 菲律宾蛤仔莆田群体与大连群体生物学比较[J]. 生态学报, 2005, 25(12): 3329-3334. YAN Xiwu, ZHANG Guofan, YANG Feng, et al. Biological comparisons between Putian population and Dalian population of manila clams Ruditapes philippenarum[J]. ACTA Ecologica sinica, 2005, 25(12): 3329-3334. |
| [16] |
刘德经, 黄天华, 肖思祺, 等. 西施舌(Coelomactra antiguata)生殖腺发育生物学零度和有效积温的初步研究[J]. 特产研究, 2002, 24(1): 33-34. LIU Dejing, HUANG Tianhua, XIAO Siqi, et al. Studies on the Thermal Sum Beneficial and Biological Zero of Gonad Development of Coelomactra antiquata(Spengler)[J]. Special Wild Economic Animal and Plant Research, 2002, 24(1): 33-34. |
| [17] |
XUE B, MENG D, LI H, et al. Determining the biological zero for gonadal development razor clams Sinonovacula constricta (lamarck 1818) in Zhejiang, China[J]. Aquaculture and Fisheries, 2021, 6(1): 78-88. |
| [18] |
周卫川, 吴宇芬, 蔡金发, 等. 褐云玛瑙螺发育零点和有效积温的研究[J]. 福建农业学报, 2001, 16(3): 25-27. ZHOU Weichuan, WU Yufen, CAI Jinfa, et al. Developmental zero and effective accumulated temperature of giant African snail[J]. Fujian Journal of Agricultural Sciences, 2001, 16(3): 25-27. |
| [19] |
闫喜武. 菲律宾蛤仔养殖生物学、养殖技术与品种选育[D]. 青岛: 中国科学院研究生院(海洋研究所), 2005. YAN Xiwu. The culture biology and technology and selective breeding in Manila clam, Ruditapes philippinarum[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences Qingdao, 2005. |
| [20] |
Marshall R, McKinley R S, Pearce C M. Effect of temperature on gonad development of the Pacific geoduck clam Panopea generosa (Gould, 1850)[J]. Aquaculture, 2012, 338/341: 264-273. |
| [21] |
Aragon-Noriega E A, Chavez-Villalba J, Gribben P E, et al. Morphometric relationships, gametogenic development and spawning of the geoduck clam Panopea globosa (Bivalvia: Hiatellidae) in the central of california[J]. Journal of Shellfish Research, 2007, 26(2): 423-431. |
| [22] |
周楠, 王莉萍, 卢南, 等. 高山小毛虫发育起点温度和有效积温的研究[J]. 云南林业科技, 1993(1): 52-56. ZHOU Nan, WANG Liping, LU Nan, et al. Study on the biological zero point and effective accumulated temperature for development of Cosmotriche saxosimilis Lajonquiere[J]. Journal of West China Forestry Science, 1993(1): 52-56. |
| [23] |
李爽, 李耕, 潘玉洲, 等. 刺参生殖腺发育的生物学零度和有效积温研究[J]. 安徽农业科学, 2016, 44(1): 81-82. LI Shuang, LI Geng, PAN Yuzhou, et al. Study on the biological zero point and effective accumulated temperature for the gonad development of Sea Cucumber[J]. Journal of Anhui Agriculture, 2016, 44(1): 81-82. |
| [24] |
楼允东, 吴萍. 温度在水产动物性别控制中的作用[J]. 上海水产大学学报, 2008, 17(4): 481-485. LOU Yundong, WU Ping. The role of temperature in sex control of aquatic animals[J]. Journal of Shanghai Fisheries University, 2008, 17(4): 481-485. |
| [25] |
朱星海, 孙红振, 杨祖晶, 等. 风信标扇贝的性腺发育与繁殖周期规律研究[J]. 中国海洋大学学报(自然科学版), 2019, 49(2): 52-58. ZHU Xinghai, SUN Hongzhen, YANG Zujing, et al. Studies on gonadal development and the reproductive cycle of Patinopecten caurinus[J]. Periodical of Ocean University of China, 2019, 49(2): 52-58. |
| [26] |
Thomas B M, Gabriela N, Lorraine M B, et al. Effect of temperature, diet, light, and cultivation density on growth and survival of larval and juvenile white Abalone Haliotis sorenseni (Bartsch, 1940)[J]. Journal of Shellfish Research, 2016, 35(4): 981-992. |
| [27] |
林志华, 单乐州, 柴雪良, 等. 文蛤的性腺发育和生殖周期[J]. 水产学报, 2004(5): 510-514. LIN Zhihua, SHAN Lezhou, CHAI Xueliang, et al. Study on the gonad development and reproductive cycle of Meretrix meretrix Linnaeus[J]. Journal of Fisheries of China, 2004(5): 510-514. |
| [28] |
马梦然, 曹鹤, 申家轩, 等. 云南派姬小蜂的发育起点温度和有效积温[J]. 植物保护, 2020, 46(3): 194-197. MA Mengran, CAO He, SHEN Jiaxuan, et al. Threshold temperature and effective accumulated temperature of Pediobius yunnanensis Liao[J]. Plant Protection, 2020, 46(3): 194-197. |
| [29] |
王妍妍, 柳学周, 刘新富, 等. 温度、盐度对条斑星鲽胚胎发育的影响[J]. 海洋水产研究, 2008, 29(6): 27-32. WANG Yanyan, LIU Xuezhou, LIU Xinfu, et al. Effects of temperature and salinity on embryonic development of barfin flounder Verasper moseri[J]. Marine Fisheries Research, 2008, 29(6): 27-32. |
| [30] |
李莹. 日本海神蛤Panopea japonica性腺发育、营养成分周年变化及遗传多样性研究[D]. 大连: 大连海洋大学, 2019. LI Ying. Gonad development, annual variation of nutrients, transcriptome analysis and genetic diversity of Panopea japonica[D]. Dalian: Dalian Ocean University, 2019. |
 2022, Vol. 46
2022, Vol. 46


