文章信息
- 彭鹏飞, 马媛, 史荣君, 王迪, 许欣, 颜彬. 2022.
- PENG Peng-fei, MA Yuan, SHI Rong-jun, WANG Di, XU Xin, YAN Bin. 2022.
- 考洲洋牡蛎养殖海域海-气界面CO2交换通量的时空变化
- Temporal and spatial variation in the sea–air CO2 flux in the oyster aquaculture area of Kaozhou Bay
- 海洋科学, 46(10): 140-149
- Marine Sciences, 46(10): 140-149.
- http://dx.doi.org/10.11759/hykx20211031001
-
文章历史
- 收稿日期:2021-10-31
- 修回日期:2022-01-14
2. 中国水产科学研究院南海水产研究所 广东省渔业生态环境重点实验室, 广东 广州 510300
2. South China Sea Fisheries Research Institute, Chinese Academy of Fisheries Sciences, Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, Guangzhou 510300, China
化石燃料的使用导致大气中以CO2为主的温室气体增加, 引起温室效应加剧, 产生一系列的气候问题[1-3]。海洋作为地球表面最大的碳库, 其对碳的吸收能力将直接影响到全球碳循环[4], 具有巨大的碳汇潜力和负排放研发前景[5]。蓝碳概念的提出, 确认了海洋在全球气候变化和碳循环过程中至关重要的作用, 地球上大约有93%的CO2会循环进入海洋, 它们或重新进入生物地化循环, 或被长期储存起来[6]。1994—2007年, 海洋对CO2的年平均吸收率为2.6±0.3 PgC, 占这一时期全球人为CO2排放量的31%±4%[7]。海洋吸收的CO2量不断增加, 会使得表层海水的碱性下降, 引起海洋酸化, 产生另一重大环境问题[8]。因此, 一方面将CO2从大气中移除, 减缓温室效应, 海洋起到至关重要的作用, 另一方面, 将CO2从海水中移除, 缓解海洋酸化, 成为重要的研究方向。
大规模的贝藻类养殖能通过收获从海洋中移出大量的碳, 明显影响到浅海碳循环, 成为一个“可移出的碳汇”[9]。中国学者在世界上率先提出渔业碳汇和碳汇渔业的概念, 得到国际社会的广泛关注[10-11], 贝类养殖是碳汇渔业的重要组成部分[12]。滤食性贝类具有高效的碳汇功能, 能显著提高海域的碳汇潜力[13]。中国贝类海水养殖产生的碳沉积量为5.115×105 t/a, 可减少大气CO2增加量的0.010 9%[14]。海水养殖的滤食性贝类通过摄食活动大量去除海水中的颗粒有机碳, 并且通过形成贝壳能够埋藏大量的碳, 伴随着养殖贝类的收获, 大量的碳能够直接从海水中移出, 这势必对养殖海区以及邻近海域的碳循环产生重要的影响[9, 14]。国内学者对我国北方典型海湾桑沟湾和乳山宫家岛以东水域、福建三沙湾盐田港等涉及贝类养殖的海域碳循环进行了研究[15-17], 分析了养殖栉孔扇贝对桑沟湾碳循环的贡献[18]。
本研究根据2018—2019年在广东考洲洋牡蛎养殖海域4个季节的调查数据, 估算该海域海-气界面CO2交换通量, 分析其与环境因子的关系, 对研究浅海牡蛎养殖区的碳源汇潜力和海洋碳生物地球化学循环具有重要的科学意义。
1 材料与方法 1.1 调查区域概况考洲洋是位于粤东沿岸的一个溺谷湾, 通过狭长的盐洲水道与红海湾相连, 水域面积约29.7 km2, 滩涂面积约13.73 km2, 是重要的近江牡蛎养殖水域之一, 出产的近江牡蛎称为“赤岸蚝”, 是地方名优特产; 湾内入海河流主要是吉隆河, 全长22 km, 流域面积116 km2, 年径流量为2.32×108 m3[19-20]。考洲洋口门处的盐洲岛将口门分隔为两个水道, 建有两座桥梁与大陆相连, 牡蛎养殖区主要位于盐洲岛以西海域, 沿岸有较多对虾高位养殖池。
1.2 站位布设与样品采集于2018年7月、11月和2019年1月、4月进行夏季、秋季、冬季和春季4个季节的调查。在牡蛎养殖区布设5个站位, 两座桥梁处各布设1个站位作为非养殖区对照, 北侧桥梁为大桥, 南侧桥梁为小桥, 调查站位见图 1, 牡蛎养殖区每站采集表层海水(水面下0.5 m)1次, 桥梁处每站采集表层海水3个样品作为重复。各种样品的采集、保存、分析和测定均按《海洋监测规范》[21]进行。现场测试水深、水温(T)、透明度, 使用Thermo Scientific Orion Star A211型pH计(相对精度±0.01)现场测试pH(NBS标度), 应用碘量法测定溶解氧(DO); 将500 mL水样经0.45 μm醋酸纤维滤膜过滤后冷冻保存带回实验室, 经丙酮萃取后, 用分光光度法测试叶绿素a(Chl a); 用SYA2-2型实验室盐度计测试盐度(S); 水样现场经WHATMAN囊式滤器过滤后带回实验室使用总溶解性无机碳分析仪(Apollo SciTech AS-C3)测试溶解无机碳(DIC)。
 |
| 图 1 调查站位 Fig. 1 Sampling stations |
海-气界面CO2交换通量采用以下公式进行估算[22-24]。
| $ F_{\mathrm{CO}_2}=k \times a_s \times \Delta p\left(\mathrm{CO}_2\right), $ | (1) |
其中,
假定海水中CO2体系处于平衡, 如果海水的温度、盐度和压力已经测定, 那么pH、总碱度(TA)、DIC和表层水二氧化碳分压[p(CO2)]就可以任意测定两个, 然后计算出其余的参数[28]。本文利用pH值和DIC数据, 采用CO2SYS计算CO2体系的其他参数HCO3–、CO32―、CO2和p(CO2) [29-31], 碳酸的第一级、第二级解离常数引自Lueker等[32], 总硼酸浓度引自Lee等[33], HF的解离常数引自Perez等[34]。
浮游植物初级生产力可用于估算浮游植物固碳强度[16]。依据海水中Chl a质量浓度和透明度计算初级生产力[35]:
| $ P_{\mathrm{P}}=C_{\mathrm{Chl} \;a} \times A \times E \times L / 2, $ | (2) |
式中, PP是初级生产力(mg C·m–2·d–1), CChl a是叶绿素a的浓度(mg·m–3), A是同化系数, 取3.7 mg C/(mg Chl a·h)[36], E是透光层深度(m), 取透明度的3倍[37], L是白天的时长(查询中国天气网日出日落时间计算)。
1.4 数据分析所有数据均用平均值±标准差表示, 应用SPSS Statistics 17.0软件对不同季节和不同区域的无机碳体系各分量的浓度、p(CO2)和CO2海-气界面交换通量等进行方差分析(ANOVA), 当P<0.01时为差异极显著, 当P<0.05时为差异显著, 数据的多重比较采用SPSS软件中的LSD法(假定方差齐性)及Dunnett’s T3法(未假定方差齐性)进行分析, 数据相关分析采用Spearman秩相关系数。
2 结果与分析 2.1 海区水环境特征海区水环境特征值见表 1。考洲洋表层海水不同采样区域的水温、pH和DO差异不显著, 盐度有一定差异。水温: 夏季>春季>秋季>冬季, 季节变化明显(P<0.05); pH: 春季>冬季>夏季>秋季, 春季和冬季差异不显著(P>0.05); DO: 冬季>春季>夏季>秋季, 冬季和春季、夏季和秋季差异不显著(P>0.05), 盐度: 春季>冬季>秋季>夏季, 夏季盐度显著低于其余3个季节(P<0.05)。盐度在不同区域排序是小桥区>大桥区>牡蛎养殖区, 牡蛎养殖区盐度显著低于大桥区和小桥区(P<0.05)。
| 季节 | 区域 | 水温/℃ | pH | 溶解氧/(mg·L–1) | 盐度 |
| 夏季 | 养殖区 | 29.9±0.1 | 8.066±0.019 | 6.11±0.25 | 22.476±2.022 |
| 大桥区 | 30.3±0.1 | 8.090±0.010 | 6.17±0.10 | 25.829±0.263 | |
| 小桥区 | 29.9±0.1 | 8.090±0.010 | 5.43±0.02 | 28.864±0.404 | |
| 秋季 | 养殖区 | 22.8±0.2 | 7.630±0.060 | 6.57±0.38 | 27.287±1.572 |
| 大桥区 | 22.8±0.1 | 7.603±0.015 | 4.74±0.07 | 29.950±0.079 | |
| 小桥区 | 22.7±0.0 | 7.690±0.000 | 5.55±0.08 | 31.154±0.252 | |
| 冬季 | 养殖区 | 18.8±0.1 | 8.112±0.058 | 7.70±0.25 | 28.795±1.330 |
| 大桥区 | 18.3±0.1 | 8.130±0.010 | 7.37±0.03 | 30.500±0.081 | |
| 小桥区 | 18.6±0.2 | 8.163±0.006 | 8.07±0.07 | 31.304±0.010 | |
| 春季 | 养殖区 | 26.0±0.5 | 8.216±0.017 | 7.38±0.20 | 29.548±0.717 |
| 大桥区 | 26.0±0.3 | 8.170±0.026 | 7.69±0.14 | 30.736±0.144 | |
| 小桥区 | 24.9±0.5 | 8.130±0.010 | 6.38±0.10 | 31.480±0.063 |
考洲洋表层海水不同季节无机碳体系各分量浓度分布见图 2。牡蛎养殖区DIC、HCO3–、CO32–、CO2质量浓度的年均值分别是1 710.1±159.0、1 577.1±132.4、113.5±54.3、19.5±12.2 μmol/kg; p(CO2)的年度变化范围是(30.70~154.96) Pa, 年均值是(65.18±39.05) Pa。HCO3–是DIC的主要组成成分, 年均占比92.14%±1.98%, CO2占比最低, 年均值1.12%±0.71%。
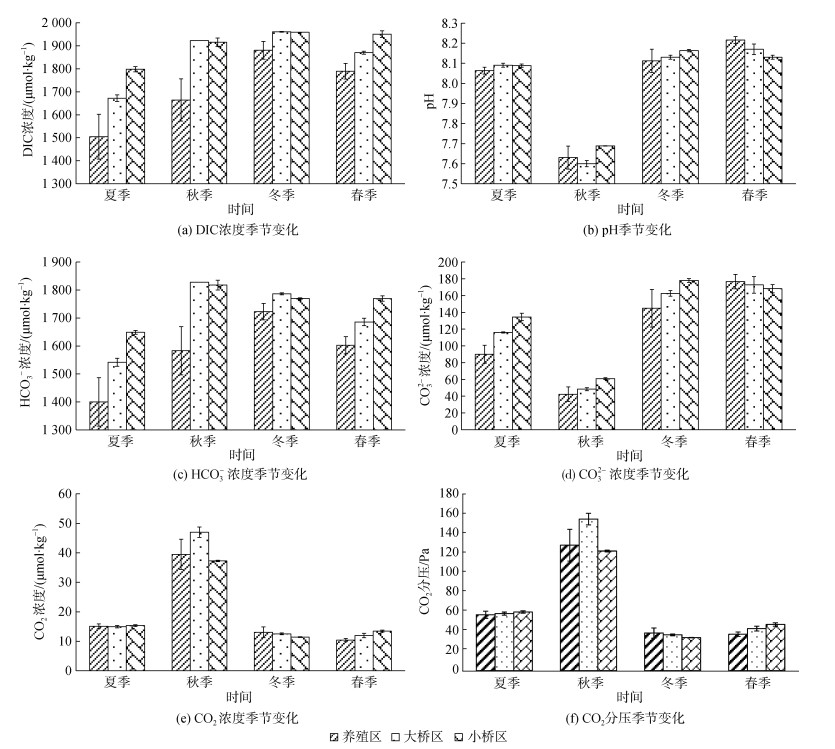 |
| 图 2 不同季节表层海水pH、p(CO2)、无机碳体系各分量浓度 Fig. 2 pH, p(CO2), DIC concentration, and its component forms in different seasons |
按年度计算, 养殖区、大桥区和小桥区pH、CO32–、CO2和p(CO2)差异均不显著(P>0.05); 牡蛎养殖区DIC、HCO3–质量浓度显著低于大桥区和小桥区(P<0.01), 后两者的差异不显著。
在养殖区, 季节对pH及无机碳体系各分量有影响(P<0.01), 主效应检验各要素的R2在0.8及以上, 其中pH、CO32–、CO2和p(CO2)的R2分别是0.970、0.945、0.957和0.957, 说明在养殖区, pH及无机碳体系各分量差异有80%以上来自于季节变化, 个别要素达90%以上。养殖区按季节排序, pH: 春季>冬季>夏季>秋季, 夏季和冬季的差异不显著(P>0.05); DIC: 冬季>春季>秋季>夏季, 冬季显著高于其余3个季节(P<0.05), 春季显著高于夏季(P<0.05), 秋季与春季、秋季与夏季的差异不显著(P>0.05); HCO3–: 冬季>春季>秋季>夏季, 秋季与其余3个季节的差异不显著(P>0.05), 其余季节之间的差异显著(P<0.05); CO32–: 春季>冬季>夏季>秋季, 春季与冬季显著高于夏季与秋季(P<0.05), 夏季显著高于秋季(P<0.05); CO2: 秋季>夏季>冬季>春季, 秋季显著高于其余3个季节(P<0.01), 夏季显著高于春季, 冬季和春季的差异不显著(P>0.05); p(CO2): 秋季>夏季>冬季>春季, 春季和冬季的差异不显著(P>0.05), 其余季节的差异极显著。
2.3 表层海水海-气界面CO2交换通量的时空变化表层海水海-气界面CO2交换通量(
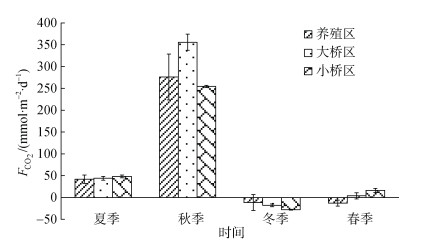 |
| 图 3 不同季节海-气界面CO2交换通量 Fig. 3 Sea–air CO2 flux in different seasons |
牡蛎养殖区夏季、秋季、冬季和春季表层海水CO2交换通量分别是(42.04±9.56)、(276.14±52.55)、(–11.59± 18.15)和(–13.02±6.71) mmol/(m2·d)。养殖区冬季各站位表层海水
表层海水Chl a及初级生产力(PP)分布见图 4。牡蛎养殖区、大桥区和小桥区表层海水Chl a质量浓度年度平均值分别是6.83±2.93、11.04±4.35、9.64± 5.65 μg/L, 养殖区的Chl a质量浓度显著低于大桥区(P<0.01), 大桥区与小桥区差异不显著(P>0.05)。
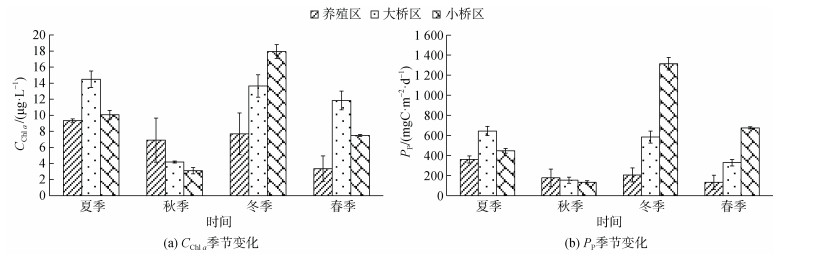 |
| 图 4 不同季节表层海水的Chl a浓度及PP Fig. 4 Chl a and PP of surface seawater in different seasons |
养殖区、大桥区和小桥区PP年度平均值分别是219.15±107.91、427.52±209.47、642.34±453.35 mgC/(m2·d), 牡蛎养殖区的PP显著低于大桥区和小桥区(P<0.05), 大桥区与小桥区差异不显著(P>0.05)。
以季节和区域进行主效应检验, 季节和区域具有交互作用, Chl a及PP的R2均在0.9以上, 说明季节和区域一起决定了这些要素90%以上的差异。
在夏季、冬季和春季, 牡蛎养殖区的PP显著低于大桥区和小桥区(P<0.05); 在秋季, 3个区域的PP差异不显著(P>0.05)。
养殖区表层海水Chl a及PP季节变化是夏季>冬季>秋季>春季。夏季的Chl a质量浓度显著高于春季(P<0.01), 其余季节之间的差异均不显著(P>0.05)。夏季PP显著高于其余3个季节(P<0.01), 其余3个季节的差异均不显著(P>0.05)。
2.5 海-气界面CO2交换通量与水环境因子的相关性分析海-气界面CO2交换通量与水环境因子的相关系数见表 2。从全年尺度来看, CO2交换通量与水温呈现显著的正相关, 与pH、DO、盐度、Chl a、DIC和PP呈现显著的负相关。从不同季节来看, CO2交换通量在4个季节与水温的相关关系均不显著; 夏季仅与DO呈显著负相关, 秋季仅与pH呈显著负相关, 冬季与pH、Chl a和PP呈现显著的负相关, 春季与pH呈现显著负相关, 与盐度、Chl a、DIC和PP呈现显著的正相关。
| 季节 | 变量 | T | pH | DO | S | Chl a | DIC | PP |
| 全年 | f | 0.305* | –0.894** | –0.844** | –0.327* | –0.374* | –0.375* | –0.323* |
| 夏季 | f | 0.295 | –0.470 | –0.745** | 0.391 | –0.159 | 0.391 | –0.182 |
| 秋季 | f | 0.209 | –0.855** | –0.465 | –0.018 | –0.100 | 0.291 | 0.073 |
| 冬季 | f | –0.062 | –0.995** | –0.597 | –0.545 | –0.627* | –0.273 | –0.618* |
| 春季 | f | –0.434 | –0.966** | –0.445 | 0.764** | 0.618* | 0.655* | 0.864** |
| 注: *表示相关性显著(P<0.05), **表示相关性极显著(P<0.01)。 | ||||||||
考洲洋是一个溺谷湾, 水交换较弱, 湾区海洋碳循环受湾外影响较弱, 夏季和秋季是养殖旺季, 冬季和春季大部分牡蛎已被收获, 是养殖淡季。本研究中, 考洲洋表层海水的DIC浓度低于我国北方典型海湾桑沟湾和乳山宫家岛以东水域[15-16], 高于福建三沙湾盐田港[17], 这可能与考洲洋所在的地理区位和水文条件有关。
表层海水p(CO2)会受到物理、化学、生物的各种影响, 水温和盐度是重要的影响因素之一[25]。沿岸海水温度主要受到太阳辐射和海洋大气热交换的影响, 海水盐度主要受到淡水(包括降雨、径流和地下水等)、外海高盐水和蒸发作用的影响[28]。考洲洋水深较浅, 无大的径流输入, 受太阳辐射影响较大, 同一季节不同区域未形成显著的水温差, 太阳辐射的季节变化决定了水温的主要差异; 夏季降雨较多, 冲淡水降低海水盐度, 夏季的盐度显著低于其余3个季节; 养殖区位于湾顶, 受外海高盐水的影响相对更小, 养殖区的盐度显著低于非养殖区。一般而言, 水温对海水中p(CO2)具有双重影响, 海水中的碳酸盐和其他弱酸盐体系的平衡随水温的变化而变化, 海水中p(CO2)随水温的升高而升高, 水温升高又导致CO2溶解度降低, 引起海水中p(CO2)降低。海水盐度增加, 离子强度增大, CO2的溶解度降低, 海水p(CO2)减小[38]。在全年尺度, 考洲洋表层海水p(CO2)及CO2交换通量与水温呈显著正相关关系, 与盐度呈显著负相关关系, 但在单个季节均未呈现此规律。4个季节调查中, 表层海水p(CO2)及CO2交换通量与水温均无显著的相关关系; 夏季、秋季和冬季表层海水p(CO2)及CO2交换通量与盐度均无显著的相关关系, 春季反而呈显著的正相关关系。可能的原因是水温和盐度的物理影响属于客观存在, 在p(CO2)及CO2交换通量季节变化上起主导作用; 而在单个季节, 养殖牡蛎、浮游生物的生理生态过程与海域水温、盐度等物理过程耦合作用, 导致表层海水p(CO2)及CO2交换通量的变化呈现出不同的变化。
浮游植物光合作用产生的固碳效应会降低海水中的p(CO2) [39]。p(CO2)与Chl a成显著负相关时, 可以推断光合作用对影响表层水p(CO2)起到决定性作用[15-16]。考洲洋4个季节调查中, 仅冬季表层海水p(CO2)及CO2交换通量与Chl a、初级生产力呈显著负相关关系, 说明冬季浮游植物光合作用可能对影响表层水p(CO2)起主导作用。在非养殖区, 表层海水p(CO2)及CO2交换通量与Chl a、初级生产力呈显著负相关关系, 在养殖区的相关关系不显著, 说明在非养殖区, 浮游植物光合作用可能对影响表层水p(CO2)起主导作用。
3.2 养殖活动对表层海水p(CO2)及CO2交换通量的影响养殖生态系统的复杂性使得p(CO2)及CO2交换通量存在较大的不均匀性[40]。在浅海贝类养殖生态系统中, 浮游植物和养殖贝类是影响p(CO2)的重要因素[16]。浮游植物的光合作用消耗CO2, 产生O2, 降低水体中的p(CO2) [39]; 养殖贝类在形成贝壳的钙化过程利用水体DIC的同时, 与呼吸过程协同释放CO2, 增加水体中的p(CO2) [41], 使得贝类在表现为生物碳汇的同时还表现为部分碳源[42]。贝类钙化作用反应式如下: Ca2++2 HCO3–=CaCO3+CO2+H2O[14], 虽然每形成1 mol的碳酸钙, 会释放1 mol的CO2, 但可以吸收2 mol的HCO3–, 实际固定1mol碳[12, 41]。
牡蛎养殖活动通过钙化作用和呼吸作用可直接影响养殖区的海洋碳循环。本研究中, 在养殖区, 养殖牡蛎钙化作用大量利用海水中的HCO3–, 形成CaCO3躯壳, 导致水体中HCO3–降低, 表现为养殖区的HCO3–显著低于非养殖区; 其中养殖旺季的钙化作用强度大于养殖淡季, 表现为养殖区养殖旺季的HCO3–显著低于养殖淡季。在非养殖区没有养殖牡蛎消耗HCO3–, 养殖淡季和养殖旺季的HCO3–无显著差异。不管是养殖旺季还是养殖淡季, 考洲洋海域养殖区和非养殖区表层海水的p(CO2)及CO2交换通量无显著差异, 与蒋增杰等[16]的研究一致, 养殖牡蛎钙化、呼吸作用等生理因素释放的CO2对表层海水p(CO2)及CO2交换通量未产生显著影响。
另一方面, 牡蛎养殖活动也可通过滤食作用降低浮游植物密度(摄食压力)和通过代谢作用增加海水中的营养物质促进浮游植物增殖(促增殖作用), 影响浮游植物的光合作用间接影响海洋碳循环。养殖区和非养殖区Chl a含量差异不显著表明养殖牡蛎的摄食压力尚未对浮游植物群落造成显著影响[16]。本研究中, 在全年尺度, 养殖牡蛎摄食压力总体可能大于其促增殖作用, 表现为养殖区的Chl a和PP显著低于非养殖区。在养殖旺季, 养殖牡蛎摄食压力与其促增殖作用可能相互抵消, 表现为养殖区和非养殖区之间的Chl a和PP差异不显著。在养殖淡季, 养殖活动补充的营养物质减少, 而吉隆河和盐洲水道给非养殖区补充的营养物质源源不断, 营养物质在非养殖区的促增殖作用可能大于在养殖区, 表现为非养殖区的Chl a和PP显著高于养殖区。在养殖区, 牡蛎养殖活动在养殖旺季的促增殖作用可能大于在养殖淡季, 表现为养殖旺季的Chl a和PP显著高于养殖淡季, 但在非养殖区, 养殖旺季的Chl a和PP却显著低于养殖淡季。说明牡蛎的养殖活动已经对养殖区浮游植物群落造成复杂的影响, 但在不同的养殖阶段其作用如何实现还需结合营养盐的变化进一步研究。
考洲洋养殖海域养殖旺季为CO2的源, 秋季的源强最大; 养殖淡季整体为CO2的弱汇, 而北方桑沟湾贝类养殖区春季和乳山宫家岛以东牡蛎养殖水域秋季均表现为CO2的汇区[15-16]。在夏季和秋季, 考洲洋牡蛎养殖区CO2源强和非养殖区的差异不显著; 在冬季, 养殖区CO2源强整体上和非养殖区的差异不显著, 但非养殖区为CO2的汇, 养殖区有的站位为汇, 有的站位为源, 这与浮游植物的光合作用影响有关, 表现为汇的地方Chl a相对较高, 且附近的牡蛎均被收获, 源的地方Chl a相对较低, 且附近有少量牡蛎未被收获; 在春季, 牡蛎养殖区为CO2的汇, 非养殖区总体上为源。
养殖牡蛎钙化作用形成的CaCO3躯壳, 绝大部分通过收获从海水中移除, 是一种碳的地球化学循环过程(循环周期长达数百万年)[14], 以贝壳掩埋或功能化利用实施碳封存, 可成为持久的碳汇, 对移除、降低大气中的CO2浓度, 缓解温室效应具有一定的应用前景。此外, 贝类滤食水体中的颗粒有机碳, 一部分促进贝类软体组织生长, 另一部分以粪和假粪的形式形成生物学沉积物, 具有更大的粒径的更高的有机物, 沉降速率大于自然的悬浮颗粒物, 可加速碳从水环境移出[43]。
4 结论1) 牡蛎养殖区表层海水中Chl a、DIC、HCO3–和初级生产力显著低于非养殖区, 养殖区和非养殖区的pH、DO、CO32–、p(CO2)及CO2交换通量差异不显著。养殖淡季表层海水中pH、DO、DIC、HCO3–和CO32–显著大于养殖旺季, 养殖旺季的p(CO2)和CO2交换通量显著大于养殖淡季, 养殖淡季和养殖旺季的Chl a和初级生产力差异不显著。养殖区DIC、HCO3–呈现冬季>春季>秋季>夏季的季节变化特征, CO2、p(CO2)、CO2交换通量呈现秋季>夏季>冬季>春季的季节变化特征。
2) 考洲洋海域水温和盐度的季节变化可能对表层海水p(CO2)及CO2交换通量季节变化起主导作用。在冬季或非养殖区, 浮游植物光合作用可能对影响表层海水p(CO2)及CO2交换通量起主导作用。养殖牡蛎的钙化、呼吸作用等生理因素释放的CO2对表层海水p(CO2)及CO2交换通量并未产生显著影响。
3) 考洲洋养殖海域养殖旺季为CO2的源, 秋季的源强最大, 养殖淡季整体为CO2的弱汇。养殖牡蛎呼吸作用和钙化作用释放CO2的过程使其在表现为生物碳汇的同时还表现为部分碳源, 钙化作用形成的CaCO3躯壳是持久的碳汇, 对移除、降低大气中的CO2浓度有积极的意义, 是一种有效的碳中和措施, 对于发展低碳经济, 实现“碳中和”目标具有重要意义。
| [1] |
SOLOMON S, PLATTNER G K, KNUTTI R, et al. Irreversible climate change due to carbon dioxide emissions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(6): 1704-1709. DOI:10.1073/pnas.0812721106 |
| [2] |
唐启升, 陈镇东, 余克服, 等. 海洋酸化及其与海洋生物及生态系统的关系[J]. 科学通报, 2013, 58(14): 1307-1314. TANG Qisheng, CHEN Zhendong, YU Kefu, et al. The effects of ocean acidification on marine organisms and ecosystem[J]. Chinese Science Bulletin, 2013, 58(14): 1307-1314. |
| [3] |
PACHAURI R K, ALLEN M R, BARROS V R, et al. Climate change 2014: Synthesis report[R]. Contribution of working groups Ⅰ, Ⅱ and Ⅲ to the fifth assessment report of the intergovernmental panel on climate change, IPCC, Geneva, 2015.
|
| [4] |
SABINE C L, FEELY R A, GRUBER N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305(5682): 367-371. DOI:10.1126/science.1097403 |
| [5] |
焦念志. 研发海洋"负排放"技术支撑国家"碳中和"需求[J]. 中国科学院院刊, 2021, 36(2): 179-187. JIAO Nianzhi. Developing ocean negative carbon emission technology to support national carbon neutralization[J]. Bulletin of Chinese Academy of Sciences, 2021, 36(2): 179-187. |
| [6] |
NELLEMANN C, CORCORAN E, DUARTE C M, et al. A Rapid Response Assessment. Blue carbon: The role of healthy oceans in binding carbon[M]//United Nations Environment Programme, GRID-Arendal. Birkeland Trykkeri AS, Norway, 2009.
|
| [7] |
GRUBER N, CLEMENT D, CARTER B R, et al. The oceanic sink for anthropogenic CO2 from 1994 to 2007[J]. Science, 2019, 363(6432): 1193-1199. DOI:10.1126/science.aau5153 |
| [8] |
DONEY S C, FABRY V J, FEELY R A, et al. Ocean acidification: The other CO2 problem[J]. Annual Review of Marine Science, 2009, 1(1): 169-192. DOI:10.1146/annurev.marine.010908.163834 |
| [9] |
张继红, 方建光, 唐启升. 中国浅海贝藻养殖对海洋碳循环的贡献[J]. 地球科学进展, 2005, 20(3): 359-365. ZHANG Jihong, FANG Jianguang, TANG Qisheng. The contribution of shellfish and seaweed mariculture in China to the carbon cycle of coastal ecosystem[J]. Advances in Earth Science, 2005, 20(3): 359-365. DOI:10.3321/j.issn:1001-8166.2005.03.014 |
| [10] |
唐启升. 碳汇渔业与又好又快发展现代渔业[J]. 江西水产科技, 2011(2): 9-11. TANG Qisheng. Carbon sink fishery and good and fast development of modern fishery[J]. Jiangxi Fishery Science and Technology, 2011(2): 9-11. |
| [11] |
王清印. 碳汇渔业——概念、发展与展望[C]//海洋资源科学利用论坛论文集. 烟台: 2011, p82-85. WANG Qingyin. The concept, development and prospects of carbon sink fisheries[C]// Collection of Essays of Forum on Scientific Utilization of Marine Resource. Yantai, 2011: 82-85. |
| [12] |
唐启升, 刘慧. 海洋渔业碳汇及其扩增战略[J]. 中国工程科学, 2016, 18(3): 68-73. TANG Qisheng, LIU Hui. Strategy for carbon sink and its amplification in marine fisheries[J]. Strategic Study of CAE, 2016, 18(3): 68-73. DOI:10.3969/j.issn.1009-1742.2016.03.012 |
| [13] |
TANG Q S, ZHANG J H, FANG J G. Shellfish and seaweed mariculture increase atmospheric CO2 absorption by coastal ecosystems[J]. Marine Ecology Progress Series, 2011, 424: 97-104. DOI:10.3354/meps08979 |
| [14] |
李海晏, 陈涛, 张海燕, 等. 中国贝类养殖对海洋碳循环的贡献评估[J]. 海洋科学, 2014, 38(5): 39-45. LI Haiyan, CHEN Tao, ZHANG Haiyan, et al. Evaluation of contribution of shellfish culture to ocean carbon cycle in China[J]. Marine Sciences, 2014, 38(5): 39-45. |
| [15] |
刘毅, 张继红, 房景辉, 等. 桑沟湾春季海-气界面CO2交换通量及其与养殖活动的关系分析[J]. 渔业科学进展, 2017, 38(6): 1-8. LIU Yi, ZHANG Jihong, FANG Jinghu, et al. Analysis of the air-sea surface carbon dioxide flux and its interaction with aquaculture activities in Sanggou Bay[J]. Progress in Fishery Sciences, 2017, 38(6): 1-8. |
| [16] |
蒋增杰, 方建光, 王巍, 等. 乳山宫家岛以东牡蛎养殖水域秋季海-气界面CO2交换通量研究[J]. 水产学报, 2012, 36(10): 1592-1598. JIANG Zengjie, FANG Jianguang, WANG Wei, et al. Sea-air CO2 flux in Crassostrea gigas aquaculture area of East Gongjia Island, Rushan, Shandong, in autumn[J]. Journal of Fisheries of China, 2012, 36(10): 1592-1598. |
| [17] |
韦章良, 韩红宾, 胡明, 等. 三沙湾盐田港海水养殖海域海-气界面CO2交换通量的时空变化[J]. 上海海洋大学学报, 2016, 25(1): 106-115. WEI Zhangliang, HAN Hongbin, HU Ming, et al. Seasonal variation of sea-air CO2 flux in mariculture area in Yantian Harbor, Sansha Bay[J]. Journal of Shanghai Ocean University, 2016, 25(1): 106-115. |
| [18] |
张明亮, 邹健, 毛玉泽, 等. 养殖栉孔扇贝对桑沟湾碳循环的贡献[J]. 渔业现代化, 2011, 38(4): 13-16. ZHANG Mingliang, ZOU Jian, MAO Yuze, et al. Contribution of culturing scallop to carbon cycle in Sanggou Bay[J]. Fishery Modernization, 2011, 38(4): 13-16. DOI:10.3969/j.issn.1007-9580.2011.04.003 |
| [19] |
李纯厚, 林钦, 蔡文贵, 等. 考洲洋浮游植物种类组成与数量分布特征[J]. 水产学报, 2006, 29(3): 379-385. LI Chunhou, LIN Qin, CAI Wengui, et al. Characteristics of species composition and quantity distribution of phytoplankton in Kaozhouyang Bay[J]. Journal of Fisheries of China, 2006, 29(3): 379-385. |
| [20] |
田志群, 董永宏. 赤岸蚝(近江牡蛎)标准化育肥养成技术[J]. 海洋与渔业, 2016, 7: 56-58. TIAN Zhiqun, DONG Yonghong. Chian oyster (Crassostrea rivularis Gould) standardized fattening cultivation technology[J]. Ocean and Fishery, 2016, 7: 56-58. |
| [21] |
中华人民共和国国家质量监督检验检疫总局. GB 17378.4-2007海洋监测规范第4部分: 海水分析[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB 17378.4-2007 The specification for marine monitoring-Part 4: Seawater analysis[S]. Beijing: Standards Press of China, 2008. |
| [22] |
WANNINKHOF R. Relationship between wind speed and gas exchange over the ocean[J]. Journal of Geophysica1 Research, 1999, 97(C5): 7373-7382. |
| [23] |
REHDER G, SUESS E. Methane and pCO2 in the Kuroshio and the South China Sea during maximum summer surface temperatures[J]. Marine Chemistry, 2001, 75(1/2): 89-108. |
| [24] |
TERNON J F, OUDOT C, DESSIER A, et al. A seasonal tropical sink for atmospheric CO2 in the Atlantic Ocean: The role of the Amazon River discharge[J]. Marine Chemistry, 2000, 68(3): 183-201. DOI:10.1016/S0304-4203(99)00077-8 |
| [25] |
WEISS R F. Carbon dioxide in water and seawater: the solubility of a non-ideal gas[J]. Marine Chemistry, 1974, 2(3): 203-215. DOI:10.1016/0304-4203(74)90015-2 |
| [26] |
World Meteorological Organization. WMO greenhouse gas bulletin (GHG bulletin): The state of greenhouse gases in the atmosphere based on global observations through 2020[R]. World Meteorological Organization (WMO), 2021, 17: 1-10.
|
| [27] |
SHIZUO, TSUNOGAI, SHUICHI, et al. Is there a "continental shelf pump" for the absorption of atmospheric CO2?[J]. Tellus B, 1999, 51(3): 701-712. DOI:10.3402/tellusb.v51i3.16468 |
| [28] |
陈敏. 化学海洋学[M]. 北京: 海洋出版社, 2009. CHEN Min. Chemical oceanography[M]. Beijing: Ocean Press, 2009. |
| [29] |
LEWIS E, WALLACE D. Program developed for CO2 system calculations[CP]. Carbon Dioxide Information Analysis Center, managed by Lockheed Martin Energy Research Corporation for the US Department of Energy Tennessee. 1998. https://www.researchgate.net/publication/240194526_CO2SYS-Program_developed_for_CO2_system_calculations.
|
| [30] |
HEUVEN S V, PIERROT D, RAE J W B, et al. CO2SYS v 1.1, MATLAB program developed for CO2 system calculations[CP]. 2011. https://www.researchgate.net/publication/282354342_CO2SYS_v_11_MATLAB_program_developed_for_CO2_system_calculations.
|
| [31] |
XU Y Y, PIERROT D, CAI W J. Ocean carbonate system computation for anoxic waters using an updated CO2SYS program[J]. Marine Chemistry, 2017, 195(20): 90-93. |
| [32] |
LUEKER T J, DICKSON A G, KEELING C D. Ocean pCO2 calculated from dissolved inorganic carbon, alkalinity, and equations for K1 and K2: Validation based on laboratory measurements of CO2 in gas and seawater at equilibrium[J]. Marine Chemistry, 2000, 70(1): 105-119. |
| [33] |
LEE K, KIM T W, BYRNE R H, et al. The universal ratio of boron to chlorinity for the North Pacific and North Atlantic oceans[J]. Geochimica Et Cosmochimica Acta, 2010, 74(6): 1801-1811. |
| [34] |
PEREZ F F, FRAGA F. Association constant of fluoride and hydrogen ions in seawater[J]. Marine Chemistry, 1987, 21(2): 161-168. |
| [35] |
CADEE G C, HEGEMAN J. Primary production in the Dutch Wadden Sea[J]. Netherlands Journal of Sea Research, 1974, 8: 240-259. |
| [36] |
RYTHER J H, YENTSCH C S. The estimation of phytoplankton production in the ocean from chlorophyll and light data[J]. Limnology and Oceanography, 1957, 2(3): 281-286. |
| [37] |
YUKUYA Y, SHUN-EI I. Dynamic status of primary production in Lake Yunoko, a small eutrophic subalpine lake in central Japan[J]. The Botanical Magazine Tokyo, 1972, 85(3): 157-176. |
| [38] |
朱连磊, 宋金明, 李学刚, 等. 东海中北部海域秋季表层海水中无机碳与海气界面碳的迁移[J]. 海洋科学, 2012, 36(10): 26-32. ZHU Lianlei, SONG Jinming, LI Xuegang, et al. Dissolved inorganic carbon and I air-sea carbon exchange flux in the central and northern East China Sea in autumn[J]. Marine Sciences, 2012, 36(10): 26-32. |
| [39] |
张龙军, 王婧婧, 张云, 等. 冬季北黄海表层海水pCO2分布及其影响因素探讨[J]. 中国海洋大学学报(自然科学版), 2008, 38(6): 955-9601. ZHANG Longjun, WANG Jingjing, ZHANG Yun, et al. Distribution and controlling factors of surface seawater partial pressure of CO2 in the Northern Yellow Sea during winter[J]. Periodical of Ocean University of China, 2008, 38(6): 955-9601. |
| [40] |
张继红, 吴文广, 任黎华, 等. 桑沟湾表层水pCO2的季节变化及影响因素分析[J]. 渔业科学进展, 2013, 34(1): 57-64. ZHANG Jihong, WU Wenguang, REN Lihua, et al. Seasonal variation of pCO2 and its potential influencing factors in aquaculture areas of Sanggou Bay[J]. Progress in Fishery Sciences, 2013, 34(1): 57-64. |
| [41] |
CHAUVAUD L, THOMPSON J K, CLOERN J E, et al. Clams as CO2 generators: The Potamocorbula amurensis example in San Francisco Bay[J]. Limnology and Oceanography, 2003, 48(6): 2086-2092. |
| [42] |
CLAIRE G, FRANCK G, DOMINIQUE D. Secondary production, calcification and CO2 fluxes in the cirripedes Chthamalus montagui and Elminius modestus[J]. Oecologia, 2008, 155(1): 133-142. |
| [43] |
齐占会, 王珺, 黄洪辉, 等. 广东省海水养殖贝藻类碳汇潜力评估[J]. 南方水产科学, 2012, 8(1): 30-35. QI Zhanhui, WANG Jun, HUANG Honghui, et al. Potential assessment of carbon sink capacity by marine bivalves and seaweeds in Guangdong Province[J]. South China Fisheries Science, 2012, 8(1): 30-35. |
 2022, Vol. 46
2022, Vol. 46

