文章信息
- 吴瑶, 姚佳佳, 杨茹君, 刘媛, 张莹莹. 2022.
- WU Yao, YAO Jia-jia, YANG Ru-jun, LIU Yuan, ZHANG Ying-ying. 2022.
- 夏季长江口海域溶解态铁的分布及混合行为研究
- Distribution and mixing behavior of dissolved iron in the Changjiang River Estuary during summer
- 海洋科学, 46(11): 15-28
- Marine Sciences, 46(11): 15-28.
- http://dx.doi.org/10.11759/hykx20220322001
-
文章历史
- 收稿日期:2022-03-22
- 修回日期:2022-05-10
2. 盐城工学院 环境科学与工程学院江苏省环境保护海涂生态与污染防治重点实验室, 江苏 盐城 224051
2. Key Laboratory of Marine Ecology and Pollution Control for Environmental Protection in Jiangsu Provincial, College of Environmental Science and Engineering, Yancheng Institute of Technology, Yancheng 224051, China
铁(Fe)是地壳含量第四丰富元素, 也是海洋浮游植物生长必不可少的微量营养元素, 对海洋的初级生产力具有控制作用。海水中溶解态铁(DFe)主要以Fe(Ⅲ)存在, 溶解度极低, 限制浮游植物的生长, 甚至在DFe输入量高的近岸区也存在DFe的限制[1], 是大部分海域处于高营养盐低叶绿素状态的原因之一。因此, 研究近岸区DFe的输入和输出以及相关的影响因素, 对于了解DFe的生物地球化学过程具有重要意义。
DFe的输入主要包括河水径流、大气沉降、海洋沉积物间隙水向上层水体扩散等, DFe的输出主要包括颗粒物表面的吸附和沉淀、微生物的吸收等。在近岸海域, 径流输入是DFe的主要来源[2], 以“世界平均河流”为基础计算出的全球河流铁输入量为1.5×109 mol·a−1。河流径流将陆源物质连同高浓度的DFe输送到沿海地区, 比如勒拿河(Lena River)的输入增加了拉普捷夫海(Laptev Sea)近岸区DFe的浓度约150~500 nmol/L[3]。研究表明河口及沿海水域观察到的DFe浓度远大于开放海洋, 如密西西比河入海口羽流的DFe浓度可达29.9 nmol/L, 而离岸水域的DFe浓度降低到1.4 nmol/L[4]; 旧金山湾中DFe浓度从萨克拉门托河(Sacramento River)淡水端(盐度 < 2)的131.5 nmol/L降低到河口(盐度 > 26)的7 nmol/L[5]; 中国珠江DFe浓度为36.8 nmol/L, 入海口DFe浓度为2.3~6.3 nmol/L, 外海海域DFe浓度为0.17~ 1.01 nmol/L[6]; 而在大西洋, DFe浓度仅为0.23~ 0.66 nmol/L[7]。由此可见, 不同河口区DFe浓度变化的范围较大。除了径流输入的影响外, DFe在从河口向开放海域迁移的过程中还受到了多种因素的共同作用。
长江是世界上第三大河流, 流域面积达1.8× 106 km2, 年径流量为9×1011 m3。与全球大多数河口相似, 长江口及邻近海域是一个高生产力的水生生态系统, 其中夏季和秋季的浮游植物生物量更高, 季节变化显著[8]。此外, 长江口海域还受到长江冲淡水和台湾暖流等水团和洋流的强烈影响[9]。Yang等[10]关于长江口海域的研究表明该区域附近的DFe浓度最高达到176.5 nmol/L, 而远岸海水的DFe平均仅6.66 nmol/L。为了探究进一步研究影响DFe分布的主要因素, 我们测定了2015年7月长江口及邻近海域DFe的浓度变化, 分析了长江淡水对东海DFe的贡献, 并且结合盐度数据来探究DFe在长江口及邻近海域的地球化学行为。
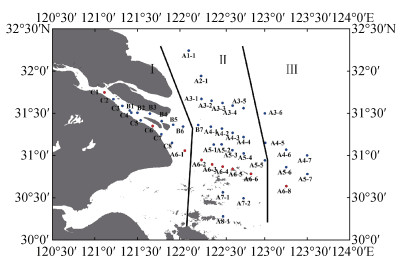
1 海水样品采集和处理 1.1 采样区域样品来自于调查船“润江”号在2015年7月9日—21日采集长江口海域研究区水样, 该航次包括C、B、A1、A2、A3、A4、A5、A7和A8断面(图 1蓝色圆点站位)。C、B和A1断面只采集表层水, 其余断面采集表层、中层和底层海水。表层采样在距离海平面下1 m处, 中层采样深度为海底深度的一半处, 底层采样在距离海底2 m处。为了使研究区域涉及范围更广、更完整, 我们引用2015年同航次站位C1、站位C6、站位A6-1~A6-8(图 1红色圆点站位)的DFe浓度和盐度(S)数据[10]。根据站位距离长江口的远近和盐度影响, 把研究区域划分为3部分: 口内(Ⅰ)区、混合(Ⅱ)区和外海(Ⅲ)区(图 1)。口内(Ⅰ)区, S < 1, 站位包括C1~C8、B1~B6和A6-1。混合(Ⅱ)区, 1≤S≤30, 站位包括B7、A1-1、A2-1、A3-1~A3-5、A4-1~A4-4、A5-1~A5-5、A6-2~A6-6、A7-1、A7-2、A8-1。外海(Ⅲ)区, S > 30, 站位包括A3-6、A4-5~A4-7、A5-6、A5-7和A6-8。由于口内(Ⅰ)区水深较浅, 我们只采集表层样品, 表层水共47个采集站位, 中层水共31个采集站位, 底层水共29个采集站位。
所有样品均用Niskin采样器采集, 用30 mL低密度聚乙烯样品瓶(美国Nalgene公司生产)盛装。样品瓶在使用前必须进行严格的清洗以避免器壁污染对结果造成影响, 分别用0.1%的洗洁精、10%的HCl(优级纯, 质量分数99.8%, 国药集团化学试剂有限公司生产)和另一个10%的HCl浸泡24 h, 每次转移样品瓶前都需要用Milli-Q水(中国富勒姆科技有限公司生产, 电阻率18.2 MΩ)冲洗6遍, 最后装满Milli-Q水并用质量分数30%的HCl(德国默克公司生产)酸化至pH为2, 用密实袋双层密封备用。采集后的样品在100级洁净台下, 用0.4 μm聚碳酸酯膜(爱尔兰Millipore公司生产)过滤。滤膜在使用前需要进行如下处理: 首先用pH=2的HCl水溶液浸泡24 h以上, 再用Milli-Q水清洗至中性, 最后浸泡在盛有Milli-Q水的广口罐中密封待用。过滤后的海水分装到3个样品瓶中, 即3个平行样品测定海水中的DFe。加入质量分数30% 的HCl酸化至pH 2以下, 存放3个月以上后测量其DFe浓度。
1.3 样品测定采用阴极溶出伏安法(cathodic stripping voltammetry, CSV)测定海水样品中的DFe[11], 所用仪器为797-AutoLab (Ⅱ)极谱仪(瑞士万通公司生产)。该极谱仪具有三电极体系, 分别为工作电极(悬汞电极, HMDE), 辅助电极(Pt电极)和参比电极(Ag/AgCl电极), 盐桥使用3.0 mol/L KCl进行填充。仪器与计算机软件“797 VA computrace”相连, 可对电化学参数进行具体设置。该方法主要使用竞争配体DHN(2, 3-二羟基苯丙氨酸)测定海水中DFe, 即通过测定一系列浓度的Fe-DHN的电化学信号, 最终得到DFe的浓度, 详细的电化学原理可以参考Van den Berg等[11]的文章。
测定时移取10 mL待测样品置于玻璃伏安池中, 加入0.5 mL哌嗪-N, N’-双(2-羟基丙磺酸)(POPSO, 德国Sigma公司生产, 100 g)/KBrO3(德国默克公司神刹那, 100 g)混合溶液作为pH缓冲液, 再加入40 μL 0.01 mol/L的DHN(德国默克公司生产, 50 g), 用旋转的聚四氟乙烯棒进行搅拌, 再用高纯N2(纯度为99.999%)进行吹扫去除O2。在特定沉积电位下反应1 min后, 按一定的扫描速率从负电压到正电压扫描三次得到Fe-DHN的还原电流, 采用标准加入法即添加Fe标准进行测定。实验各试剂初始浓度和仪器的电化学参数如表 1所示。温度(T)和盐度(S)利用911 PLUS CTD传感器(美国Seabird有限公司生产)现场测定获得。其它参数如叶绿素(Chl a)、溶解有机碳(DOC)引用于2015年同航次Zhao等[12]的数据, 溶解氧(DO)引用于2015年同航次Lyu等[13]的数据, 根据其分布图探究对DFe分布的影响。
| 鼓气时间 | 沉积电位 | 沉积时间 | 平衡时间 | 扫描速率 | 扫描范围 | 搅拌速率 | DHN | POPSO | KBrO3 | 缓冲pH |
| 300 s | −0.2 V | 60 s | 10 s | 0.09 V/s | −0.1~1.2 V | 2 000 r/min | 0.01 mol/L | 0.1 mol/L | 0.4 mol/L | 8.0~8.1 |
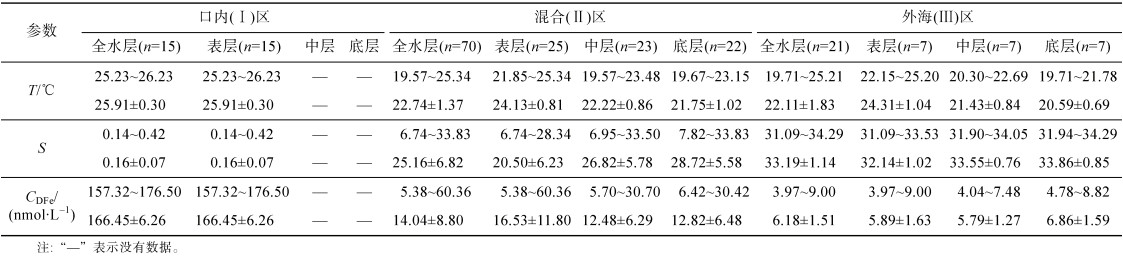
研究区域表、中、底层温度的水平分布如图 2所示, 总体上呈现出由近岸向远岸降低的趋势, 温度梯度垂直海岸线指向东南方向, 梯度变化较小。整体来看, 口内(Ⅰ)的温度范围为25.23~26.23 ℃, 平均值为25.91±0.30 ℃, 混合(Ⅱ)区的温度范围为19.57~25.34 ℃, 平均值为22.74±1.37 ℃, 外海(Ⅲ)区的温度范围为19.71~25.21 ℃, 平均值为22.11± 1.83 ℃ (表 1)。受陆地影响较大, 温度高值区主要出现在长江口、西北以及西南沿岸水域。表层水中口内(Ⅰ)区(图 2a)温度最高, 混合(Ⅱ)区和外海(Ⅲ)区温度无明显差别, 而中层和底层水中温度从混合(Ⅱ)区到外海(Ⅲ)区降低(图 2b和图 2c)。由于(Ⅰ)区只采集了表层水, 因此在垂直分布上只比较(Ⅱ)区和(Ⅲ)区的表、中和底层水的温度、盐度和DFe差异。温度在垂直分布上呈现出由表层向中层、底层递减的趋势, 表层水温度最高为24.17±0.87 ℃, 中层水温度次之为22.04±0.91 ℃, 底层水温度最低为21.47±1.05 ℃。
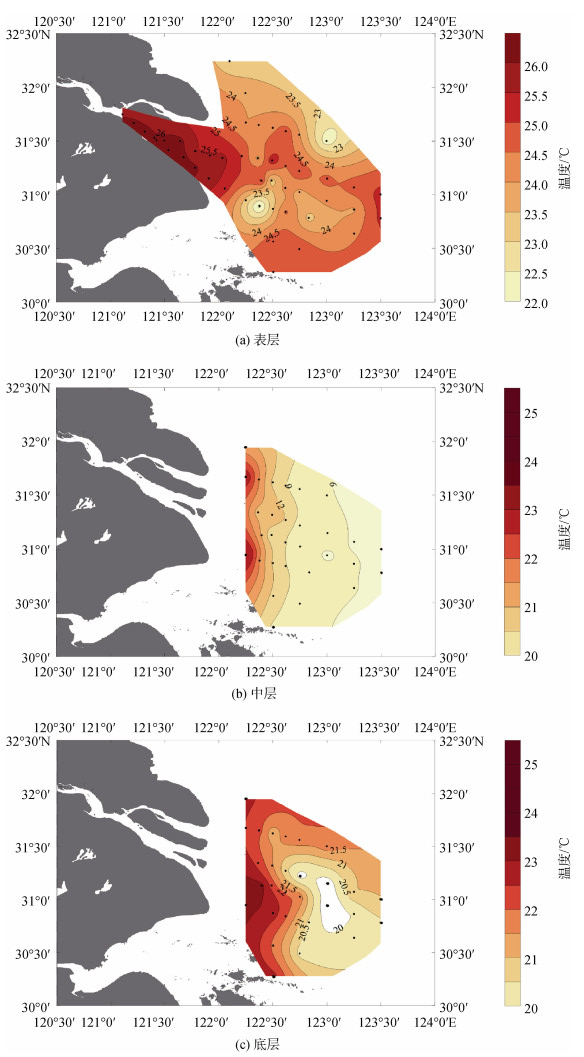 |
| 图 2 长江口海域表、中、底层温度分布图 Fig. 2 Temperature distribution of the surface, middle, and bottom layers of the Changjiang River Estuary |
研究区域表、中、底层盐度的水平分布如图 3所示, 与温度的分布趋势相反, 盐度均表现出从口内(Ⅰ)区到外海(Ⅲ)区逐渐升高的趋势, 盐度梯度垂直海岸线指向东南方向, 梯度变化明显。整体来看, 口内(Ⅰ)的盐度范围为0.14~0.42, 平均值为0.16±0.07, 混合(Ⅱ)区的盐度度范围为6.74~33.83, 平均值为25.16±6.82, 外海(Ⅲ)区的盐度范围为31.09~34.29, 平均值为33.19±1.14(表 1)。盐度由表层向中层、底层呈现递增的趋势, 依次为23.02± 7.48、28.39±0.91和29.96±5.34, 分层现象不明显。表层水受长江冲淡水影响较大, 低盐度区域面积较大, 而中层和底层海水盐度较表层高。在夏季, 底层水由于受到高盐台湾暖流水的影响[14], 盐度较高的区域可以延伸至近岸海域(图 3c)。
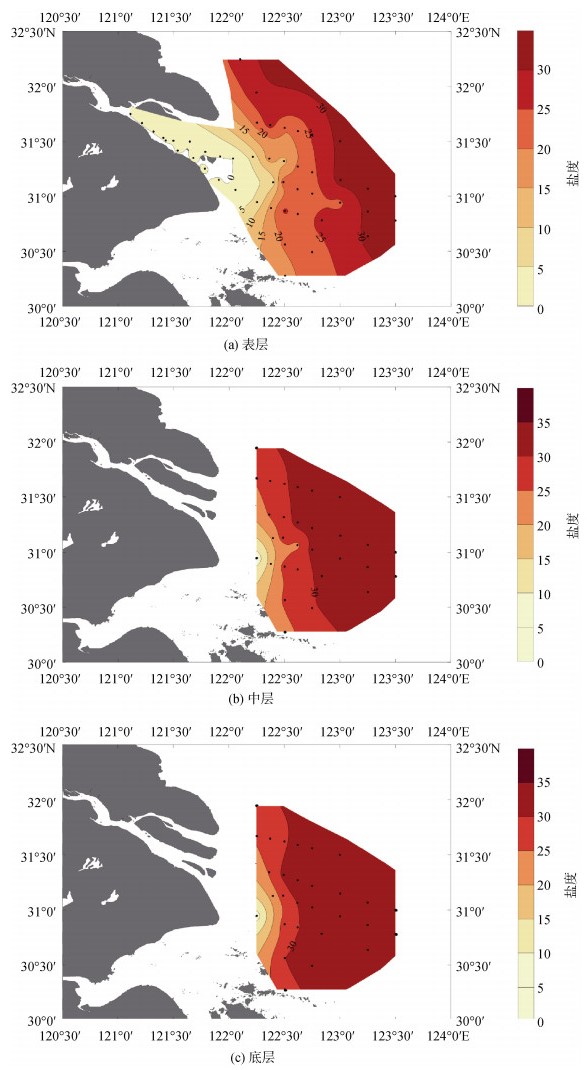 |
| 图 3 长江口海域表、中、底层的盐度分布图 Fig. 3 Salinity distribution of the surface, middle, and bottom layers of the Changjiang River Estuary |
整体来看, DFe浓度的水平分布(图 4)呈现从口内(Ⅰ)区到外海(Ⅲ)区逐渐降低的趋势。受长江冲淡水输入的影响, 表、中、底层水的DFe浓度最大值均出现在122°E附近的近岸水域。表层水的最大值为176.50 nmol/L(C6站位), 中层水的最大值为30.70 nmol/L(A6-2站位), 底层水的最大值为30.42 nmol/L(A3-1站位), 研究区域的东南部DFe浓度均较低。在垂直分布上DFe浓度有差异, 总体上看表层水最大, 中层水和底层水相似。其中, 混合(Ⅱ)区表层海水DFe平均浓度最高, 中层和底层海水DFe平均浓度相近。外海(Ⅲ)区底层海水DFe平均浓度最高, 表层和中层海水DFe平均浓度相近(表 2)。
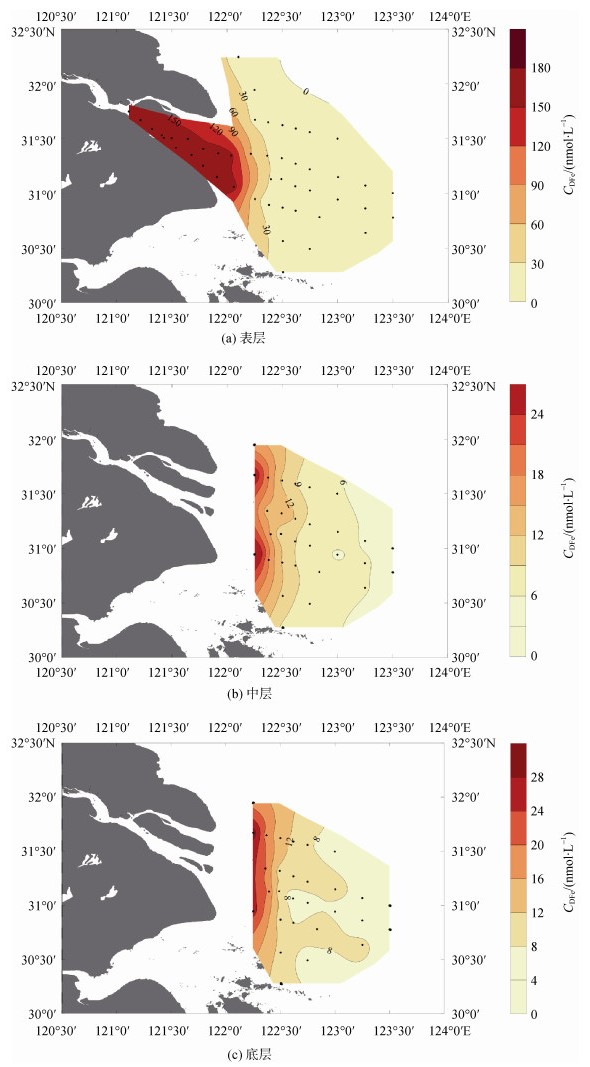 |
| 图 4 长江口海域表、中、底层的DFe分布图 Fig. 4 DFe distribution of the surface, middle, and bottom layers of the Changjiang River Estuary |
|
径流输入、大气沉降等因素是影响沿海地区DFe输入和输出的重要原因, 生物的原位吸收和释放也会造成DFe浓度的波动[15]。在近岸海域, 河流径流量的季节变化直接影响DFe迁移的季节和空间差异[16], 不同的水团运动也会影响DFe的迁移。本文我们重点研究径流输入、水团和盐度等环境因子对DFe迁移的影响。
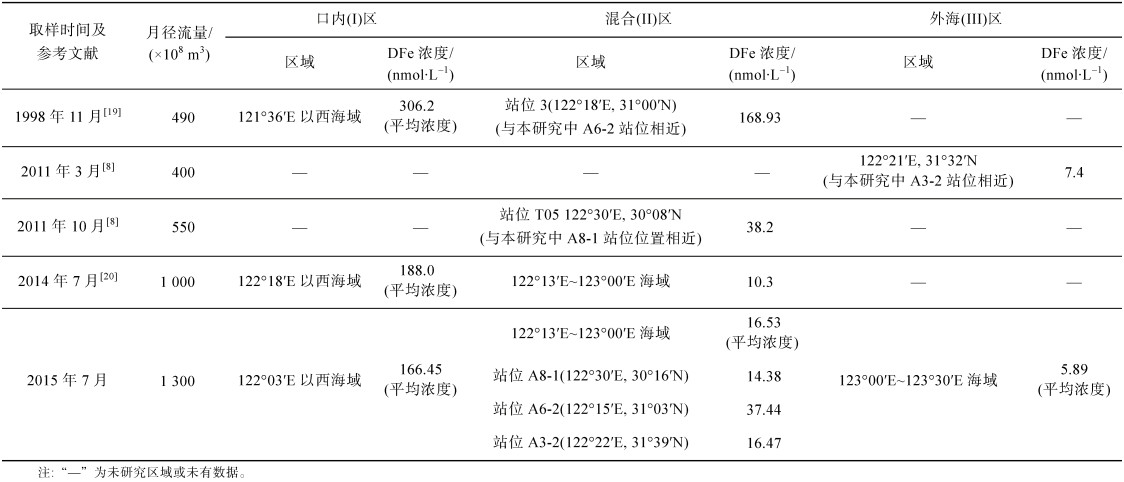
3.1 径流输入对DFe分布的影响径流输入是近岸海域DFe的主要来源, 其中DFe在有机物的络合作用下以胶体的形式稳定存在。携带大量DFe的长江水对于DFe向东海等外海的迁移影响重大, 尤其是对于长江口附近的DFe输入。从表 2可以看出长江口内(Ⅰ)区DFe浓度(166.45±6.26 nmol/L)显著高于混合(Ⅱ)区(14.04± 8.80 nmol/L)和外海(Ⅲ)区(5.89±1.63 nmol/L), 这一结果表明长江陆源输入是该地区的主要来源之一。在由河口向外海迁移的过程中, DFe浓度呈降低的趋势。本研究中外海(Ⅲ)区DFe浓度比混合(Ⅱ)区低, 说明长江水DFe输入的影响逐渐减小。这种趋势在其他河口区域也多有报道。如在Mersey河口盐度为18.8的采样站位中, DFe浓度为83.5 nmol/L, 而位于外海区域的站位浓度降至4.80 nmol/L[17]。在径流量巨大的亚马逊河口海域, Rio Negro河水中DFe平均浓度为3.4 μmol/L, 混合区DFe浓度范围为7~54 nmol/L, 外海大西洋海域DFe浓度范围为0.2~1.1 nmol/L[18]。
此外, 本研究将3个区域表层的DFe浓度与其他文献中报道的数据进行了比较, 如表 3所示。从表可以看出口内(Ⅰ)区的DFe浓度较大, 1998年11月和2014年7月测得的平均浓度分别为306.2 nmol/L和188 nmol/L[19-20]。通过对比分析发现, 河流径流量越大, 浓度越低, 表明径流对口内(Ⅰ)区DFe的具有稀释作用。此外, 1998年11月长江表层水混合(Ⅱ)区的DFe也表现出较高的浓度, 如站位3 DFe浓度为168.92 nmol/L(表 3), 远大于本研究的A6-2站位(37.44 nmol/L)。
|
河流径流量对DFe的迁移也有重要影响, 流量越大则DFe迁移的距离越远, 进而造成流域面积内同一站位的DFe浓度不同。本研究采样时间为夏季, 降水量多, 长江径流量较大, 为1.3×1011 m3(表 3), 河口(Ⅰ)区的面积往东延伸至122°03′E, 而流量最小(4.90× 1010 m3)的1998年11月影响区域较小, 相同的研究区域仅往东延伸至121°36′E附近[19]。本研究的站位A3-2(122°22′E, 31°39′N, S=26.75)位于混合(Ⅱ)区, DFe值为16.47 nmol/L, 而在月径流量较小(4× 1010 m3)的2011年3月, 相近位置的站位D01(122°21′E, 31°32′N, S=32)则属于外海(Ⅲ)区, 其DFe含量为7.4 nmol/L(表 3)。
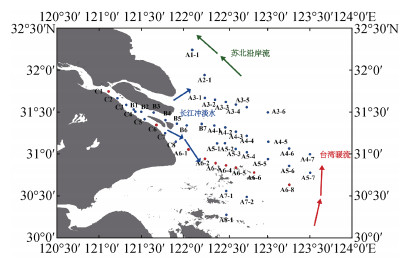
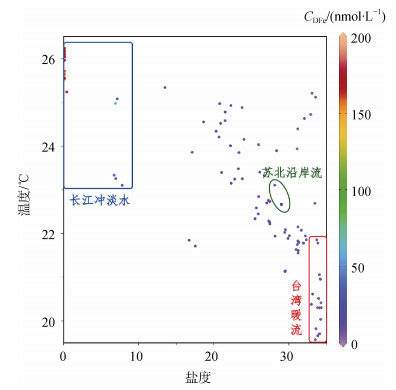
3.2 水团对DFe分布的影响水文条件的变化对溶解态铁的浓度和分布都有较大影响, 河口及近岸海域温度、盐度与溶解态铁浓度的相关关系体现了不同水团对溶解态铁分布产生的影响。依据对T-S点聚图的分析研究, 我们将研究区域内的水团主要划分为以下3个水团: (1)长江冲淡水, 主要出现在表层和中层(图 5中蓝色框线区域); (2)苏北沿岸流, 主要出现在表层(图 5中绿色框线区域); (3)台湾暖流, 主要出现在中层和底层(图 5中红色框线区域)。
 |
| 图 5 长江口海域温度、盐度和DFe浓度 Fig. 5 Temperature, salinity, and dissolved iron in the Changjiang River Estuary |
各水团的运动轨迹如图 6所示。长江冲淡水以温度高(T > 23 ℃)、盐度低(S < 10)为特征, 主要受长江淡水影响。夏季河流流量较大, 长江冲淡水包含两条支流, 一条从长江口流向东海的东北部, 并延伸至黄海东南部, 另一条则随着其他沿海岸向西南方向流动(图 6)。长江冲淡水携带的DFe浓度较高(图 5), 对口内(Ⅰ)区DFe的分布具有重要的贡献。位于长江口以北的苏北沿岸流温度较低(23 ℃左右), 而盐度较高(28左右)(图 5), 在夏季风的作用下自南向北流动[21](图 6)。该水团可能影响研究区域北部的一些近岸站如站位A1-1和A2-1(图 6), 并将DFe由南向北输送。与长江冲淡水相比, 苏北沿岸流携带的DFe浓度更低(图 5)。外海(Ⅲ)区主要受到台湾暖流的影响, 该区域特征为盐度高(S > 33), 温度低(T < 23 ℃)(图 5), 由南向北延伸, 含有较低浓度的DFe, 且对研究区域东南部的DFe浓度具有强烈的稀释作用。由于沉积物的释放, 底层海水DFe浓度一般明显高于表层和中层海水[10], 如2017年夏季长江口上覆水中DFe的浓度可达100 μmol/L[22], 但是在本研究中, 由于台湾暖流对水体的扰动作用, 使得DFe的浓度在底层与中层没有显著区别(表 2)。
从水平分布上来看, 由口内(Ⅰ)区到外海(Ⅲ)区随着盐度的增大, DFe浓度由157.33 nmol/L逐渐降低到4.85 nmol/L, 浓度下降率达到96.92%, 表明大部分DFe在近岸海域被去除或被稀释, 能够迁移至外海DFe的浓度只有河口区的小部分。这种情况在其他河口区, 如Millica河口(去除率98%)[25], Yenisty河口等区域(去除率98%)[26]等得到印证。从垂直分布上来看, 表、中、底层的DFe浓度均与盐度呈负相关(表层皮尔森相关系数为−0.914, 中层皮尔森相关系数为−0.769, 底层皮尔森相关系数为−0.750, P < 0.01)。表层由于受到长江冲淡水的影响较大, 盐度梯度尤为明显, 因此相关性更高。
DFe与盐度之间的负相关关系可以用下述指数模型来表达[10]:
| $ y = a_{0}×\text{e}^{kS}+y_{0}, $ | (1) |
式中, y代表在盐度为S时海水中DFe浓度的模拟值, a0表示河流DFe的净输入量, k表示DFe的降低指数, y0是表示最大盐度时DFe的模拟存留浓度。根据本研究的实测数据对指数方程(1)进行拟合可得式(2):
| $ y = 160.21×\text{e}^{(−0.21×S)}+ 10.04, $ | (2) |
拟合的相关系数R是0.992 (在置信度95%以上), 其中160.21 nmol/L为DFe的模拟输入量, 10.04 nmol/L为最大盐度时DFe值的模拟存留浓度。将实验数据与模拟数据进行比较发现: 实际测得的净输入量为157.33 nmol/L, 与模拟输入量相近, 而实际测得DFe最低浓度为3.97 nmol/L(盐度为31.09), 与模拟浓度(10.27 nmol/L)相比较低。实际存留量与模拟数据存在差异, 是因为模型中没有设计稀释的变量, 而实际在河流输入的过程中, DFe浓度较高的河水在入海口被浓度较低的海水稀释, 导致存留量降低。
根据两个端元值的连线作出理论稀释线如图 7所示, 可得式(3):
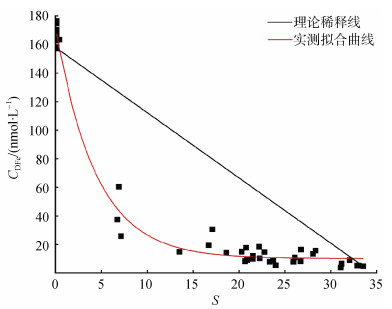 |
| 图 7 长江口海域盐度梯度内DFe浓度与盐度非线性拟合及理论稀释线 Fig. 7 Nonlinear fitting between DFe concentration and salinity in the salinity gradient of the Changjiang River Estuary and its theoretical dilution line 注: ▇为样品实测值。 |
| $ y_\text{T} = –5.479\;6S + 183.89, $ | (3) |
式中, yT表示当盐度为S时DFe浓度的理论值。结合指数去除模型(式2)及理论稀释线(式3), 由下式可以计算出DFe的理论去除率:
| $ Y(\text{DFe}的理论去除率) = (y_\text{T} – y)/y_\text{T} ×100\%, $ | (4) |
根据式(4)计算得出本论文中DFe的理论最大去除率为97.75%, 与实际测得的浓度下降率相近。此外, 通过将稀释量与去除量进行比较得出, 当S < 17.95时, 铁主要被去除, 当S≥17.95时, 铁主要受物理稀释影响。经验证, 实测数据也符合模型计算结果, 研究区域中口内(Ⅰ)区所有站位及混合(Ⅱ)区的A4-2, A5-1, A6-2, A6-3站位以去除为主, 混合(Ⅱ)区其余站位及外海(Ⅲ)区主要以物理稀释为主。本文建立的模型可以很好地描述DFe在近海区的地球化学行为, 利用这个模型, 可以试图对难以取样区域的DFe浓度和盐度之间关系进行估算。
Yang等[10]的研究也得出了长江口DFe随盐度增加而降低的模型(式3), 通过与本研究的模型对比可以看出参数k、a0和y0都存在差别, 该结果与取样区域有密切联系。本研究中DFe的下降指数k为−0.21, 小于Yang等[10]的−0.28, 可能是因为研究区域面积较大, 取样站位涉及长江口北部和南部海域, 盐度梯度小, 所以DFe浓度下降慢。而Yang等[10]只对入海口一个断面进行分析, 数据相对较为集中, 盐度增加快而DFe浓度下降快, 趋势明显。a0与河流净输入的DFe浓度有关, 因此k越大则y0越小。
| $ y= 175.28×\text{e}^{(–0.28×S)}+9.86. $ | (5) |
研究证明不同河口沿盐度梯度DFe浓度的变化量可以用相同的指数曲线表示, 如Millica河口为y= 24 379.0×e(0.32×S)+757.2[25], Ob河口为y= 552.73× e(−0.16×S)+8.50[26], Yenisey河口为y= 240.99×e(−0.15×S)+ 3.64[26], San Francisco湾为y=7 190.3×e(−0.66×S)+41.33[27]。
3.4 其他因素对DFe分布的影响有机质是影响DFe分布和迁移的一个重要因素, 它不仅可以增大铁的溶解度, 还能影响铁的氧化还原循环。其中腐殖质(HS)是有机质的重要组成部分, HS在河口区的絮凝作用导致DFe去除而无法迁移至外海。分析同航次数据[12]可以看出, DOC总体上表现出从近岸到远岸下降的趋势, 浓度最高的站点出现在河口附近。相关性分析发现本研究中DFe浓度与DOC含量存在显著性正相关(相关系数为0.900, P < 0.01) (表 4), 因此DOC可能作为该区域重要的有机配体来源, 控制着DFe的迁移。根据2015年同航次A断面的HA数据[10]与DOC的相关性分析发现两者呈显著性正相关(0.909, P < 0.01), 说明HA是DOC的主要部分, 是DOC中重要的铁天然有机配体。HA的铁配合容量(iron binding capacity, IBC)受到盐度的影响, 当盐度为0.14时, IBC最高为103.1 nmol Fe/(mg HA), 当盐度增大至31.49时, IBC值降至20.9 nmol Fe/(mg HA)[10]。随着盐度的增大, IBC逐渐减小, 因此结合的铁浓度也逐渐减小。由于海水中超过99%的DFe以有机络合形式存在[28], 因此DOC是影响DFe分布和迁移的主要因素。
| 化学因子 | DFe | Chl a | DO | DOC |
| DFe | 1 | −0.552** | −0.502** | 0.900** |
| Chl a | 1 | 0.603** | −0.481** | |
| DO | 1 | −0.501** | ||
| DOC | 1 | |||
| 注: **表示在0.01水平(双侧)上显著相关, *表示在0.05水平(双侧)上显著相关。 | ||||
Fe是氧化还原敏感元素, 因此氧化还原环境也具有不可忽略的影响。分析同一航次表层DO浓度[13]与DFe浓度可以得到负相关关系(相关系数为−0.502, P < 0.01)(表 4), 长江口海域中DO的浓度范围为6.74~ 8.95 mg/L, 平均值为(7.59±0.66)mg/L, 靠近河口区DO的值较小, 高值出现在122.5°E~123.5°E海域。DFe易被高浓度的DO氧化而形成氧化物, 进而沉淀从溶解相迁出, 其浓度相应的降低[29]。除对表层的影响外, 底层水的缺氧沉积物易产生高浓度的还原铁, 还原铁溶解以及从沉积物中释放出来, 造成底层水DFe浓度较高[30]。赤潮的发生会导致长江口海域底层水缺氧, 尤其是在122.75°N~123°N, 30.5°E附近[31]。此外, DO高值区域与Chl a高值区一致, 并且Chl a与DO具有显著的正相关性(0.603, P < 0.01), 因此可能是浮游植物的光合作用贡献了较多的DO。海水中高DO含量表明此区域海水中浮游植物生物量较多, 浮游植物的吸收进而导致DFe含量的下降。
海洋浮游植物的生长对夏季DFe浓度的影响也不容忽视, 浮游植物的生长促进DFe的消耗, 导致海水中DFe由海水中迁移至浮游植物体内, 并进一步随着浮游植物的消亡而变成颗粒态沉积从而从水体去除, 一般将Chl a浓度可以作为反映浮游植物生物量高低的指标。根据2015年同航次Zhao等[12]的数据计算得出长江入海口沿岸表层同站位叶绿素a含量的范围为0.47~12.69 μg/L, 平均值为3.29±3.18 μg/L。研究区域东南部的A7-2站位含量最高, 为12.69 μg/L, 可能与浙江沿岸海域赤潮的发生有关[8]。相关性分析显示DFe浓度与叶绿素a含量呈显著性负相关(相关系数为−0.552**, P < 0.01)(表 4), 叶绿素a含量高时DFe浓度低, 表明该海域浮游植物的生长吸收大量DFe, 导致DFe浓度较低。叶绿素a的含量明显的季节性变化也是导致DFe浓度变化的重要原因, 例如Zhou等[32]测得春、夏、秋和冬季长江河口站表层叶绿素a平均值分别为1.086 μg/L、3.941 μg/L、0.852 μg/L和0.549 μg/L, 而本研究中夏季平均值与其相似, 为3.29±3.18 μg/L。由于春季和夏季是长江口海域赤潮和藻华多发的季节, 海洋浮游植物的大量繁殖也导致了该海域叶绿素a的含量较高, 而秋季浮游植物开始衰败, 因此叶绿素a的含量逐渐降低。为了进一步证明长江口海域DFe与浮游植物的关系, 我们总结了本实验室2011年春季、秋季和2013年夏季在混合区(30.00°N~32.00°N, 122°E~123°E)表层DFe浓度平均值的数据(表 5)。从表中可以看出, 春季DFe的浓度最高, 秋季次之, 夏季最低。因此夏季较高的初级生产力可能是导致DFe浓度低于春季和秋季的原因。
通过对2015年7月9日—21日长江口海域中DFe空间分布及影响DFe分布因素的探究, 主要得出以下结论。
(1) 长江输入影响东海沿岸海域的DFe分布。长江水季节性输入量的变化影响陆源DFe的迁移方向和迁移距离。当流量大时, 如夏季, 来自长江的陆源DFe向东北和西南方向迁移, 且迁移距离较其他季节远。
(2) DFe浓度的水平分布受到不同水团的影响, 如长江冲淡水、苏北沿岸流和台湾暖流, 其中长江冲淡水携带的DFe浓度最高, 台湾暖流携带的DFe浓度最低。
(3) DFe的迁移受到盐度的影响, 河口区随着盐度的增大, 大部分DFe会在混合(Ⅱ)区被去除, 导致迁移至外海(Ⅲ)区DFe浓度大大降低, 经计算得到河口区的理论去除率为97.75%。
(4) 此外, DOC在河口区的絮凝作用是导致DFe去除的主要因素。DO较高的环境中DFe易形成氧化物沉淀去除。海洋浮游植物的生长吸收大量近岸海域的DFe, 导致DFe转化为颗粒态在近岸海域被去除, 也是导致DFe浓度低的重要因素之一。
| [1] |
MOREL F M, HUDSON R J, PRICE N M. Limitation of productivity by trace metals in the sea[J]. Limnology and oceanography, 1991, 36(8): 1742-1755. DOI:10.4319/lo.1991.36.8.1742 |
| [2] |
WETZ M S, HALES B, CHASE Z, et al. Riverine input of macronutrients, iron, and organic matter to the coastal ocean off Oregon, USA, during the winter[J]. Limnology and Oceanography, 2006, 51(5): 2221-2231. DOI:10.4319/lo.2006.51.5.2221 |
| [3] |
TURNER D R, HUNTER K A. The biogeochemistry of iron in seawater[M]. UK: Wiley Chichester, 2001.
|
| [4] |
POWELL R T, WILSON-FINELLI A. Importance of organic Fe complexing ligands in the Mississippi River plume[J]. Estuarine, Coastal and Shelf Science, 2003, 58(4): 757-763. DOI:10.1016/S0272-7714(03)00182-3 |
| [5] |
BUNDY R M, ABDULLA H A, HATCHER P G, et al. Iron-binding ligands and humic substances in the San Francisco Bay estuary and estuarine-influenced shelf regions of coastal California[J]. Marine Chemistry, 2015, 173: 183-194. DOI:10.1016/j.marchem.2014.11.005 |
| [6] |
ZHANG R, ZHU X, YANG C, et al. Distribution of dissolved iron in the Pearl River (Zhujiang) Estuary and the northern continental slope of the South China Sea[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2019, 167: 14-24. DOI:10.1016/j.dsr2.2018.12.006 |
| [7] |
CULLEN J T, BERGQUIST B A, MOFFETT J W. Thermodynamic characterization of the partitioning of iron between soluble and colloidal species in the Atlantic Ocean[J]. Marine Chemistry, 2006, 98(2/4): 295-303. |
| [8] |
SU H, YANG R J, ZHANG A B, et al. Dissolved iron distribution and organic complexation in the coastal waters of the East China Sea[J]. Marine Chemistry, 2015, 173: 208-221. DOI:10.1016/j.marchem.2015.03.007 |
| [9] |
LIU J P, XU K H, LI A C, et al. Flux and fate of Changjiang River sediment delivered to the East China Sea[J]. Geomorphology, 2007, 85(3/4): 208-224. |
| [10] |
YANG R J, SU H, QU S L, et al. Capacity of humic substances to complex with iron at different salinities in the Changjiang River estuary and East China Sea[J]. Scientific Reports, 2017, 7(1): 1-9. DOI:10.1038/s41598-016-0028-x |
| [11] |
VAN DEN BERG C M. Chemical speciation of iron in seawater by cathodic stripping voltammetry with dihydroxynaphthalene[J]. Analytical Chemistry, 2006, 78(1): 156-163. DOI:10.1021/ac051441+ |
| [12] |
ZHAO L B, GAO L. Dynamics of dissolved and particulate organic matter in the Changjiang (Changjiang River) Estuary and the adjacent East China Sea shelf[J]. Journal of Marine Systems, 2019, 198: 103188. DOI:10.1016/j.jmarsys.2019.103188 |
| [13] |
LYU L N, LIANG H R, HUANG Y H, et al. Annual hypoxia causing long-term seawater acidification: Evidence from low-molecular-weight organic acids in the Changjiang Estuary and its adjacent sea area[J]. Science of The Total Environment, 2021, 151819. |
| [14] |
WEI H, HE Y C, LI Q J, et al. Summer hypoxia adjacent to the Changjiang Estuary[J]. Journal of Marine Systems, 2007, 67(3): 292-303. |
| [15] |
SARTHOU G, BAKER A R, BLAIN S, et al. Atmospheric iron deposition and sea-surface dissolved iron concentrations in the eastern Atlantic Ocean[J]. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 2003, 50(10/11): 1339-1352. |
| [16] |
DE BAAR H J W. Distributions, sources and sinks of iron in seawater[M]//TURNER D R, HUNTER K A. Biogeochemiotry of iron in seawater. New York: Wiley, 2001: 123-253.
|
| [17] |
MAHMOOD A, ABUALHAIJA M M, VAN DEN BERG C M, et al. Organic speciation of dissolved iron in estuarine and coastal waters at multiple analytical windows[J]. Marine Chemistry, 2015, 177: 706-719. DOI:10.1016/j.marchem.2015.11.001 |
| [18] |
AUCOUR A M, TAO F X, MOREIRA-TURCQ P, et al. The Amazon River: behaviour of metals (Fe, Al, Mn) and dissolved organic matter in the initial mixing at the Rio Negro/Solimões confluence[J]. Chemical Geology, 2003, 197(1): 271-285. |
| [19] |
WANG Z L, LIU C Q. Distribution and partition behavior of heavy metals between dissolved and acid-soluble fractions along a salinity gradient in the Changjiang Estuary, eastern China[J]. Chemical Geology, 2003, 202(3): 383-396. |
| [20] |
ZHU X C, ZHANG R F, WU Y, et al. The remobilization and removal of Fe in Estuary—A case study in the Changjiang Estuary, China[J]. Journal of Geophysical Research: Oceans, 2018, 123(4): 2539-2553. DOI:10.1002/2017JC013671 |
| [21] |
卢健, 张启龙, 李安春. 苏北沿岸流对浒苔暴发及漂移过程的影响[J]. 海洋科学, 2014, 38(10): 83-89. LU Jian, ZHANG Qilong, LI Anchun. The influence of Subei coastal current on the outbreak and drift of Enteromoropha prolifera[J]. Marine Sciences, 2014, 38(10): 83-89. DOI:10.11759/hykx20130128001 |
| [22] |
DUAN L Q, SONG J M, YIN M L, et al. Dynamics of arsenic and its interaction with Fe and S at the sediment-water interface of the seasonal hypoxic Changjiang Estuary[J]. Science of The Total Environment, 2021, 769: 145269. DOI:10.1016/j.scitotenv.2021.145269 |
| [23] |
YUAN D L, ZHU J R, LI C Y, et al. Cross-shelf circulation in the Yellow and East China Seas indicated by MODIS satellite observations[J]. Journal of Marine Systems, 2008, 70(1/2): 134-149. |
| [24] |
CHANG P H, ISOBE A. A numerical study on the Changjiang diluted water in the Yellow and East China Seas[J]. Journal of Geophysical Research: Oceans, 2003, 108(C9): 3299. DOI:10.1029/2002JC001749 |
| [25] |
BOYLE E A, EDMOND J M, SHOLKOVITZ E R. The mechanism of iron removal in estuaries[J]. Geochimica et Cosmochimica Acta, 1977, 41(9): 1313-1324. DOI:10.1016/0016-7037(77)90075-8 |
| [26] |
FOX L E, WOFSY S C. Kinetics of removal of iron colloids from estuaries[J]. Geochimica et Cosmochi mica Acta, 1983, 47(2): 211-216. DOI:10.1016/0016-7037(83)90134-5 |
| [27] |
BUNDY R M, BILLER D V, BUCK K N, et al. Distinct pools of dissolved iron‐binding ligands in the surface and benthic boundary layer of the California Current[J]. Limnology and oceanography, 2014, 59(3): 769-787. DOI:10.4319/lo.2014.59.3.0769 |
| [28] |
GLEDHILL M, VAN DEN BERG C M. Determination of complexation of iron (Ⅲ) with natural organic complexing ligands in seawater using cathodic stripping voltammetry[J]. Marine Chemistry, 1994, 47(1): 41-54. DOI:10.1016/0304-4203(94)90012-4 |
| [29] |
史向明. 近海沉积物—水界面的耗氧和氧化还原敏感元素(Fe, Mn)的迁移[D]. 厦门: 厦门大学, 2019. SHI Xiangming. Benthic oxygen consumption and the transport of redox sensitive elements (Fe and Mn) across the sediment-water interface in coastal seas[D]. Xiamen: Xiamen University, 2019. |
| [30] |
PAKHOMOVA S V, HALL P O, KONONETS M Y, et al. Fluxes of iron and manganese across the sediment– water interface under various redox conditions[J]. Marine Chemistry, 2007, 107(3): 319-331. DOI:10.1016/j.marchem.2007.06.001 |
| [31] |
XU S M, ZHAI S K, ZHANG A B. Distribution and environment significance of redox sensitive trace elements of the Changjiang Estuary hypoxia zone and its contiguous sea area[J]. Acta Sedimentologica Sinica, 2007, 25(5): 759-766. DOI:10.3969/j.issn.1000-0550.2007.05.015 |
| [32] |
ZHOU W H, YUAN X C, HUO W Y, et al. Distribution of chlorophyll a and primary productivity in the adjacent sea area of Changjiang River Estuary[J]. Acta Oceanologica Sinica, 2004, 26(3): 143-150. DOI:10.3321/j.issn:0253-4193.2004.03.017 |
| [33] |
SU H, YANG R J, LI Y, et al. Influence of humic substances on iron distribution in the East China Sea[J]. Chemosphere, 2018, 204: 450-462. DOI:10.1016/j.chemosphere.2018.04.018 |
 2022, Vol. 46
2022, Vol. 46